不同信号肽对酿酒酵母蔗糖转化酶Suc2分泌表达水平的影响
王天琦, 王碧莹, 付 彤, 陈晓艺, 李宪臻, 杨 帆
(大连工业大学 生物工程学院,辽宁 大连 116034)
燃料乙醇作为一种清洁的生物质能源具有可再生及改善、保护生态环境的作用[1]。以甘蔗、玉米为原料生产乙醇因争粮争地问题发展受到限制[2]。而以纤维素为原料生产乙醇,由于其预处理方法成本较高造成工业化生产进程缓慢[3];研究发现富含菊糖的菊芋可以代替玉米淀粉生产乙醇,且每吨乙醇的生产成本是利用淀粉生产成本的70%[4]。菊糖是由D-呋喃果糖通过β-1,2糖苷键相连而成的多聚果糖[5]。目前,仅有少数几种微生物可以利用菊糖生产乙醇,并且生产乙醇能力有限[6]。酿酒酵母(Saccharomycescerevisiae)具有其他菌株无法比拟的优点,如产乙醇能力强、遗传操作平台成熟、抗逆性强、适合大规模生产,是利用菊糖产乙醇的首选微生物[7]。目前,已有少数几种酿酒酵母被证明能够直接利用菊糖生产乙醇[8]。而蔗糖转化酶Suc2是这些酿酒酵母中分解代谢菊糖的关键水解酶。有研究表明,隶属于糖苷水解酶32家族(GH32)的蔗糖转化酶Suc2具有菊糖外切酶活力,是这些酿酒酵母中分解代谢菊糖的关键水解酶[9-10]。Suc2能够催化菊糖中β-呋喃果糖苷末端非还原性β-呋喃果糖苷残基水解,释放出的果糖可以转化为1,6-二磷酸果糖进入糖酵解过程,随后启动厌氧发酵生成乙醇[8]。研究表明,酿酒酵母中蔗糖转化酶表达水平直接影响其转化菊糖产乙醇的效率[4]。因此,通过优化分泌表达途径来提高蔗糖转化酶Suc2的分泌表达效率对于提高酿酒酵母发酵菊糖产乙醇的能力至关重要。利用酿酒酵母分泌信号肽增强重组蛋白分泌表达水平是目前最有效的策略之一[11]。分泌信号肽位于分泌蛋白的N端,由短链氨基酸组成,并分为三个不同的区域:1~5个氨基酸组成带正电荷的N端;7~15个疏水氨基酸组成的H核心区;3~7个能被信号肽酶切割的亲水氨基酸组成的C端[12]。很多研究表明,使用合适的分泌信号肽对细胞外分泌蛋白的表达至关重要。Inokuma等[13]使用酿酒酵母信号肽spSED1将β-葡聚糖苷酶BGL1和里氏木霉内切葡聚糖酶EGII的细胞外活性提高至1.3倍和1.9倍,并且spSED1使毕赤酵母(Pichiapastoris)中BGL1的细胞外活性提高了1.6倍。Marten等[14]在酿酒酵母SYE2102中使用MFα的启动子和分泌信号肽融合Suc2使其表达量显著提高,并有效分泌至周质空间中。研究表明,使用一些异源的分泌信号肽也会使目的蛋白的表达量显著提高。Xiong等[15]在酿酒酵母中表达人体溶菌酶hLM时,利用人血清蛋白HSA的分泌信号肽可以很好的指导其分泌。此外,还有研究通过对信号肽进行序列优化改造来实现蛋白质分泌水平的提高[12]。Aza等[16]对信号肽spMFα中4个位点(Aα9D、Aα20T、Lα42S、Dα83E)进行突变,优化后的spMFαopt使两种漆酶PK2和APL的分泌水平相较于未优化的spMFα分别提高了2倍和12倍。为了使Suc2更有效分泌到细胞外,选择一种合适的分泌信号肽至关重要。对于不同的分泌信号肽,宿主菌株内源的分泌信号肽是很有潜力的候选者,因为它们可以保证被宿主的分泌表达系统所识别。已有研究表明5种源自酿酒酵母内源的分泌信号肽AGA2、EXG1、PLB1、PHO5和SCW11能够有效介导酿酒酵母对不同蛋白的分泌[14,17]。另有研究表明,来自于毕赤酵母和解脂耶氏酵母的分泌信号肽DAN4、MSB2和PRO[18-20]能够实现多种外源蛋白的高效表达,如胰岛素前体IP、真菌防御素Plectasin等[18]。此外,近期研究成果还对天然信号肽一级结构进行了优化,构建了新型分泌信号肽MFαnat、MFαopt和HECH[14,16],这些序列均源自分泌蛋白或者质膜表达的蛋白。由此,本研究选择11种不同来源的分泌信号肽进行生物信息学的初步筛选及预测,随后使用RF克隆(Restriction-free cloning)的策略[21]将不同的分泌信号肽与蔗糖转化酶Suc2融合,对重组菌进行蛋白质分泌水平、酶活力、分泌效率以及乙醇产量进行分析,期望获得菊糖基乙醇高效生产菌株。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒SaccharomycescerevisiaeBY4741、EscherichiacoliDH10B 获赠于大连化学物理研究所赵宗宝研究员课题组。质粒 pYC230-SUC2获赠于中国科学院青岛生物能源与过程研究所。本研究所构建的质粒与重组菌株如表1所示。

表1 本实验涉及的质粒与重组菌株信息表Table 1 The list of strains and plasmids constructed in this study
1.1.2 主要试剂与仪器设备 质粒提取试剂盒、胶回收试剂盒、D-山梨醇、ACTB、蛋白胨等购自上海生工生物工程股份有限公司; 酵母浸粉、琼脂粉购自Oxoid公司; 氯化钠、异丙醇、无水乙酸钠、硫酸镁等购自天津市科密欧化学试剂有限公司; GoldviewII核酸染料购自北京赛百盛生物工程公司; 菊糖购自上海蓝季科技发展有限公司;ExTaq DNA 聚合酶、Prime STAR DNA 聚合酶、DNA Marker、限制性内切酶(SalⅠ、PstⅠ、XbaⅠ)等购自大连TaKaRa公司; 其他常规试剂均为分析纯购自上海国药集团。梯度PCR仪(6325,Eppendorf公司);电转仪(Eporator,Eppendorf公司);凝胶成像分析系统(ImageQuant LAS 4000,美国通用公司);微量分光光度计(Nanovue Plus,美国通用公司);紫外分光光度计(UV-5200,上海元析仪器有限公司);多功能酶标仪(F50,Tecan公司);数字式全自动压力灭菌锅(SX700,日本TOMY公司)。
1.2 方法
1.2.1 不同分泌信号肽序列的获取与引物的合成 本研究选择的酿酒酵母、解脂耶氏酵母和毕赤酵母的分泌信号肽序列,从NCBI(https://www.ncbi.nlm.nih.gov/)和SGD(https://www.yeastgenome.org/)获取;人工合成及优化改造的分泌信号肽序列从文献中获取[14-15];为了更好地构建重组载体,所有序列均添加了载体和蔗糖转化酶Suc2的一部分,送至上海生工生物工程股份有限公司进行合成;扩增带同源臂的不同信号肽序列所用引物使用Primer Premier 5设计,上游引物sp-F序列(5′-3′)为CATTCTCTTGTTCTTGTGC,下游引物sp-R序列(5′-3′)为CGGTGTCATTTGGGTTGTATTG,送至上海生工生物工程股份有限公司进行合成。
1.2.2 生物信息学分析方法 信号肽在线预测软件SignalP-5.0(http://www.cbs.dtu.dk/services/SignalP/);蛋白亲疏水性预测软件Ex PAsy在线软件(https://web.expasy.org/protscale/)。
1.2.3 不同分泌信号肽重组质粒的构建及鉴定 使用引物sp-F和sp-R扩增1.2.1合成的片段,并使用胶回收试剂盒进行纯化。通过RF克隆的方法,将质粒pYC230-SUC2上Suc2的原始分泌信号肽替换为目的分泌信号肽。通过电击转化的方法将重组质粒转化至大肠埃希菌DH10B中,挑取长势较好的单菌落进行菌落PCR(菌落PCR引物sp-F和sp-R)验证,验证正确后,送至吉林省库美生物科技有限公司测序鉴定。
1.2.4 不同分泌信号肽重组菌的构建与鉴定 将测序结果正确的重组质粒电击转化至酿酒酵母BY4741,挑取长势较好的单菌落接入YPD后,使用质粒提取试剂盒提取酿酒酵母质粒,通过电击转化的方法转入大肠埃希菌DH10B中,挑取单菌落进行菌落PCR(菌落PCR引物sp-F和sp-R)验证,验证正确后,送至吉林省库美生物科技有限公司测序鉴定。
1.2.5 重组菌发酵培养方法 种子液培养方法:从平板挑取重组菌1环接种至10 mL YPD培养基中,30 ℃、200 r/min 摇床培养24 h。取1 mL种子液接入15%菊糖培养基中,30 ℃、200 r/min 摇床培养。摇瓶发酵培养方法:取1 mL种子液接入15%菊糖培养基中,30 ℃、100 r/min 摇床培养。并在发酵过程中分别于0、4、8、12、24、36、48、60、72、84 h取样。
1.2.6 蔗糖转化酶Suc2酶活力测定方法 研究表明,蔗糖酶Suc2同时具有菊糖外切酶活力[9]。因此,基于已报道方法[10],为了更加全面的考察Suc2的水解活性,本研究同时检测Suc2对蔗糖和菊糖两种底物的活性。重组菌在15%菊糖培养基发酵48 h时取样测定Suc2的蔗糖酶活和菊糖酶活[8]。酶活测定方法:使用0.1 mol/L PBS缓冲液(pH 6.8)将发酵菌液稀释适当倍数,取50 μL稀释菌液与450 μL蔗糖或菊糖底物(20 g/L,pH 5.0)混匀,50 ℃反应15 min。采用DNS法[22]测定酶活,重组菌的酶活用还原糖含量表示。蔗糖酶及菊糖酶酶活定义:50 ℃条件下,每分钟水解2%蔗糖或2%菊糖释放1 μmol葡萄糖当量所需要的酶含量为1 U。
1.2.7 分泌效率测定方法 发酵液上清蔗糖酶活测定:重组菌在15%菊糖培养基发酵48 h后,取发酵液6 000 g离心3 min,取发酵液上清液,使用0.1 mol/L PBS缓冲液(pH 6.8)稀释适当倍数后,按照1.2.6方法测定蔗糖酶活。破碎细胞后上清蔗糖酶活测定:重组菌在15%菊糖培养基发酵48 h后,取发酵液6 000 g离心3 min,弃发酵液上清后加入等体积TES缓冲液(pH 8.0),重悬菌体后加入适量0.4~0.6 mm酸洗玻璃珠,利用组织破碎仪进行反复破碎,直至80%以上酿酒酵母被破碎。随后将破碎液6 000 g离心3 min,取破碎液上清,使用0.1 mol/L PBS缓冲液(pH 6.8)稀释适当倍数后,按照1.2.6方法测定蔗糖酶活。Suc2的分泌效率由重组菌发酵液上清蔗糖酶活占重组菌总蔗糖酶活的比率来表征,其中总蔗糖酶酶活为发酵液上清蔗糖酶活和破碎细胞后上清蔗糖酶活的总和。分泌效率计算具体见公式:

式中:A1为发酵液上清蔗糖酶酶活;A2为破碎细胞后上清蔗糖酶酶活。
1.2.8 重组菌Western Blot分析 接种重组菌至15%菊糖培养基48 h后,收获发酵液浓缩,进行SDS-PAGE凝胶电泳,电转移至PVDF膜,封闭液室温封闭2 h,一抗为稀释后的Suc2特异性抗体,4 ℃过夜孵育,室温下TBST洗3次,每次10 min。二抗为用TBST稀释的羊抗兔IgG HRP,4 ℃孵育2 h,室温下TBS洗3次,每次10 min,DAB显色,显色后用图像处理软件ImageJ对Western blot结果进行灰度分析。
1.2.9 发酵产乙醇能力的测定 取发酵液上清过0.22 μm滤膜,所得滤液进行气相色谱检测。气相色谱操作条件[23]:色谱柱为安捷伦VF-WAX(30 m×0.25 mm×0.50 μm),顶空方法进行进样,加热箱温度为85 ℃,定量环温度为105 ℃,传输线温度为110 ℃,样品瓶平衡时间为30 min,进样持续时间为1 min,GC循环17 min。进样量1 μL,检测器温度260 ℃。程序升温条件:75 ℃,保持5 min,以25 ℃/min升至220 ℃,保持10 min。
1.2.10 发酵液残糖总量测定方法 取50 μL离心所得上清,加入50 μL 0.5 mol/L H2SO4溶液和400 μL ddH2O,沸水浴30 min后,加入500 μL 0.1 mol/L NaOH溶液,混匀。采用DNS法[22],测定还原糖浓度。
1.2.11 生物量的测定 采用比浊法[24]测定生物量,取50 μL重悬发酵液加入950 μL ddH2O,测定在600 nm波长下的吸光值(OD600)。
2 结果与分析
2.1 不同分泌信号肽切割位点及疏水性分析
首先,从NCBI(https://www.ncbi.nlm.nih.gov/)和SGD(https://www.yeastgenome.org/)数据库中获得11种不同蛋白的氨基酸序列。如表2所示,使用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)预测以上蛋白氨基酸序列中分泌信号肽序列。

表2 本实验涉及分泌信号肽序列及生物信息学分析Table 2 Sequences and bioinformatics analysis of SP in this study
有实验证明,分泌信号肽的疏水核心长度及疏水性也影响蛋白质的分泌表达,强疏水性的分泌信号肽能够高效引导新生肽的转运[12]。有研究表明,对抗体蛋白阿瓦斯汀(Avastin)的分泌信号肽疏水区进行改造后,用新的疏水性较低的分泌信号肽代替原有的分泌信号肽,造成了产量降低[25]。此外,Gierasch等[26]发现酵母PHOA分泌信号肽疏水核心Leu与Ala的比值为6∶4时,前体蛋白分泌加工能力最高,在此比值附近,信号肽分泌加工能力随疏水性的增强而提高。因此使用Ex PAsy(https://web.expasy.org/protscale/)预测了蛋白的亲疏水性,如表2所示,11种不同的分泌信号肽的疏水值在0.803~1.210之间,均较高。其中,疏水值最高的为毕赤酵母黏性蛋白MSB2的分泌信号肽,最低的为酿酒酵母内源可溶性细胞壁蛋白SCW11的分泌信号肽。因此,本研究选择的11种分泌信号肽可以进行后续实验。
2.2 内源分泌信号肽对Suc2分泌能力的影响
为了确定蔗糖转化酶Suc2最适分泌信号肽,首先利用RF克隆策略,将5种酿酒酵母内源分泌信号肽spAGA2、spEXG1、spPLB1、spPHO5及spSCW11与蔗糖转化酶Suc2融合并转化至S.cerevisiaeBY4741中。得到5种重组菌BY-AG、BY-EX、BY-PL、BY-PH及BY-SC。由于蛋白前体跨膜转运效率与分泌信号肽及成熟蛋白质的氨基酸序列相关,对于特定的蛋白质,疏水性较高的分泌信号肽通常会产生较高的易位效率[27]。由于spAGA2的疏水性较高,可以合理的预测,对于蔗糖转化酶Suc2,spAGA2可以提供较高的跨膜效率。
首先,利用Western blot检测了5种重组菌发酵48 h后细胞内Suc2的表达水平(图1A),灰度分析结果如图1B所示,5种重组菌细胞内Suc2的表达水平与野生型BY-S相似(P>0.05)。以上结果说明,不同分泌信号肽对Suc2细胞内的表达水平几乎没有影响。为了进一步确定不同信号肽对Suc2的分泌能力的影响,利用Western blot检测了5种重组菌发酵48 h后发酵液上清中Suc2的表达水平,如图1C所示,在140 kDa处可见明显Suc2条带。灰度分析结果如图1D所示,其中BY-AG中的Suc2表达水平明显最高,与预测结果一致,说明spAGA2可以使Suc2更有效地分泌到细胞外。而BY-EX中的Suc2表达水平与野生型BY-S相似,BY-PL、BY-PH及BY-SC中的Suc2表达水平相较于野生型BY-S有所降低。

图1 重组菌株菊糖发酵48 h后Suc2表达水平分析Fig.1 Expression levels of Suc2 in recombinants after 48 h inulin fermentation A:胞内中Suc2的蛋白质印迹;B:胞内Suc2表达水平定量分析;C:发酵液上清中Suc2的蛋白质印迹;D:发酵液上清中Suc2表达水平定量分析;以BY-S中Suc2的表达量进行归一化处理,设置为1.0A: Western blot analysis of intracellular Suc2; B: Quantitative analysis of intracellular Suc2 expression levels; C: Western blot analysis of extracellular Suc2; D: Quantitative analysis of extracellular Suc2 expression levels;The expression level of Suc2 in BY-S was normalized as 1.0
为观察不同分泌信号肽对Suc2分泌能力的影响,测定5种重组菌酶活。在48 h菊糖发酵条件下,BY-AG、BY-EX、BY-PL、BY-PH及BY-SC的蔗糖酶酶活如图2A所示,其中蔗糖酶酶活最高的为BY-AG,相对于未改造分泌信号肽野生型BY-S提高42%。而BY-EX的蔗糖酶酶活相对于野生型则降低了27%,BY-PL、BY-PH和BY-SC的蔗糖酶酶活与野生型的相似。由于Suc2是酿酒酵母水解菊糖产乙醇的关键酶,对该酶以菊糖为底物的酶活进行了测定。在48 h菊糖发酵的条件下,BY-AG、BY-EX、BY-PL、BY-PH和BY-SC的菊糖酶酶活如图2B所示,其中最高的BY-AG相较于野生型的BY-S提高了26%,而BY-EX、BY-PL、BY-PH和BY-SC均与野生型BY-S相似。

图2 重组菌株菊糖发酵48 h后的蔗糖酶酶活(A)及菊糖酶酶活(B)Fig.2 Invertase activity(A) and inulin activity(B) of recombinants after 48 h inulin fermentation“**”代表实验菌株与对照存在极显著性差异(P<0.01),图3、4同″**″ There is a very significant difference between the strain and control (P<0.01),Figure 3 and Figure 4 are the same
为了进一步验证上述结果,对BY-AG、BY-EX、BY-PL、BY-PH及BY-SC的分泌效率进行了测定。如图3所示,BY-AG、BY-EX、BY-PL、BY-PH、BY-SC中Suc2的分泌效率在(23.85±1.03)%~(28.71±1.08)%之间。其中,分泌效率最高的为BY-AG相较于野生型BY-S提高了17%。而BY-EX、BY-PL、BY-PH及BY-SC则表现出与野生型BY-S相似的情况(P>0.05),并且与菊糖酶酶活结果保持一致。本研究结果与Mori等[17]学者的研究一致。该团队使用spAGA2融合β-半乳糖苷酶LacA的菌株上清液表现出的LacA活性是野生型的1.5倍,而融合spEXG1的菌株上清活性是野生型的0.9倍。以上结果说明,使用spAGA2替换Suc2原始分泌信号肽可以有效提高Suc2在酿酒酵母BY4741中的分泌水平。
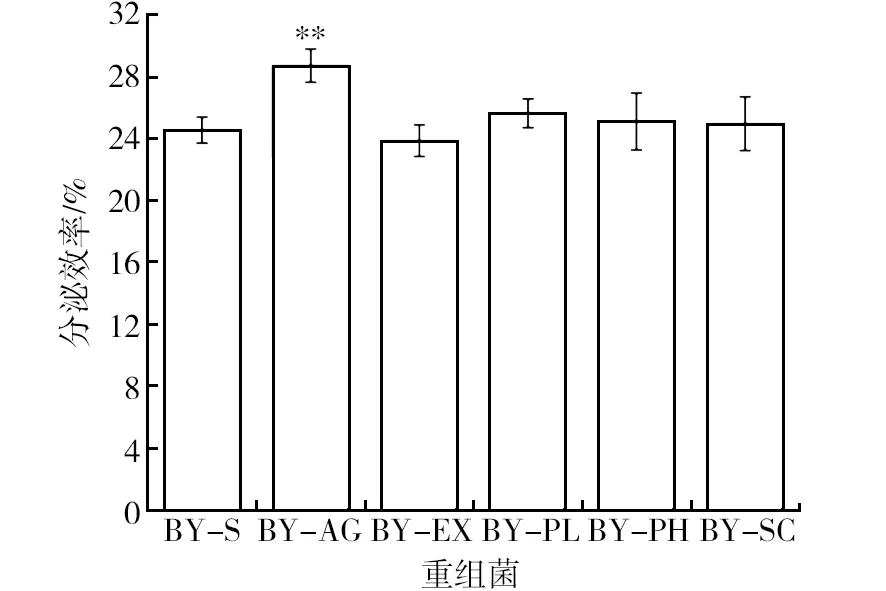
图3 重组菌株菊糖发酵48 h后Suc2的分泌效率Fig.3 The secretory efficiency of Suc2 in recombinants after 48 h inulin fermentation
为了研究5种重组菌利用菊糖发酵产乙醇的能力,利用气相色谱对重组菌发酵液中的乙醇含量进行了测定。5种重组菌的乙醇产量如图4所示,其中BY-AG的乙醇产量最高,可达到(78.11±4.44) g/L,相较于野生型BY-S发酵液中的乙醇含量提高了28%,并且与蔗糖酶酶活及菊糖酶酶活结果一致。而BY-EX、BY-PL、BY-PH及BY-SC与野生型BY-S的乙醇产量相似(P>0.05),同样与菊糖酶酶活结果保持一致。因此,使用spAGA2融合Suc2的重组菌BY-AG的Suc2分泌表达水平显著提高,同时BY-AG也是一株能够利用菊糖高效产乙醇的重组菌。
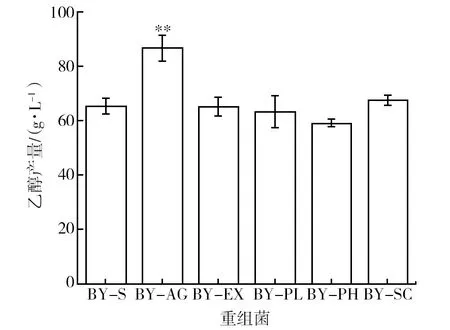
图4 重组菌株菊糖发酵48 h后的乙醇产量分析Fig.4 Ethanol production of recombinants after 48 h inulin fermentation
2.3 异源及优化的分泌信号肽对Suc2分泌能力的影响
为了探究酿酒酵母异源分泌信号肽及优化的分泌信号肽对蔗糖转化酶Suc2分泌能力的影响,利用RF克隆策略,将3种酿酒酵母异源的分泌信号肽spPRO、spDAN4、spMSB2及3种优化后的分泌信号肽spMFαnat、spMFαopt、spHECH融合转化至S.cerevisiaeBY4741中。得到6种重组菌BY-PR、BY-DA、BY-MS、BY-NA、BY-OP及BY-HE。如表3所示,其中spMSB2的疏水性最高为1.210,根据替换内源分泌信号肽后的结果,可以预测,对于蔗糖转化酶Suc2而言,spMSB2将提供更高的跨膜效率,从而使Suc2的表达量提高。
首先,本研究利用Western blot检测了6种重组菌发酵48 h后细胞内Suc2的表达水平(图5A),灰度分析结果如图6B所示,6种重组菌细胞内Suc2的表达水平与野生型BY-S相似(P>0.05)。以上结果与内源信号肽重组菌结果一致,进一步验证,不同分泌信号肽对Suc2细胞内的表达水平几乎没有影响。为了进一步确定不同信号肽对Suc2的分泌能力的影响,利用Western blot检测了6种重组菌发酵48 h后发酵液上清中Suc2的表达水平,如图5C所示,在140 kDa处可见明显Suc2条带。灰度分析结果如图5D所示,BY-PR、BY-DA、BY-MS及BY-HE中的Suc2表达水平有明显提高,其中BY-MS的表达量最高,与预测结果一致。而BY-NA中的Suc2表达水平与野生型BY-S相似,BY-OP中的Suc2表达水平相较于野生型BY-S有所降低。

图5 重组菌株菊糖发酵48 h后Suc2表达水平分析Fig.5 Expression levels of Suc2 in recombinants after 48 h inulin fermentationA:胞内Suc2的蛋白质印迹;B:胞内Suc2表达水平定量分析;C:发酵液上清中Suc2的蛋白质印迹;D:发酵液上清中Suc2表达水平定量分析;以BY-S中Suc2的表达量进行归一化处理,设置为1.0A: Western blot analysis of intracellular Suc2; B: Quantitative analysis of intracellular Suc2 expression levels; C: Western blot analysis of extracellular Suc2; D: Quantitative analysis of extracellular Suc2 expression levels;The expression level of Suc2 in BY-S was normalized as 1.0
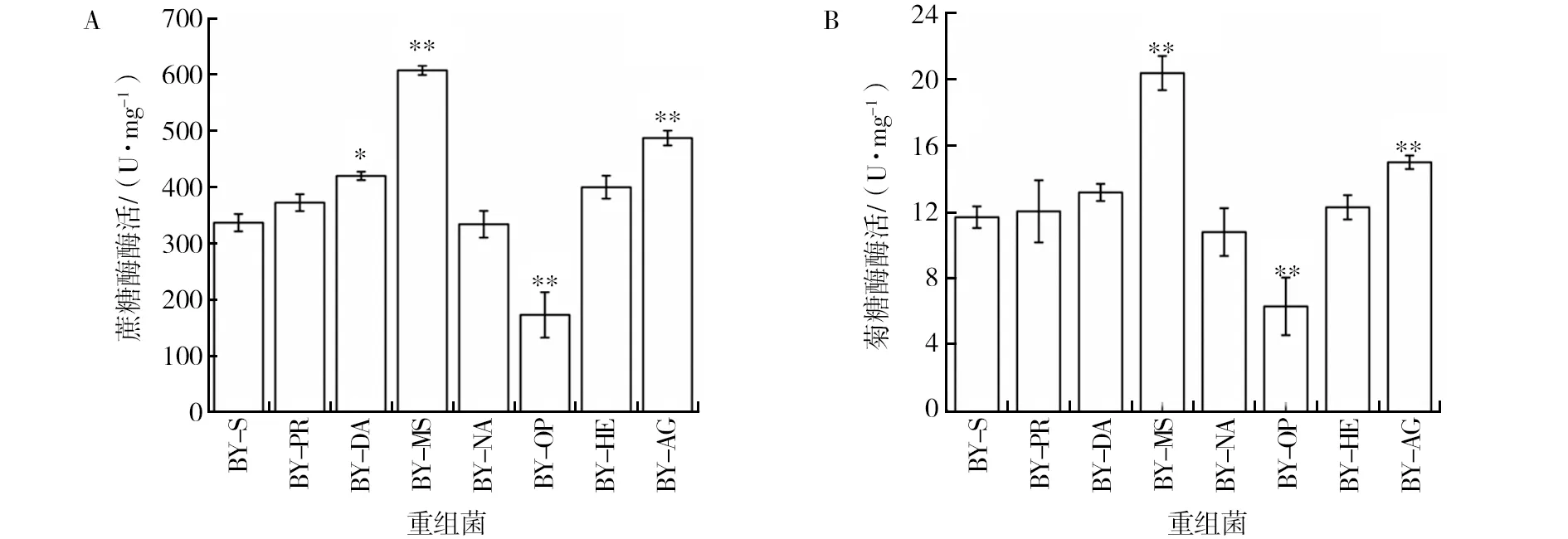
图6 重组菌株菊糖发酵48 h后的蔗糖酶酶活(A)及菊糖酶酶活(B)Fig.6 Invertase activity(A) and inulin activity(B) of recombinants after 48 h inulin fermentation* 代表实验菌株与对照存在显著性差异(P<0.05),** 代表实验菌株与对照存在极显著性差异(P<0.01),图7、8同* There is a significant difference between the strain and control (P<0.05),** There is a very significant difference between the strain and control (P<0.01),figure 7 and figure 8 are the same
为了比较不同异源及优化分泌信号肽和内源分泌信号肽spAGA2对Suc2分泌能力的影响,在48 h菊糖发酵的条件下,BY-PR、BY-DA、BY-MS、BY-NA、BY-OP、BY-HE及BY-AG的蔗糖酶酶活如图6A所示,BY-DA、BY-MS及BY-HE相较于未改造分泌信号肽的野生型BY-S的蔗糖酶酶活有显著提高,其中最高的BY-MS较野生型提高了80%,同时BY-MS较改造内源分泌信号肽的BY-AG提高了24%。BY-PR与BY-NA的蔗糖酶酶活与野生型相似(P>0.05),而BY-OP的蔗糖酶酶活则较野生型降低了50%。在48 h菊糖发酵的条件下,BY-PR、BY-DA、BY-MS、BY-NA、BY-OP、BY-HE及BY-AG的菊糖酶酶活如图6B所示,BY-MS及BY-HE相对于野生型BY-S的菊糖酶酶活有显著提高,其中最高的BY-MS较野生型提高了74%,较BY-AG提高了35%。BY-PR、BY-DA、BY-NA及BY-HE的菊糖酶酶活与野生型相似(P>0.05),而BY-OP则较野生型降低了53%。结果表明,异源分泌信号肽具有提高Suc2的表达水平的潜力,而序列优化改造的信号肽spMFαopt却使Suc2的表达水平显著降低,说明spMFαopt不适用于蔗糖转化酶Suc2。
为验证上述结果,对BY-PR、BY-DA、BY-MS、BY-NA、BY-OP、BY-HE及BY-AG的分泌效率进行了测定。如图7所示,分泌效率最高的BY-MS较野生型BY-S提高了20%,BY-OP分泌效率最低,相较于野生型降低了33%,且与蔗糖酶酶活和菊糖酶酶活结果一致。而BY-PR、BY-DA、BY-NA及BY-HE的分泌效率与野生型相似(P<0.05)。本研究结果与Duan等[20]的研究一致。该团队使用spMSB2融合yEGFP、Gal、SECA后使其细胞外产量提高了1.5~8.0倍。
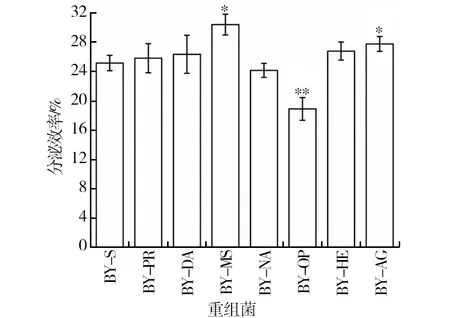
图7 重组菌株菊糖发酵48 h后Suc2的分泌效率Fig.7 The secretory efficiency of Suc2 in recombinants after 48 h inulin fermentation
为了研究重组菌利用菊糖发酵产乙醇的能力,利用气相色谱对重组菌发酵液中的乙醇含量进行了测定。重组菌的乙醇产量如图8所示,其中BY-MS的乙醇产量最高,可达到(86.31±2.59) g/L,相较于野生型BY-S发酵液中的乙醇含量提高了56%,相较于BY-AG提高了7%,并且与蔗糖酶酶活及菊糖酶酶活结果一致。而BY-PR、BY-DA、BY-NA、BY-OP及BY-HE与野生型BY-S的乙醇产量相似(P>0.05)。因此,使用spMSB2融合Suc2的重组菌BY-MS的Suc2分泌表达水平显著提高,同时BY-MS也是一株能够利用菊糖高效产乙醇的重组菌。
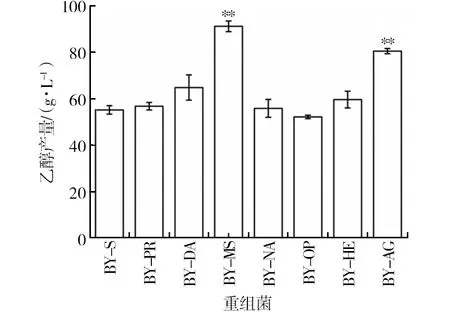
图8 重组菌株菊糖发酵48 h后的乙醇产量分析Fig.8 Ethanol production of recombinants recombinants after 48 h inulin fermentation
2.4 BY-MS摇瓶发酵性能分析
为了对先前实验中发酵性能最优异的重组菌BY-MS进行进一步表征,将BY-S与BY-MS分别以1%的接种量接种到菊糖培养基进行厌氧发酵,在对数生长前期每4 h取一次样,此后每12 h取一次样,对样品生物量、蔗糖酶酶活、残糖总量及乙醇产量进行测定。如图9所示,随着菌体不断生长,BY-S与BY-MS的菊糖消耗量均不断增加,两者均在24 h生物量达到峰值,且BY-MS显著高于BY-S(P<0.05),推测是由于BY-MS的蔗糖转化酶Suc2表达量提高,更有效的利用菊糖供给重组菌生长。随后由于发酵过程中代谢物质的产生,如乙醇、乙酸等,以上物质不利于菌体生长,此后生物量呈现出逐渐下降趋势。与此同时,BY-S与BY-MS的蔗糖酶酶活随着时间推移逐渐升高,可能是由于Suc2在发酵过程中逐渐积累的原因,在48 h时,BY-MS的蔗糖酶酶活达到(126.61±7.20) U/mL显著高于BY-S的(81.35±1.06) U/mL(P<0.01)。最后,BY-S与BY-MS的乙醇产量均在48 h达到峰值,其中BY-MS发酵液中的乙醇产量(81.35±1.07) g/L显著高于BY-S的(56.45±1.06) g/L(P<0.01),且BY-MS乙醇生产强度(1.69 g/(L·h))显著高于BY-S(1.18 g/(L·h))。Yuan等[28]在酿酒酵母JZIC的染色体上整合了黑曲霉的菊糖内切酶基因,并优化了其启动子和信号肽,结果表明,含有启动子TDH3ph和信号肽MFα的重组菌可以有效水解菊糖,其利用比本工作初始浓度更高的200 g/L菊糖发酵48 h的乙醇产量达到55.3 g/L。与之相比,BY-MS利用更低浓度的菊糖(150 g/L)在相同的发酵时间内,生产了更高浓度的乙醇(81.35 g/L),表现出更好的发酵性能。以上结果表明,BY-MS中蔗糖转化酶Suc2的表达水平显著高于野生型BY-S,同时可以更好的利用菊糖生产乙醇。
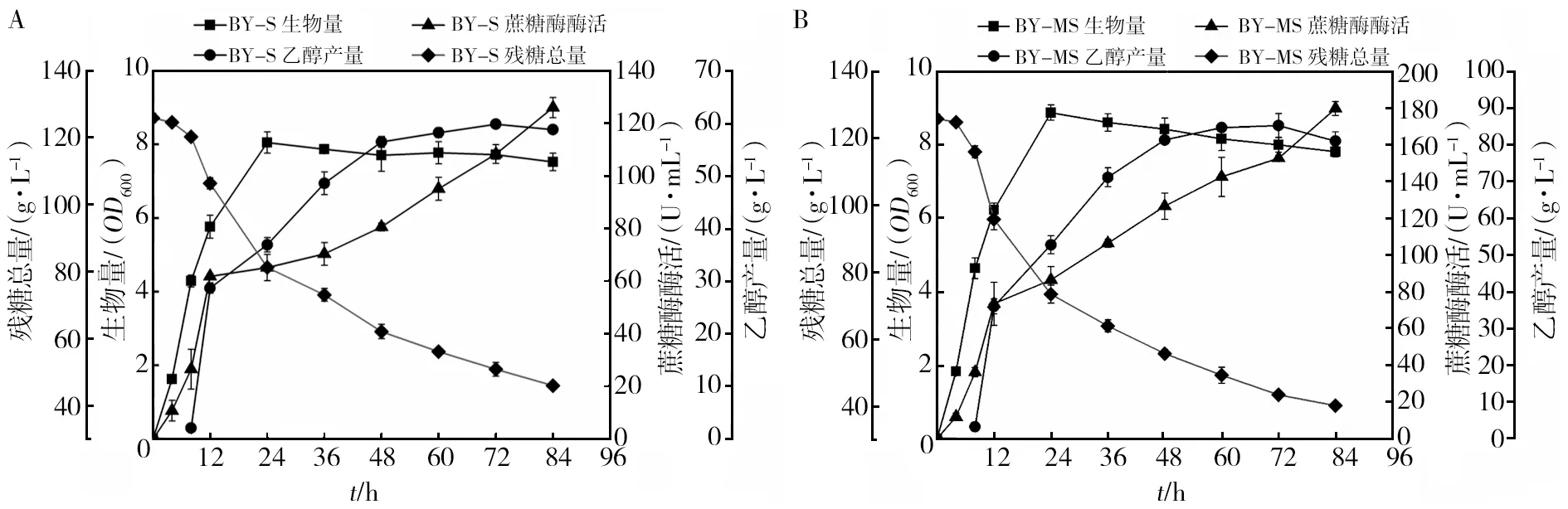
图9 重组菌株BY-S(A)、BY-MS(B)发酵过程中生物量、蔗糖酶酶活、乙醇产量和残糖总量的测定Fig.9 Determination of biomass, invertase activity, ethanol production and total residual sugar during fermentation of recombinant strains BY-S (A) and BY-MS (B)
3 讨 论
燃料乙醇是一种可再生的清洁生物质能源,其工业化生产对缓解能源压力、保护及改善生态环境具有重要意义[29-30]。以菊糖为原料,利用酿酒酵母生产生物乙醇具有节约生产成本、产量高等优点[31]。其中,天然酿酒酵母中利用菊粉的关键水解酶—蔗糖转化酶Suc2分泌表达水平较低,直接影响其转化菊糖产乙醇的效率,无法满足工业需求。本研究为提高酿酒酵母中蔗糖转化酶Suc2的分泌水平,选择了11种不同的分泌信号肽,包括酿酒酵母内源性、其他菌株来源以及已报道序列优化改造的信号肽,随后,使用RF克隆的策略将11种分泌信号肽与蔗糖转化酶Suc2融合,并构建了相应的表达菌株。对所有重组菌的蛋白分泌水平、酶活及乙醇产量的测定结果表明,不同的分泌信号肽指导Suc2分泌到细胞外的能力各有不同。其中,含有来源于毕赤酵母黏性蛋白信号肽MSB2的重组菌BY-MS的蛋白分泌水平、酶活及乙醇产量,相对于未改造分泌信号肽的原始菌有显著提高。重组菌BY-MS的蔗糖酶酶活与菊糖酶酶活较野生型BY-S分别提高了80%和74%,蔗糖转化酶Suc2的分泌效率提高了20%。同时,重组菌BY-MS利用菊糖产乙醇的能力提高了56%,产量达到86.31 g/L。最后对重组菌BY-MS摇瓶发酵性能分析时发现,发酵48 h时,BY-MS的乙醇生产强度达到峰值,BY-MS乙醇生产强度(1.69 g/(L·h))较野生型BY-S(1.18 g/(L·h))提高了44%。
目前,越来越多的新策略被用于酿酒酵母的菊糖发酵过程优化、菌种改良及代谢调控中,以克服菌株自身局限性[4]。Onsoy等[32]比较了酸处理菊糖法和菊糖酶水解菊糖后发酵生产乙醇的效果,结果表明,当用硫酸水解菊芋汁后进行乙醇发酵时,其生产能力为0.65 g/(L·h),而用菊糖酶水解菊芋汁后发酵生产乙醇的生产能力为 0.39 g/(L·h)。Yuan等[33]将马克斯克鲁维酵母和假丝酵母外切菊糖酶基因在酿酒酵母中的表达,并比较了两种重组子利用菊糖发酵产乙醇的性能,结果表明,来自于假丝酵母的外切菊糖酶基因更适于构建酿酒酵母工程菌,其乙醇生产强度为1.35 g/(L·h)。Hong等[34]在酿酒酵母D452-2中异源表达了马克斯克鲁维酵母外切菊糖酶基因,并优化改造了其启动子和分泌信号肽,结果表明含有启动子PGK1和分泌信号肽MFα的重组菌利用188.2 g/L菊糖发酵66 h乙醇产量达到80.2 g/L,乙醇生产强度为1.22 g/(L·h)。与以上研究成果相比,本研究构建的酿酒酵母重组菌BY-MS利用低于文献报道的菊糖浓度(150 g/L)发酵时,乙醇生产强度(1.69 g/(L·h))更高,表现出更好的发酵菊糖产乙醇性能。本研究为提高蔗糖转化酶Suc2的分泌水平、构建高效菊糖基乙醇生产菌株提供参考。

