炎调方维持肺泡上皮细胞水液代谢平衡减轻肺损伤的机制研究*
徐梦菡 施 荣 熊旭东
(上海中医药大学附属曙光医院,上海 201203)
脓毒症是引起急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)重症的常见病因,肺部大量渗出性病变引起的肺水肿是其主要病理生理表现[1],治疗存在难点。肺泡内外的液体平衡因多种因素被破坏从而引发肺水肿,肺泡上皮细胞(AEC)上的钠水转运系统维持肺泡内外液体平衡[2]。
课题组经过多年临床和基础实验,制定了炎调方用于治疗脓毒症急性肺损伤。临床研究显示,炎调方能够减轻脓毒症致急性肺损伤(ALI)患者的炎症反应,提高患者氧合水平。基础研究也显示,炎调方能减轻脓毒症致ALI大鼠炎症介质释放,减轻肺部渗出,但其作用机制尚未完全清楚。本实验拟通过观察炎调方对维持肺泡上皮细胞水液代谢平衡的影响,探讨其对脓毒症诱发急性肺损伤的可能机制,为进一步阐明炎调方治疗脓毒症致ALI的作用机制提供实验数据。
1 材料与方法
1.1 动物与细胞
72 只清洁级SD 成年雄性大鼠(由上海西普尔-必凯实验动物有限公司提供),体质量200~220 g,由上海中医药大学动物实验中心提供并饲养。大鼠肺泡Ⅱ型细胞RLE-6TN购自中国科学院细胞库。
1.2 试药与仪器
炎调方由赤芍、当归、生大黄、芒硝、桃仁、玄参等组成,以上饮片均由上海中医药大学附属曙光医院提供,制备成含生药1.0 g/mL 的黄棕色透明液体,4 ℃保存备用。表面活性蛋白(SP-D)ELISA检测试剂盒(上海臻科生物,ZK-5092);ENaC、NKAα1、NKAβ1、AQP1、AQP5 和GAPDH 一抗(美国CST 公司);BCA 蛋白定量试剂盒(南京建成生物工程研究所);RPMI 1640 培养基(美国GIBCO 公司)。药物血清制备:正常大鼠进行炎调方灌服,连续3 d,每日1 次,在末次灌胃1 h 后从进行腹腔动脉取血,在无菌条件下进行分离血清、加热灭活备用。CO2细胞恒温培养箱(美国Thermoforma 公司),Healforce 生物安全柜(香港力康发展有限公司),倒置显微镜(CKX41)(日本Olympus 公司),匀浆器Polytron PT10-35 组织扩散仪(瑞士Kinematica 公司),WH-861漩涡混合器(上海科达测试仪器厂)。
1.3 模型制备
脓毒症模型采用盲肠结扎穿孔术(CLP)制备:大鼠用2% 戊巴比妥钠(40 mg/kg)麻醉后,在腹正中行1.5 cm切口,找到盲肠并在根部进行结扎,用18号针穿孔3 次,挤出少量肠内容物,留置2 mm 皮瓣防止针孔闭合,将盲肠回纳入腹腔,缝合腹壁,术后在皮下注射生理盐水(30 mL/kg)抗休克。
1.4 分组与给药
72 只雄性SD 大鼠随机分为4 组。正常对照组6只,麻醉后腹主动脉采血。假手术组6 只,麻醉后开腹后仅翻动肠道,然后关腹,12 h后麻醉并腹主动脉采血致死。模型组24 只,分别在CLP 后的2、8、12、24、48 h麻醉并腹主动脉采血致死,每个时间点6 只。炎调方组:造模前进行炎调方灌胃(9.9 g/kg)3 d,每日1 次,第3 次灌胃后2 h 行CLP 术造模,分别于CLP 后2、8、12、24 h麻醉并腹主动脉采血致死,每个时间点6只。
1.5 标本采集与检测
1.5.1 肺湿/干重比 将大鼠的左肺取出,使用干燥滤纸吸去组织表面的多余水分,放置在电子天平上称重(湿重),后置于60 ℃烤箱内进行干烤处理,持续时间为72 h,干烤结束后待其冷却再次称重(干重),计算肺的湿/干重比(湿/干重比=湿重÷干重)。
1.5.2 血气指标 在CLP后的2、8、12、24、48 h麻醉大鼠并穿刺腹主动脉采血2 mL,立即将血样转移到血气分析仪中进行分析,以测量大鼠动脉血液中的氧分压(PO2)和二氧化碳分压(PCO2)。
1.5.3 细胞存活率 采用MTT 比色法检测炎调方含药血清10%、20%、30%浓度对LPS 诱导的大鼠肺泡Ⅱ型细胞RLE-6TN 存活率的影响。LPS 100 ng/mL 预处理细胞2 h,再加入不同浓度的炎调方含药血清,培养2、12 h,避光环境下每孔加入5 g/L MTT 溶液20 μL,37 ℃5%CO2培养箱内继续培养4 h,吸弃上清,每孔加入DMSO 150 μL。观察490 nm 波长处的吸光度OD。细胞存活率=OD药物组÷OD空白组×100%。
1.5.4 酶联免疫吸附试验(ELISA) 按照ELISA试剂盒说明书进行大鼠血清和细胞上清液中SP-D的含量检测。
1.5.5 免疫细胞化学检测 制备细胞爬片,经磷酸盐缓冲液(PBS)冲洗、4%多聚甲醛固定、3%过氧化氢处理、血清封闭等步骤,加入一抗,4 ℃孵育过夜。次日,PBS冲洗,滴加荧光二抗,读片。免疫印迹法检测:配制蛋白裂解液RIPA∶PMSF(100∶1),加入肺组织碎块中,蛋白裂解液与组织体积比为9∶1,匀浆,12 000 r/min,4 ℃条件下离心15 min,取上清。提出蛋白,BCA 蛋白测定试剂盒测定蛋白浓度,计算各组蛋白上样体积。SDSPAGE,浓缩胶80 V,分离胶恒压110 V,待溴酚蓝至凝胶底部停止电泳。转膜、封闭、一抗(1∶1 000)孵育4 ℃过夜,二抗(1∶10 000)稀释,室温下孵育2 h 后。化学发光成像系统进行检测、拍照。
1.6 统计学处理
2 结 果
2.1 各组大鼠肺湿重/干重(W/D)比较
见表1。造模后2 h和8 h,炎调方低、中、高剂量组的大鼠肺湿重/干重与模型组无显著差异(P>0.05);造模后12 h,仅炎调方高剂量组能显著降低脓毒症大鼠肺湿重/干重(P<0.05),而在24 h 和48 h,与模型组比较,炎调方中、高剂量组均降低了脓毒症大鼠肺湿重/干重(P<0.05)。
表1 各组脓毒症大鼠肺湿重/干重比较(±s)

表1 各组脓毒症大鼠肺湿重/干重比较(±s)
注:与模型组比较,*P <0.05。下同。
组 别假手术组模型组低剂量组中剂量组高剂量组2 h 3.73±0.29 4.19±0.58 4.25±0.51 4.17±0.52 4.11±0.25 8 h 3.69±0.29 4.87±0.63 4.40±0.36 4.33±0.45 4.33±0.27 12 h 3.75±0.29 5.27±0.27 5.12±0.15 4.86±0.18 4.31±0.15*24 h 3.77±0.29 5.65±0.19 5.64±0.25 5.02±0.14*4.60±0.15*48 h 3.67±0.29 5.70±0.58 5.46±0.68*5.01±0.30*4.49±0.26*
2.2 各组大鼠血气指标比较
见表2。造模后2 h、8 h 和12 h,炎调方低、中、高剂量组PO2与模型组无显著差异(P>0.05);而在造模后24 h 和48 h,与模型组比较,炎调方中、高剂量组均升高了脓毒症大鼠PO2(P<0.05)。造模后2 h和8 h,炎调方低、中、高剂量组PCO2与模型组无显著差异(P>0.05);造模后12、24、48 h,炎调方低、中、高剂量组显著降低了脓毒症大鼠PCO2(P<0.05)。
表2 各组大鼠PO2、PCO2比较(mmHg,±s)
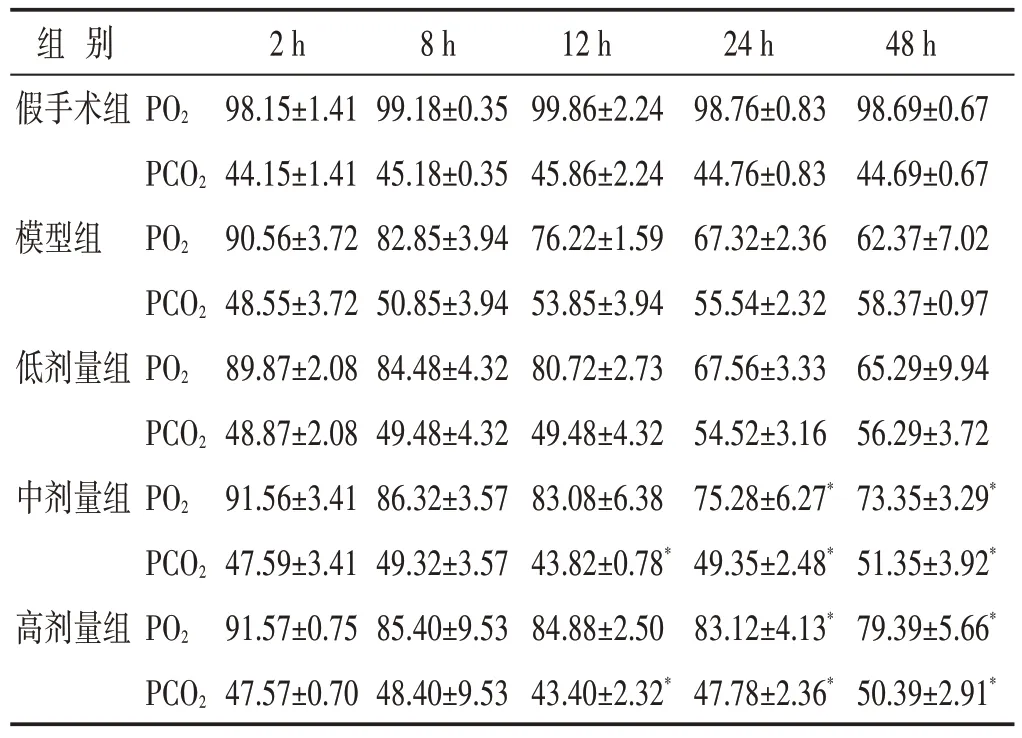
表2 各组大鼠PO2、PCO2比较(mmHg,±s)
组 别假手术组模型组低剂量组中剂量组高剂量组PO2 PCO2 PO2 PCO2 PO2 PCO2 PO2 PCO2 PO2 PCO2 2 h 98.15±1.41 44.15±1.41 90.56±3.72 48.55±3.72 89.87±2.08 48.87±2.08 91.56±3.41 47.59±3.41 91.57±0.75 47.57±0.70 8 h 99.18±0.35 45.18±0.35 82.85±3.94 50.85±3.94 84.48±4.32 49.48±4.32 86.32±3.57 49.32±3.57 85.40±9.53 48.40±9.53 12 h 99.86±2.24 45.86±2.24 76.22±1.59 53.85±3.94 80.72±2.73 49.48±4.32 83.08±6.38 43.82±0.78*84.88±2.50 43.40±2.32*24 h 98.76±0.83 44.76±0.83 67.32±2.36 55.54±2.32 67.56±3.33 54.52±3.16 75.28±6.27*49.35±2.48*83.12±4.13*47.78±2.36*48 h 98.69±0.67 44.69±0.67 62.37±7.02 58.37±0.97 65.29±9.94 56.29±3.72 73.35±3.29*51.35±3.92*79.39±5.66*50.39±2.91*
2.3 各组大鼠血清SP-D水平比较
见表3。造模后2、8、12 h,炎调方低、中、高剂量组SP-D 与模型组无显著差异(P>0.05);造模后24 h 和48 h,与模型组比较,炎调方中、高剂量组均降低了脓毒症大鼠SP-D 水平(P<0.05),且在造模48 h 后,炎调方低剂量组也能显著抑制模型组诱导的SP-D 水平(P<0.05)。
表3 各组大鼠SP-D水平比较(g/L,±s)

表3 各组大鼠SP-D水平比较(g/L,±s)
组 别假手术组模型组低剂量组中剂量组高剂量组2 h 39.27±4.28 102.20±25.24 99.92±12.92 98.58±30.37 98.98±15.45 8 h 39.38±3.56 107.20±22.44 101.40±21.27 99.53±14.25 99.67±14.01 12 h 42.23±2.60 88.57±5.98 87.07±16.75 83.95±9.29 82.57±15.44 24 h 41.40±4.25 100.02±4.65 94.58±8.96 92.30±17.57*72.22±11.09*48 h 39.77±3.27 97.35±9.57 84.28±18.19*86.10±15.45*79.58±15.85*
2.4 各组大鼠肺组织中离子通道相关蛋白表达比较
见图1。脓毒症手术造模后,模型组离子通道相关蛋白表达均低于假手术组;造模2、8、12、24、48 h,炎调方均以剂量依赖性地增加α-ENaC、NKAα1、NKAβ1蛋白表达;造模48 h,炎调方高剂量组显著增加了AQP1蛋白表达;造模8 h,炎调方高、中、低剂量组均能提高AQP5表达。

图1 各组大鼠肺组织中α-ENaC、NKAα1、NKAβ1、AQP1和AQP5蛋白表达
2.5 各组大鼠肺泡Ⅱ型细胞存活率比较
见表4。LPS干预细胞后,炎调方不同浓度处理细胞2 h对其存活率无显著影响;而炎调方不同浓度处理细胞12 h 后,显著提高了RLE-6TN 细胞的存活率(P<0.05)。
表4 各组大鼠肺泡巨噬细胞RLE-6TN存活率比较(%,±s)

表4 各组大鼠肺泡巨噬细胞RLE-6TN存活率比较(%,±s)
组 别假手术组模型组低剂量组中剂量组高剂量组2 h 1.58±0.07 1.38±0.05*1.39±0.06 1.41±0.04 1.48±0.07 12 h 2.07±0.03 1.59±0.07*1.62±0.03 1.68±0.05*1.76±0.02*
2.6 各组大鼠肺泡巨噬细胞RLE-6TN 上清中SP-D水平比较
见表5。炎调方中剂量(20%药物血清)和高剂量(30%药物血清)处理细胞12 h均显著降低了LPS 诱导的SP-D水平(P<0.05)。
表5 各组大鼠肺泡巨噬细胞RLE-6TN上清中SP-D水平比较(g/L,±s)

表5 各组大鼠肺泡巨噬细胞RLE-6TN上清中SP-D水平比较(g/L,±s)
组 别对照组模型组低剂量组中剂量组高剂量组2 h 13.49±0.89 23.04±1.07*21.26±1.36 21.59±0.43 19.24±1.71△12 h 15.18±1.09 36.05±2.11*36.29±3.01 31.19±1.28△25.83±0.81△
2.7 各组大鼠肺泡Ⅱ型细胞RLE-6TN 中离子通道相关蛋白表达
见图2。免疫荧光实验显示,炎调方处理细胞2、12 h,中、高剂量药物血清均能增加α-ENaC、NKAα1、NKAβ1、AQP1和AQP5蛋白表达。

图2 各组大鼠肺泡Ⅱ型细胞RLE-6TN中α-ENaC、NKAα1、NKAβ1、AQP1和AQP5蛋白表达
3 讨 论
脓毒症是宿主对感染反应失调引起的危及生命的器官功能障碍,其诱发ALI/ARDS 与多种信号通路相关[3-5]。有关ALI/ARDS 的治疗仍是当前难点,除积极抗感染治疗原发病外,现代医学以机械通气、血液净化等治疗为主要措施,但未能有效降低死亡率。通过临床观察,笔者发现脓毒症主要证型为热毒内盛证。究其病因病机乃邪毒内陷于腑,容于营血。针对以上主要病机,笔者临床应用炎调方发现其对脓毒症中多种炎症介质超量释放具有抑制作用,并能改善ALI 患者氧合[6-8]。为进一步研究其可能机制,笔者开展了动物实验,研究结果显示炎调方能有效保护肺组织,减轻肺部渗出[9-10]。
脓毒症引起的多种炎症细胞和炎性介质浸润易引起AEC 受损[11-12],最终导致大量液体在肺间质及肺泡内聚集,出现严重通气/血流比例失调,发展为ALI/ARDS[2]。AEC 对液体重吸收能力是减轻肺水肿的关键因素,AECⅡ主要负责维持正常肺水转运,使肺泡内外液体维持平衡[13]。肺泡上皮细胞钠水转运系统由Na+-K+-ATP 酶(NKA)、钠通道(ENaC)、水通道(AQP)组成。AECⅡ上的钠通道以ENaC-α 为主,过量肺泡液的吸收依赖于NKA 和ENaC 活性[14-16]。同时,AECI覆盖面占肺泡总面积的90%,其上也存在ENaC,在钠水转运系统中也占有重要地位[17]。AQP1 和AQP5 是重要的水通道蛋白,研究表明,LPS 可以通过抑制AQP1和AQP5的表达从而诱导大鼠急性肺损伤[18]。
基于以上研究进展,为进一步明确炎调方治疗ALI/ARDS的可能机制,笔者假设炎调方抑制脓毒症大鼠肺部渗出的机制可能与通过肺泡上皮细胞调节水液代谢有关。研究通过体内与体外实验相结合,围绕钠水转运系统开展。动物实验结果显示,炎调方能显著抑制模型组诱导的肺湿重/干重增加,降低SP-D 水平,降低PO2和PCO2,说明炎调方可以缓解模型组诱导的肺损伤。进一步发现炎调方组中钠水转运系统蛋白表达增加,表明炎调方可能通过增强钠水转运系统从而减轻肺水肿。体外实验显示,炎调方能显著降低了LPS 诱导的RLE-6TN 的死亡率以及SP-D 水平,增加钠水转运系统蛋白表达。以上结果说明,炎调方能通过调节大鼠AECII 调控钠水转运系统保障肺泡内外液体平衡,缓解脓毒症大鼠肺水肿。结合以上结果,笔者进一步丰富了炎调方治疗脓毒症致ALI/ARDS 的作用机制。
ALI/ARDS病理生理由多种细胞和信号通路参与,但目前相关机制仍未完全明确,也导致我们的研究存在一定的局限性。也因中药复方组成成分的复杂性和作用机制可能存在多靶点,因此,炎调方治疗ALI有效成分和核心机制仍需进一步研究阐明。

