RT-3DE、TDI及2D-STI超声技术对乳腺癌蒽环类化疗患者亚临床心脏毒性的预测价值
贾玄慧,亢春苗,沈亚梅,刘莹,朱媛
陕西省人民医院超声诊断中心1、肿瘤内科2,陕西 西安 710068
目前,乳腺癌在世界范围内的新发病例多于肺癌,已发展为第一大癌,且随着乳腺癌诊断、干预技术的快速发展,患者的生存率也不断升高[1-2]。化疗是临床治疗乳腺癌较为重要且常用的一种方式,一方面会提高患者的生存率,另一方面还会降低死亡率、复发率。当前,化疗药物种类繁多,其中以蒽环类药物应用最为广泛,但是蒽环类药物在抗肿瘤的同时会导致心脏毒性,使患者发生亚临床心脏功能障碍、扩心病、心律失常及症状明显的心力衰竭等副作用[3]。相关研究表明,蒽环类药物造成的心脏毒性是乳腺癌化疗患者合并心力衰竭的重要致病原因,相较于其他心力衰竭病因,化疗所致心力衰竭的预后较差[4]。因此,及时发现蒽环类药物导致的亚临床心脏毒性能够辅助临床调整干预方案,降低乳腺癌化疗患者发生心血管不良事件的风险,进而提升生活质量。近年来,实时三维心脏超声(RT-3DE)、组织多普勒成像(TDI)及二维斑点追踪成像(2D-STI)等超声技术在乳腺癌患者诊断中得到广泛应用,能够准确评估心室收缩及舒张功能,进而判断患者是否出现心脏功能障碍[5]。基于此,本研究将探讨RT-3DE、TDI及2D-STI三种超声技术对乳腺癌蒽环类化疗患者亚临床心脏毒性的预测价值。
1 资料与方法
1.1 一般资料 回顾性分析2021 年8 月至2022年10月陕西省人民医院收治的30例选择蒽环类药物化疗的乳腺癌患者的临床资料。纳入标准:(1)确诊为乳腺癌,同时HER-2 为阳性;(2)临床资料完整;(3)在本院进行化疗;(4) TNM 为Ⅱ~Ⅲ期;(5)病历资料完整,且能随访调查者。排除标准:(1)病灶出现转移;(2)预计生存期不足3 个月;(3)属于过敏体质,或对研究药物有禁忌证;(4)合并其他恶性肿瘤;(5)处于哺乳期或妊娠期。年龄29~63 岁,平均(47.94±8.46)岁。本研究经我院医学伦理委员会批准。
1.2 治疗方法 所有患者的化疗方案均为表柔比星联合环磷酰胺,表柔比星60 mg/m2,静脉推注d1~d2,一周期为21 d。
1.3 检查方法 所有患者均于化疗前、化疗3个周期后(表柔比星剂量180 mg/m2)及化疗6个周期后(表柔比星剂量360 mg/m2)进行RT-3DE、TDI 及2D-STI检查。具体操作:(1)检查前准备:叮嘱患者保持左侧卧位,呼吸平静后,记录肢体导联心电图,二维超声图像大于60帧/s;(2)RT-3DE检查:选择GE Vivid E95三维容积探头M5S,调节仪器参数与探头位置,并帧频超过20 帧/s,清晰显示心尖四腔心切面,调整图像,点击触摸屏上Tri-plane,进入4D模式获取连续6 个连续心动周期左室全容积动态图像,应用EchoPAC工作站脱机后处理图像,分别于舒张和收缩末期各取二尖瓣环中点和心尖部内膜面一点,软件自动勾画及手动微调后获取左心室舒张末容积(LVEDV)、左心室收缩末容积(LVESV)、三维左室射血分数(3D-LVEF);(3)TDI检查:选择TDI成像模式,测量心尖四腔新切面状态下的室间隔侧早期舒张速度(septal e')、二尖瓣环侧壁早期舒张速度(laterale'),计算E/e';(4)2D-STI 检查:连续采集3个心动周期心尖三、四、两腔心的动态实时二维灰阶图像,将应变分析软件启动,选择心肌节段6 个,并手动修正区域宽度使心室壁运动被准确追踪,自动识别心内膜并生成应变-时间曲线,对应变-时间曲线进行手动分析,若跟踪欠佳需再次对心内膜边界进行扫描。若跟踪理想,使2D-整体纵向应变(GLS)自动生成。
1.4 观察指标 (1)比较患者化疗前后的RT-3DE、TDI 及2D-STI 参数,包括LVEDV、LVESV、3D-LVEF、E/e'、2D-GLS指标的变化;(2)基于3D-LVEF,统计化疗6个周期后乳腺癌患者的亚临床心脏毒性发生率。亚临床心脏毒性诊断[6]:LVEF下降>10%且绝对值≥50%或同基线比较,GLS 减低>15%;(3) RT-3DE、TDI 及2D-STI参数诊断亚临床心脏毒性的效能。
1.5 统计学方法 应用SPSS23.0统计软件进行数据统计分析。计量资料符合正态分布,以均数±标准差(±s)表示,重复测量资料采用方差分析,组间两两比较采用t检验;计数资料比较采用χ2检验;选择受试者工作特征曲线(ROC)分析RT-3DE、TDI及2D-STI参数对亚临床心脏毒性的预测价值。均以P<0.05 为差异有统计学意义。
2 结果
2.1 患者化疗前后的RT-3DE、TDI 及2D-STI 参数比较 化疗前及化疗3 个周期、6 个周期后,患者的LVEDV、LVESV、E/e'比较差异均无统计学意义(P>0.05);化疗3 个周期及6 个周期后,患者的3D-LVEF、2D-GLS均明显低于化疗前,且化疗6个周期后,患者的3D-LVEF 明显低于化疗3 个周期后,差异均有统计学意义(P<0.05),但化疗3个周期及6个周期后的2D-GLS比较差异无统计学意义(P>0.05),见表1和图1。
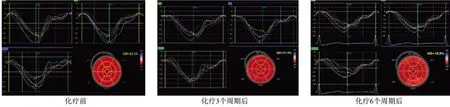
图1 患者化疗前后左室三个心尖切面时间-应变曲线图和左室各节段应变牛眼图Figure 1 Time-strain curves of three apical sections of the left ventricle and the bull's eye maps of strain at each segment of the left ventricle before chemotherapy and after 3,6 cycles of chemotherapy
表1 患者化疗前后的RT-3DE、TDI及2D-STI参数比较(±s,n=30)Table 1 Comparison of RT-3DE,TDI,and 2D-STI parameters before and after chemotherapy(±s,n=30)
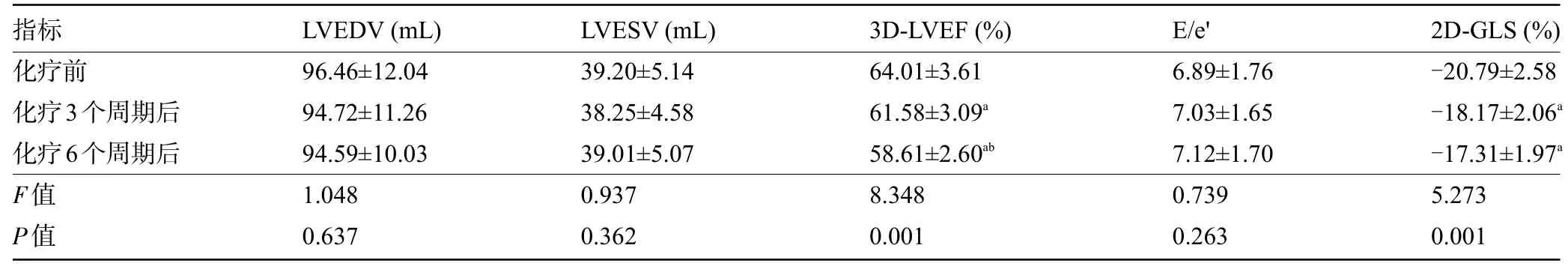
表1 患者化疗前后的RT-3DE、TDI及2D-STI参数比较(±s,n=30)Table 1 Comparison of RT-3DE,TDI,and 2D-STI parameters before and after chemotherapy(±s,n=30)
注:与化疗前比较,aP<0.05;与化疗3周期后比较,bP<0.05。Note:Compared with that before chemotherapy,aP<0.05;compared with that after 3 cycles of chemotherapy,bP<0.05.
?
2.2 化疗期间亚临床心脏毒性发生情况 化疗6 个周期后,30 例乳腺癌化疗患者中4 例出现亚临床心脏毒性,占比13.33%。
2.3 RT-3DE 及2D-STI 参数诊断亚临床心脏毒性的效能 经ROC分析结果显示,3D-LVEF、2D-GLS、3D-LVEF+2D-GLS 诊断亚临床心脏毒性的曲线下面积(AUC)值分别为0.784、0.752、0.815,其中3D-LVEF+2D-GLS 诊断效能最高,其次为3D-LVEF、2D-GLS,见表2。
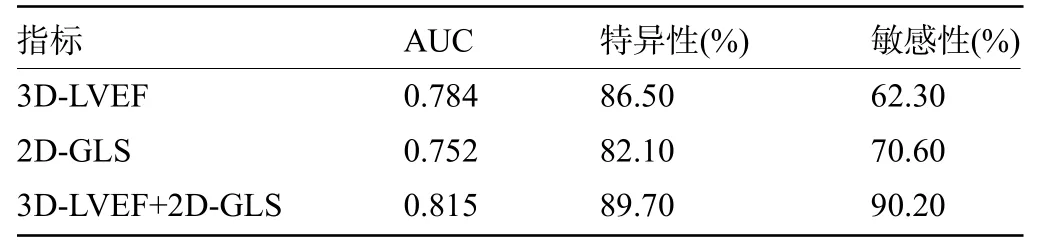
表2 RT-3DE及2D-STI参数诊断亚临床心脏毒性的效能Table 2 Efficacy of RT-3DE and 2D-STI parameters in diagnosing subclinical cardiotoxicity
3 讨论
蒽环类药物属于乳腺癌化疗中较为常用的一种药物,在干预乳腺癌的同时会引发许多不良事件,其造成的心脏毒性为化疗最严重的一种合并症,由于患者在化疗药物下暴露会过早的出现心血管疾病[7]。相关文献显示,经蒽环类药物化疗的患者由于心脏病致死的概率要比一般人群高3.4 倍[8]。目前,蒽环类药物引发的心脏毒性机制还不清楚,可能同氧化应激反应等有关[9]。因此,针对使用蒽环类药物化疗的乳腺癌患者,需关注化疗药引发的心脏毒性,使其被及时发现并干预。
E/e'能够反映左室充盈压力,是评估左室舒张功能的精准、客观指标之一[10]。本研究结果显示,E/e'于化疗前及化疗3个周期、6 个周期后并无明显差异,提示没有患者出现左室舒张功能障碍。近几年,国内外相关文献显示,2D-GLS 为心脏毒性早期预测的较为敏感的指标之一[11-12]。本研究结果显示,化疗3个周期后,2D-GLS 就明显低于化疗前,且在化疗6 个周期后进一步降低,这同上述文献的结论一致。GLS为心室长轴方向发生的形变,是心内膜中纵向心肌纤维在收缩过程中产生的,且在整个心肌内,纵向心肌纤维占比较大,在心脏正常作用维持方面较为重要。于心内膜下,蒽环类药物有较高浓度,同中间肌层环形纤维比较,纵向纤维受到的影响最早。所以,在使用蒽环类药物进行化疗后,GLS 参数变化较早,同时较明显。但是2D-STI 主要追踪的是二维平面上的心肌斑点,由于心脏属于动态三维立体结构,斑点追踪极易丢失,因而GLS对心脏整体功能难以精准反映[13]。
本研究结果显示,RT-3DE 下的3D-LVEF 参数在化疗3 个周期后就出现显著变化,提示RT-3DE 能够较早的发现LVEF值的下降,及时评估左室收缩功能,进而及时预测心脏毒性。由于TDI 及2D-STI 都不能准确地计算左室实际容积,且二维LVEF 的获取受多种因素影响,导致其对早期心脏毒性检测不敏感。RT-3DE 实时动态的将心脏运动及结构显示出来,它克服了心脏腔几何形状的限制,使测量精准性提高,进而利于心功能监测[14-15]。ROC曲线显示,3D-LVEF+2D-GLS诊断亚临床心脏毒性的AUC值为0.815,诊断效能最高。
本研究结果还发现,RT-3DE 在化疗前的可行性欠佳,且于化疗过程中及结束后会进一步限制其可行性,这主要是由于:(1)时间、空间分辨率低,同时随着帧频的增加,图像分辨率会降低,RT-3DE要求图像质量高,如果未能使心内膜较好的显示出来,就会干扰图像分析,特别是对乳腺体积大、吸烟、肥胖的患者影响较大。(2)其扫描角度窄,不能全部显示扩大的左室,从而干扰图像处理。(3)采集图像期间,患者心率、体位变化、呼吸都会干扰无缝隙图像拼接,极易出现重组处错位。(4)乳房再造或切除左侧乳腺患者的胸壁解剖结构的转变会使其可行性降低。(5)本研究没有纳入放疗病例,但Santoro 等[16]文献显示,放疗导致的皮肤损伤会干扰图像质量,进而限制其可行性。
综上所述,RT-3DE 能够在早期识别出乳腺癌蒽环类化疗患者亚临床心脏毒性,且有较高的诊断效能,但是于部分患者中其价值在一定程度上受到了限制,针对此类患者需结合2D-STI进行诊断。

