Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的协同抑制作用
朱泽康,王 昭,聂 蓉,刘国荣,2,3*
(1 北京工商大学食品与健康学院 北京100048 2 北京工商大学老年营养与健康教育部重点实验室 北京100048 3 北京工商大学北京市食品添加剂工程技术研究中心 北京 100048)
世界卫生组织统计全球每年有6 亿人感染食源性疾病,大多数病例是食用受致病性微生物污染的食品导致[1]。铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的可引发呕吐、腹泻等食物中毒不良症状的食源性革兰氏阴性致病菌,在医院感染获得性食源性致病菌病的病例中,铜绿假单胞菌所引起的占比为10%左右[2]。它常见于腐败的水产品、肉类及凉拌即食产品等,如蔬菜沙拉、鱼罐头等[3-4]。
生物被膜(Biofilm,BF)是指细菌黏附于接触表面,分泌多种胞外基质互相黏结、围绕自身而形成的具有某些特定功能或结构的膜。BF 的存在能提高铜绿假单胞菌在各种环境中定植能力及耐药性,其耐药性比浮游态细菌高出10~1 000 倍[5]。BF对细菌有保护作用,不仅可以阻止抗生素等药物发挥作用,还可以帮助逃脱免疫吞噬细胞,导致其难以清除[6]。同时,铜绿假单胞菌的生物被膜对多种物理手段,如高温高压、消毒剂、紫外线照射等具有较强的抵抗力,从而提升了食品中感染铜绿假单胞菌的几率与治理难度[7]。因此,有必要寻找某些药物来有效抑制铜绿假单胞菌BF 的生成。
乳酸链球菌素(Nisin)是乳酸链球菌所分泌的具有抑菌作用的多肽,Nisin 是被FDA/WHO 认证并允许用作食品添加剂且商业化的细菌素,它具有高效抑菌性、高安全性、无残留等特性,能有效抑制或杀死革兰氏阳性菌(Gram-positive bacteria,G+)[8]。然而,G+与革兰氏阴性菌(Gram-negative bacteria,G-)的细胞壁结构不同,Nisin 对于G-一般无抑制效果,因铜绿假单胞菌的BF 存在,故可将Nisin 阻挡在胞外,仅对铜绿假单胞菌起很少的作用[9]。此外,Nisin 的生产成本高,不利于在食品工业中大规模使用。研究表明,通过改变作用时的pH、温度或者联合其它物质能够有效增加G-对Nisin 的敏感性,以及降低Nisin 的使用量[10-11]。有人发现某些中药成分对铜绿假单胞菌的BF 有一定的抑制作用,如董满园等[12]发现150 μmol/mL 和厚朴酚对铜绿假单胞菌PAO1 有抑制作用。谢林利等[13]发现2 μg/mL 的黄芩素可以显著抑制铜绿假单胞菌X140 的黏附性和抑制生物膜的形成。程慧娟等[14]发现50 μg/mL 穿心莲内酯对铜绿假单胞菌PAO1 的生物被膜有抑制作用。
本研究筛选与Nisin 联合的中药成分(和厚朴分、穿心莲内酯、黄芩素),评估Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的协同抑制作用及效果。采用扫描电镜(Scanning electron microscope,SEM)观察铜绿假单胞菌ATCC 9027 生物被膜的结构变化。通过测定其对铜绿假单胞菌生物被膜的组成成分及相关基因表达的影响,探讨和厚朴酚对铜绿假单胞菌生物被膜的抑制机制。旨在减少由铜绿假单胞菌生物被膜引起的食品安全问题,同时为增强G-对Nisin 的敏感性和降低防腐剂使用剂量提供参考依据,为开发新型天然防腐剂提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株 铜绿假单胞菌9027 购于美国标准菌种保藏库(ATCC)。
1.1.2 试验试剂 1%结晶紫染液、乳酸链球菌素、XTT 钠盐、和厚朴酚、黄芩素、穿心莲内酯,塞纳生物科技有限公司;LB 肉汤培养基,北京奥博星生物技术有限责任公司;2.5%戊二醛,雷根生物科技有限责任公司;甲萘醌,梯希爱化成工业有限公司;RNA 提取试剂盒、(SYBR Green)荧光定量预混试剂,天根生物科技有限公司。
1.2 仪器及设备
SpectraMax i3 酶标仪,美谷分子仪器上海有限公司;SU8010 场发射扫描电子显微镜、E-1010离子溅射仪,日立高新技术有限公司;实时荧光定量PCR 仪,Bio-Rad 公司。
1.3 试验方法
1.3.1 可抑制铜绿假单胞菌生物被膜的物质筛选
采用结晶紫染色法,测定各中药成分对铜绿假单胞菌ATCC 9027 生物被膜形成的抑制效果;将菌悬液(2×107CFU/mL),取100 μL 至96 孔板中,孔中分别再加入100 μL Nisin、穿心莲内酯、黄芩素、和厚朴酚,使最终质量浓度分别为1 000,200,40,10 μg/mL,加入PBS 作对照。37 ℃培养24 h,弃上清液,200 μL PBS 轻柔清洗3 次;用甲醇固定10 min 后去除残液,用0.1%结晶紫染色30 min,再用PBS 冲洗;加入0.1%乙酸和95%乙醇溶液各100 μL 后,用酶标仪测定595 nm 波长下的吸光值;设置3 个重复,取平均值。
1.3.2 Nisin、和厚朴酚单独处理对铜绿假单胞菌生物被膜最小抑制浓度的测定 釆用二倍稀释法和XTT 还原法测定和厚朴酚和Nisin 的MBIC50;在96 孔板中,分别加入100 μL(2×107CFU/mL)菌悬液,再加入100 μL 最终质量浓度分别为4,2,1,0.5,0.25,0.125,0.0625 mg/mL Nisin,或加入100 μL 最终质量浓度分别为400,200,100,50,25,12.5,6.25 μg/mL 和厚朴酚,对照组为等量菌液、PBS,37 ℃培养24 h。吸去96 孔板中菌液,用PBS 清洗2 遍,在每个孔内加入158 μL 20 g/L 葡萄糖的PBS 缓冲液,40 μL XTT 和2 μL 甲萘醌。铝箔覆盖37 ℃避光培养3 h,转移至新96 孔板中,测定492 nm 下的吸光值。设置3 个重复,取平均值。抑制率超过50%时所需的最小药物浓度作为最低抑制生物被膜浓度(MBIC50)。通过酶标仪测定生物被膜态菌液与对照组的吸光度,从而获得生物被膜抑制率。
1.3.3 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的协同作用评估 通过棋盘法(微量稀释法)检测Nisin 与和厚朴酚的联合用药效果。96 板中每孔加入100 μL 菌悬液(2×107CFU/mL),在每孔中同时加入Nisin 与和厚朴酚各50 μL,其中Nisin 与和厚朴酚的浓度从1 倍MBIC50值到1/32倍MBIC50值依次减少。以和厚朴酚、Nisin 单独作用组和PBS 为对照,重复3 次。用分级抑菌浓度指数(FICI)来判断Nisin 与和厚朴酚的相互作用,计算公式如下:
1.3.4 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的抑制效果分析
1.3.4.1 对生物被膜形成的抑制效果分析 在96孔板中加入100 μL 2×107CFU/mL 的菌液和100 μL 不同浓度药物,对照组为加入100 μL PBS,37℃分别培养3,6,9,12,18,24,36 h,参照1.3.2 节的方法,测定细菌生物被膜的抑制率。
1.3.4.2 对成熟生物被膜的清除效果分析 在96孔板中加入100 μL 2×107CFU/mL 的菌液,37 ℃培养24 h 后,弃上层浮游菌液,无菌PBS 清洗2次,加入100 μL LB 培养基和100 μL 药物,加入200 μL LB 培养基作对照。然后37 ℃分别培养3,6,9,12,18,24,36 h,参照1.3.2 节的方法测定细菌生物被膜的清除率。
1.3.5 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜结构的影响 将菌液稀释至2×107CFU/mL,取1 mL 接种到12 孔板中,孔板中提前加入圆形盖玻片,加入1 mL 不同药物,以PBS 为对照,37 ℃培养24 h 后弃上清,用PBS 清洗2 遍,加入1 mL 2.5%戊二醛溶液固定8 h 以上。弃废液,以去离子水清洗菌体,重复3 次后,依次用50%,70%,85%,95%的酒精脱水,每个梯度静置13 min。用无水乙醇脱水14 min,脱水3 次,后冷冻干燥1 d,取出干燥完全的样品、阴极喷涂将样品金覆盖,观察铜绿假单胞菌ATCC 9027 形态与结构并拍照。
1.3.6 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜组成成分的影响
1.3.6.1 对EPS 合成的影响 采用苯酚-硫酸法测定铜绿假单胞菌ATCC 9027 生物被膜中可溶性多糖与不可溶性多糖含量。BF 的培养和处理方法参考1.3.4.1 和1.3.4.2 节的步骤,将BF 吸取至离心管中,4 ℃下8 000 r/min 离心30 min 后,取200 μL 上清液与200 μL 6%苯酚溶液、0.5 mL 浓硫酸混合,100 ℃水浴15 min,后测定490 nm 波长处吸光值,为可溶性多糖含量。而离心后的沉淀重悬于0.9%的生理盐水(含0.22%的甲醛)中,80 ℃水浴30 min,在4 ℃下12 000 r/min 离心30 min取上清测定不可溶性多糖含量,方法同上。
1.3.6.2 对eDNA 分泌量的影响 取1 mL 菌悬液加入到12 孔板中,再分别加入1 mL 不同组分药物,37 ℃培养24 h;按Drisse 等[7]的方法提取eDNA,用分光光度计检测浓度,为抑制作用下的eDNA 含量。试验重复3 次。
取1 mL 菌悬液加入到12 孔板中,37 ℃培养24 h 后弃上层浮游菌液,并用PBS 清洗2 次,后加入1 mL TSB 培养基和1 mL 药物,以PBS 作对照。37 ℃培养18 h 后测定清除作用下的eDNA 含量,方法同上。
1.3.7 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜合成相关基因表达的影响 采用Primer 6软件设计生物被膜相关基因lasR、pqsA、pelA、algC、lasI 上下游引物。
生物被膜的培养和处理方法同上,取菌悬液6 mL,参考RNA 提取试剂盒说明书提取总RNA,采用一步法反转录合成cDNA,最后q-PCR 扩增,以rpoD 为内参基因。试验重复3 次。
RT-qPCR 反应体系(20 μL):SYBR Green1 2×SuperRealPreMix Plus 10 μL;DNase/RNase -Free Water 6.8 μL;上、下游引物(10 μmol/L)各0.6 μL;cDNA 2 μL。RT-qPCR 反应条件:95 ℃15 min;98 ℃10 s,55 ℃20 s,72 ℃30 s,40 个循环。

表1 荧光定量PCR 引物列表Table 1 List of primers for fluorescent quantitative PCR
2 结果与分析
2.1 最佳中药成分的筛选
筛选对铜绿假单胞菌ATCC 9027 生物被膜有最佳抑制效果的中药成分。由图1 可知,Nisin对铜绿假单胞菌ATCC 9027 生物被膜的抑制率为39%,有较好的抑制效果;而和厚朴酚、穿心莲内酯、黄芩素的抑制率分别为29.6%,15.1%,3%,其中和厚朴酚对铜绿假单胞菌ATCC 9027 生物被膜抑制效果最好;因此,选取和厚朴酚作为与Nisin 联合的中药成分。
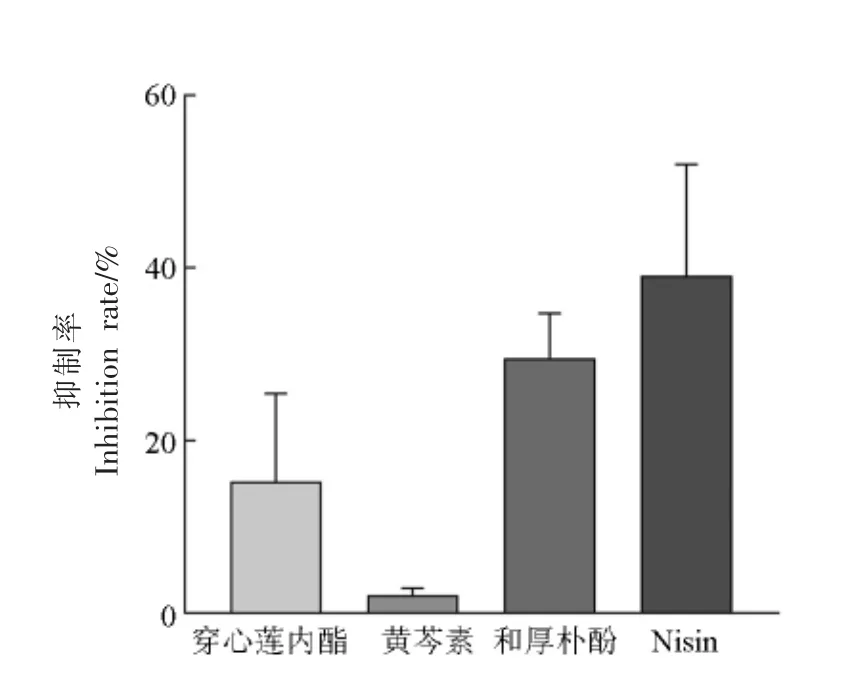
图1 中药成分单独作用下铜绿假单胞菌ATCC 9027 生物被膜的抑制率Fig.1 Inhibition rate of P.aeruginosa ATCC 9027 biofilm under the action of Chinese herbal ingredients alone
2.2 Nisin、和厚朴酚对铜绿假单胞菌ATCC 9027 生物被膜的MBIC50
由表2 可知,1 mg/mL Nisin 对铜绿假单胞菌ATCC 9027 生物被膜的抑制率为50.7%,随着Nisin 浓度的减少,抑制率也逐渐降低,当Nisin 质量浓度大于1 mg/mL 时,抑制率的增幅并不明显。和厚朴酚仅在12.5 μg/mL 便能达到52.0%抑制率,与Nisin 作用效果相似,其抑制率随着和厚朴酚的含量增加而增加,然而超过12.5 μg/mL 后抑制率的增幅不大。因此,Nisin、和厚朴酚对铜绿假单胞菌ATCC 9027 生物被膜的MBIC50分别为1 mg/mL 和12.5 μg/mL。
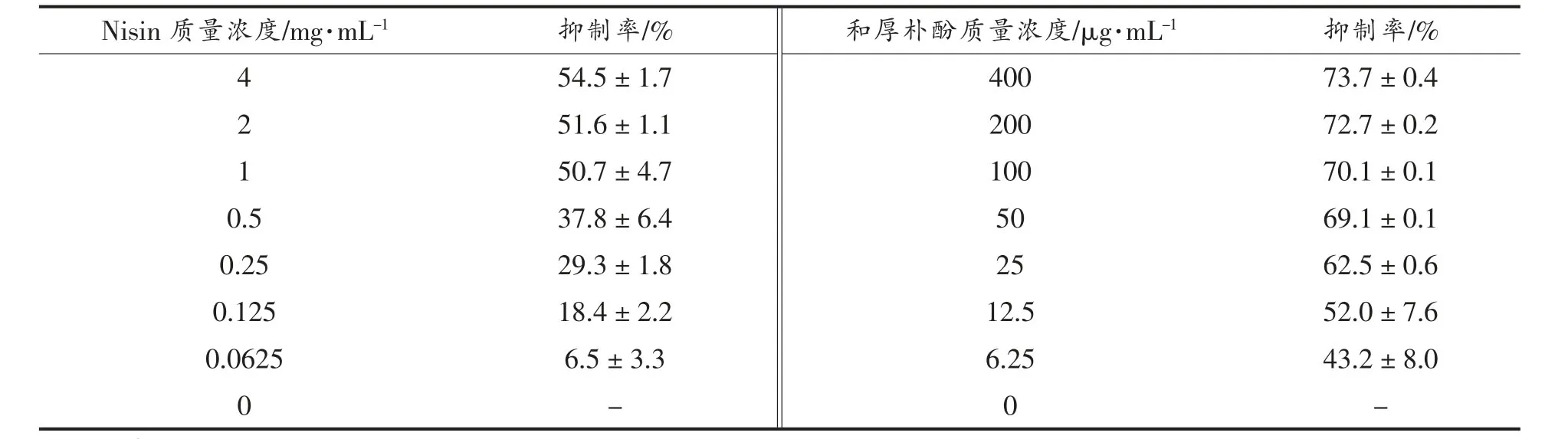
表2 Nisin 与和厚朴酚单独作用对菌株BF 的抑制率Table 2 Inhibition of the biofilm of the strain by Nisin with honokiol alone
2.3 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的协同作用评估
由图2 可知,存在8 个组合能够使铜绿假单胞菌ATCC 9027 的BF 抑制率在50%左右。FICI值结果见表3,发现有5 个组合的FICI 值在0.250~0.500 之间,表明联合处理对铜绿假单胞菌ATCC 9027 生物被膜有协同抑制作用,其中当0.125 mg/mL Nisin 与1.5625 μg/mL 和厚朴酚联用时,协同抑制效果最佳,然而也存在无关和相加作用的组合。
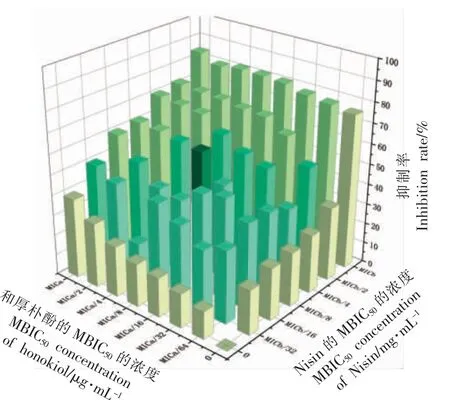
图2 Nisin 与和厚朴酚联合对铜绿假单胞菌ATCC 9027 生物被膜的抑制率Fig.2 Inhibition rate of biofilm of P.aeruginosa ATCC 9027 by Nisin in combination with honokiol

表3 不同浓度组合下的Nisin 与和厚朴酚联合作用的FICI 值Table 3 FICI values of Nisin in combination with honokiol at different concentration combinations
2.4 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜的抑制效果分析
2.4.1 生物被膜抑制率时间变化曲线 如图3 所示,Nisin 与和厚朴酚联用、和厚朴酚单独处理的抑制率随时间的延长而增加,18 h 时达到顶峰,抑制率分别为77.1%,70.9%,然后开始缓慢下降。而Nisin 的抑制率在12 h 达到最大,为48.3%,并且此后抑制率大幅度下降,是因为BF 在生长初期对Nisin 的抵抗力较低,后期因为Nisin 对G-菌的作用效果差而无法抑制BF 的生长。
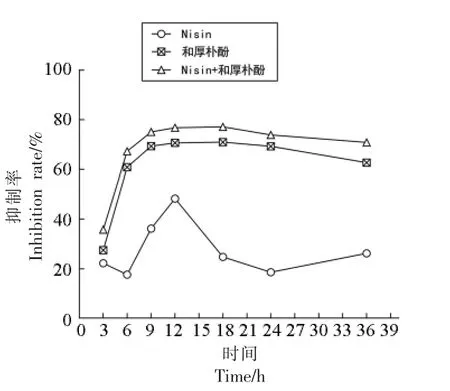
图3 4种处理下铜绿假单胞菌ATCC 9027 的生物被膜抑制率时间变化曲线Fig.3 Time variation curves of biofilm inhibition rate of P.aeruginosa ATCC 9027 under four treatments
2.4.2 生物被膜清除率时间变化曲线 由图4 可知,和厚朴酚、药物联用对BF 的清除率随时间延长缓慢上升,在18 h 时达到最大,分别为25.1%和51.5%,药物联用表现出更好的清除效果。然而在18~24 h,清除率剧烈下降,这可能是因为药物被消耗导致其清除效果变差;Nisin 单独处理的清除效果差,而一直缓慢上升,也许是由于Nisin 难以穿透G-菌的BF,需要更长的作用时间才能达到与联用处理同等的清除效果。

图4 4种处理下铜绿假单胞菌ATCC 9027 的生物被膜清除率时间变化曲线Fig.4 Time variation of biofilm clearance rate of Pseudomonas aeruginosa ATCC 9027 under four treatments
2.5 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜结构的影响
SEM 扫描电镜结果如图5 所示,空白对照形成较为稳定的生物被膜,菌体以多层堆叠形式聚集,外层有大量包裹物,呈现出明显的立体三维结构(图5d);Nisin 单独处理只有极少黏附菌落,大部分菌落都互不黏附(图5a);和厚朴酚单独处理下绝大部分菌体呈杆状分布,表面有少量丝状物质出现(图5b)。而在联合作用下,生物被膜稀疏,大多数细菌都以单体、散体形式存在,只有极少数的细菌还在黏附载体上,菌体周边较为清晰,几乎无生物被膜(图5c)。进一步验证了Nisin 与和厚朴酚联用对铜绿假单胞菌ATCC 9027 生物被膜形成的协同抑制作用,同时药物影响了胞外聚合物的形成,间接影响了生物被膜,因此有必要进一步研究药物对生物被膜态菌的作用机理。

图5 Nisin 与和厚朴酚协同抑制铜绿假单胞菌ATCC 9027 的扫描电镜图片Fig.5 Scanning electron MBIC roscope images of Nisin in combination with honokiol to inhibit P.aeruginosa ATCC 9027
2.6 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜组成成分的影响
2.6.1 对EPS 含量的分析 EPS 是BF 至关重要的成分之一,由图6 可知,Nisin、和厚朴酚、药物联用组对可溶性多糖抑制率分别为22.4%,10.2%,44.8%,对不可溶性多糖的抑制率分别为4.4%,4.3%,12.0%。结果表明,Nisin 与和厚朴酚单用和联用均有效降低了铜绿假单胞菌ATCC 9027 生物被膜可溶性多糖含量,而对不溶性多糖的影响较少。此外,药物联用组比单用组表现出更好的抑制效果。

图6 抑制作用下铜绿假单胞菌ATCC 9027 生物被膜的可溶性多糖(a)与不可溶性多糖(b)含量Fig.6 Soluble polysaccharide(a)and insoluble polysaccharide(b)contents of the biofilm of P.aeruginosa ATCC 9027 under inhibition
在清除作用中也有类似的结果,由图7 可知,Nisin、和厚朴酚、药物联用组对可溶性多糖的清除率分别为35.2%,21.9%,43.8%,对不可溶性多糖的清除率分别为3.5%,4.5%,10.2%。无论是抑制还是清除作用下,和厚朴酚对可溶性多糖的影响较低。
2.6.2 对eDNA 含量的分析 如图8a 所示,不同处理均可抑制eDNA 的分泌。Nisin、和厚朴酚、药物联用组的抑制率分别为26.7%,81.8%,86.1%,其中和厚朴酚和药物联用组对eDNA 的抑制更高。如图8b 所示,Nisin、和厚朴酚、药物联用对eDNA 的清除率分别为33%,40.5%,60.3%,药物联用对eDNA 合成的影响最大这与其有最佳抑制与清除效果的结果一致。相对于清除作用对eDNA的影响,和厚朴酚抑制作用效果更好。

图8 药物表现抑制作用(a)与清除作用(b)时eDNA 的含量Fig.8 The amount of eDNA when the drug exhibits inhibition(a)versus clearance(b)
2.7 Nisin 与和厚朴酚联用对铜绿假单胞菌生物被膜合成相关基因表达的影响
由图9 可知,在Nisin、和厚朴酚以及二者联用 发挥抑 制和清 除BF 效果时,lasR、pelA、lasI、pqsA 与algC 基因都出现明显下调,药物联合组比单药组的效果更为明显。在抑制BF 形成时,药物处理对BF 合成相关基因表达量的影响程度为:药物联用组〉Nisin〉和厚朴酚,这与其对BF 的抑制程度类似。其中,在和厚朴酚单独处理中,控制Pel多糖形成的pelA 基因仅下调了38.1%,表明单独使用和厚朴酚对EPS 的影响较少,这与EPS 的分泌量一致。当清除BF 时,药物处理对BF 合成相关基因表达量的影响程度为:药物联用组〉和厚朴酚〉Nisin,同样与清除效果的趋势相同;Nisin 处理对pelA、lasI、pqsA 与algC 基因的抑制效果弱,这是因为Nisin 难以进入成熟BF 而导致其清除效果差。然而,无论是在单独处理还是在联合使用中,lasR 基因都显著下调,这表明两种药物都能显著影响Psl 多糖的形成。在抑制BF 时,相对Nisin组,和厚朴酚处理下的影响eDNA 分泌的pqsA 下调程度低,然而和厚朴酚组中对eDNA 的抑制效果强于Nisin 组,与基因表达结果相反,这是因为有多个基因调控eDNA 的分泌,可能和厚朴酚在其它位点强烈抑制eDNA 的合成。

图9 不同处理后表现抑制作用(a)与清除作用(b)时对BF 相关基因转录水平的影响Fig.9 Effect on transcript levels of biofilm-associated genes after different treatments showing repression(a)and clearance(b)
3 讨论与结论
3.1 讨论
生物被膜对细菌有保护作用并且可增强其耐药性,而且在食品设备中难以清除,是重大的食品安全隐患。为减少铜绿假单胞菌生物被膜的危害,首先分析3 种中药成分对铜绿假单胞菌生物被膜的抑制效果,发现和厚朴酚抑制作用最强;然后,通过棋盘法筛选出Nisin 与和厚朴酚联用的最佳组 合:1.5625 μg/mL 和厚朴酚与0.125 mg/mL Nisin;SEM 结果表明,不同处理组下BF 的形态有明显区别,其中在药物联合下,大多数细菌为零散形式存在,零散的单个杆菌上几乎没有生物被膜。一方面可能是因为黏附介质,如可溶性多糖与不可溶性多糖分泌量降低[15],另一方面可能是由参与BF 基质构成和推动BF 扩张运动的eDNA 减少而造成[16]。
构成BF 的主要成分为胞外多糖、多肽、胞外蛋白及胞外DNA 等。其中EPS 是BF 最重要的成分之一,它能影响铜绿假单胞菌之间的黏附性,是初始黏附时期BF 发展的支架,不仅作为影响BF形成的信号分子,还能作为抵抗免疫和抗生素攻击的屏障[17]。eDNA 也是BF 的重要组成,在BF 的发展、作为连接介质具有重要作用,且在维持和稳定成熟BF 的结构中也具有重要作用[18]。本研究发现,Nisin 与和厚朴酚联用能有效对EPS 和eDNA产生抑制和清除,从而影响BF 的存在。
为探讨Nisin 与和厚朴酚联用抑制铜绿假单胞菌ATCC 9027 生物被膜的可能机制,利用RTqPCR 分析BF 相关调控基因的表达。EPS 一般为3 种多糖构成:Pel、Psl 及藻酸盐,其中Psl 多糖对BF 的建立、抵抗抗生素具有重要作用,在成熟阶段还能促进细菌运动,研究发现lasR 能与psl 操纵子的启动子区域相结合,能间接控制Psl 多糖的合成[19]。Pel 多糖可对形成牢固的BF 发挥重要作用,可作为黏附因子帮助其在介质表面黏附,研究表明pelA 与Pel 多糖的形成有关[20]。藻酸盐对于BF 结构的稳定性和防护作用至关重要,能够维持BF 所必需的水分和营养,还被证明能减少免疫细胞及抗生素对BF 的攻击,研究表明algC 参与藻酸盐前体合成,能够间接影响藻酸盐的形成[21]。本研究表明,在药物对BF 表现抑制与清除作用时,lasR、pelA 与algC 的基因表达量下调,药物联用组尤其显著,表明当药物对BF 产生抑制或清除作用时,可能是通过减少Psl 多糖、Pel 多糖及藻酸盐的含量,从而影响BF。铜绿假单胞菌群体感应系统主要由lasI/lasR 系统、rhlI/rhlR 系统以及基于喹诺酮信号(Pseudomonas aeruginosa quinolone signal,PQS)的群体感应系统组成[22]。PQS 系统对BF 形成时细菌聚集、BF 结构稳定等具有重要作用,它还可以促进eDNA 的释放[23]。有研究表明pqsABCDE 操纵子能够编码2-庚基-4-喹诺酮(2-Heptyl4-quinolone,HHQ),而HHQ 是PQS 系统的信号分子2-庚基-3-羟基-4-喹诺酮的前体物质,因此pqsA 能够间接调控PQS 系统,从而影响BF 的形成[24]。LasR 系统能够调控胞外酶、外毒素A 及BF 的形成,研究发现lasI 能够编码信号分子——N-(3-氧代十二烷酰基)-L-高丝氨酸内[25],它是铜绿假单胞菌生物被膜形成所必需的,它能与LasR 相结合,从而影响BF 的生成和分散[26]。本研究表明,当药物对BF 表现抑制与清除作用时,药物联用组中pqsA 与lasI 的基因表达量下调更为显著,因此推测药物是通过下调pqsA 与lasI 的表达量,间接调控PQS 系统及LasR 系统,从而影响eDNA 及BF 的形成。因此,Nisin 与和厚朴酚协同抑制铜绿假单胞菌ATCC 9027 BF 和清除BF 的作用机制与lasR、pelA、algC、pqsA、lasI 相关。
3.2 结论
综上所述,Nisin 与和厚朴酚联合使用的多个组合均对铜绿假单胞菌ATCC 9027 生物被膜具有协同抑制作用,其中1.5625 μg/mL 和厚朴酚与0.125 mg/mL Nisin 组合的抑制效果最好。对生物被膜的抑制率和清除率先增加,在18 h 时达到最大值,然后逐渐降低。其主要作用机制是通过降低lasR、pelA、lasI、pqsA 与algC 基因的表达,减少EPS 的生成及eDNA 的分泌,从而抑制铜绿假单胞菌ATCC 9027 生物被膜的形成和清除成熟生物被膜。然而Nisin 与和厚朴酚是通过何种方式影响相关基因的表达尚不清楚,需进一步研究。生物被膜的形成是复杂且由多种机制调控的过程,本课题组下一步将寻找Nisin 与和厚朴酚抑制和清除生物被膜的其它潜在作用机制。

