过表达Sirt3通过Keap1/Nrf2通路调控高糖应激诱导的肾小管上皮细胞衰老*
王自强, 王颖, 赵坤霄, 王保兴, 李英△
(1河北医科大学第三医院肾内科,河北 石家庄 051000;2海南医学院第一附属医院肾内科,海南 海口 570102)
高糖诱导细胞产生过多的活性氧(reactive oxygen species, ROS),从而加速糖尿病肾病(diabetic nephropathy, DN)的进展[1-2]。过量的ROS产生细胞毒性,破坏蛋白质和DNA,激活DNA损伤反应,诱导应激性衰老[3]。既往研究表明,在DN早期,肾小管上皮细胞即处于持续氧化应激状态,继而呈现增生、肥大等应激性衰老过程[4]。
沉默信息调节因子(silent information regulator,sirtuin/Sirt)家族属于第Ⅲ类组蛋白去乙酰化酶,依赖烟酰胺腺嘌呤二核苷酸(NAD+)驱动其去乙酰化酶活性[5]。在哺乳动物中,已鉴定出7个Sirt2同源物(Sirt1~7),在生物调控机制和亚细胞定位上各存在差异。Sirt3定位于线粒体,参与衰老相关的病理过程,如心血管和神经退行性疾病、代谢综合征等[6]。新近研究表明,Sirt3通过抗氧化机制发挥抗衰老作用[7]。我们前期研究表明,高糖环境下HK-2细胞中Sirt3的表达显著降低[8]。通过上调Sirt3的表达可抑制高糖诱导的氧化应激和细胞凋亡过程[9]。Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1, Keap1)/核因子E2相关因子2(nuclear factor E2-related factor 2, Nrf2)通路是调控氧化还原平衡的重要信号通路,而Nrf2介导的抗氧化途径被破坏是导致细胞衰老的驱动力[10]。那么,Sirt3在高糖诱导的应激性衰老的过程中是否也起到保护作用,Keap1/Nrf2通路是否参与该过程,值得进一步探索。本研究拟观察Sirt3在高糖刺激诱导的氧化应激和应激性衰老中的作用,并进一步探讨其作用是否是通过影响Keap1/Nrf2通路的活性来实现的。
材料和方法
1 试剂耗材
D-葡萄糖(Sigma);DMEM培养基、Lipofectmine 3000和P3000(Invitrogen);β-actin抗体(Proteintech);Sirt3、P16、P21、Nrf2、血红素加氧酶(heme oxygenase 1, HO-1)、醌氧化还原酶1(NADPH quinone oxidoreductase 1, NQO1)、Keap1和histone H3抗体(Abcam);pCMV3载体质粒和pCMV3-Sirt3质粒(Sino Biological);衰老相关β-半乳糖苷酶(senescenceassociated β-galactosidase, SA-β-Gal)染色试剂盒和ROS测定试剂盒(Solarbio);Nrf2抑制剂ML385(Med-ChemExpress);反向转录系统和qPCR Master Mix(Promega);细胞核/质分离试剂盒(Invent Biotechnologies)。
2 细胞培养与分组
人近端小管上皮细胞HK-2细胞(American Type Culture Collection),培养环境:37 ℃,5% CO2, 95%空气。当细胞生长至60%左右时,于指定时间点按照细胞分组给予不同的刺激。细胞分组1:拟观察HK-2细胞在高糖环境下培养6、12、24、48、72 h时相关指标表达的变化。细胞分为正常糖(normal glucose,NG; 葡萄糖浓度为5.5 mmol/L)对照组、甘露醇高渗对照(甘露醇浓度24.5 mmol/L,葡萄糖浓度5.5 mmol/L)组和高糖(high glucose,HG;葡萄糖浓度为30 mmol/L)组,分别培养6、12、24、48、72 h。细胞分组2:为了观察过表达Sirt3对高糖环境下HK-2细胞氧化应激、应激性衰老及相关通路的影响,将细胞分为NG(葡萄糖浓度为5.5 mmol/L)组、HG(葡萄糖浓度为30 mmol/L)组、高糖+空载质粒转染(HG+vector)对照组、高糖+转染Sirt3质粒(HG+Sirt3)组,各组均刺激48 h。细胞分组3:为了研究阻断Keap1/Nrf2通路后,过表达Sirt3对高糖环境下HK-2细胞应激性衰老等蛋白表达的影响,将细胞分为NG(葡萄糖浓度为5.5 mmol/L)组、HG(葡萄糖浓度为30 mmol/L)组、HG+Sirt3组、高糖+转染Sirt3质粒+ML385(HG+Sirt3+ML385)组,各组均在刺激48 h后,进行相关检测。
3 实验方法
3.1 SA-β-Gal染色 使用SA-β-Gal染色试剂盒检测细胞衰老。HK-2细胞经相应刺激后,PBS洗涤两次,室温下4%甲醛固定15 min, PBS洗涤,用1 mL新鲜制备的SA-β-Gal染色液[包含溶液A(10 μL)、溶液B(10 μL)、染色溶液C(930 μL)和X-Gal溶液(50 μL),终浓度为1 mg/mL]于37 ℃无CO2培养箱中孵育过夜。普通光学显微镜下观察。
3.2 细胞内ROS检测 HK-2细胞以约1×106的密度传代至6孔板,进行细胞爬片,予不同刺激结束后。采用活性氧检测试剂盒,用10 μmol/L 2′、7′-二氯荧光素二乙酸酯(DCHF-DA)检测细胞内ROS水平。具体步骤:PBS洗涤细胞,用预先配制的DCFHDA染色30 min,PBS避光清洗,于荧光显微镜下观察。绿光荧光强度与ROS水平呈正比。
3.3 Western blot检测相关蛋白的表达 HK-2细胞刺激结束后,用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液提取总蛋白,核蛋白提取使用细胞核/质分离试剂盒,BCA法测定蛋白浓度,蛋白质样品中加入SDS缓冲液,100 ℃变性7 min,-20 ℃保存。采用8%~12%的SDS-PAGE进行蛋白分离,转膜,5%脱脂牛奶37 ℃封闭1 h。4 ℃过夜孵育Ⅰ抗 (兔抗Sirt3、HO-1、P16、P21、Keap1及Nrf2多克隆抗体均1∶1 000稀释,兔抗NQO1多克隆抗体1∶10 000稀释,兔抗β-actin多克隆抗体1∶2 000稀释)。次日,TBST洗涤(3×15 min),37 ℃条件下孵育Ⅱ抗(1∶5 000) 1 h,TBST洗涤(3×15 min)。新鲜配置ECL发光液,Odyssey FC成像系统显色,ImageJ软件分析。
3.4 RNA提取及RT-qPCR分析 TRIzol试剂提取细胞总RNA,cDNA试剂盒合成cDNA,采用qPCR Master Mix进行qPCR。反应条件:95 ℃ 30 s;95 ℃10 s,60 ℃ 30 s,40个循环。以β-actin作为内参照,采用2-ΔΔCt法分析基因的相对表达量。详细引物序列见表1。
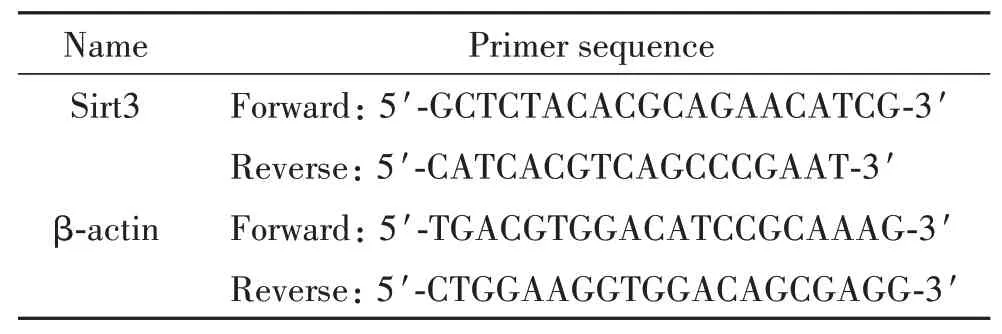
表1 RT-qPCR中所用的引物序列Table 1. The sequences of the primers for RT-qPCR
3.5 质粒转染 应用Lipofectamine 3000和P3000试剂,pCMV3或空pCMV3载体转染HK-2细胞。将HK-2细胞以每孔1×106个细胞的密度接种于6孔板中,质粒及转染试剂加至无血清、无抗生素培养基中,孵育6 h后,将培养基改为含抗生素和10%胎牛血清的新鲜DMEM培养基继续孵育6 h。
4 统计学处理
计量资料以均数±标准差(mean±SD)表示,采用SPSS 23.0软件进行统计学分析,数据来自至少3次独立实验,各组间比较采用单因素方差分析或Kruskal-Wallis检验,以P<0.05为差异有统计学意义。
结果
1 过表达Sirt3可减轻高糖刺激诱导的HK-2细胞衰老
1.1 高糖对HK-2细胞Sirt3表达的影响及高糖刺激诱导细胞衰老过程 Western blot及RT-qPCR结果显示,与NG组比较,在高糖刺激48 h后,HK-2细胞中Sirt3蛋白及mRNA表达显著降低(P<0.05)。高糖环境下HO-1的表达随刺激时间的延长而变化,呈先上升后下降的趋势(P<0.05)。P16和P21蛋白的表达均呈时间依赖性,NG组中P16蛋白表达很少,P21几乎不表达。与NG组相比,在高糖培养48 h后,HK-2细胞中P16和P21蛋白的表达显著增加(P<0.05),且可观察到更多的SA-β-Gal阳性细胞,见图1。

Figure 1. High glucose decreased the expression of the Sirt3 protein, induced oxidative stress, and accelerated cellular senescence in HK-2 cells. A: HK-2 cells were treated with HG (30 mmol/L) for different time periods. The protein levels of Sirt3, P16,P21 and HO-1 were analyzed by Western blot; B: Sirt3 mRNA expression under the different conditions was examined by RT-qPCR; C: image of SA-β-Gal staining in the NG and HG groups treated for 48 h, as captured by microscope, blue staining reflects positive cells. Mean±SD. n=3. *P<0.05, **P<0.01 vs NG group.图1 高糖可降低HK-2细胞中Sirt3蛋白的表达,诱导氧化应激,加速细胞衰老
1.2 探索过表达Sirt3能否使HK-2细胞对抗高糖刺激诱导的细胞衰老 如图2A,Western blot结果显示,与NG组相比,高糖刺激48 h后HO-1蛋白的表达明显减低,P16和P21蛋白的水平显著升高(P<0.05)。与HG+vector组比较,过表达Sirt3后P16和P21蛋白的表达水平均明显降低(P<0.05),且过表达Sirt3可显著逆转高糖环境下细胞内ROS的积聚(图2B)。与HG组相比,HG+Sirt3组SA-β-Gal阳性细胞较少(图2C)。

Figure 2. Overexpression of Sirt3 protects against HG-induced oxidative stress and cellular senescence. A: the protein levels of HO-1, P16 and P21 were analyzed by Western blot; B: intracellular ROS accumulation was detected by a fluorescence microscope; C: stress-induced senescence of HK-2 cells was detected by SA-β-Gal staining, blue staining reflects positive cells. Mean±SD. n=3. *P<0.05 vs NG group; ##P<0.01 vs HG+vector group.图2 过表达Sirt3可使HK-2细胞对抗高糖诱导的氧化应激和应激性衰老
2 过表达Sirt3对HK-2细胞中Keap1/Nrf2通路及其下游蛋白NQO1的影响
Western blot结果显示,在高糖刺激后6 h,Nrf2和NQO1蛋白水平均升高,并持续升高至24 h,在48 h后逐渐下降(P<0.05)。如图3B所示,与NG组相比,高糖(48 h)环境下HK-2细胞中Nrf2、NQO1蛋白降低,Keap1蛋白表达升高(P<0.05),质粒转染过表达Sirt3后,Nrf2及其下游蛋白NQO1的表达增加,keap1表达降低(P<0.05)。为了评估Nrf2转录的变化,我们检测了核Nrf2蛋白的表达水平。结果显示,与HG+vector组相比,在Sirt3转染的HK-2细胞中,细胞核Nrf2的表达显著增加(P<0.05),见图3C。

Figure 3. Effects of Sirt3 overexpression on Keap1/Nrf2 pathway-related proteins in HK-2 cells under high glucose environment. A:the levels of Keap1/Nrf2 signaling pathway related proteins in HK-2 cells detected by Western blot; B: the effect of Sirt3 overexpression on the Keap1/Nrf2 signaling pathway related proteins in HK-2 cells detected by Western blot; C: the effect of Sirt3 overexpression on the nuclear Nrf2 in HK-2 cells detected by Western blot. Mean±SD. n=3. *P<0.05 vs NG group; #P<0.05, ##P<0.01 vs HG+vector group.图3 Sirt3过表达对高糖环境下HK-2细胞中Keap1/Nrf2信号通路相关蛋白的影响
3 抑制Keap1/Nrf2通路的活性可削弱Sirt3对HK-2细胞的作用
为进一步验证Sirt3是否通过Keap1/Nrf2通路保护HK-2细胞,对抗高糖刺激诱导的细胞衰老,我们采用ML385(Nrf2抑制剂)抑制Keap1/Nrf2通路活性。Western blot结果显示,与HG+Sirt3组相比,加入ML385后,Nrf2、NQO1和HO-1的蛋白表达水平显著降低(P<0.05),衰老相关蛋白P16和P21的表达水平显著升高(P<0.05),见图4。

Figure 4. Effects of Sirt3 overexpression on Keap1/Nrf2 pathway-related proteins such as Nrf2, NQO1, HO-1 (A), p16 and p21 (B)in HK-2 cells under a high glucose environment after adding ML385. Mean±SD. n=3. *P<0.05 vs NG group; #P<0.05 vs HG group; △△P<0.01 vs HG+Sirt3 group.图4 ML385可逆转过表达Sirt3对高糖环境下HK-2细胞应激性衰老的影响
讨论
本研究结果表明高糖可诱导HK-2细胞应激性衰老,过表达Sirt3可减轻高糖诱导的氧化应激,增加抗氧化酶的表达,降低细胞内ROS的集聚,抑制细胞衰老。过表达Sirt3激活Keap1/Nrf2信号通路及其下游蛋白,而特异性抑制Keap1/Nrf2信号通路活性可导致上述作用明显减弱。提示Sirt3可通过激活Keap1/Nrf2通路及其下游蛋白的表达,在抗氧化应激和高糖应激诱导的衰老中发挥作用。
既往研究表明,在DN早期,肾小管上皮细胞即表现出应激性衰老和肾小管功能障碍,这可能是各种病理损伤的重要原因[11]。动物实验中,在早期糖尿病大鼠模型发现衰老的肾小管上皮细胞。建模10天后,衰老相关蛋白P16、P21和SA-β-Gal的表达显著增加[12]。在体外,高糖环境下肾小管上皮细胞亦出现应激诱导的衰老[13]。本研究结果表明,在高糖刺激的肾小管上皮细胞中,P16和P21蛋白的表达呈时间依赖性,于高糖刺激12 h时开始增加,48 h达到峰值,SA-β-Gal阳性细胞数量在48 h显著增加。
Sirtuins是依赖NAD+的蛋白去乙酰化酶,介导对应激刺激的适应性反应[14]。其中,Sirt3在维持线粒体稳态及功能等方面发挥重要作用,如调节ROS的生成。研究表明,Sirt3介导的线粒体抗氧化应激效应参与apigenin对糖尿病大鼠肾脏的保护作用,且显著提高细胞内NAD+/NADH比值,继而减轻高糖环境下近端肾小管上皮细胞损伤[15]。Sirt3具有抗细胞衰老的作用。体外实验表明,通过激活Sirt3信号可抑制高糖诱导内皮细胞衰老过程[16]。Sirt3对晚期糖基化终末产物诱导的骨髓间充质干细胞衰老和老年性骨质疏松症有保护作用[17]。本研究结果表明,Sirt3参与高糖刺激诱导的HK-2细胞应激性衰老过程。过表达Sirt3可显著上调HO-1蛋白的表达,降低细胞内ROS水平。而过表达Sirt3显著降低了P16和P21蛋白的表达,SA-β-Gal阳性细胞数量显著减少。这些结果表明,过表达Sirt3可以减轻高糖刺激诱导的氧化应激和应激性衰老。
Keap1/Nrf2通路是体内氧化还原平衡的重要调控途径。有研究表明,Keap1/Nrf2通路参与糖尿病肾病的发生发展。Nrf2的激活可减轻高糖刺激诱导的氧化应激损伤,抑制肾系膜基质的形成,恢复肾病理损伤[18]。本研究还观察到高糖条件下HK-2细胞中Nrf2及其下游蛋白NQO1的表达随刺激时间的变化而变化,呈先增加后下降的趋势。过表达Sirt3部分逆转了高糖引起的Nrf2和NQO1蛋白的下调,增加了细胞核Nrf2的表达。结果表明,过表达Sirt3可上调Keap1/Nrf2信号通路的活性,促进Nrf2向细胞核的易位。
近年来,研究发现Nrf2介导的抗氧化通路的破坏是细胞衰老的驱动力[10,19]。另有研究发现,双氢青蒿素通过Nrf2/HO-1通路降低了骨髓源性抑制细胞(MDSCs)中衰老相关蛋白P16、P21、P53和衰老相关分泌表型的表达[20]。抗氧化剂肉桂醛可以通过激活Nrf2,下调CDKN2A/P16INK4A的表达来抑制角质细胞衰老[21]。本研究采用Nrf2特异性抑制剂ML385进行干预。结果表明,加入ML385后,HK-2细胞中Nrf2及其下游蛋白NQO1的表达显著下调,而Sirt3对氧化应激和应激性衰老的保护作用消失。以上结果进一步表明,Sirt3通过激活Keap1/Nrf2信号通路,降低高糖刺激诱导的氧化应激反应并对抗应激性衰老的发生。
综上所述,Sirt3通过上调Keap1/Nrf2通路及其下游蛋白,降低氧化应激反应,减轻高糖环境下应激诱导的细胞衰老(图5)。Sirt3作为DN治疗的潜在靶点,其作用机制仍有待进一步探索。

Figure 5. The possible mechanism by which Sirt3 reduces stress-induced cellular senescence.图5 Sirt3保护HK-2细胞对抗高糖应激诱导的细胞衰老的可能机制

