基于非增强CT 影像组学列线图在术前预测胸腺上皮肿瘤风险分类中的应用价值
张梦琪,玉苏甫·肉孜,洪 悦,陈 杰
新疆维吾尔自治区人民医院放射影像中心,新疆 乌鲁木齐830001
胸腺上皮肿瘤(thymic epithelial tumor,TET)是前上纵隔最常见的原发肿瘤,占前纵隔病变的47%[1]。2015 年WHO 修订了TET 组织学分型,将其简化为低危(A、AB、B1 型)和高危(B2、B3、C 型)2 种[2]。既往研究显示,高危组侵袭性较低危组强,生存率较低[3]。低危组手术完全切除的机会较大,而B2 或B3型则需新辅助放化疗[4-5]。CT 是TET术前重要的检查手段,术前评估多基于CT 增强扫描的特征表现[6],非增强CT(non-enhanced computed tomography,NECT)所提供的影像学特征较少,但其具有经济实用、简便快捷的优势。目前,影像组学在各种疾病中的应用越来越多,其在多种肿瘤鉴别诊断中具有重要作用[7-8]。因此,本研究旨在基于NECT 联合影像组学列线图在术前预测TET 的WHO 简化病理分型,为临床选择治疗方案提供新的思路。
1 资料与方法
1.1 一般资料
回顾性收集2010 年1 月至2023 年1 月我院经病理证实的TET 患者。纳入标准:①病理、临床数据齐全;②术前2 周内行胸部CT 平扫。排除标准:①图像质量差,影响病灶分割;②合并其他类型肿瘤或混合型TET 患者。最终共纳入92 例,男51 例,女41 例;年龄33~81 岁,平均(52.9±11.5)岁。咳嗽20 例,呼吸困难12 例,胸痛16 例,胸闷15 例,重症肌无力10 例,无症状19 例。低危组48 例,高危组44 例;按照7∶3 比例随机分为训练集64 例,其中低危组35 例,高危组29 例;测试集28 例,其中低危组13 例,高危组15 例。
1.2 仪器与方法
采用GE Lightspeed 64 层螺旋VCT 或Siemens Somatom FLASH 双源CT 机。患者取仰卧位,单次深屏气时行胸部CT 扫描。扫描参数:120 kV,200~300 mAs,球管旋转速度0.5 s/r,螺距1.375,准直64×0.6 mm,探测器宽度40 mm,视野36 mm×36 mm,矩阵512×512,层厚、层距均为5 mm,窗位、窗宽分别为50、350 HU。
1.3 影像组学模型的构建
获取DICOM 格式的CT 图像,导出格式为NII。为减少不同设备对图像组学特征稳定性的影响,对图像进行标准化和重采样后再提取特征。预处理后图像采用ITK-SNAP 软件(版本3.8.0),由2 位分别具有5、10 年以上工作经验的放射科医师在不知病理结果的情况下共同对全瘤进行逐层勾画ROI 并建立VOI。使用PyRadiomics 软件(版本3.0.1)从勾画VOI 的原始图像及wavelet 滤波图像、高斯拉普拉斯算子(Laplacian of Gaussian,LoG)、指数、对数、平方、平方根等图像中提取影像组学特征,LoG 的sigma参数为1、2、3。特征提取包括一阶特征、形态特征、纹理特征。
使用Python scikit-learn v1.0.2 软件包进行特征降维和模型构建。所有组学特征行Mann-Whitney U检验,保留P<0.05 的特征;采用10 倍交叉验证,通过最小绝对收缩和选择算子(least absolute eshrinkage and selection operator,LASSO)算法进一步降维,得到使LASSO 回归模型的误差达到最小的λ 值,保留权重系数不为0 的影像组学特征,并与其加权系数相乘构成影像组学评分。将最终筛选得到的组学特征输入逻辑回归模型(logistic regression,LR)、支持向量机(support vector machine,SVM)、随机森林模型(random forest,RF)、极端梯度提升(extreme gradient boosting,XGBoost)、梯度提升(gradient boosting)、轻量梯度提升(light gradient boosting machine,LightGBM)、朴素贝叶斯法(naive bayes,NB)、K 近邻(K-nearest neighbors,KNN)、极度随机树(extremely randomized trees,ExtraTrees)机器学习模型中进行模型构建。
1.4 临床模型及联合模型的构建
收集患者年龄、性别、肿瘤最大径、平扫CT 值、位置、分叶、塑形性、囊变、钙化、是否有重症肌无力、纵隔肿大淋巴结、胸膜/心包肥厚、胸腔/心包积液、血管/心脏受侵及肺内转移等基本临床资料。筛选有统计学意义的指标构建临床模型,设置与影像组学标签构建过程中相同的参数。结合影像组学评分和临床评分建立联合模型并绘制其列线图。
1.5 统计学方法
采用Python(版本3.67)语言软件进行数据分析。计量资料以表示,组间比较行独立样本t 检验或Mann-Whitney U 检验。计数资料组间比较行χ2检验(或连续校正Yates χ2检验)。采用ROC 曲线评价不同模型的预测性能,并计算敏感度、特异度。采用DeLong 检验估计不同模型间AUC 值的差异。使用scikit-learn 软件包绘制校准曲线。使用Python 的rpy2软件包及rms 软件包(https://pypi.org/project/RMS/)绘制列线图。以P<0.05 为差异有统计学意义。
2 结果
2.1 基本临床资料
训练集和测试集中低危组与高危组基本临床资料见表1。训练集中,2 组纵隔增大淋巴结、胸膜/心包肥厚比较,差异均有统计学意义(均P<0.05);测试集中,2 组胸膜/心包肥厚、肺内转移比较,差异均有统计学意义(均P<0.05)。
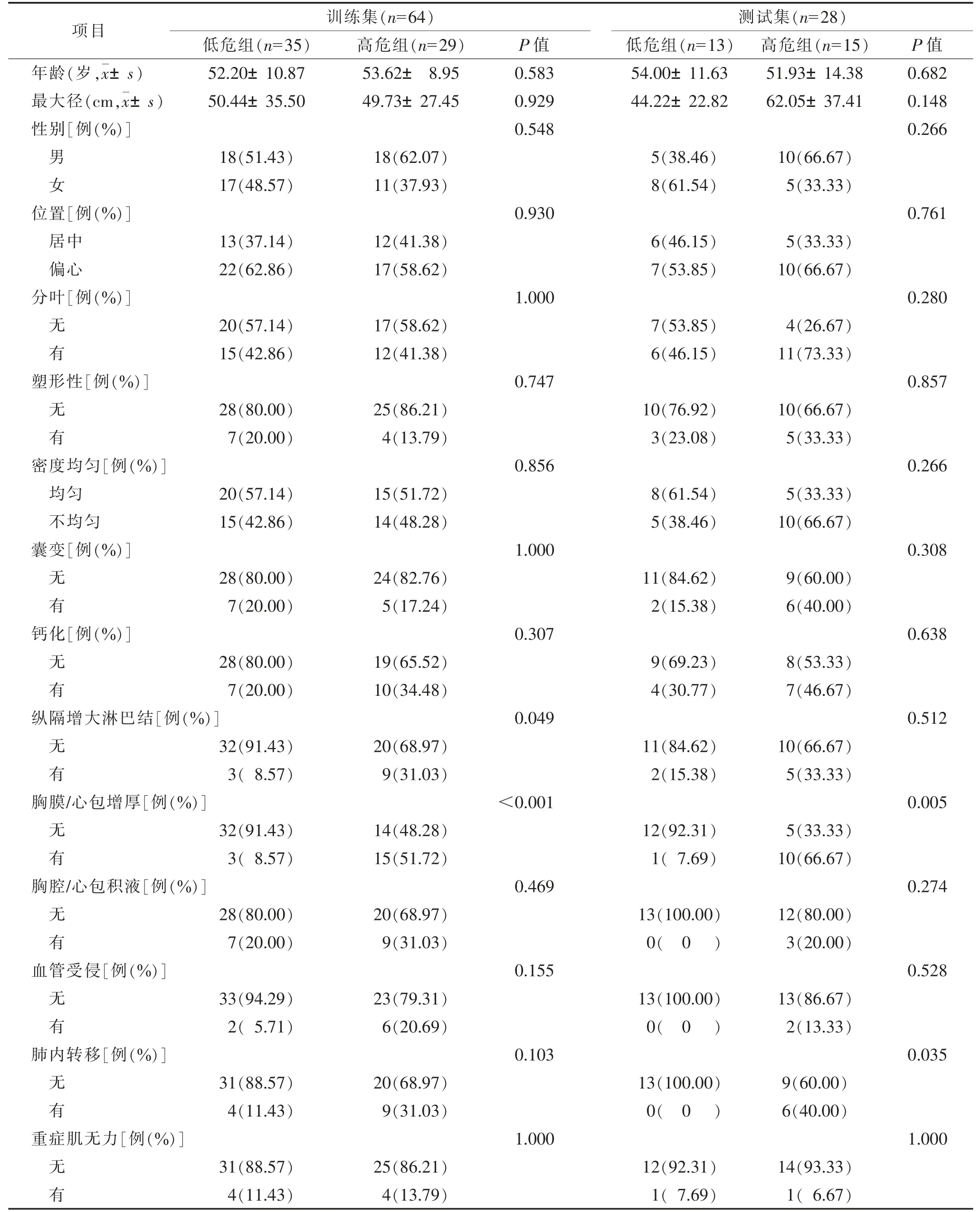
表1 胸腺上皮肿瘤患者训练集和测试集低危组与高危组临床资料比较
2.2 模型构建与效能评估
共提取1 834 个组学特征,应用Mann-Whitney U检验筛选出25 个特征,使用LASSO 算法和10 折交叉验证进一步筛选特征(图1),根据最优λ 值0.025 6,最终共获得11 个主要特征,影像组学评分计算公式为:
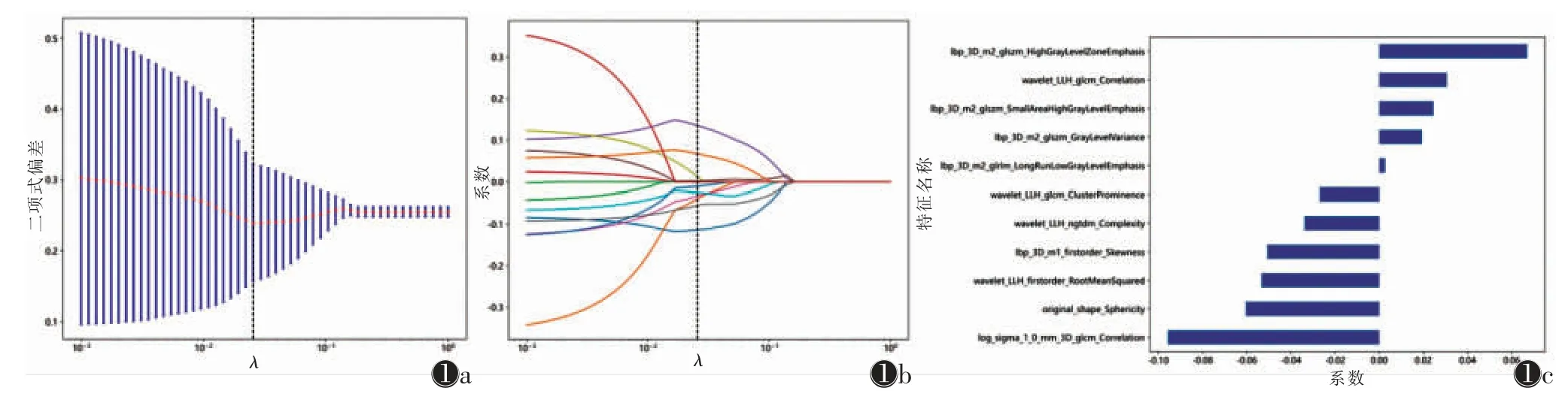
图1 影像组学特征筛选流程 注:图1a 为最小绝对收缩和选择算子(LASSO)算法10 折交叉验证筛选出的组学特征,二项式偏差最小值对应的横坐标为最优λ 值;图1b 每条曲线代表各自变量系数的变化,其中垂线对应最优λ 值;图1c 为特征权重条形图
影像组学评分=0.490-0.051×lbp_3D_m1_first order_Skewness+0.003×lbp_3D_m2_glrlm_LongRun LowGrayLevelEmphasis+0.019×lbp_3D_m2_glszm_GrayLevelVariance+0.067×lbp_3D_m2_glszm_High GrayLevelZoneEmphasis+0.025×lbp_3D_m2_glszm_SmallAreaHighGrayLevelEmphasis-0.096×log_sigma_1_0_mm_3D_glcm_Correlation-0.060×original_shape_Sphericity-0.053×wavelet_LLH_firstorder_RootMean Squared-0.027×wavelet_LLH_glcm_ClusterProminence+0.031×wavelet_LLH_glcm_Correlation-0.034×wavelet_LLH_ngtdm_Complexity。
构建LR、SVM、RandomForest、KNN 等9 种机器学习模型,其中SVM 机器学习模型整体准确率最高。因此选择SVM 作为构建影像组学模型的基础模型(图2)。
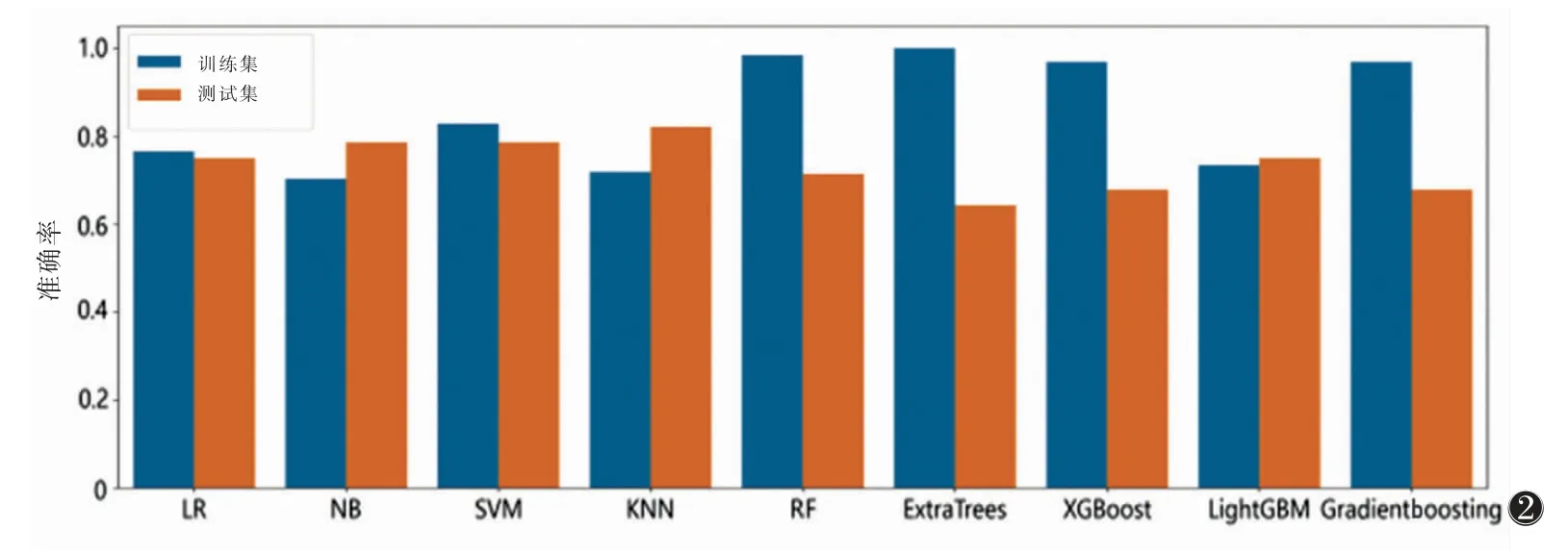
图2 9 种机器学习模型整体准确率柱状图 注:LR 为逻辑回归模型,NB 为朴素贝叶斯法,SVM 为支持向量机,KNN 为K 近邻,RF 为随机森林模型,ExtraTrees 为极度随机树,XGBoost 为极端梯度提升,LightGBM 为轻量梯度提升,Gradientboosting 为梯度提升
选取纵隔肿大淋巴结、胸膜/心包肥厚构建临床模型。再与影像组学评分共同构建联合模型并制作列线图(图3)。校准曲线表明训练集中各模型拟合度好(图4)。训练集及测试集中联合模型诊断效能均较高(表2,图5)。DeLong 检验显示,训练集及测试集中影像组学模型及联合模型均优于临床模型(均P<0.05),影像组学模型与联合模型间AUC 比较,差异均无统计学意义(均P>0.05),但联合模型AUC略高于影像组学模型。
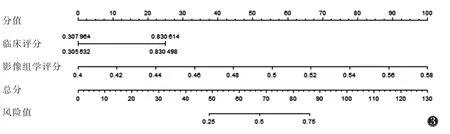
图3 基于临床评分、影像组学评分构建的联合模型的列线图
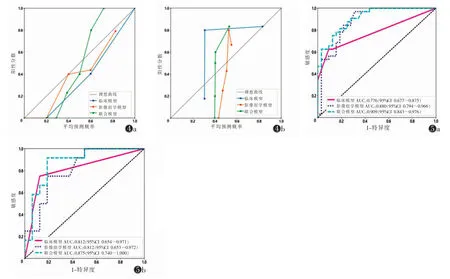
图4 临床模型、影像组学模型、联合模型的校准曲线 注:图4a 为训练集;图4b 为测试集。当模型的预测概率与实际概率越接近,提示模型的拟合优度越好 图5 临床模型、影像组学模型及联合模型鉴别胸腺上皮肿瘤低危与高危的ROC 曲线 注:图5a 为训练集;图5b 为测试集
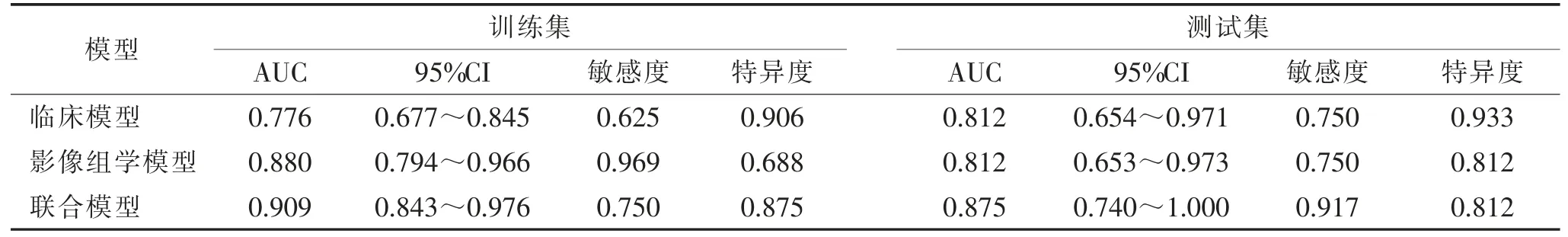
表2 不同模型的诊断效能比较
3 讨论
TET 患者多无临床相关症状,仅在体检时发现。CT 可提供病变的形态学和解剖学信息,但易受诊断医师主观判断和经验的影响,因此常规影像学表现无法很好地预测肿瘤的恶性程度。研究表明,基于胸腺肿瘤的CT 模型,包括肿瘤体积、边界和强化程度等影像特征,预测恶性程度的准确率仅70.8%[9]。CT 增强扫描影像组学具有区分低危组和高危组TET 的潜力[10]。但部分患者无法行CT 增强扫描,而NECT 提供的诊断信息又相对较少。本研究仅58 例(63.04%)完成了CT 增强扫描。因此,本研究基于NECT 图像,旨在分析预测模型的效能。
目前,有关影像组学在诊断胸腺病变中应用的研究较多。Xiao 等[11]报道了联合MRI 列线图在个体化诊断和亚型预测方面的应用,但其仅使用了LR 机器学习模型。Kayi 等[12]选择了4 种影像组学模型区分低危组和高危组TET,但并未进一步探讨影像组学列线图的价值。Dong 等[13]在CT 增强扫描的基础上,选择了5 种机器学习模型,构建了影像组学列线图以预测TET 的风险类型,但并未分析NECT 的预测价值。Liu 等[14]分别构建了NECT、CT 增强扫描模型,而基于NECT 的模型表现更好,但研究仅使用了LR 机器学习模型。本研究基于9 种机器学习模型,并通过增加临床特征,进一步提高了影像组学模型的效能。影像组学特征可反映NECT 图像中的信息,而临床特征则提供了其他识别疾病风险的线索。上述2 个因素结合,可有效提高诊断效能。
本研究通过训练集,在区分低危组和高危组TET方面选择了相关的临床特征,包括纵隔淋巴结增大和胸膜/心包肥厚。在肺部炎症或肿瘤性病变时,多伴纵隔淋巴结增大。本研究中高危组中更易出现纵隔淋巴结增大,与其生物学特性相符。Liu 等[14]也发现,纵隔脂肪浸润、纵隔淋巴结增大和胸腔积液在TET 的不同组中存在差异。胸腔积液可出现在高危组TET中,是常见侵袭性TET 的一种临床表现。本研究2 组胸腔积液发生率比较差异无统计学意义,可能与例数较少有关。低危组肿块通常较小,形状规则或呈浅分叶状,密度均匀,包膜完整,周围脂肪间隙清晰;当体积较大时,常压迫周围组织,很少侵入周围结构或侵犯同侧胸膜或心包,因此边界清晰。相反,高危组肿块常呈分叶状,边缘不规则,密度不均匀,周围脂肪间隙部分缩小或消失,易产生同侧胸膜植入性转移或浸润心包和大血管[15]。TET 引发的重症肌无力多由组织学类型和免疫失衡决定,其严重程度与肿瘤大小无关。本研究中,低危组4 例重症肌无力均为AB型,与Tovazhnyanska 等[16]的研究结果一致。AB 型TET 患者的临床表现最严重,相对于淋巴样TET(B1型)患者,肌无力症状较轻。本组重症肌无力仅10 例,因此需加大样本量进一步探讨重症肌无力在TET 风险分类中的价值。
本研究建立并验证了一种基于NECT 的影像组学列线图方法,用于预测低危和高危TET。这种方法无创、快速、方便,通过SVM 算法可获得最佳预测影像组学模型。Feng 等[17]的研究也证实,SVM 模型在简化的TET 风险分类中具有最佳的预测性能,但其研究基于2D-ROI 分割,而本研究采用了3D-ROI 分割,可提供肿瘤的3D 纹理信息。通过结合影像组学评分和临床评分构建联合模型,训练集AUC 为0.909,测试集AUC 为0.875,优于临床模型和影像组学模型,其预测TET 的风险类型比单纯使用临床危险因素和影像组学特征更好。列线图可在模型复杂度和学习能力之间获得最佳的泛化能力,且简洁明了,易于理解和操作,具有一定的临床应用价值。
本研究最终选取的11 个影像组学特征,在区分低危和高危TET 方面,灰度级大小区域矩阵特征(GLSZM)得分最高。因肿瘤分型不同和肿瘤内部的异质性差异,GLSZM 代表的灰度值变异性也不同,可能与肿瘤细胞的恶性程度增加、细胞体积和细胞致密性有关。目前,有关影像组学特征在模型中的作用及其背后生物学机制研究较少。因此,这些特征的潜在意义需进一步研究。
本研究的局限性:①为单中心回顾性分析,样本量较小,且按照7∶3 比例划分训练集和测试集,可能导致模型过拟合,需扩大样本量以减少选择偏差;②手工勾画病变轮廓时可能会导致误差,特别是较小的肿瘤,会降低精确度;③模型构建仅针对TET 低危和高危2 组,缺乏对不同亚型之间的对比研究;④受增强扫描病例数量的限制,仅使用CT 平扫图像,后续可考虑在增加病例数量的基础上纳入CT 增强扫描图像。
综上所述,基于所选临床特征及NECT 影像组学特征的可视化列线图模型,可能有助于TET 临床术前诊疗方案的选择。但该模型的临床应用价值和稳定性仍需进一步改进和探索,以期获得更好的效果。

