高产抗菌脂肽Fengycin 芽孢杆菌的诱变育种和发酵条件优化
陈尚里,于福田,沈圆圆,刘小玲
(广西大学轻工与食品工程学院,广西南宁 530004)
Fengycin 是一种由芽孢杆菌产生的环状脂肽分子,包括10 个氨基酸和一个C14~C18脂肪酸链,同时具有亲水性和亲脂性,这也导致其具有出色的生物表面活性剂活性和多种生物活性[1-2]。Fengycin 的疏水性能与微生物细胞膜的磷脂双分子层相互作用,改变其结构和通透性,从而杀死病原类微生物[3]。各种病原体,尤其是真菌病害,正在对全球食品安全构成越来越大的风险,Fengycin 具有抗菌范围广、安全降解性高和溶血性低等特点,在食品、医药和生物防治等方面拥有广阔的应用前景[4-5]。
目前,Fengycin 昂贵的生产成本,是限制其进一步商业化和产业化的关键。近年来,许多策略被用来提高微生物脂肽类次级代谢物的产量,包括诱变育种、基因工程(启动子工程、基因组和转录组学分析)和发酵优化[6-8]。紫外诱变、常压室温等离子体(ARTP)诱变、化学诱变是用于提高微生物脂肽类次级代谢产物产量简单且经济有效的方法[9-10]。诱变育种中物理、化学因素导致微生物的DNA 碱基损伤,引起三联体突变,这些突变可以通过影响蛋白质合成对微生物代谢产生重大影响,最终导致次级代谢产物产量的提升[6,11-13]。Ameri 等[14]报道,在紫外线诱变后,与野生型相比,萎缩芽孢杆菌FSHM2的嗜热碱性脂肪酶活性增加了2 倍。在微生物诱变选育过程中,单一诱变往往会产生“疲劳效应”,采用多种诱变选育相结合的复合诱变通常能够获得更加高产的菌株,Beacham 等[15]报告的微拟球藻在经过EMS 和紫外线诱变后,脂肪酶产量提升了3 倍。通过响应面优化发酵条件,也是提高微生物脂肽类次级代谢产物产量的有效方法,李光月等[16]通过响应面法优化枯草芽孢杆菌FHYB201030 的发酵工艺,使其表面活性素产量提升480 mg/L,较优化前提高34.56%。
本文以本实验团队前期从北部湾红树林筛得的芽孢杆菌YA-215 为基础,通过复合诱变育种(紫外诱变、ARTP 诱变、化学诱变),获取高产Fengycin突变株。采用高通量测序手段对突变株进行进行扫描图测序和完成图测序(扫描图利用目前使用最广泛的二代测序平台Illumina Hiseq×10 平台,完成图采用二代+三代即Illumina Hiseq+PacBio 的测序方式),结合NCBI 数据库进行对比,探究突变株UA397的分类地位。在单因素实验上,通过基于Box-Behnken 模型的响应面试验设计获取最优发酵工艺,以期解决Fengycin 产量低的问题,为Fengycin 在医药、食品、农业等领域的研究及产业化应用奠定产量基础。
1 材料与方法
1.1 材料与仪器
芽孢杆菌(Bacillus)YA-215 本课题组实验室分离保藏;LB 肉汤培养基(g/L):胰蛋白胨10.0 g,酵母浸粉5.0 g,氯化钠10.0 g 北京索莱宝科技有限公司;LB 琼脂培养基:胰蛋白胨10.0 g,酵母浸粉5.0 g,氯化钠10.0 g,琼脂15 g 北京索莱宝科技有限公司;血球计数板、乙腈(色谱纯)德国默克公司;Fengycin 标准品 Sigma 公司;;氯化钠、无水乙醇、蔗糖、果糖、半乳糖、葡萄糖、甘露糖、可溶性淀粉、蛋白胨、酵母提取物、玉米浆粉、(NH4)2SO4、NH4Cl 或NaNO3等其他试剂 均为国产分析纯。
SW-CJ-2F 洁净工作台 苏州安泰空气技术有限公司;SUNRISE 酶标仪 帝肯(上海)有限公司;UV-6100 紫外可见分光光度计 上海美谱达仪器有限公司;ZQZY-85CS 振荡培养箱 上海知楚仪器有限公司;DHP-9082 电热恒温培养箱 上海齐欣科学仪器有限公司;GI80TW 高压蒸汽灭菌锅 致微(厦门)仪器有限公司;CR21N 高速冷冻离心机 日立公司;UV-254 暗箱式紫外透射仪 北京鼎国生物技术发展中心;ARTP-Ⅱ常压室温等离子体诱变仪 无锡源清天木生物科技有限公司;E2695/2998PDA 高效液相色谱(包括2998 二极管阵列检测器,Empower3 Pro 色谱工作站)美国Waters 公司。
1.2 实验方法
1.2.1 菌株的活化与菌悬液制备 菌株的活化与菌悬液制备参照孟兆丽等[17]的方法改进,取-80 ℃保藏菌种采取平板划线法接种于LB 固体培养基上,37 ℃、70%湿度的条件下倒置培养24 h。挑取单菌落,接种于100 mL 的LB 肉汤培养基中,200 r/min、37 ℃、70%湿度振荡培养箱培养24 h(一级活化)。从一级活化的菌悬液中取1 mL(1%接种量)接种至100 ml 的LB 肉汤培养基中,200 r/min、37 ℃、70%湿度振荡培养箱培养24 h(二级活化)。采用稀释涂布平板法测定二级活化的菌悬液中的活菌数,用无菌生理盐水调节菌悬液浓度至108CFU/mL。
1.2.2 诱变方法
1.2.2.1 紫外诱变方法 紫外诱变的方法参照辛磊等[18]的方法改进,打开紫外灯(25 W)照射诱变仪内部空间20 min 灭菌后,取芽孢杆菌YA-215 菌悬液(1×108CFU/mL)5 mL 和灭菌转子添加至无菌培养皿(90 mm),开启磁力搅拌器。使用紫外灯(25 W)照射,照射时间分别为 0、10、20、30、40、50、60、70、80、90、100、110、120 s,照射距离20 cm。将照射后的菌悬液用无菌生理盐水稀释107倍,取100 μL 均匀涂布于LB 琼脂培养基,以照射时间0 s 的为空白对照。避光倒置于恒温培养箱,37 ℃,70%培养24 h后计菌落,并绘制致死率曲线(公式1)。挑取单菌落发酵培养24 h 后,取上清液进行Fengycin 产量测定,以Fengycin 产量较出发菌株YA-215 增大10%的菌株为正突变菌株,计算正突变率(公式2)。选择最佳正突变率的时间进行诱变。
1.2.2.2 ARTP-化学复合诱变方法 ARTP-化学复合诱变的方法参照杨心萍等[19]的方法改进,将紫外诱变得到的高产突变株菌悬液(1×108CFU/mL)10 μL添加至灭菌后的玻璃载片,并均匀涂布。将玻璃载片放入ARTP 诱变仪中,诱变处理时间分别为 0、20、40、60、80、100、120、140、160、180 s。将照射后的菌悬液用无菌生理盐水稀释至107倍,取100 μL 均匀涂布于添加浓度为0.3%的LiCl 溶液的LB 琼脂培养基,以处理时间0 s 的为空白对照。避光倒置于恒温培养箱,37 ℃,70%湿度培养24 h 后计数菌落,并绘制致死率曲线(公式1)。挑取单菌落发酵培养24 h 后,取上清液进行Fengycin 产量测定,以Fengycin 产量较出发菌株增大10%的菌株为正突变菌株,计算正突变率(公式2)。选择最佳正突变率的的时间进行诱变。
1.2.3 突变菌株的筛选 对诱变后平板中的菌落编号,挑取单菌落依次接种至10 mL LB 肉汤培养基中,200 r/min、37 ℃、70%湿度振荡培养箱培养24 h,取发酵上清液,4 ℃、8000 r/min 的条件下离心10 min,测定Fengycin 产量,挑选发酵液中Fengycin产量高的菌株。
1.2.4 Fengycin 产量测定 取1 mL 发酵上清液,4 ℃、8000 r/min 的条件下离心10 min,采取高效液相色谱检测,在波长200~350 nm 内进行紫外吸收扫描,按照Gancel 等[20]的方法,采用C18分析柱,流动相为超纯水和乙腈,流速为0.6 mL/min;进样量为5 μL,采用梯度洗脱方式,40 min 内乙腈相由45%上升至55%。
1.2.5 菌株鉴定 菌株的全基因组测序及鉴定交给美吉生物进行,测序方式为de novo 测序,结果在Majorbio 云平台(www.majorbio.com)在线平台进行分析。
1.2.6 单因素实验 通过单因素实验对不同碳源、不同碳源添加量、不同的氮源、不同氮源添加量、不同接种量、不同发酵温度、不同发酵时间等因素进行探究,挑选出最优发酵工艺,单因素实验设计如表1所示。
1.2.7 Box-Behnken 试验设计 在单因素实验基础上,以接种量(A)、发酵温度(B)、发酵时间(C)为自变量,以Fengycin 产量(Y)为响应值进行Box-Behnken 试验设计(BBD),以评估它们对所选突变体产生表面活性素的综合影响。试验因素与水平编码如表2 所示。

表2 Box-Behnken 试验因素与水平Table 2 Factors and levels of Box-Behnken tests
1.3 数据处理
所有实验均重复3 次,结果用平均值±标准差表示;采用SPSS Statistics 26.0 软件对每一组数据进行单因素方差分析(ANOVA),然后进行显著性检验,P<0.05 认为具有显著性差异;采用Mega 6.0 软件选择NJ(Neighbor-Joining)法构建系统进化树;采用Design-Expert 12.0 软件设计组合试验和利用Origin9.8进行绘图。
2 结果与分析
2.1 紫外诱变
2.1.1 紫外诱变致死率和正突变率 对芽孢杆菌YA-215 进行紫外诱变,紫外诱变致死率和正突变率如图1 所示。可以看出,随着紫外照射时间的延长,芽孢杆菌YA-215 的致死率不断增加;当照射时间达到110 s 后致死率达到100%。正突变率随着紫外照射时间的延长不断提高,当照射时间为90 s 时,正突率变达到最高点13.2%;当紫外照射时间超过90 s后,正突变率迅速下降,这可能是因为为紫外照射剂量过大,对芽孢杆菌的遗传物质造成了不可修复的损害,这与Yu 等[21]的研究一致,同时致死率迅速增加至100%也证明了这一点。因此本实验选择紫外照射时间90 s,致死率90.23%,正突变率13.2%的条件进行紫外诱变。
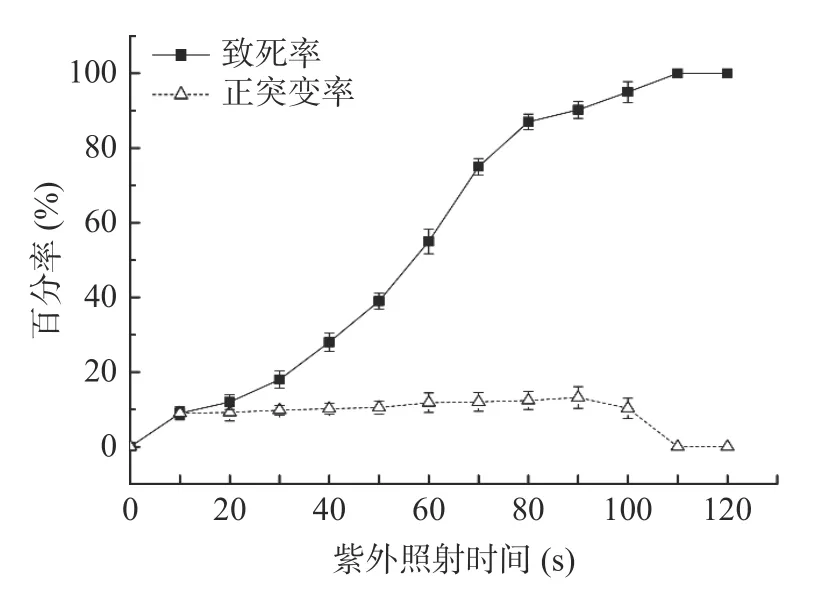
图1 紫外诱变致死率和正突变率Fig.1 UV mutagenesis lethality and positive mutation rate
2.1.2 紫外诱变筛选 UV 诱变后,共筛选出589 个正突变株,图2 为Fengycin 产量最高的八个突变株:mutUV99(200.28 mg/L)、mutUV133(204.25 mg/L)、mutUV184(199.35 mg/L)、mutUV197(209.33 mg/L)、mutUV225(215.04 mg/L)、mutUV354(206.77 mg/L)、mutUV472(217.34 mg/L)、mutUV503(221.39 mg/L)与野生型YA-215(113.02 mg/L)的对比。其中突变菌株mutUV503 的Fengycin 产量最高为221.39 mg/L,是野生型YA-215 的1.95 倍;沙见宇等[22]通过紫外诱变选育获得一株高莫纳克林K 菌株,其莫纳克林K 产量较紫外诱变前提高了27%。因此选择突变菌株mutUV503 继续进行ARTP-LiCl 诱变。
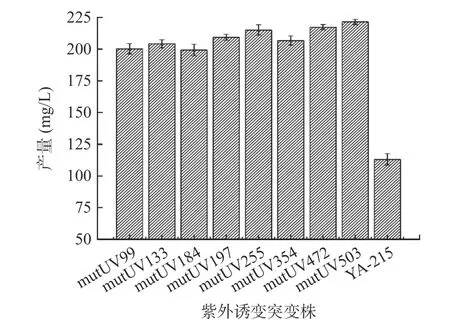
图2 紫外诱变突变株的Fengycin 产量Fig.2 Fengycin production of UV mutagenesis mutants
2.2 ARTP-化学诱变
2.2.1 ARTP-化学诱变致死率和最佳正突变率 对突变株mutUV503 进行ARTP-化学诱变,ARTP-化学诱变致死率和正突变率如图3 所示。与紫外诱变相似,随ARTP 的处理时间的延长,致死率不断上升,处理时间超过160 s 时,致死率达100%。ARTP 中的活性能量粒子能够改变芽孢杆菌的DNA 序列,长时间的ARTP 处理引起基因过度损伤,不能诱发细胞的修复机制[23]。因此本实验选择ARTP 处理120 s,致死率91.2%,正突变率11.35%的条件进行诱变。
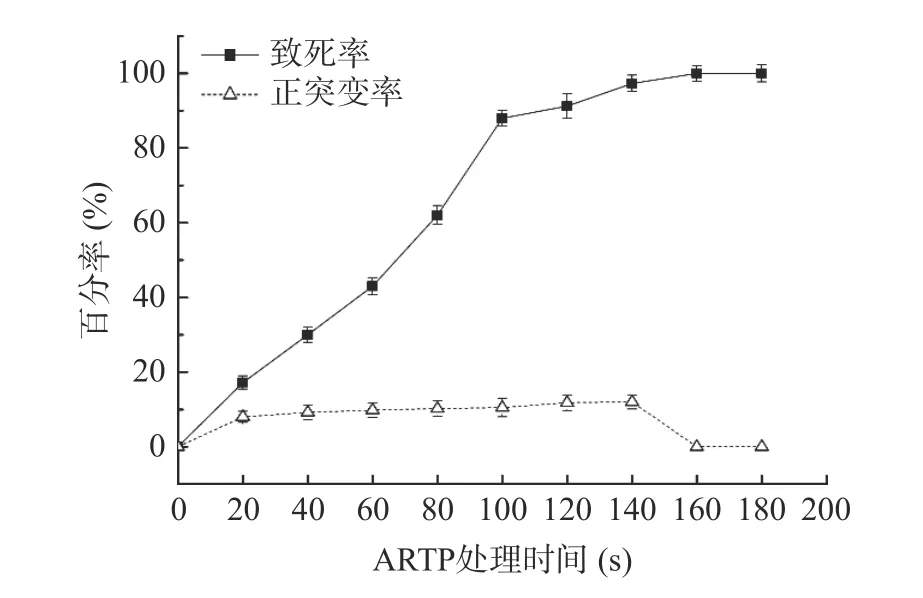
图3 ARTP-化学诱变致死率和正突变率Fig.3 ARTP-chemical mutagenesis lethality and positive mutation rate
2.2.2 ARTP-化学诱变诱变筛选结果 ARTP-LiCl诱变后共筛选出893 个正突变菌株,图4 为Fengycin 产量最高的5 个复合诱变突变株:mutUA397(388.34 mg/L)、mutUA112(355.34 mg/L)、mutUA244(327.78 mg/L)、mutUA362(362.51 mg/L)、mutUA558(370.92 mg/L)与紫外诱变突变株mutUV503(221.39 mg/L)的对比。其中突变体mutUA397 的Fengycin 产量最高为388.34 mg/L,较未经ARTP-化学诱变前提升了75.4%;童凡等[24]通过ARTP 诱变育种,使得产淀粉酶菌株酶活提升了78%。紫外诱变后的突变体经ARTP-化学诱变后,Fengycin 产量再次大幅提升,这是由于同一菌株经单一诱变处理,会产生“疲劳效应”,从而影响细胞的生长、代谢等,造成诱变效果不理想,因此采用多种手段对菌株进行复合诱变,更容易获得高产突变株[25]。因此,选择突变菌株mutUA397(命名为UA397)进行下进一步的实验。
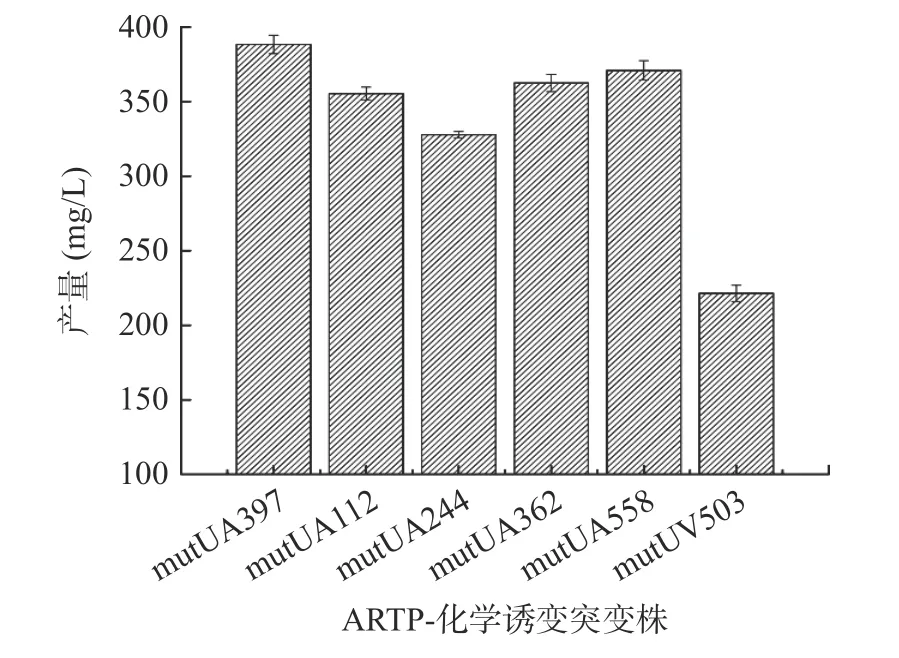
图4 ARTP-化学诱变突变株Fengycin 产量Fig.4 Fengycin production of ARTP-chemical mutagenesis mutants
2.3 突变体鉴定和基因簇分析
将突变株UA397 基因序列与NCBI 数据库对比,16S 比对结果如表3 所示,结果显示突变株UA397 与暹罗芽孢杆菌Bacillus siamensis.GCF_000262045.1 最为接近,序列相似度为99.871%,比对覆盖率100%。通过Mega 6.0 软件选择NJ(Neighbor-Joining)法,基于20 株与突变株UA397 在种属水平上最接近菌种的核心序列构建系统进化树,如图5 所示。根据系统临近进化树,突变株UA397 被归为暹罗芽孢杆菌。

图5 系统发育树Fig.5 Phylogenetic tree
暹罗芽孢杆菌UA397 的基因组Clusters of Orthologous Groups of Proteins 注释分析如图6 所示,突变株UA397 中共有3086 个基因得到了COG注释,占基因组中81.10%的基因共具有23 个COG功能分类,其中19.9%的基因没有功能特征。涉及氨基酸转运与代谢的基因为第一大类,共注释304个基因;次级代谢产物基因簇分析中发现Fengycin合成基因簇,如图7 所示。
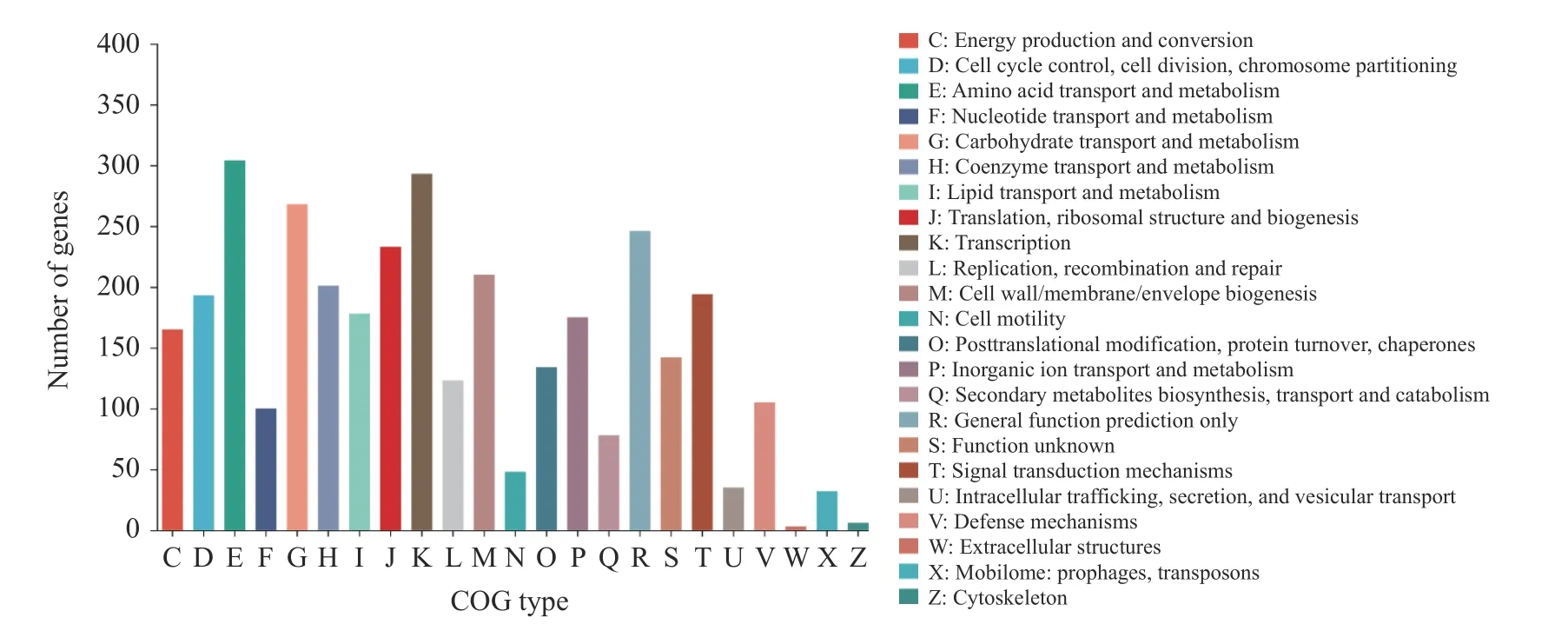
图6 COG 功能注释Fig.6 COG functional notes
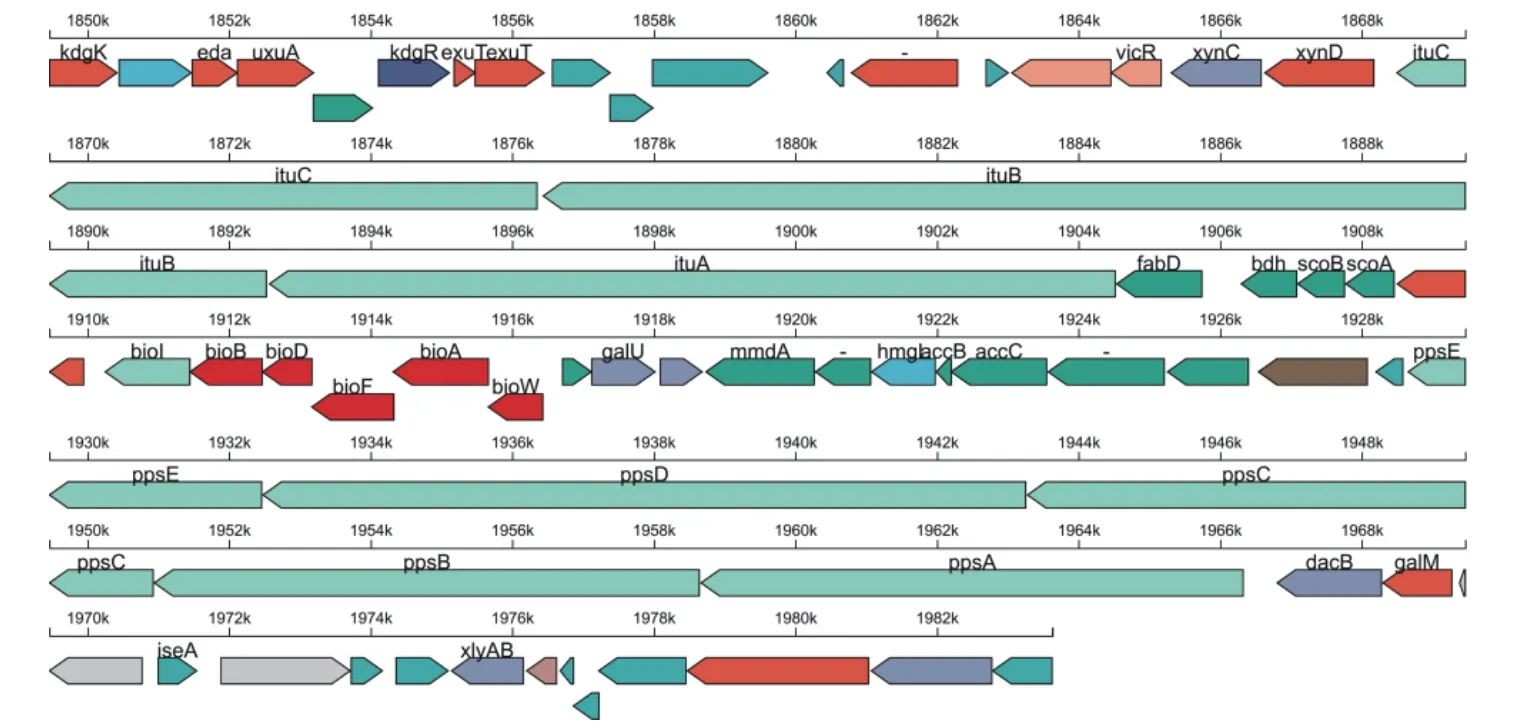
图7 Fengycin 合成基因簇线性图谱Fig.7 Linear map of Fengycin synthetic gene cluster
2.4 发酵工艺优化
2.4.1 单因素实验
2.4.1.1 不同碳源对Fengycin 产量的影响 图8 显示了不同碳源(蔗糖、果糖、半乳糖、葡萄糖、甘露糖、可溶性淀粉)对暹罗芽孢杆菌UA397 的Fengycin 产量的影响。结果表明,当蔗糖为单一碳源时,Fengycin 产量最高;葡萄糖为单一碳源时,Fengycin产量最低。相较于葡萄糖等单糖,双糖和多糖更有利于促进暹罗芽孢杆菌UA397 发酵过程中脂肽类次级代谢产物Fengycin 产量的提高,这也与冒鑫哲等[26]的研究一致,因此选择蔗糖为最佳碳源。
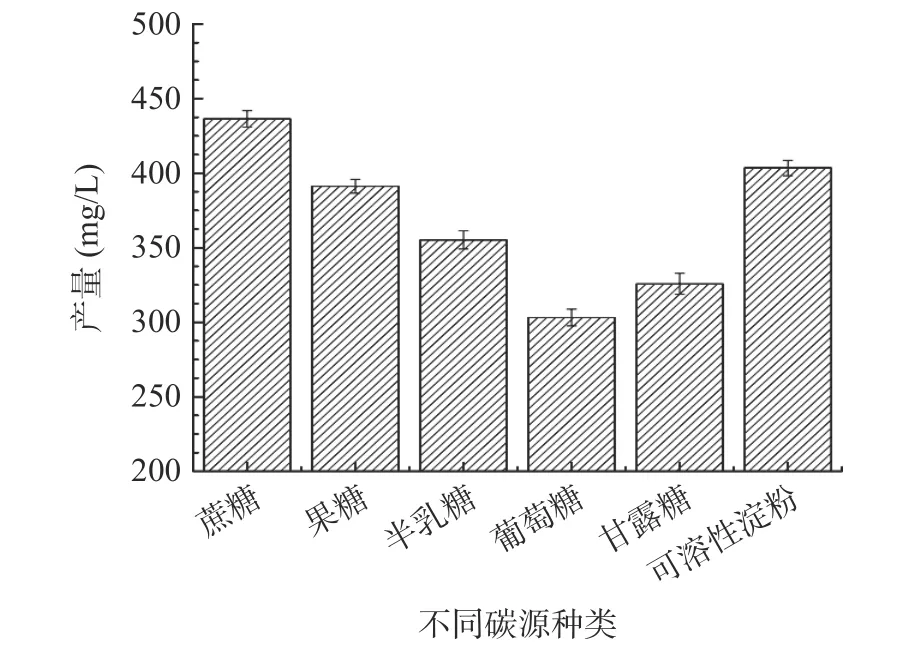
图8 不同碳源种类对Fengycin 产量的影响Fig.8 Effects of different carbon sources on the yield of Fengycin
2.4.1.2 碳源添加量对Fengycin 产量的影响 图9显示了最佳单一碳源蔗糖不同添加量(10、15、20、25、30、35 g/L)对Fengycin 产量的影响。结果表明,随着蔗糖添加量的不断增加,Fengycin 产量呈现先上升后下降的趋势,当蔗糖添加量为25 g/L 时,获得了最高的Fengycin 产量435.75 mg/L。当蔗糖添加量较低时,不足以满足暹罗芽孢杆菌UA397 的生长繁殖,会导致Fengycin 产量下降。韩唱等[27]报道了蔗糖添加量过高时,会导致液体培养基中溶氧量不足与渗透压增大,影响芽孢杆菌的生长和多肽类次级代谢物的产量。因此选择25 g/L 为最佳碳源添加量。
2.4.1.3 不同氮源对Fengycin 产量的影响 图10 显示了不同氮源(蛋白胨、酵母提取物、玉米浆、(NH4)2SO4、NH4Cl、NaNO3)对Fengycin 产量的影响。结果表明,氮源的种类对Fengycin 产量有极大的影响,当蛋白胨作为氮源时,获得了最佳的Fengycin 产量438.44 mg/L。蛋白胨、酵母提取物、玉米浆等有机氮源相较于无机氮源更加有利于芽孢杆菌的生长与多肽类次级代谢产物的产生[27]。因此选择蛋白胨作为最佳氮源。
2.4.1.4 不同氮源添加量对Fengycin 产量的影响图11 显示了最佳氮源蛋白胨不同添加量(10、15、20、25、30、35 g/L)对Fengycin 产量的影响。结果表明,随着蛋白胨添加量的增加,Fengycin 产量不断提升。当蛋白胨添加量到达30 g/L 以后,随着蛋白胨添加量的增加,Fengycin 产量达到450.01 mg/L 后不再提升,这也冒鑫哲等[26]的研究一致。出于节约成本方面的考虑,选择最佳蛋白胨添加量为30 g/L。
2.4.1.5 不同接种量对Fengycin 产量的影响 图12显示了不同接种量(1%、3%、5%、7%、9%)对Fengycin 产量的影响。结果表明,随着接种量的增加,Fengycin 产量呈现先上升,后下降的趋势,在接种量为5%时,Fengycin 产量达到最大值475.35 mg/L。接种量过大时,导致后期发酵液中菌体浓度过大,菌体利用培养基中的营养生长发育,最终导致多肽类次级代谢产物Fengycin 产量下降[28-29]。因此响应面Box-Behnken 试验设计选取的水平为3%、5%、7%。
2.4.1.6 不同发酵温度对Fengycin 产量的影响 图13显示了不同发酵温度(31、34、37、40、43 ℃)对Fengycin 产量的影响。结果表明,随着发酵温度的增加,Fengycin 产量呈现先上升,后下降的趋势,在发酵温度为37 ℃时,Fengycin 产量达到最大值475.75 mg/L。过高过低的发酵温度温度都不利于菌体的生长繁殖,从而导致多肽类次级代谢产物Fengycin 的产量下降,冒鑫哲等[26]报道了37 ℃为最适宜芽孢杆菌生产的温度。因此响应面Box-Behnken 试验设计选取的水平为34、37、40 ℃。
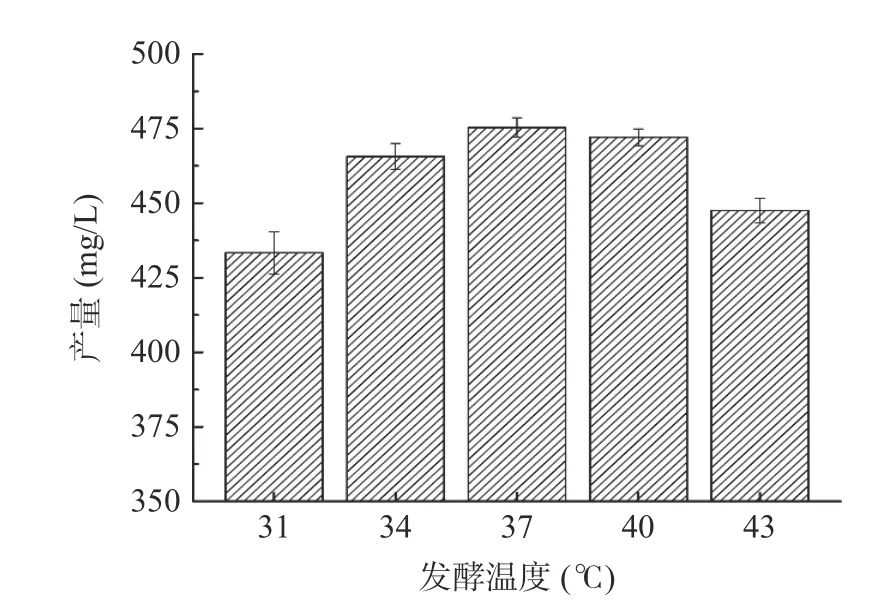
图13 不同发酵温度对Fengycin 产量的影响Fig.13 Effects of different fermentation temperatures on the yield of Fengycin
2.4.1.7 不同发酵时间对Fengycin 产量的影响 图14显示了不同发酵时间(12、24、36、48、60 h)对暹罗芽孢杆菌UA397 的Fengycin 产量的影响。结果表明,随着发酵时间的延长,Fengycin 产量呈现先上升,后下降的趋势,在发酵时间为36 h 时,Fengycin产量达到最大值513.64 mg/L。发酵时间不到24 h时,菌体还在对数生长期,未能进入平稳期,因此,Fengycin 产量极低;发酵时间过长,发酵液中营养物质不足,菌体将次级代谢产生的多肽Fengycin 用于生长繁殖,从而导致Fengycin 产量下降[30-31,20]。因此响应面Box-Behnken 试验设计选取的水平为24、36、48 h。
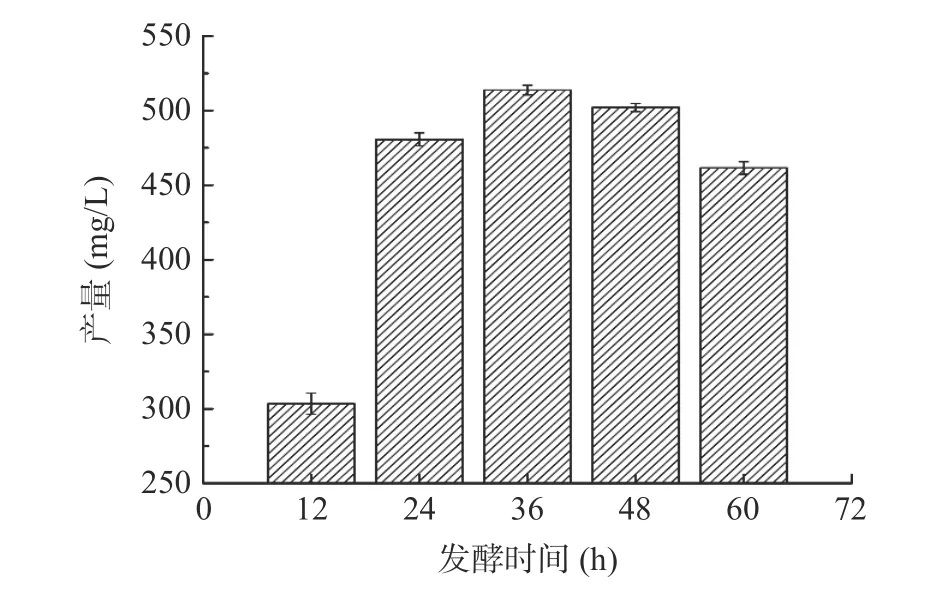
图14 不同发酵时间对Fengycin 产量的影响Fig.14 Effect of different fermentation time on the yield of Fengycin
2.4.2 响应面试验设计 在单因素实验的结果的基础上,以A(接种量)、B(发酵温度)、C(发酵时间)3 个对Fengycin 产量有重要影响的因素为自变量,以Y(Fengycin 产量)为响应值,采用Design Expert 8.0.6 软件设计了三因素三水平的响应面试验,Box-Behnken 试验设计与结果见表4。
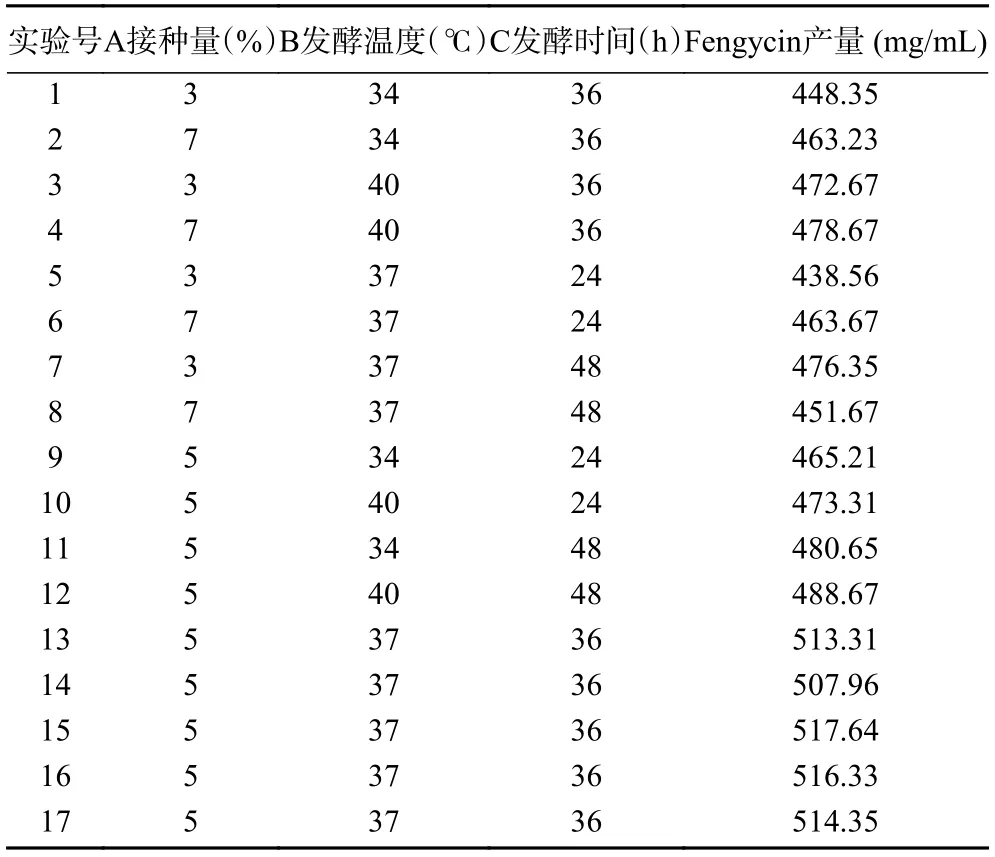
表4 Box-Behnken 试验设计与结果Table 4 Design and results of Box-Behnken experimental design
对A(接种量)、B(发酵温度)、C(发酵时间)3 个单因素进行二次多项式回归拟合,构建响应值Y(Fengycin 产量)的回归模型方程表示为:
Y=513.92+2.66A+6.99B+7.07C-2.22AB-12.45AC-0.02BC-33.79A2-14.40B2-22.56C2
对回归模型进行方差分析和差异显著性检验如表5 所示,回归模型F值为43.39(P<0.0001),极其显著;失拟项的F值为3(P=0.1583),不显著,表明该模型拟合良好。确定系数R2为0.9824,表明Fengycin 产量的预测值与真实值具有较高的一致性。此外,R2Pre=0.7965 和R2Adj=0.9598,表明该模型具有较好的拟合度和可信度,能够准确地预测响应值Fengycin 产量与模型中各个因素之间的关系。其中接种量(A)对Fengycin 产量影响不显著(P>0.05),发酵温度(B)和发酵时间(C)对Fengycin 产量影响极显著(P<0.01);交互项AB、BC 对Fengycin 产量影响不显著(P>0.05),AC 对Fengycin 产量影响极显著(P<0.01);二次项A2、B2、C2对Fengycin 产量影响极显著(P<0.01)。
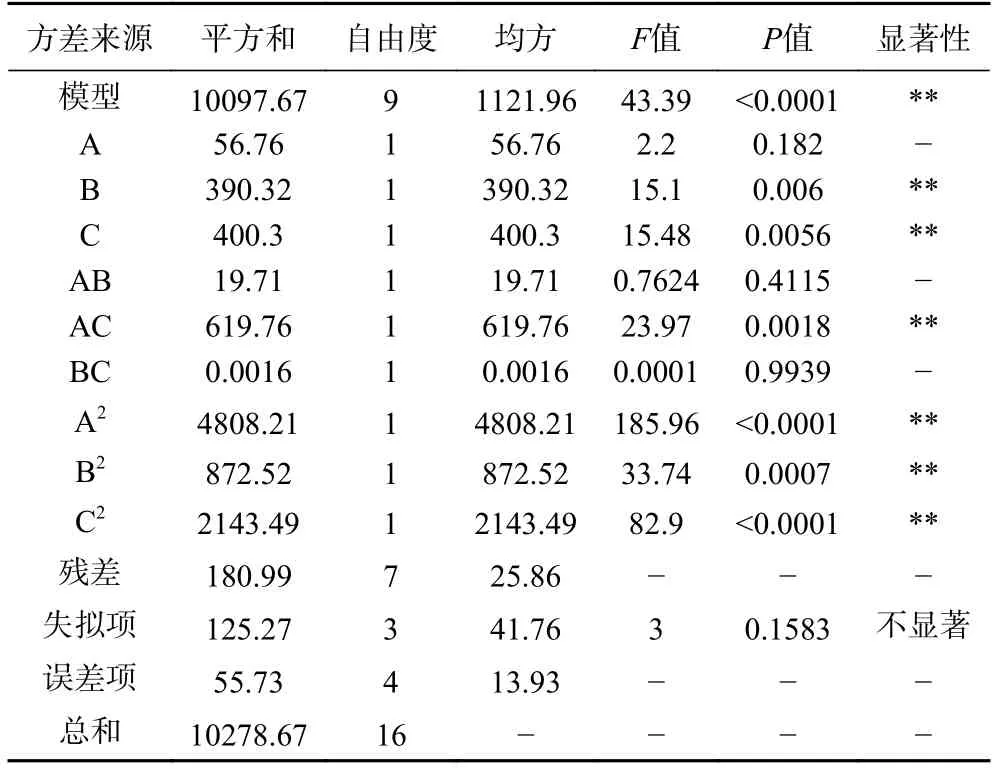
表5 回归模型方差分析Table 5 Analysis of variance of regression model
响应面三维曲面图(图15)可直观反映A(接种量)、B(发酵温度)、C(发酵时间)各个因素之间的交互作用对Fengycin 产量的影响。通过3D 曲面坡度的变化趋势,可以直观地看出各个因素对响应值Fengycin 产量的影响,等高线中的最小椭圆的中心点即是Fengycin 产量的最高点。由图可以看出,3 个因素对Fengycin 产量影响的显著性顺序为C(发酵时间)>B(发酵温度)>A(接种量)。
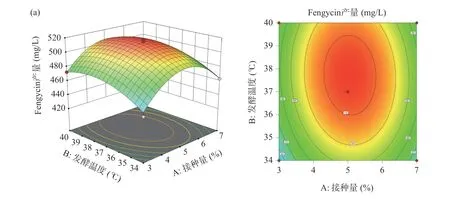
图15 因素间交互作用对Fengycin 产量影响的响应面及等高线图Fig.15 Response surface and contour lines of the interaction of various factors on Fengycin production
2.4.3 最佳发酵条件的确定及验证 从回归模型中,预测到的最佳发酵条件为,蔗糖25 g/L、蛋白胨30 g/L、接种量5.006%、发酵温度37.727 ℃、发酵时间37.873 h,预测的Fengycin 产量为515.32 mg/L。为了验证响应面试验所确定的回归模型结果的准确性,并考虑到实际实验条件的限制,设置发酵条件为:蔗糖25 g/L、蛋白胨30 g/L、接种量5.01%、发酵温度37.7 ℃、发酵时间37.8 h,进行验证试验。验证实验所得Fengycin 产量为517.09±1.78 mg/L。
3 结论
本研究通过UV 和ARTP-化学诱变选育相结合的方法获得了一株高产的Fengycin 的暹罗芽孢杆菌UA397,其Fengycin 产量是野生型芽孢杆菌YA-215 的3.436 倍。此外通过基于Box-Behnken 模型的响应面试验设计确定了暹罗芽孢杆菌UA397 的最佳发酵条件:蔗糖25 g/L、蛋白胨30 g/L、接种量5.01%、发酵温度37.7 ℃、发酵时间37.8 h,在此条件下,Fengycin 产量为517.09 mg/L,是出发菌株在未优化发酵工艺时产量的4.57 倍。本实验为通过复合诱变育种和发酵工艺优化提高芽孢杆菌脂肽类次级代谢产物的产量提供一定的理论基础,同时也为Fengycin 在医药、食品、农业等领域的产业化应用奠定产量基础。

