膳食成分对儿茶素生物利用率的影响及多酚协同增效的研究进展
虞睿宁,蒋志林,吴晓琴,沈建福,
(1.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;2.常山富而康山茶油有限公司,浙江衢州 324200)
儿茶素作为一种酚类化合物,广泛存在于各类水果、蔬菜、植物性饮料和葡萄酒中,其中茶叶是儿茶素类化合物的主要来源。儿茶素具有抗氧化和抗菌活性,可作为膳食补充剂添加到功能食品中;还可用于治疗多种疾病,包括心血管疾病、肥胖、糖尿病、乳腺癌、前列腺癌等[1]。儿茶素从茶叶等植物中提取、添加到食品或药物中、经过胃肠道消化直到到达在体内发挥最大功效的作用部位的整个过程,都需要保持良好的稳定性,才能发挥最好的功效。然而儿茶素结构不稳定,易受环境因素干扰,使其在胃肠道的消化过程中生物活性大大降低,存在生物利用率低下的缺陷[2]。
为了尝试解决儿茶素在机体中生物利用率不高的问题,研究者们采用儿茶素结构修饰或纳米结构包埋等方式来提高儿茶素的生物利用率,但关于人们日常膳食摄入的营养物质(如碳水化合物、蛋白质、脂质和膳食多酚等)对儿茶素生物利用率的影响,缺乏相关的系统性综述。本篇综述主要介绍了儿茶素的结构和影响儿茶素稳定性的因素、儿茶素在人体内吸收和代谢的机制,主要阐述了膳食成分对儿茶素的生物利用率的影响及其机制,最后列举了儿茶素与膳食多酚协同增效的应用,以帮助读者更全面地了解膳食成分对儿茶素生物利用率的影响,更深入地认识协同增效作用在发挥儿茶素生物活性、治疗各类疾病中的应用价值,为改善膳食结构、开发协同增效的新型食品提供新思路。
1 儿茶素的结构及其稳定性
1.1 儿茶素的结构
儿茶素属于黄烷醇类化合物,分子式为C15H14O6,分子量为290.27,是从茶叶等天然植物中提取出来的一种酚类活性物质。儿茶素类化合物具有2-苯基苯并二氢吡喃结构,可以分为游离型和酯化型两种,其中游离型态包括儿茶素(Catechin,C)、表儿茶素(Epicatechin,EC)、表没食子儿茶素(Epigallocatechin,EGC)等,酯化的没食子酸型有表儿茶素没食子酸酯(Epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)等,主要的几种顺反异构体结构式如图1 所示[3]。
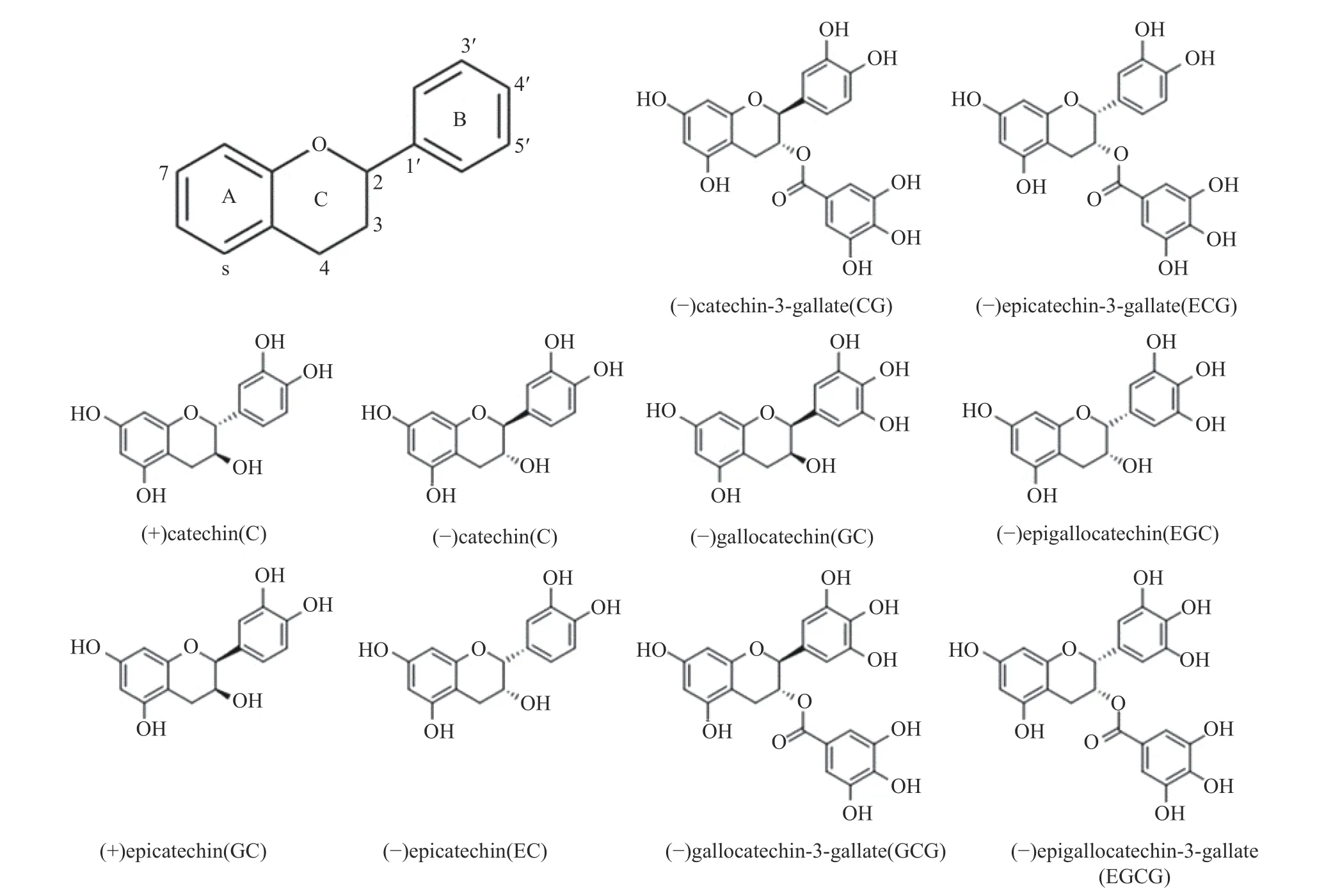
图1 儿茶素主要的几种顺反异构体结构式[3]Fig.1 Chemical structure of the major cis-trans isomers of catechins[3]
1.2 儿茶素的稳定性
儿茶素含有多个酚羟基,容易受各种化学作用和环境因素的影响,发生氧化降解。影响儿茶素稳定性的因素有很多,主要包括温度、pH、光照、氧气和离子浓度等[4]。
研究表明,温度和pH 是影响儿茶素稳定性的主要因素。Xu 等[5]研究了在25~165 ℃温度范围内,pH为2.2~8.0 的水体系中EGCG 的稳定性,发现EGCG的稳定性随着pH 和温度的升高而降低,且在pH 为3、温度为25 ℃时稳定性达到最佳。在中性和碱性条件下,EGCG 的B 环容易自氧化,产生茶碱素A等自氧化产物[6]。在60 ℃贮藏条件下,酯型儿茶素、非酯型儿茶素的稳定性低于没食子酸,容易脱去没食子酰基或发生差向异构作用[7]。吴倩倩等[8]采用纯水、自来水和11 种盐来研究不同金属离子对EGCG 稳定性的影响,发现Cu+、Fe3+、Fe2+对EGCG稳定性的影响程度较大,且离子浓度越高,稳定性越低。高温环境下儿茶素之间容易发生非酶促低聚反应生成二聚体,光照条件特别是UVB 辐照下易发生异构化和裂解,最终使溶液变黄,所以儿茶素类化合物应低温避光保存[9]。另外,氧分压也会影响EGCG的稳定性,EGCG 在充入氮气的低氧分压环境中的稳定性大大提升,贮藏6 h 后EGCG 仅降解了5%[10]。以上研究表明,在较高的温度、pH、盐离子浓度的条件或是光照、高氧环境下,儿茶素的稳定性较差。
2 儿茶素的生物利用情况
生物利用率的定义是指药物或摄入的营养素到达体循环和发挥生物功能的特定部位的百分数[11]。研究表明,在大鼠体内,只有不到5%的口服儿茶素剂量进入体循环[12]。人体在饮用3 g 脱咖啡因的绿茶后,血浆中所含EGCG、EGC 和EC 的最大浓度分别为0.57、1.60 和0.6 μmol/L[13]。摄入的约1.68%的儿茶素在消化6 h 后存在于人的血浆、尿液、粪便中的量分别为0.16%、1.1%和0.42%,可见儿茶素的生物利用率不高[14]。Chow 等[15]在人体内进行了EGCG 的药代动力学研究,发现口服给药后血液中检测到的EGCG 的量不足1%。绿茶儿茶素在人体内的代谢过程如图2 所示[16]。导致儿茶素口服生物利用率低的因素主要包括胃肠道稳定性差,肠道吸收率低,以及各类代谢酶和肠道菌群的作用等[17]。

图2 绿茶儿茶素代谢示意图[16]Fig.2 Schematic diagram of metabolism of green tea catechins[16]
2.1 胃肠消化对儿茶素生物利用率的影响
人体摄入儿茶素后,需要经过酸性的胃液环境和碱性的小肠环境最终到达十二指肠。由于pH 升高,残余溶解氧和代谢酶含量的上升,胃肠道的环境使儿茶素的生物利用度大大降低[18]。体外模拟消化实验表明,在经过唾液、胃液、肠液消化后,C、EGC 和EGCG 的消化回收率分别为5.3%,4.6%和6.1%[19]。除了降解之外,儿茶素还受到胃肠道中残留溶解氧诱导的自氧化和差向异构化的影响[20]。此外,一部分儿茶素会被大量II 期酶如硫酸转移酶(Sulfotransferases,SULTs)、UDP-葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGTs)和儿茶酚-O-甲基转移酶(Recombinant Catechol-O-Methyltransferase,COMT)等进行代谢转化,待小肠吸收后,剩余的儿茶素进入结肠,未发现特异性受体携带的EGCG 进入小肠上皮细胞表面的细胞[21]。甲基化的EGCG 被进一步硫酸化和葡萄糖醛酸化,导致尿液和血浆中的EGCG代谢物增加[22]。
2.2 肠道吸收对儿茶素生物利用率的影响
儿茶素的肠道通透性差也是限制其生物体内利用度的重要因素。儿茶素亲水性强、缺乏吸收的特异性受体,其吸收位置主要在十二指肠,通过上皮细胞内的细胞旁和细胞间扩散两种方式进行被动扩散吸收[22]。细胞研究显示,儿茶素具有较低的表观渗透系数,因为它们在被依赖于ATP 的蛋白质吸收后发生主动外流,外排转运系统的组成部分P-糖蛋白(Permeability glycoprotein,P-gp)、多药耐药相关蛋白(Multidrug resistance-associated proteins,MRP)和乳腺癌耐药蛋白(Breast cancer resistance protein,BCRP)广泛存在于肠表面,大量的儿茶素及其代谢产物被上皮细胞中的ATP 转运蛋白泵作为底物送回肠道内腔,导致较低的生物转运率[23]。
2.3 肠道菌群对儿茶素生物利用率的影响
肠道微生物群也在儿茶素在肠道的代谢中起着关键作用。研究表明膳食摄入90%~95%的多酚会直接到达结肠后被微生物降解,目前已被证实的肠道微生物催化酚类代谢及其分解途径包括双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)和拟杆菌属(Bacteroides)等[24]。Gordon 等[25]使用猪盲肠体外模型模拟了微生物对最常见的黄酮-3-醇的降解,发现在厌氧生理条件下,EGCG 在4~8 h 内被猪肠道微生物完全代谢。同样,另一项研究表明,用放射性同位素标记口服EGCG 治疗大鼠,发现大鼠8 h后表现出最高的代谢率,表明EGCG 在吸收前被肠道微生物群代谢[26]。Takagaki 等[27]报道表明大鼠肠道细菌和细菌菌株可以将EGCG 水解成表没食子儿茶素和没食子酸。Catterall 等[28]研究了茶叶抗氧化剂(+)-儿茶素和(-)-表儿茶素在大鼠体内的生物利用度和药代动力学特征,将这些化合物的氚化衍生物以相当于人类饮食摄入水平的剂量水平通过口服和静脉注射两种方式给大鼠,结果发现口服儿茶素3 h 后血液中氚与水中的氢发生交换,而大鼠静脉注射后不发生这种交换现象,推测可能是肠道菌群微生物的作用。
3 膳食成分对儿茶素生物利用率的影响
由于儿茶素的生物利用率不高,为更好地发挥儿茶素对人体的有益作用,有人提议每天饮用8~16杯绿茶,然而过量食用儿茶素可能产生毒性效应[29]。为此,研究者们通常对儿茶素进行结构修饰,将儿茶素的基团甲基化、酰基化、酯化或者进行糖苷修饰来提高儿茶素的稳定性,也有设计纳米结构给药系统将儿茶素包埋起来,减少外界因素的影响,提高其靶向性[30]。除此之外,日常摄入的各类食物在人体消化吸收的过程中也会与儿茶素发生相互作用,人体每日必需的膳食营养成分如碳水化合物、蛋白质、脂质等,都可能会与儿茶素产生协同作用,影响儿茶素的生物利用率[31]。膳食成分对儿茶素生物利用率的影响及机制见表1。
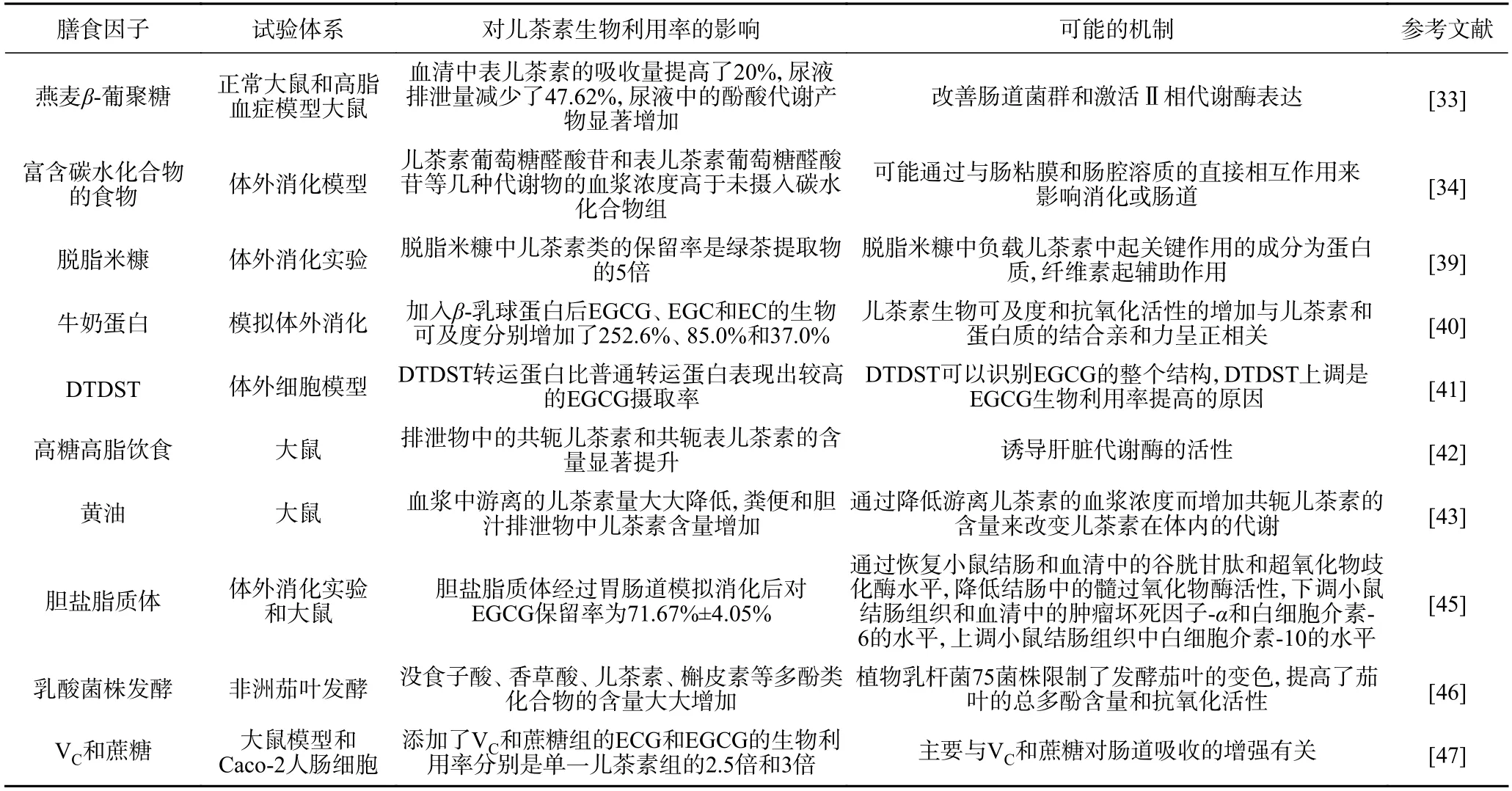
表1 膳食成分对儿茶素生物利用率的影响及机制Table 1 Mechanisms of dietary factors in improving the bioavailability of catechins
3.1 碳水化合物
均衡营养膳食要求每天摄入碳水化合物的比例应在50%~60%左右,碳水化合物作为人体必需的营养成分,研究其对儿茶素生物利用率的作用有重要意义。膳食纤维是常见的一类非淀粉类多糖,可以与多酚物质通过共价作用或者非共价作用相互结合。目前已有大量研究证实了膳食纤维和多酚的相互作用能够提高多酚的化学稳定性,减少其在胃肠道中的释放,保持其生物活性,提高其生物利用率[32]。
隋勇[33]将膳食纤维燕麦β-葡聚糖添加到荔枝果皮原花青素(Litchi pericarp proantho cyanidins,LPPC)中,发现血清中表儿茶素的吸收量提高了20%,尿液排泄量减少了47.62%,尿液中的酚酸代谢产物显著增加,其机制可能是通过β-葡聚糖与LPPC 的相互作用改善肠道菌群、上调Ⅱ相代谢酶表达加速LPPC代谢转化,实现LPPC 中儿茶素的生物利用率的提高,这也为原花青素和膳食纤维联用改善高脂血症提供新思路。碳水化合物还能增强转运蛋白的活性,促进胃肠蠕动、分泌消化液。Serra 等[34]采用体外消化模型评价富含碳水化合物的食物对葡萄籽原花青素可消化性和生物利用率的影响,发现胃中儿茶素和表儿茶素的含量显著增加,可消化性和生物利用率提升。
3.2 蛋白质
儿茶素会与唾液中富含脯氨酸的蛋白质作用生成沉淀,产生苦涩的味道。可见儿茶素也会与食品中的蛋白质和机体中的消化酶发生相互作用,但受蛋白种类、分子结构、分子大小、活性基团、反应条件等的不同,对儿茶素生物利用率的影响存在差异[31,35]。
早期有研究牛奶蛋白与可可多酚的相互作用,在巧克力中添加牛奶蛋白质,发现受试者食用后对多酚类物质的吸收量并无差别[36]。还有在茶叶中添加牛奶的研究,有些甚至导致儿茶素的总回收率下降[37]。但之后也有研究发现了蛋白质与儿茶素的亲和力,对于儿茶素在胃肠道中吸收的有利影响。
蛋白质会与多酚物质通过疏水相互作用或氢键接触结合,形成稳定的蛋白质-多酚复合物,其中β-酪蛋白对多酚的亲和能力>α-酪蛋白>β-乳蛋白,蛋白对多酚的负载效率为30%~50%[38]。石萌[39]选用米糠作为儿茶素类的可食载体原料,制备了载有儿茶素类的脱脂米糠,其中蛋白质作为米糠负载儿茶素的主要成分,在吸附儿茶素、提高儿茶素负载量上发挥重要作用。体外消化实验的结果表明脱脂米糠中儿茶素类的保留率是绿茶提取物的5 倍,显著提升了儿茶素类化合物在肠液中的稳定性。Qie 等[40]通过模拟体外消化,研究茶儿茶素、牛奶蛋白和消化酶之间的竞争性相互作用对蛋白质消化率、儿茶素生物可及度和抗氧化活性的影响。加入β-乳球蛋白(β-Lactoglobulin,β-Lg)后,EGCG、EGC 和EC 的生物可及度分别增加了252.6%、85.0%和37.0%,但添加β-酪蛋白(β-Casein,β-CN)却只增加了EC 的生物可及度,而对EGCG 和EGC 的生物可及度产生负面影响。总的来说,添加β-Lg 的儿茶素的生物利用度显著高于添加β-CN 的儿茶素,可见儿茶素生物可及度和抗氧化活性的增加与儿茶素和蛋白质的结合亲和力呈正相关。基于此,Ishii 等[41]研制出了一种新的EGCG 转运蛋白即DTD 硫酸盐转运蛋白(DTDST),以爪蟾卵母细胞作为体外细胞模型,将微量注射DTDST cRNA 的卵母细胞与普通转运蛋白组相对照,DTDST 转运蛋白表现出较高的EGCG 摄取率。
3.3 脂质
一般来说,黄油等脂类物质的摄入并不能促进儿茶素的吸收。Molinar 等[42]研究高糖高脂膳食对摄入葡萄籽原花青素大鼠的影响,发现通过诱导肝脏代谢酶的活性,排泄物中的共轭儿茶素和共轭表儿茶素的含量显著提升。Zhang 等[43]将黄油和儿茶素联用,研究黄油对儿茶素在体内吸收代谢的影响,发现血浆中游离的儿茶素量大大降低,粪便和胆汁排泄物中儿茶素含量增加。但脂质具有亲水和疏水活性的两端,会形成脂质体或者胶束,将儿茶素等多酚小分子包埋在里面,延缓儿茶素在体内的释放,在胃肠道消化中具有良好的稳定性。Athmouni 等[44]通过制备儿茶素-磷脂复合物来提高儿茶素的生物利用度,构建的儿茶素-磷脂复合物对镉金属诱导的大鼠肝损伤起到保护作用。王力[45]比较了脂质体、类脂质体和胆盐脂质体三种载体包埋EGCG 后对其胃肠道稳定性和生物利用率的影响,模拟消化实验结果显示胆盐脂质体经过胃肠道模拟消化后对EGCG 保留率为71.67%±4.05%,远远高于其他组。然后通过大鼠实验进一步研究EGCG 的药代动力学,发现胆盐脂质体组将EGCG 的药代动力学曲线下面积提高近两倍,显著延缓了EGCG 在体内的释放。
3.4 膳食补充剂
除了上述主要的膳食成分外,益生菌、抗氧化剂、膳食多酚等膳食补充剂也会与儿茶素发生作用,提高儿茶素的生物利用度。Degrain 等[46]研究了不同乳酸菌株对非洲茄叶发酵过程中酚类化合物及其抗氧化活性的影响,其中植物乳杆菌发酵后没食子酸、香草酸、儿茶素、槲皮素等多酚类化合物的含量大大增加,显著提升了抗氧化活性。Peters 等[47]分别使用大鼠模型和Caco-2 人肠细胞培养模型做体内和体外实验,研究了VC和蔗糖的添加对儿茶素生物利用度的影响。研究表明添加了VC和蔗糖组的ECG 和EGCG 的生物利用率分别是单一儿茶素组的2.5 倍和3 倍,其机制主要与VC和蔗糖对肠道吸收的增强有关。Xi 等[48]的研究发现柠檬汁可以提高儿茶素的生物利用度,他们以高脂饲料喂养的猪作为动物模型,评价抗氧化和降血脂作用。发现柠檬酸的加入显著提高了血浆儿茶素水平,降低血浆中胆固醇和三酰甘油(TG)水平,有助于更好地发挥降血脂作用。姜黄素作为一种天然多酚物质,也具有抗氧化活性。汤琪[49]用卵磷脂改性高岭石作为乳化稳定剂,研究双重(W/O/W)乳液对姜黄素和儿茶素的协同包封作用,结果姜黄素和儿茶素的包封效率达到94%~98%,比姜黄素或儿茶素单独负载的乳液的包封效率提高约10%,有较好的协同抗氧化活性。
4 基于儿茶素与膳食多酚协同效应的相关应用
膳食多酚是指人体从膳食中获得的多酚类化合物,主要为果蔬多酚、谷物多酚、中药多酚等[50]。儿茶素作为茶多酚的一种,目前已有研究证实了儿茶素对人体健康的有益作用,儿茶素具有抗过敏、抗氧化、抗炎和抗菌活性,被广泛应用于治疗癌症、心血管疾病、高血脂症、糖尿病等领域[1]。由于儿茶素强的生物效应大都发生在接近毒性的剂量,因此研究者们通过调整膳食组成,使得儿茶素与其他膳食多酚组合发挥协同增效作用,开发了高效的组合疗法。儿茶素与膳食多酚协同增效的应用及其机制,结果见表2。
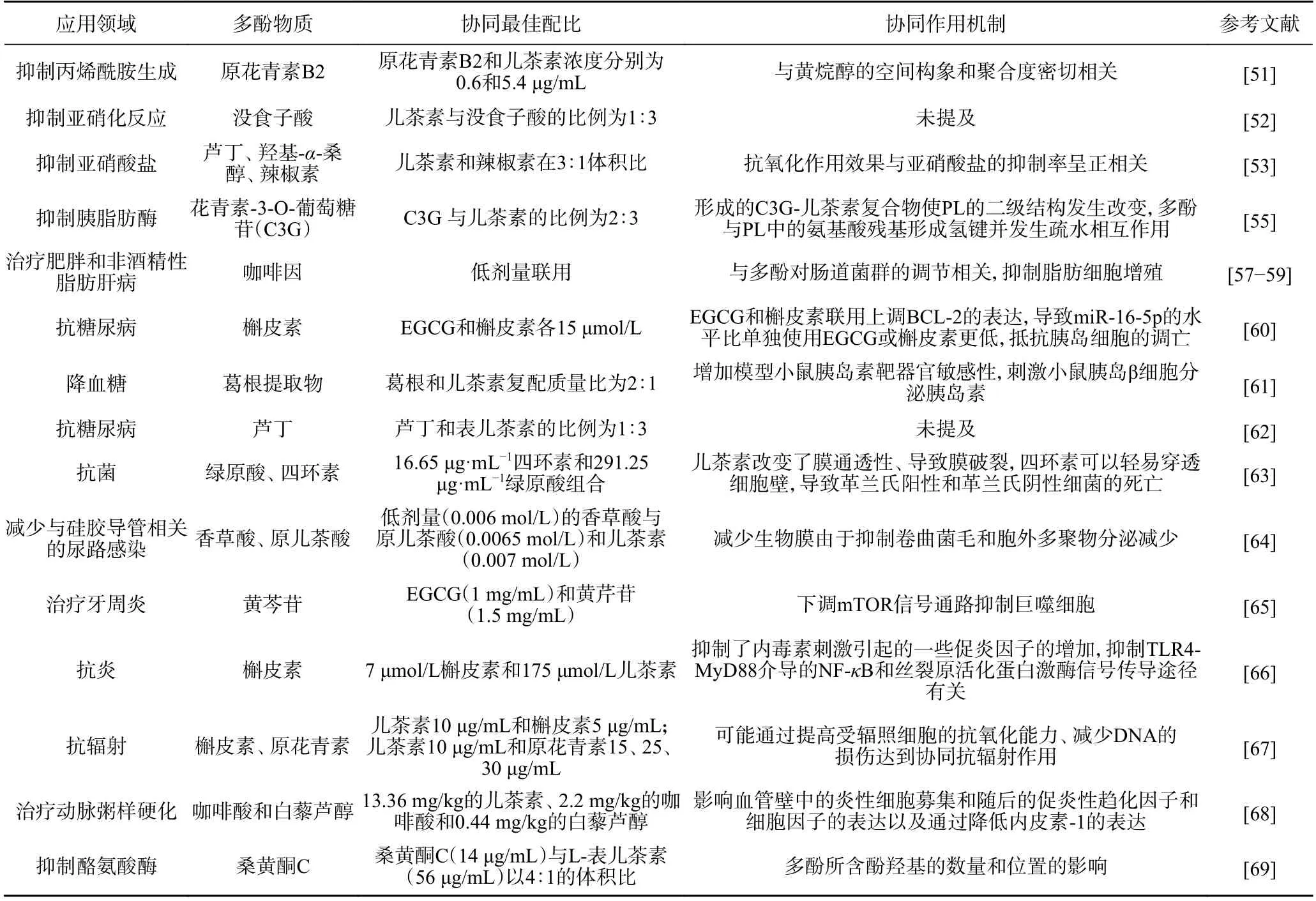
表2 儿茶素与膳食多酚协同增效的应用及其机制Table 2 Synergistic application and mechanisms of catechins and dietary polyphenols
4.1 抑制食品生产加工中的危害物
丙烯酰胺是一种致癌物质,主要存在于煎炸、焙烤等经过高温加工的食品中。Zhao 等[51]探究黄烷-3-醇类化合物在抑制丙烯酰胺生成方面的协同抑制作用,当原花青素B2 和儿茶素浓度分别为0.6 和5.4 μg/mL 时,协同抑制率为70.11%,抑制效果达到最佳,与单独添加相比大大减少用量,提高效率。亚硝酸盐是典型的肉制品腌制剂,具有发色、抗氧化和抑制肉毒梭状杆菌产生毒素的作用,但在肉制品加工过程中亚硝酸盐的使用不当可能会产生有害物质亚硝胺,危害人体健康。基于此,Ren 等[52]探讨了原花青素、儿茶素和没食子酸三种多酚类化合物在模拟胃液条件下对亚硝化反应的影响。结果显示原花青素、儿茶素和没食子酸对亚硝酸盐的清除率和亚硝胺合成的阻断率随着多酚含量和反应时间的增加而增加,三种多酚对亚硝化反应的抑制能力为儿茶素>原花青素>没食子酸。然后通过比较复配后的联合作用指数CI 和总IC50值,发现儿茶素和没食子酸组对亚硝化反应有最强的抑制作用和协同作用,且在儿茶素与没食子酸的比例为1:3 时,对亚硝酸盐的清除效果和对亚硝胺合成的阻断效果最好。Peng 等[53]同样发现花椒中所含的儿茶素、芦丁和羟基-α-桑醇会与辣椒素发生协同作用,增强抗氧化能力,提高亚硝酸盐清除率。
4.2 降脂减肥
喝茶有降脂减肥的功效,主要归因于茶叶中含有的茶多酚以及儿茶素氧化聚合产物如茶黄素、茶红素以及茶褐素等。越来越多的研究表明,儿茶素类化合物可以通过影响脂肪细胞、增加能量消耗、调节脂质代谢、改善肠道菌群等途径来达到降脂减肥的作用[54]。Wang 等[55]从黑米和红豆皮提取物中提取出花青素-3-O-葡萄糖苷(C3G)和儿茶素,将C3G 和儿茶素两者联用,降低了胰脂肪酶(PL)的IC50值,是有效的PL 抑制剂,通过分子对接模拟,发现其抑制机理是形成的C3G-儿茶素复合物使PL 的二级结构发生改变,这些多酚与PL 中的氨基酸残基形成氢键并发生疏水相互作用,在未来C3G-儿茶素复合物可被用于开发预防肥胖的食品补充剂。
将膳食多酚应用于治疗非酒精性脂肪肝病是目前新的研究方向,已有研究证实了儿茶素可降低患者的身体质量指数(BMI)、胰岛素抵抗指数(HOMAIR)、TG 水平,所试患者耐受性良好[56]。杨哲[57]发现低剂量EGCG 和咖啡因对肥胖和非酒精性脂肪性肝病的改善具有协同作用,他根据绿茶的摄入方式,分为绿茶茶汤(GTI)组、煎煮液(GTD)组、含咖啡因茶多酚(CGTP)组、脱咖啡因茶多酚(DCGTP)组、绿茶提取物(GTE)组五组,结果表明GTC 组和CGTP组的疗效优于其他组,CGTP 组摄入的剂量更低、更安全。其作用机制与多酚对肠道菌群的调节相关,具体包括增加粪便中乙酸、丙酸和总短链脂肪酸(SCFAs)的含量;降低大鼠G 蛋白偶联受体43(GPR 43)的表达;增加肠道中微生物胆汁盐水解酶基因拷贝,促进未结合胆汁酸(BA)的产生;增加肝胆汁酸受体TGR5 表达等[58]。另有研究发现咖啡碱和儿茶素组合能够抑制脂肪细胞增殖,其作用机制是通过调控3T3-L1 细胞分化过程中相关转录因子PPARγ2、C/EBPαmRNA 的表达降低FAS mRNA 的表达继而降低FAS 蛋白的表达水平最后导致细胞内TG 的沉积减少。咖啡碱、儿茶素与去甲肾上腺素的共同添加能够提高HSL 蛋白的表达量,降低脂肪细胞内脂质的沉积,具有潜在预防肥胖的功能[59]。
4.3 降血糖
膳食多酚可以预防和治疗糖尿病,其作用机制可以分为两类:一类是通过减慢糖类的消化吸收、保护胰岛β细胞的依赖胰岛素分泌的降糖途径;另一类是通过抑制葡萄糖和果糖吸收、调节消化酶活性的非依赖胰岛素降糖途径[50]。EGCG 和槲皮素通常共存于可食用植物中,两者组合能逆转链脲佐菌素(STZ)诱导的细胞损伤并促进胰岛素的分泌,其效果优于单一化合物。从Micro RNA 的角度深入探究EGCG 和槲皮素的协同作用,发现EGCG 和槲皮素联用上调BCL-2 的表达,导致miR-16-5p 的水平比单独使用EGCG 或槲皮素更低,抵抗胰岛细胞的调亡,结果表明EGCG 和槲皮素具有协同抗糖尿病作用[60]。袁传勋等[61]探究了葛根提取物和茶多酚的协同辅助降血糖活性实验,葛根提取物和茶多酚两者单独抑制α-葡萄糖苷酶时,半抑制浓度分别为1.000 与0.1159 μg/mL,在最佳的复配质量比为2:1 条件下,两者的半抑制浓度分别降至0.1331 与0.06655 μg/mL,具有良好的协同效果,然后用Ⅱ型糖尿病小鼠模型进一步验证了体内降血糖效果。Mechchate 等[62]研发了一种儿茶素、表儿茶素和芦丁三者混合的新型抗糖尿病制剂,通过口服耐糖测试,当芦丁和表儿茶素的比例为1:3 时,降糖效果最佳。
4.4 抗炎抗菌
现阶段致病微生物的抗生素耐药性问题引发研究者们关注。Alqahtani 等[63]利用柱色谱法分离丙酮提取物,鉴定出10 种酚类活性成分。其中儿茶素和绿原酸作为最主要的化合物与四环素发生协同相互作用,显著增强对蜡样芽孢杆菌,金黄色葡萄球菌,绿脓桿菌,大肠桿菌,肺炎克雷伯菌和伤寒沙门氏菌等菌的抗菌作用,改善微生物的耐药性。Bernal-Mercado 等[64]将儿茶素、原儿茶素和香草酸联合作用替代抗生素,抑制泌尿致病性大肠杆菌(UPEC)粘附在硅胶导管表面,有效减少与硅胶导管相关的尿路感染。
除了抗菌作用,多酚的协同增效在抗炎方面也有大量应用。周毅等[65]探究了EGCG 和黄芩苷对小鼠牙周炎的作用效果及其机制,通过下调mTOR信号通路抑制巨噬细胞,协同作用效果优于单一EGCG。Li 等[66]通过脂多糖(LPS)刺激巨噬细胞RAW 264.7 细胞来研究槲皮素和儿茶素的协同抗炎作用。结果显示,槲皮素和儿茶素的联合治疗抑制了内毒素刺激引起的一些促炎因子的增加,包括一氧化氮、肿瘤坏死因子-α、白细胞介素-1β、一氧化氮合酶和环氧合酶-2 等。此外,通过抑制NF-kappa B p65 和p50 的磷酸化以及ETS 结构域蛋白和c-Jun 氨基末端激酶的磷酸化,其对核因子-κB 的抑制作用显著强于单独使用槲皮素或儿茶素。这些结果表明槲皮素和儿茶素具有协同的抗炎作用,这可能与它们在抑制TLR4-MyD88 介导的NF-κB 和丝裂原活化蛋白激酶信号传导途径有关。
4.5 其他
除上述列举的功效之外,儿茶素与膳食多酚的协同增效作用还被应用于抗辐射、缓解动脉粥样硬化疾病、抗衰老等领域。吴涛等[67]建立体外AHH-1 淋巴细胞辐射损伤模型,发现儿茶素、槲皮素和葡萄籽原花青素之间存在协同抗辐射作用。多酚类物质的摄入可以缓解冠状动脉疾病,Norata 等[68]的研究表明儿茶素、咖啡酸和白藜芦醇的混合物可以通过影响血管壁中炎症细胞的募集和促炎性趋化因子的表达对小鼠动脉粥样硬化和血管壁基因表达模式产生影响,显著减少小鼠的动脉粥样硬化。酪氨酸酶是调节黑色素合成途径中的关键限速酶,其参与了各种生理代谢过程和疾病,如衰老、恶性癌症以及神经变性等。多酚所含酚羟基的数量和位置是影响酪氨酸酶抑制活性的关键,当桑黄酮C(14 μg/mL)与L-表儿茶素(56 μg/mL)以4:1 的体积比混合时,酪氨酸酶抑制率达到最高[69]。
5 总结与展望
儿茶素的生物利用率低是导致体外和体内研究不一致的主要因素,胃肠道中的极端pH 条件以及相关消化酶和肠道菌群的作用是导致儿茶素不稳定、发生降解聚合的因素。研究证实调整膳食组成、各类食物的配比是提高儿茶素生物利用率的一种有效途径。此外,研究表明儿茶素与多酚类物质可以发挥协同增效作用,比单一多酚的添加用量低、治疗效果更好。
尽管儿茶素的相关研究已有大量成果发表,但当前研究也存在以下不足之处。首先,多数研究仅考虑了单一的膳食成分对儿茶素生物利用率的影响,未能考虑在多种膳食因子的作用下会发生的变化,对此还需要进一步研究。另外大部分研究仅停留在体外胃肠道消化实验和正常动物模型中,对于其在临床和不同疾病模型的应用要继续开展研究。除此之外,各类多酚间最大协同下的浓度配比还有待研究,不同多酚之间的相互作用机制也有待明确。儿茶素不但可以制成药物用于临床治疗,也可以添加到食品原料中,提高食品的营养价值和保质期,但也要考虑儿茶素本身的涩味带来的不良感官品质与风味的影响。

