大鼠肠囊外翻法分析核桃肽吸收特性及抗氧化肽筛选鉴定
李浩铭,李维佳,李 佳,方 丽,宋佳淇,吴 丹,闵伟红
(吉林农业大学食品科学与工程学院,吉林长春 130118)
生物活性肽是由2~20 个不同氨基酸组成、具有组织亲和力高、安全性好且在细胞内发挥较强生理活性的一类物质[1]。按照来源划分,生物活性肽可分为内源肽和外源肽。内源肽常以酶、激素等形式在机体中发挥生理作用[2],但食物中摄取的外源肽不同于内源肽,其需要借助人体消化系统进入体内才能发挥活性功能[3]。外源肽的利用必须克服胃肠消化酶的分解和穿透小肠上皮细胞形成的肠道屏障[4],许多长肽在胃的酸性条件下已被分解成短肽,无法完整进入小肠,而一些短肽已有研究证实其能耐受胃酸的条件,但小肠吸收率低,生物利用度低[5]。有研究证实小肠壁表面含有许多刷状缘肽酶,多肽必须成功抵抗刷状缘肽酶水解才能被完整吸收,二肽基肽酶(DPPIV)是在肠道中密集分布且活性最高的刷状缘肽酶[6-7],其是一种可裂解多肽N末端二肽的丝氨酸蛋白酶,当多肽残基末端倒数第二氨基酸是脯氨酸、羟基脯氨酸、脱氢脯氨酸或丙氨酸时,DPP-IV 与之结合能力较强[8]。Suzuki 等[9]研究发现,涉及甘氨酸、脯氨酸和羟脯氨酸的肽键不易被大多数胃和胰腺蛋白酶水解。因此,含有脯氨酸、羟基脯氨酸、脱氢脯氨酸或丙氨酸的多肽可通过与DPP-IV 结合而抵抗肠消化酶水解作用,从而以完整形式吸收。
氧化应激是指机体受到不同应激原刺激或病原菌感染时,产生大量自由基,特别是活性氧(reactive oxygen species,ROS)通过氧化还原机制对机体产生的氧化损伤[10]。氧化应激已被证明是许多常见疾病的发病诱因之一,如高血压[11]、慢性阻塞性肺病[12]等。因此,抗氧化剂的挖掘利用对人类健康至关重要。又因天然成分安全性更高,而使天然抗氧化剂的筛选成为抗氧化成分挖掘的新方向。核桃蛋白通过酶解纯化并筛选鉴定后得到特定核桃肽序列[13],已有研究证实了某些特定核桃肽具有抗氧化[14]、改善记忆力[15]等生理功能。王薇等[16]通过酶水解法制备核桃蛋白水解物,并通过ORAC 法和H2O2诱导的PC12细胞筛选出3 条抗氧化肽QGRPWG、PSRADIY 和AYNIPVNIAR。然而,活性肽完整高效吸收是其发挥活性功能的前提,近几年活性肽的生理功能被不断拓展,但关于活性肽吸收与生理活性的关系及活性肽氨基酸组成与吸收的关系相关研究鲜有报道,探索活性肽的吸收特性及肽吸收与功能活性的关系成为众多学者关注的热点。目前,因体内动物消化吸收模型具有周期长、消耗大等特点,构建体外模拟消化吸收模型已成为研究者关于研究生物活性分子吸收问题的新方法[17-18],已有许多学者通过建立体外大鼠外翻肠囊模型进行了营养组分评价[19],如矿物质[20]、脂肪酸[21]、糖醇[22-23]和黄酮物质[24]的吸收特性及生物利用度已有明确报道。丁龙[25]利用Caco-2 细胞单层膜和外翻大鼠肠囊模型研究了蛋清蛋白模拟消化水解物混合肽的吸收情况。
因此,本研究通过大鼠肠囊外翻法和抗氧化活性测定研究了核桃肽消化产物的抗氧化活性和其吸收特性明确活性肽在肠道吸收的最优条件,继而利用Nano-HPLC-MS/MS 和分子对接技术筛选鉴定出与DPP-IV 稳定结合且能完整高效吸收的抗氧化活性肽,为核桃源高效吸收抗氧化肽开发利用奠定了理论基础。
1 材料与方法
1.1 材料与仪器
核桃蛋白肽混合物 由脱脂核桃粕酶解超滤制得,分子量<3 kDa(纯度≥85%,氨基酸≥15%),由吉林农业大学发酵工程实验室自制[26];健康雄性Sprague Dawley(SD)大鼠 33 只 体质量200~220 g,辽宁长生生物技术股份有限公司(生产许可证号:NO.SCXK(辽)2020-0001);5% w/v 水合氯醛 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联 氮-二(3-乙 基-苯并噻唑-6-磺酸)二铵盐(ABTS)、乙二胺四乙酸(EDTA)、谷胱甘肽(GSH)美国Sigma 有限公司;其他试剂均为国产分析纯。
Fluoroskan Ascent FL 荧光酶标仪、串联EASYnanoLC1200 的Orbitrap Fusion 质谱仪 美国赛默飞世尔科技有限公司;UNIC-7200 紫外分光光度计成都泰盟科技有限公司;Allegra X-22 型台式高速离心机 北京东讯天地医疗仪器有限公司。
1.2 实验方法
1.2.1 不同分子量核桃肽抗氧化性的测定
1.2.1.1 DPPH 自由基清除能力的测定 参照Yang等[27]的方法,向试管中加入2 mL 核桃肽溶液和2 mL 60 µmol/L 的DPPH 溶液(乙醇溶解),混合均匀后避光放置30 min,在517 nm 波长下测吸光值。取同浓度的GSH 作为阳性对照。清除率计算公式如下:
式中:A0为用蒸馏水代替核桃肽溶液的空白吸光值;A1为核桃肽溶液吸光值;A2为不加DPPH 溶液的对照吸光值。
1.2.1.2 ABTS+自由基清除能力的测定 参照Song等[28]的方法,制备ABTS+自由基储备液:7 mmol/L的ABTS 水溶液和2.49 mmol/L 的过硫酸钾水溶液等体积混合,避光放置12~16 h,4 ℃保存。配制ABTS+自由基工作液:加入5 mmol/L 的PBS 稀释,使溶液在734 nm 波长下吸光度为0.700±0.002。测定时,向96 孔板每孔加入10 µL 核桃肽溶液和190 µL ABTS+自由基工作液,6 min 后于734 nm 波长下测定吸光值。取同浓度的GSH 作为阳性对照。清除率计算公式如下:
式中:A0为用蒸馏水代替核桃肽溶液的空白吸光值;A1为核桃肽溶液吸光值;A2为不加ABTS 溶液的对照吸光值。
1.2.1.3 Fe2+螯合能力的测定 参照Zhang 等[29]的方法,在试管中依次加入0.5 mL 核桃肽溶液,1 mL 20 µmol/L 的FeCl2溶液和1 mL 0.5 mmol/L 菲洛嗪,混匀后25 ℃,水浴20 min 后,于562 nm 波长下测吸光值。取同浓度的EDTA 作为阳性对照。Fe2+螯合率的计算公式如下:
式中:A0为用蒸馏水代替核桃肽溶液的空白吸光值;A1为核桃肽溶液吸光值;A2为不加菲洛嗪的对照吸光值。
1.2.2 构建大鼠离体肠囊外翻模型 本实验严格按照吉林农业大学实验动物中心(实验动物使用许可证:SYXK(吉)2018-0023)的建议进行(伦理审查受理号:20210311002)。参考Wei 等[30]的方法并进行部分修改。将购买的33 只大鼠随机分成1 个空白组,5 个浓度组(2、4、6、8、10 mg/mL),保持2 h 的孵育时间;5 个时间组(1、1.5、2、2.5、3 h),保持6 mg/mL的黏膜侧肽浓度,每组3 只平行实验,适应性饲养1 周,禁食15 h 后开始实验。抓取大鼠待其状态平稳后腹腔注射4%水合氯醛(剂量:10 µL/g,以大鼠体重计算)麻醉,随后通过腹部切口快速取出大鼠小肠(十二指肠、空肠、回肠)并采用断头法处死大鼠,将小肠用预冷生理盐水清洗去除肠内容物后在4 ℃,通入95% O2的缓冲液中将肠囊外翻,浆膜侧加入1 mL KRB-IPA 缓冲液(pH7.4),肠囊两端扎紧,黏膜侧放入不同浓度分子量<3 kDa 核桃肽肠消化产物中,37 ℃恒温水浴处理相应时间后取出肠囊,收集肠囊浆膜侧溶液。空白组采用等量KRBIPA 缓冲液(pH7.4)替代分子量<3 kDa 核桃肽肠消化产物溶液。
1.2.3 肽吸收率测定 利用紫外可见光光度计在270 nm 处测定大鼠离体肠囊外翻法收集的黏膜侧和浆膜侧样品肽浓度,并计算肽吸收率,计算公式如下:
式中:A1为浆膜侧肽含量;A2为黏膜侧肽含量。
1.2.4 核桃肽体外消化产物抗氧化能力测定 分别选取小肠的不同部位(十二指肠、空肠、回肠)、肽浓度(2、4、6、8、10 mg/mL)和转运时间(1、1.5、2、2.5、3 h)作为3 个变量,测定核桃肽浆膜侧肽溶液抗氧化活性(考察核桃肽浓度对浆膜侧肽溶液抗氧化活性的影响时,以肽浓度为变量,控制转运时间为2 h;考察转运时间对浆膜侧肽溶液抗氧化活性的影响时,以转运时间为变量,控制核桃肽浓度为6 mg/mL)。
1.2.5 Nano-HPLC-MS/MS 分析 收集大鼠肠囊浆膜侧溶液,对其冷冻干燥制成粉末,并采用C18除盐柱进行除盐后,采用Acclaim PepMap C18(75 μm×25 cm)分析柱;进样量8 µL;流量300 nL/min,流动相A 相:0.1%甲酸水溶液;B 相:含0.1%甲酸的乙腈溶液,柱温40 ℃,电喷雾电压2 kV。质谱参数设置如下:MS 扫描范围100~1500 m/z,分辨率=70000,AGC target=3e6,最大注入时间 50 ms;HCD-MS/MS(top 20):分辨率=17500,隔离窗口=2 m/z,AGC target=1e5,最大注入时间45 ms,碰撞能量为28 ev,动态排除时间=30 s。
根据Nano-HPLC-MS/MS 鉴定得到的de novo表对肽浓度6 mg/mL 吸收2 h 十二指肠部分大鼠肠囊浆膜侧活性肽序列信息进行整理总结,分析可被吸收的肽结构特征。
1.2.6 分子对接 通过Discovery Studio 2017 R2(Biovia,San Diego,CA,USA)模拟大鼠外翻肠囊浆膜侧Nano-HPLC-MS/MS 鉴定后且具有抗氧化特征氨基酸的肽序列与DPP-IV 的相互作用,并使用CHARMm 力场使其能量最小化。DPP-IV 的晶体结构来源于PDB 数据库(5T4B),可在https://www.rcsb.org 获得。根据结合能得分,评估活性肽与DPPIV 结合的稳定性。
1.2.7 合成肽制备及抗氧化活性测定 委托合肥赛曼诺生物科技有限公司完成,采用固相合成技术对肽NLRFPL(Asn-Leu-Arg-Phe-Pro-Leu,纯 度98.65%)、KGHLFPN(Lys-Gly-His-Leu-Phe-Pro-Asn,纯度98.07%)和NPDDEFRPQ(Asn-Pro-Asp-Asp-Glu-Phe-Arg-Pro-Gln,纯度98.04%)进行分别合成。
具体方法同1.2.1,分别配制0.2 mg/mL 合成肽溶液,以DPPH 自由基清除能力、ABTS+自由基清除能力、Fe2+螯合能力为指标,比较NLRFPL、KGHLFPN、NPDDEFRPQ 的抗氧化能力。
1.3 数据处理
每个实验至少平行重复三次,实验数据以平均值±标准差表示。采用单因素方差分析和Duncancs多重检验分析数据差异性,P<0.05 表示有差异性,具有统计学意义。数据处理采用SPSS 20.0 软件分析,图形采用Origin 9.0 软件绘制。
2 结果与分析
2.1 不同分子量核桃肽抗氧化能力测定
采用DPPH、ABTS、FRAP 法测定了经脱脂核桃粕酶解超滤得到的不同分子量核桃肽(1 mg/mL)的抗氧化活性。如图1A 所示,经过酶解超滤后分子量<3 kDa 核桃肽的DPPH 自由基清除率(93.58%±0.85%)显著高于3~10 kDa 核桃肽(87.01%±0.92%)和>10 kDa 核桃肽(84.04%±1.03%)(P<0.05),并与1 mg/mL 谷胱甘肽GSH(95.21%±0.75%)无显著差异(P>0.05)。ABTS 在氧化剂作用下会氧化成绿色的ABTS+自由基,有自由基清除剂存在时,ABTS+产生被抑制,通过测定吸光度即可得出样品清除ABTS+自由基的能力;如图1B 所示,ABTS+自由基清除率结果与DPPH 相似,<3 kDa 核桃肽(82.35%±0.74%)显著高于3~10 kDa 核桃肽(74.21%±0.72%)和>10 kDa核桃肽(70.31%±1.03%)(P<0.05)。FRAP 测定结果如图1C 所示,Fe2+的存在会加速脂质氧化的过程,通过测定物质对Fe2+螯合能力可以评估样品的抗氧化能力。经过酶解超滤后分子量<3 kDa 核桃肽的Fe2+螯合能力(93.46%±1.07%)显著高于3~10 kDa 核桃肽(82.46%±1.15%)和>10 kDa 的核桃肽(85.05%±0.63%),并与1 mg/mL EDTA(94.30%±0.87%)无显著差异(P>0.05)。以上结果表明经过酶解后,分子量较小的肽组分被释放,分子量低的肽穿过肠道屏障能力更强,更利于发挥其活性,且小分子肽容易与脂质自由基反应,减少了自由基介导的脂质过氧化作用,从而具有更好的抗氧化活性。关海宁等[31]通过测定大豆分离蛋白水解肽DPPH 自由基清除能力和ABTS+自由基清除能力发现分子量与其抗氧化能力呈显著负相关。Liu 等[32]已证明低分子量肽组分比高分子量肽组分具有更高的抗氧化能力。因此,本文选择分子量<3 kDa 核桃肽进行后续试验。

图1 不同分子量核桃蛋白肽的抗氧化能力Fig.1 Antioxidant capacity of walnut protein peptides with different molecular weights
2.2 核桃肽体外消化产物抗氧化能力测定
2.2.1 核桃肽浓度对浆膜侧肽溶液抗氧化活性的影响 分别采用DPPH、ABTS、FRAP 法测定了经大鼠肠囊外翻实验后黏膜侧不同初始浓度的肽溶液对吸收后肠囊浆膜侧肽抗氧化活性的影响,结果如图2所示。由图2A 可知,经过相同的转运时间,浆膜侧肽DPPH 自由基清除率随黏膜侧肽浓度的增加而增加而后趋于稳定,在黏膜侧肽浓度为6 mg/mL 时,DPPH 清除率在十二指肠(78.99%±1.76%)达到最高;图2B 可得到相似结果,当转运时间相同时,浆膜侧肽ABTS+自由基清除率也随黏膜侧肽浓度的增加而提高,同样在浓度为6 mg/mL 时,十二指肠浆膜侧肽ABTS+自由基清除率为最高(60.04%±1.22%),而后ABTS+自由基清除率无显著变化(P>0.05)。图2C的FRAP 测定结果也验证了图2A、图2B 的结果,在黏膜侧肽浓度增加到6 mg/mL 时,Fe2+螯合率达到峰值,分别为十二指肠(84.67%±1.65%)、空肠(82.67%±1.37%)、回肠(79.36%±1.67%)。综上,核桃肽模拟肠消化产物初始浓度为6 mg/mL 时,经肠囊外翻实验后浆膜侧肽的抗氧化能力最强。6 mg/mL是核桃肽模拟肠消化产物小肠吸收发挥抗氧化活性的最佳浓度,而过量的肽可能受到肠道屏障的限制无法完成转运过程或被外排作用排出。然而,促进肽在肠道的吸收是提高其生物利用度的关键,抗氧化能力测定结果显示了十二指肠浆膜侧肽抗氧化能力均略高于空肠和回肠,但无显著差异。
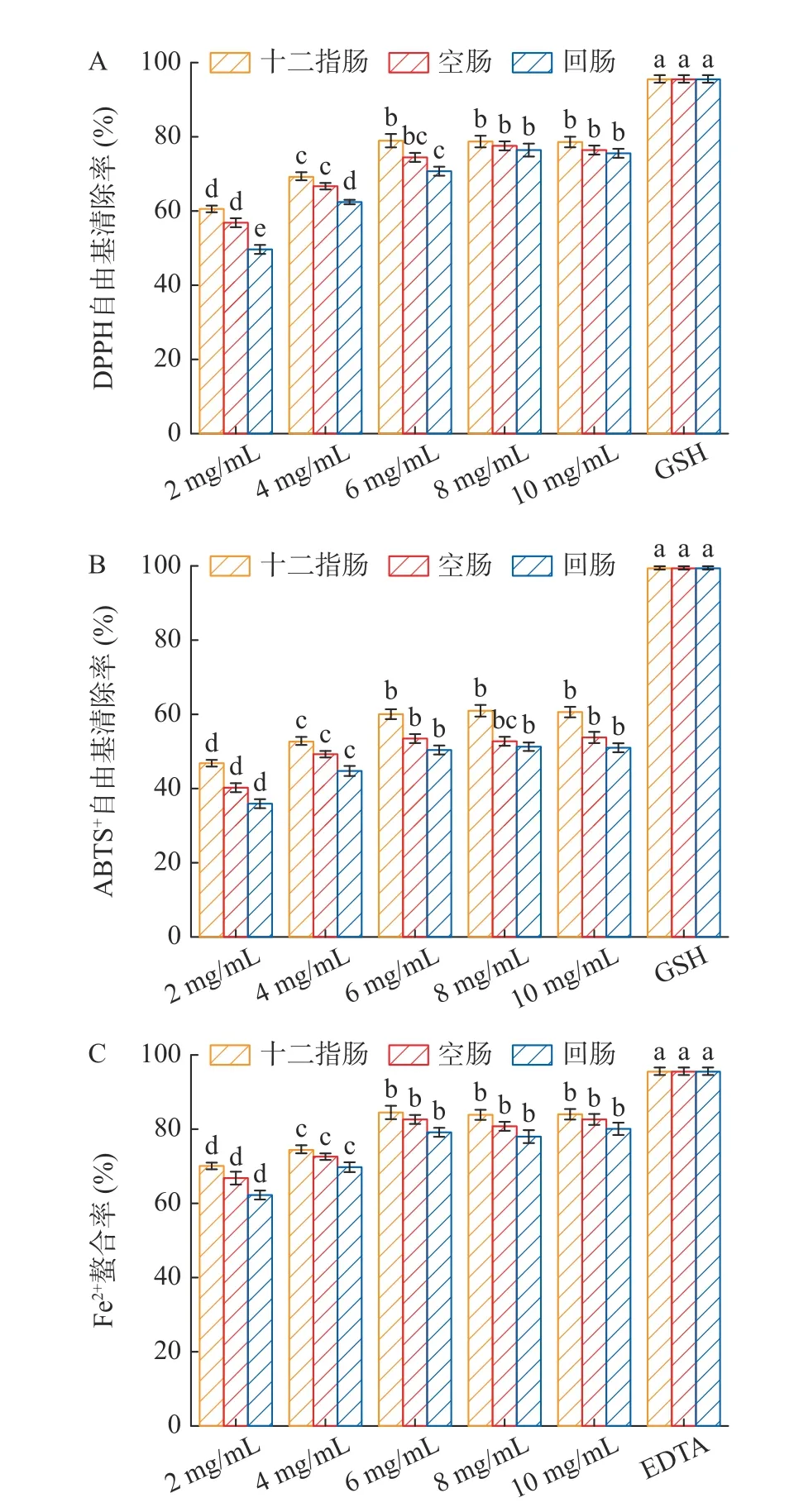
图2 大鼠外翻肠囊黏膜侧肽浓度对浆膜侧肽溶液抗氧化活性的影响Fig.2 Effect of the concentration of the peptide of the everted rat sacs mucosal side on the antioxidant activity of the serosal side peptide solution
2.2.2 不同转运时间对浆膜侧肽溶液抗氧化活性的影响 如图3A 所示,保持相同的黏膜侧肽浓度,大鼠外翻肠囊浆膜侧肽溶液的DPPH 自由基清除率随转运时间的增加而提高后趋于稳定,在转运2 h 时达到最大值,分别为十二指肠(78.21%±1.25%)、空肠(73.26%±0.68%)、回肠(70.57%±1.16%)。由图3B也可知,ABTS+自由基清除率随转运时间的延长而增加,同样在2 h 时达到最大值,分别为十二指肠(63.65%±1.49%)、空肠(55.76%±1.10%)、回肠(50.64%±1.16%)。图3C 也可得到相似结果,在转运时间2 h 时,Fe2+螯合率为最高值,而后无显著差异(P>0.05)。因此,2 h 为核桃肽模拟肠消化产物发挥抗氧化活性的最优时间。

图3 不同转运时间对大鼠外翻肠囊浆膜侧肽溶液抗氧化活性的影响Fig.3 Effect of different transport time on the antioxidant activity of serosal side peptide solution of everted rat sacs
综合图2 和图3 结果表明,6 mg/mL 是核桃肽体外模拟肠消化产物发挥抗氧化活性的最佳浓度,2 h 是其小肠吸收后发挥活性的最优时间。
2.3 核桃肽在大鼠外翻肠囊中的吸收情况
如图4 所示,以大鼠外翻肠囊浆膜侧肽浓度为检测指标,保持相同的转运时间,肠囊黏膜侧肽浓度为6 mg/mL 时十二指肠部分肽吸收率(49.63%±3.08%)显著高于空肠(17.30%±2.57%)和回肠(12.61%±2.06%)部分(P<0.05),同时肠囊黏膜侧6 mg/mL 肽浓度小肠的吸收率达到最高值而后趋于稳定,表明6 mg/mL 是核桃肽小肠吸收的初始饱和浓度。如图5 所示,以核桃肽模拟肠消化产物不同转运时间为单因素变量,对大鼠外翻肠囊浆膜侧肽浓度进行测定,转运时间2 h 时,十二指肠肽吸收率(51.50%±2.93%)显著高于空肠肽吸收率(21.72%±3.48%)和回肠肽吸收率(13.29%±2.15%)(P<0.05),且转运时间2 h 时小肠肽吸收率达到最大值而后趋于稳定,表明2 h 是核桃肽小肠吸收的最优时间。

图4 大鼠外翻肠囊不同黏膜侧肽浓度的肽吸收率Fig.4 Peptide absorption rate of different mucosal side peptide concentrations in everted rat sacs
综上,6 mg/mL 是核桃肽小肠吸收的初始饱和浓度,2 h 是核桃肽小肠吸收的最大时间。小肠转运是动态平衡的过程,物质在小肠吸收时也伴随少量的外排作用,大鼠外翻肠囊浆膜侧和黏膜侧随肽浓度的增加,时间的延长,肠囊逐渐趋于饱和状态,达到小肠吸收转运的最大量。
2.4 大鼠外翻肠囊浆膜侧肽组分 Nano-HPLC-MS/MS 鉴定
2.4.1 大鼠外翻肠囊浆膜侧肽组分分子量分布 对肽浓度6 mg/mL 吸收2 h 十二指肠部分大鼠肠囊浆膜侧活性肽Nano-HPLC-MS/MS 鉴定结果的de novo表活性肽分子量进行整理总结,由图6 可知,大鼠外翻肠囊浆膜侧分子量>2 kDa 的肽序列102 条,分子量1~2 kDa 的肽序列6607 条,分子量0.5~1 kDa 的肽序列16543 条,<0.5 kDa 的肽序列2590 条,大鼠肠囊浆膜侧核桃肽序列平均分子量792 Da,分子量584 Da 的肽序列居多,表明核桃肽在穿过大鼠小肠时发生分解,大分子长肽与消化酶结合位点多于小分子肽,因此大分子肽更易被分解为小分子短肽,更有利于小肠吸收而发挥其活性。

图6 大鼠外翻肠囊浆膜侧不同分子量肽序列数量分布Fig.6 Number distribution of peptide sequences with different molecular weights on serosal side of everted rat sacs
对肽浓度6 mg/mL 吸收2 h 十二指肠部分大鼠肠囊浆膜侧活性肽Nano-HPLC-MS/MS 鉴定结果的de novo 表活性肽末端氨基酸组成进行整理总结,由表1 可知,暴露于C 端/N 端的Pro、Thr、Leu 数量明显高于其他氨基酸,表明肽经过消化吸收过程,与疏水性氨基酸相连的肽键更容易断裂,疏水性氨基酸含量增加可能是其抗氧化能力提高的原因,姜颖俊等[33]研究了绿豆抗氧化肽的制备,也证明了绿豆肽的抗氧化活性与其氨基酸组成及疏水性结构密切相关。Chen 等[34]研究发现,His、Cys、Pro、Tyr、Lys和Arg 等是抗氧化肽中常见的氨基酸组成。因此,活性肽抗氧化能力与疏水性氨基酸组成密切相关。

表1 大鼠外翻肠囊浆膜侧肽序列末端氨基酸组成Table 1 Amino acid composition at the end of serosal side peptide sequence of everted rat sacs
对肽浓度6 mg/mL 吸收2 h 十二指肠部分大鼠肠囊浆膜侧活性肽Nano-HPLC-MS/MS 鉴定结果的de novo 表活性肽氨基酸组成进行整理总结。表2表明与肠囊黏膜侧肽序列对比后,在肠囊浆膜侧鉴定出的33 条可被小肠完整吸收的核桃源新型肽的Nano-HPLC-MS/MS 鉴定结果,肽链长度方面,共对比筛选出五肽20 条,四肽7 条,六肽3 条,七肽、九肽、十肽各1 条;氨基酸组成方面,疏水性氨基酸显著多于亲水性氨基酸,表明含有疏水性氨基酸短肽可能更有利于肽在小肠完整形式吸收。
综上,活性肽的分子量随着消化吸收的进行而降低,疏水性氨基酸等不断暴露。Beau 等[35]证明了低分子量(<1 kDa)肽具有高抗氧化活性,这可能是因为低分子量肽更有利于人体肠道吸收。同时氨基酸组成也是影响肽抗氧化活性的关键因素。Chi 等[36]报道了疏水性氨基酸含量高的肽可以通过与细胞膜的疏水性相互作用顺利进入靶器官,其丰富的电子可以用于淬灭自由基。因此,低分子量且疏水性氨基酸含量高的短肽可能具有较高的抗氧化活性。
2.5 分子对接探究核桃肽与DPP-IV 相互作用及抗氧化肽筛选鉴定
2.5.1 核桃肽与DPP-IV 相互作用 有研究证实肽链中疏水性氨基酸对其抗氧化活性贡献最大,且P、L、N、H 是抗氧化肽的特征性氨基酸,C 端第三个氨基酸为W、Y、F、M、L、I 的肽链结构也有助于增强多肽抗氧化活性[37]。因此,对肽浓度6 mg/mL 吸收2 h 十二指肠部分大鼠肠囊浆膜侧活性肽进行Nano-HPLC-MS/MS 鉴定得到表2 中33 条小肠可完整形式吸收的核桃源新型肽,从中选取29 条具有特征性氨基酸的肽序列,与DPP-IV 进行分子对接得到表3结果。如表3 所示,3 条含有脯氨酸的肽NLRFPL、KGHLFPN 和NPDDEFRPQ 与DPP-IV 的结合能最低分别为-8.8、-8.6 和-8.6 kcal/mol,因此,NLRFPL、KGHLFPN 和NPDDEFRPQ 是能够与DPP-IV 位点结合的最稳定肽序列。陈静等[38]研究发现,乳源肽中含有脯氨酸的肽LPLP 和QEPV 是通过与DPP-IV活性部位结合发挥其活性作用,并推断含脯氨酸多肽的构型与DPP-IV 活性位点结合相关。因此,NLRFPL、KGHLFPN 和NPDDEFRPQ 具有脯氨酸(P)、特征疏水性氨基酸(L、N、H),推测其抗氧化活性可能高于其他肽序列。
2.5.2 活性肽抗氧化能力测定 选取0.2 mg/mL 的肽浓度,分别对3 种DPP-IV 结合稳定的肽进行了抗氧化能力测定。由图7A 可知,以GSH 为阳性对照,3 种肽的DPPH 自由基清除率分别为KGHLFPN(66.32%±1.03%)、NLRFPL(60.21%±1.96%)、NPDDEFRPQ(43.25%±2.43%),KGHLFPN 的DPPH 自由基清除能力显著高于NPDDEFRPQ 和NLRFPL(P<0.05)。由图6B 可知,3 种肽的ABTS+自由基清除率分别为KGHLFPN(52.32%±2.03%)、NLRFPL(50.21%±1.99%)、NPDDEFRPQ(32.25%±2.43%),KGHLFPN 的ABTS+自由基清除能力显著高于NPDDEFRPQ(P<0.05),略高于NLRFPL 但无显著差异(P>0.05)。由图6C 可知,以EDTA 为阳性对照,3 种肽的Fe2+螯合率分别为KGHLFPN(70.32%±1.53%)、NLRFPL(65.21%±2.98%)、NPDDEFRPQ(50.25%±3.03%),KGHLFPN 的Fe2+螯合能力显著高于NPDDEFRPQ(P<0.05),略高于NLRFPL 但无显著差异(P>0.05)。因此,KGHLFPN 是抗氧化活性最佳的肽序列。

图7 DPP-IV 结合肽抗氧化能力测定Fig.7 Determination of antioxidant capacity of DPP-IV binding peptide
3 结论
本实验通过大鼠外翻肠囊法和抗氧化能力测定(DPPH 自由基清除率、ABTS+自由基清除率、Fe2+螯合率),利用Nano-HPLC-MS/MS 和模拟分子对接技术,筛选出核桃肽的小肠吸收最优条件为核桃肽消化产物浓度6 mg/mL,吸收时间为2 h,并筛选出与DPP-IV 结合稳定且抗氧化能力最佳的核桃源肽KGHLFPN,为促进功能因子在小肠吸收进入血液循环作用于其靶点器官发挥生理活性奠定理论基础,为开发小肠高效吸收的核桃源抗氧化肽提供理论参考。然而,本研究并未继续探索核桃肽KGHLFPN的吸收机制,因此核桃肽KGHLFPN 吸收途径及吸收通路还有待进一步研究,同时对核桃肽KGHLFPN的体内生理活性功能有待进一步探索。

