姜黄素对慢性高眼压大鼠视网膜神经节细胞凋亡的影响及机制
许莞菁,孙雨浩,赵 爽,赵 军,张娟美
0 引言
青光眼是能够损伤视神经并造成特征性视野缺损的一组慢性、进行性、不可逆性的眼病,是不可逆失明的主要原因,其在全球范围内对视力丧失的影响仅次于白内障[1]。青光眼眼前节病变因类型的不同而有所区别,而青光眼眼后节病变多表现为视神经头的典型凹陷性萎缩和视网膜神经节细胞(retinal ganglion ceils,RGCs)的慢性进行性丢失[2]。研究表明,青光眼的易感性随着年龄的增长而增加,分析可能是由于持续的氧化应激损害及抗氧化防御机制的生理性减弱所致[3]。在氧化应激或其它因素刺激下,机体会上调一系列抗氧化防御酶如谷氨酰半胱氨酸连接酶调节亚基(glutamate-cysteine ligase modifier subunit,GCLM)和血红素加氧酶-1(heme oxygenase-1,HO-1)的表达,这些酶及下游产物可在类似青光眼的损害中发挥细胞保护作用[4-6]。既往研究发现,从传统草药姜黄根茎中提取的天然多酚类化合物姜黄素具有抗炎、抗氧化、抗增殖、抗血管生成等多种药用价值[7]。本研究参考青光眼的氧化应激学说,研究姜黄素的抗氧化生物活性在青光眼动物模型中对RGCs和视网膜的作用及机制,以期为青光眼的治疗提供新的思路和方法。
1 材料和方法
1.1材料
1.1.1实验动物无特殊病原体级(specific pathogen free,SPF)雄性Spraque-Dawley(SD)大鼠21只,6~8周龄,体质量220~240g,裂隙灯及眼底镜检查无眼部疾病,由湖北省实验动物研究中心提供[许可证号:SCXK(鄂)2020-0018]。所有动物实验程序均按照国家科学技术委员会颁布的《实验动物管理条例》和青岛大学关于动物道德使用的指导方针进行。所有大鼠均在温度和湿度受控的房间饲养,保持12h光照/黑暗循环。
1.1.2主要试剂与仪器姜黄素(Sigma)、0.5%丙美卡因滴眼液(ALCAINE)、左氧氟沙星眼膏(远大健康)、细胞凋亡检测试剂盒(Elabscience)、GCLM抗体(Affinity)、HO-1抗体(Affinity)、兔多抗GAPDH(杭州贤至生物有限公司)、兔多抗GCLM(Affinity)、兔多抗HO-1(Affinity);生物显微镜(尼康)、超微量紫外可见光分光光度计(杭州米欧仪器有限公司)、PCR仪(杭州米欧仪器有限公司)、电转仪(北京六一仪器厂)及酶标仪(Thermo)。
1.2方法
1.2.1实验分组及动物模型的建立采用随机数字表法将21只SPF级SD大鼠分为假手术组(7只)、高眼压模型组(7只)及姜黄素治疗组(7只)。高眼压模型组和姜黄素治疗组建立慢性高眼压大鼠模型,采用标准烧灼巩膜上静脉法造模,SD大鼠用1%戊巴比妥钠按照45mg/kg行腹腔内注射麻醉,选取左眼为术眼,左眼滴0.5%丙美卡因滴眼液,在角膜缘后1mm处沿顺时针方向剪开6∶00~14∶00位的球结膜,分离结膜下筋膜及肌肉,分别在上直肌两侧及外直肌下方附近找到3条“Y”字形巩膜上静脉,游离并抬起静脉总支,夹闭并用加热的大头针烧灼角巩膜远侧的静脉主干,使静脉封闭,烧灼成功后复位缝合球结膜。假手术组仅在同样位置剪开左眼球结膜,不烧灼巩膜上静脉。术毕左眼结膜囊内涂左氧氟沙星眼膏,将大鼠放置于保温毯上,待其自然苏醒后放回笼内,术后5d每日结膜囊内涂左氧氟沙星眼膏1次。
1.2.2眼压测定待麻醉显效后,采用TONO-PEN AVIA眼压计笔尖紧密接触角膜,每眼连续测量5次稳定读数,读数的平均值作为眼压测定值。分别于造模前、造模后30min测量眼压,造模后左眼眼压大于术前眼压的1.7倍即视为造模成功。每周监测眼压直至3wk后实验结束。
1.2.3给药方式姜黄素治疗组术后给予姜黄素灌胃,灌胃剂量为4mL/kg(10mg/kg),每日1次,连续3wk。假手术组和高眼压模型组则给予纯水灌胃,灌胃剂量为4mL/kg,每日1次,连续3wk。
1.2.4取材造模3wk后所有大鼠使用10倍的麻醉剂量(1%戊巴比妥钠,450mg/kg)实施安乐死,每组随机选取4只取左眼眼球组织,用4%多聚甲醛固定,制备石蜡切片,每组其余3只取左眼眼球组织,去除角膜、晶状体和玻璃体,分离视网膜组织,放入-80℃冰箱中冻存备用。
1.2.5HE染色观察视网膜组织形态病理变化和RGCs数量及神经节细胞层厚度将制备好的眼球组织石蜡切片进行脱蜡、苏木素染色、伊红染色、脱水、透明、封片,高倍显微镜下(×200)观察视网膜变化,采集图像;在神经节细胞层(ganglion cell layer,GCL)区域取600μm,应用Image-Pro Plus 6.0分析软件计数RGCs,每组随机选取4眼,每眼随机选取3张切片计数,取平均值;应用Image-Pro Plus 6.0分析软件测量GCL厚度,每组随机选取4眼,每眼随机选取3张切片,每张切片测量5次取平均值。
1.2.6TUNEL染色检测RGCs凋亡率和视网膜细胞总凋亡率将制备好的眼球组织石蜡切片进行脱蜡水化、蛋白酶K孵育、标记工作液孵育、DAPI孵育、封片,荧光显微镜下(×400)观察采集图像,每组随机选取4眼,每眼随机选取3个高倍视野(×400)计算细胞凋亡率取平均值,每个高倍视野采用Image-Pro Plus 6.0分析软件计数凋亡RGCs数(TUNEL染色阳性)、RGCs总数和凋亡视网膜细胞数(TUNEL染色阳性)、视网膜细胞总数,细胞凋亡率=TUNEL染色阳性细胞数/ 细胞总数。
1.2.7免疫组织化学染色检测视网膜GCLM与HO-1蛋白的表达将制备好的眼球组织石蜡切片进行脱蜡水化、抗原修复、阻断过氧化物酶、血清封闭,依次加入一抗(1∶100)、HRP标记的羊抗鼠/兔二抗、DAB显色液,显微镜观察到颜色改变后,自来水冲洗、苏木素复染、脱水透明、封片,晾干后,在显微镜下观察并采集图像,每组随机选取4眼,每眼随机选取4个高倍视野(×400)计算光密度取平均值,每个高倍视野采用Image-Pro Plus 6.0分析软件测量视网膜积分光密度和面积,光密度=积分光密度/面积。
1.2.8Westernblot检测视网膜GCLM与HO-1蛋白的表达从-80℃冰箱中取出保存的视网膜组织,提取视网膜组织中总蛋白、测定蛋白浓度、制备电泳胶,待电泳分离及电转移后,依次用一抗(1∶1000)、二抗进行孵育,显色曝光后,采用Image-Pro Plus 6.0分析软件分析胶片灰度值,以GAPDH为内参蛋白,计算灰度值比值GCLM/GAPDH和HO-1/GAPDH,实验重复3次。
1.2.9实时荧光定量PCR检测视网膜GCLMmRNA与HO-1mRNA的表达从-80℃冰箱中取出保存的视网膜组织,Trizol法提取RNA后,逆转录合成cDNA,以GAPDH作为内参照。正向和反向引物:Rat GAPDH:正向:5’-ACAGCAACAGGGTGGTGGAC-3’;反向:5’-TTTGAGGGTGCAGCGAACTT-3’;产物长度:253bp。Rat GCLM:正向:5’-TAAACCCTGATGAAAGAGA-3’;反向:5’-GTAAGGCTGCAAATGCT-3’;产物长度:197bp。Rat HO-1:正向:5’-GCATGTCCCAGGATTTGTCC-3’;反向:5’-GGTTCTGCTTGTTTCGCTCT-3’;产物长度:192bp。采用2-ΔΔCt法计算目的基因的相对表达量,实验重复3次。
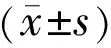
2 结果
2.1各组大鼠眼压比较造模前,3组大鼠眼压比较差异均无统计学意义(P>0.05);造模后30min,1、2、3wk,高眼压模型组和姜黄素治疗组大鼠眼压均高于假手术组,差异均有统计学意义(P<0.05),而高眼压模型组与姜黄素治疗组大鼠眼压差异均无统计学意义(P>0.05)。假手术组大鼠各时间点眼压两两比较差异均无统计学意义(P>0.05),高眼压模型组和姜黄素治疗组大鼠造模后各时间点眼压均高于造模前,差异均有统计学意义(P<0.05),见表1,图1。
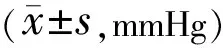
表1 各组大鼠造模前后眼压的比较
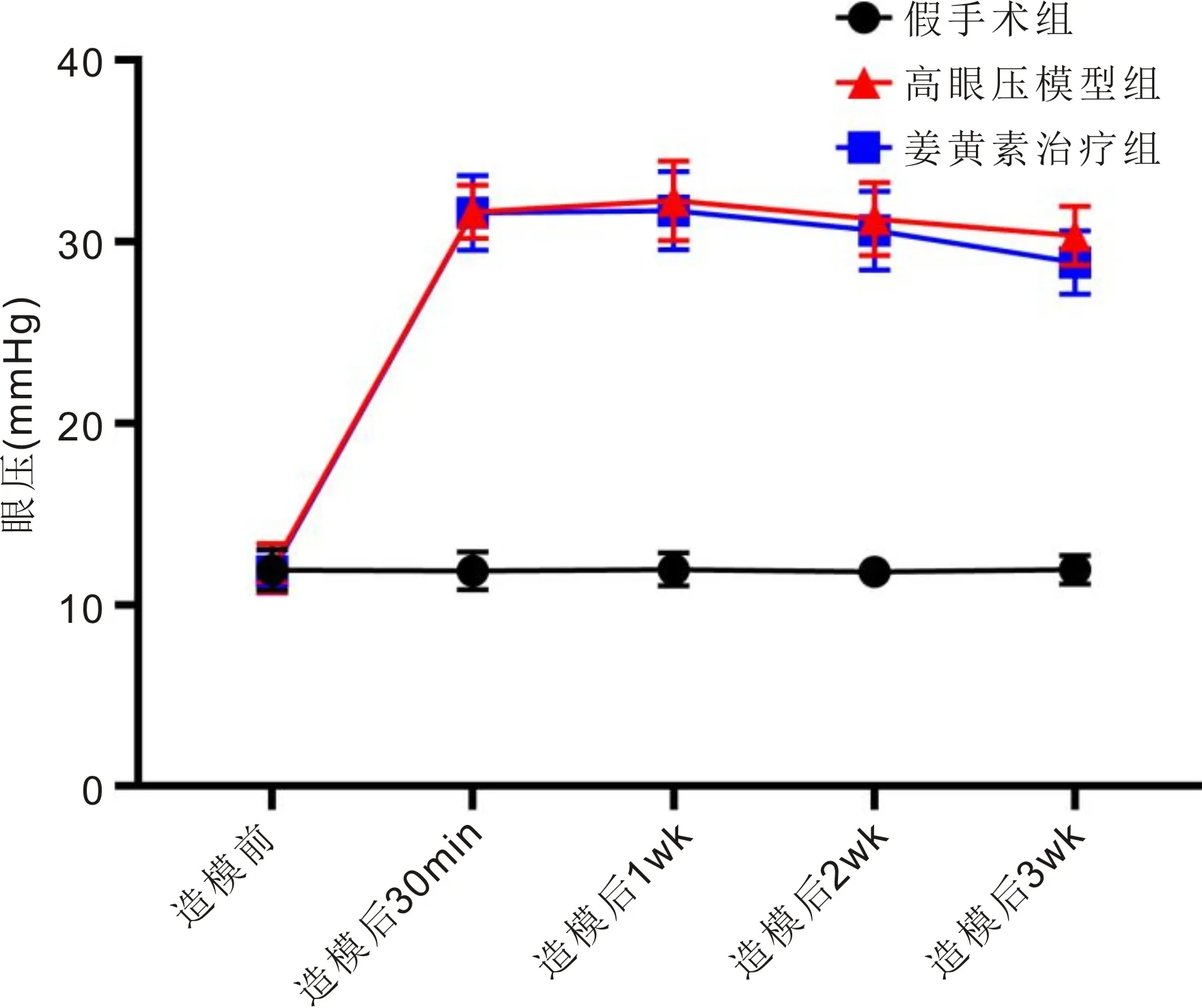
图1 各组大鼠造模前后眼压情况。
2.2各组大鼠视网膜组织形态病理变化和RGCs数量及GCL厚度比较HE染色结果显示,假手术组大鼠视网膜组织形态正常,分层清楚,细胞排列规整,单层RGCs外形正常、排列整齐、数量正常,细胞核内染色质分布均匀,内核层与外核层细胞排列紧密、规整;高眼压模型组大鼠视网膜组织形态紊乱,分层不清晰,细胞排列欠规整,单层RGCs外形不规则、排列紊乱、数量减少,可见部分细胞核固缩、溶解、碎裂等变性病理改变,内核层与外核层细胞排列疏松、紊乱,呈水肿样改变;姜黄素治疗组大鼠视网膜组织形态基本正常,分层清楚,细胞排列尚规整,单层RGCs外形较规则、排列尚整齐、数量基本正常,变性细胞核较少,内核层与外核层细胞排列稍疏松、紊乱。假手术组、高眼压模型组、姜黄素治疗组大鼠RGCs数量分别为37.583±3.167、20.167±1.478、26.500±3.249个,差异有统计学意义(F=40.962,P<0.05);GCL厚度分别为12.933±0.622、8.963±0.617、11.289±0.318μm,差异有统计学意义(F=55.035,P<0.05)。与假手术组相比,高眼压模型组和姜黄素治疗组大鼠RGCs数量均减少、GCL厚度均降低,差异均有统计学意义(P<0.05);与高眼压模型组相比,姜黄素治疗组大鼠RGCs数量增加、GCL厚度升高,差异均有统计学意义(P<0.05),见图2~4。
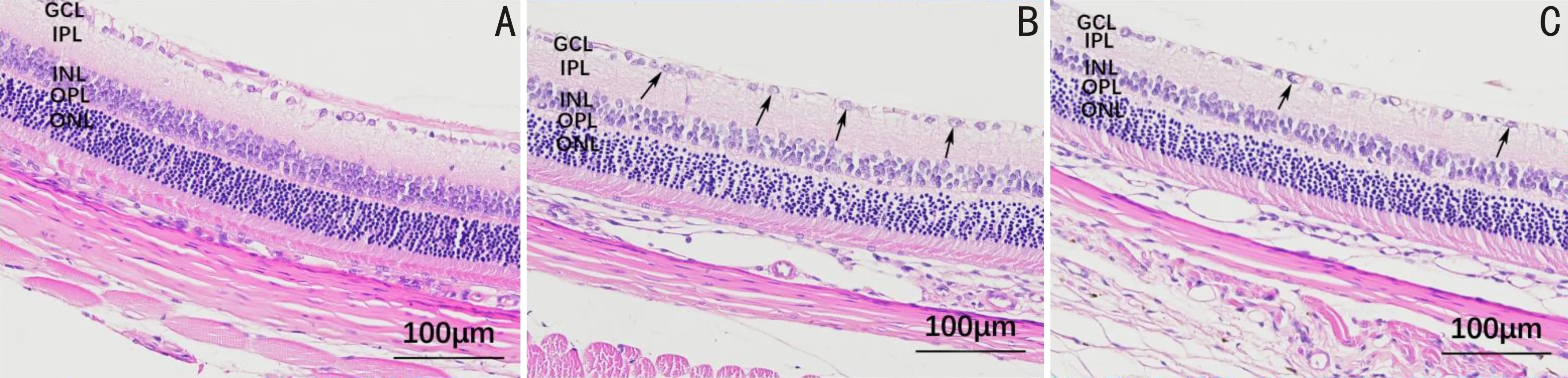
图2 HE染色观察各组大鼠视网膜组织形态变化
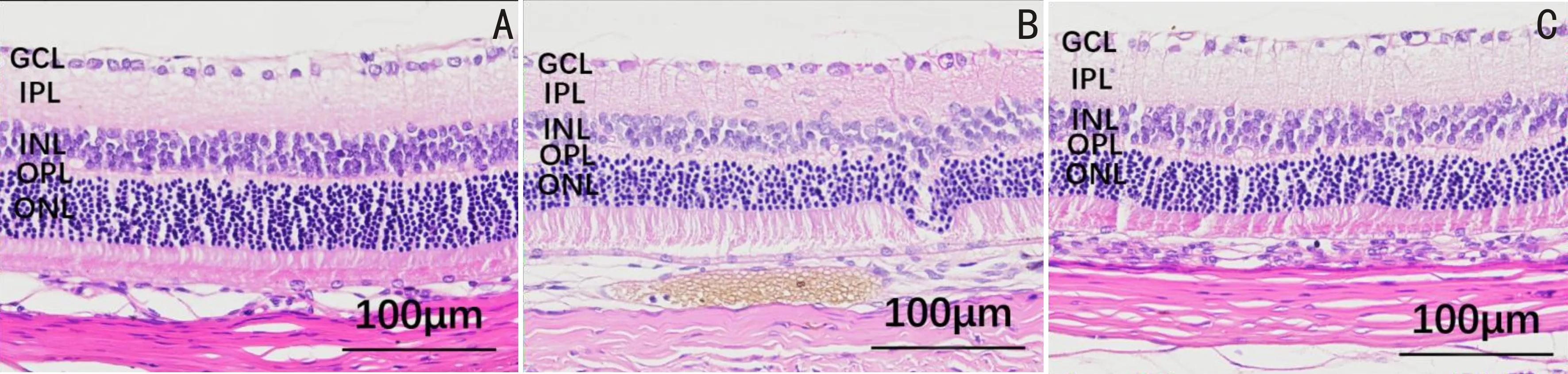
图3 HE染色观察各组大鼠GCL厚度
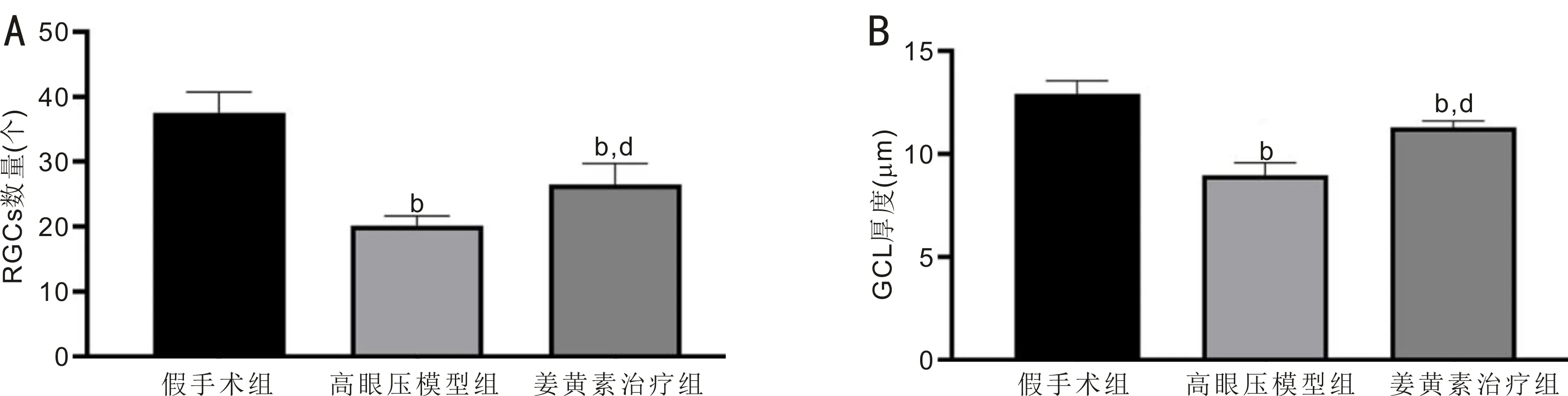
图4 造模后3wk各组大鼠RGCs数量和GCL厚度比较
2.3各组大鼠RGCs和视网膜细胞凋亡情况比较TUNEL染色结果显示,假手术组、高眼压模型组、姜黄素治疗组大鼠RGCs凋亡率分别为(1.660±1.159)%、(13.713±2.223)%、(5.316±1.938)%,差异有统计学意义(F=45.628,P<0.05);视网膜细胞总凋亡率分别为(1.957±0.809)%、(13.562±1.758)%、(6.603±1.204)%,差异有统计学意义(F=78.808,P<0.05)。与假手术组相比,高眼压模型组和姜黄素治疗组大鼠RGCs和视网膜细胞总凋亡率均升高,差异均有统计学意义(P<0.05);与高眼压模型组相比,姜黄素治疗组大鼠RGCs和视网膜细胞总凋亡率降低,差异均有统计学意义(P<0.05),见图5、6。
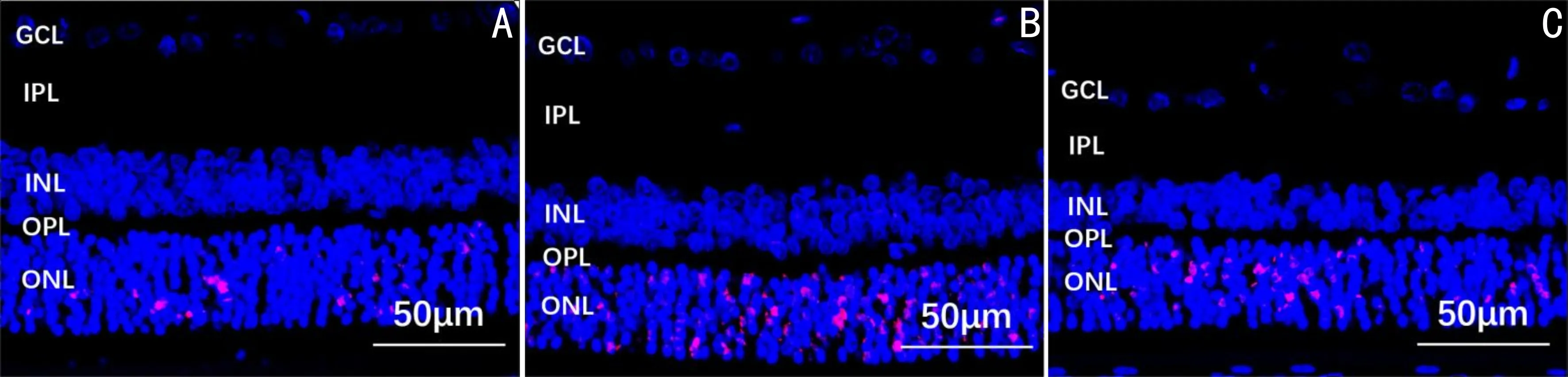
图5 TUNEL染色观察各组大鼠RGCs和视网膜细胞凋亡情况
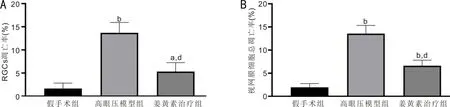
图6 造模后3wk各组大鼠RGCs和视网膜细胞凋亡率比较
2.4各组大鼠视网膜GCLM和HO-1蛋白表达水平比较免疫组织化学染色检测结果显示,假手术组、高眼压模型组、姜黄素治疗组大鼠视网膜GCLM蛋白平均光密度值分别为0.00148±0.00054、0.00429±0.00046、0.00662±0.00041,差异有统计学意义(F=120.038,P<0.05);HO-1蛋白平均光密度值分别为0.00346±0.00042、0.00721±0.00050、0.01100±0.00058,差异有统计学意义(F=221.878,P<0.05)。与假手术组相比,高眼压模型组和姜黄素治疗组大鼠视网膜GCLM和HO-1蛋白平均光密度值均升高,差异均有统计学意义(P<0.05);与高眼压模型组相比,姜黄素治疗组大鼠视网膜GCLM和HO-1蛋白平均光密度值升高,差异均有统计学意义(P<0.05),见图7~9。

图7 免疫组织化学染色观察各组大鼠视网膜GCLM蛋白表达情况
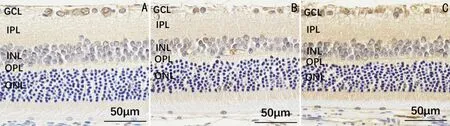
图8 免疫组织化学染色观察各组大鼠视网膜HO-1蛋白表达情况

图9 免疫组织化学染色检测各组大鼠视网膜GCLM与HO-1蛋白表达水平比较
Western blot检测结果显示,假手术组、高眼压模型组、姜黄素治疗组大鼠视网膜GCLM/GAPDH灰度值比值分别为0.091±0.039、0.390±0.075、0.614±0.002,差异有统计学意义(F=87.206,P<0.05);HO-1/GAPDH灰度值比值分别为0.395±0.033、0.709±0.092、0.986±0.094,差异有统计学意义(F=42.672,P<0.05)。与假手术组相比,高眼压模型组和姜黄素治疗组大鼠视网膜GCLM/GAPDH和HO-1/GAPDH灰度值比值均升高,差异均有统计学意义(P<0.05);与高眼压模型组相比,姜黄素治疗组大鼠视网膜GCLM/GAPDH和HO-1/GAPDH灰度值比值升高,差异均有统计学意义(P<0.05),见图10。
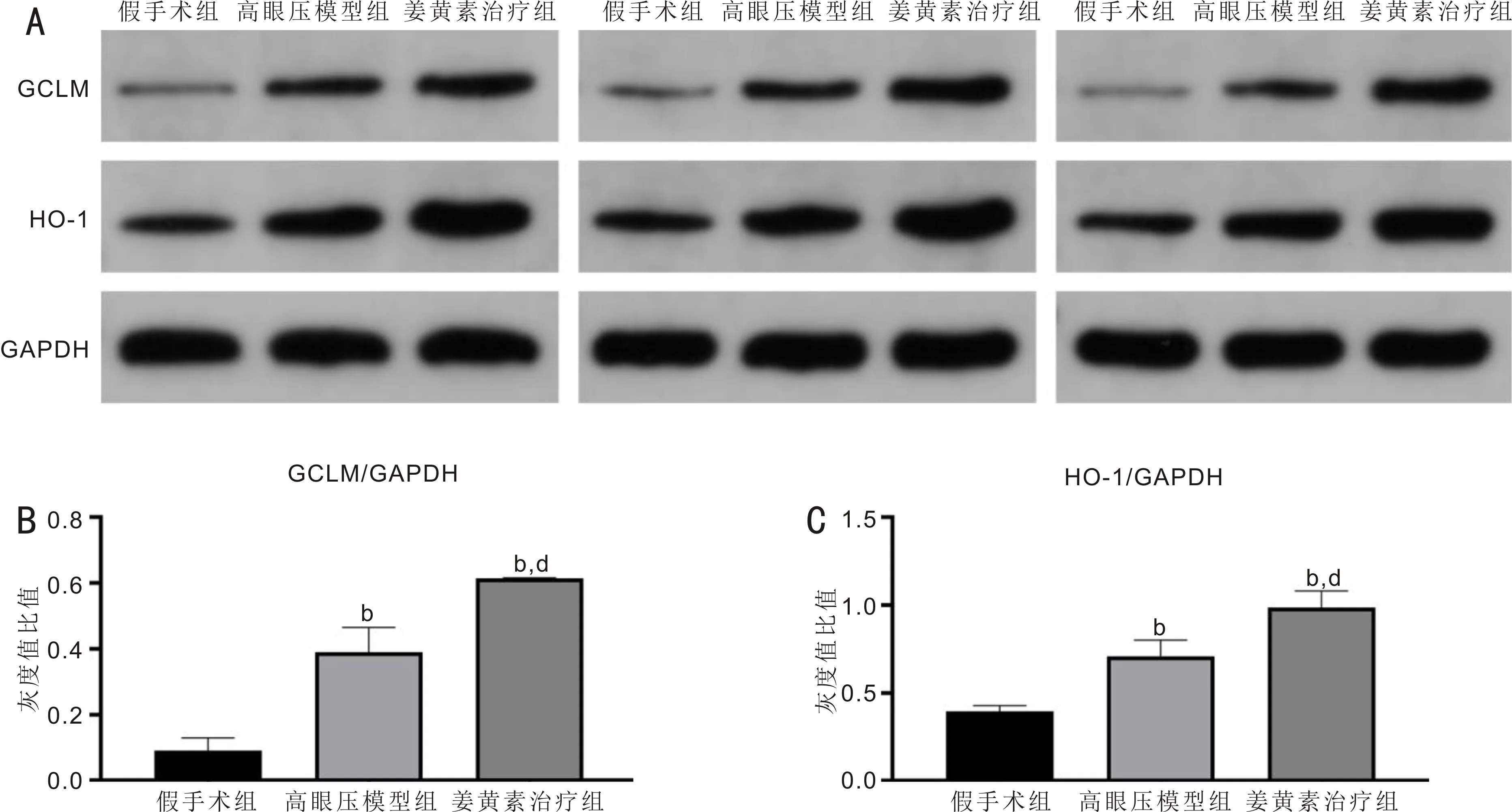
图10 Western blot检测各组大鼠视网膜GCLM和HO-1蛋白表达水平
2.5各组大鼠视网膜GCLMmRNA与HO-1mRNA表达水平比较实时荧光定量PCR检测结果显示,假手术组、高眼压模型组、姜黄素治疗组大鼠视网膜GCLM mRNA相对表达水平分别为0.986±0.066、1.816±0.336、2.538±0.402,差异有统计学意义(F=19.493,P<0.05);HO-1 mRNA相对表达水平分别为0.974±0.041、3.041±0.426、5.147±0.530,差异有统计学意义(F=84.352,P<0.05)。与假手术组相比,高眼压模型组和姜黄素治疗组大鼠视网膜GCLM mRNA和HO-1 mRNA的相对表达水平均升高,差异均有统计学意义(P<0.05);与高眼压模型组相比,姜黄素治疗组大鼠视网膜GCLM mRNA和HO-1 mRNA的相对表达水平升高,差异均有统计学意义(P<0.05),见图11。
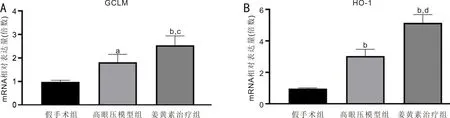
图11 实时荧光定量PCR检测各组大鼠视网膜GCLM和HO-1 mRNA相对表达水平
3 讨论
近年,视神经保护性治疗越来越受到重视,由于青光眼患者不可逆性视功能损害是视神经损伤并导致RGCs凋亡的结果,因此,青光眼的治疗已经不再满足于仅降低眼压,而是预防视神经损伤及RGCs进行性丢失。RGCs的死亡涉及多种机制,包括神经营养因子剥夺、炎症、氧化应激、线粒体功能障碍、谷氨酸兴奋性毒性和自噬失调等,其中氧化应激是一条重要的损伤途径[8]。氧化应激指氧化剂和抗氧化剂之间的平衡发生紊乱,导致活性氧(reactive oxygen species,ROS)过度积累并造成损伤[9]。RGCs及其轴突容易受到氧化应激的影响,是因为视网膜耗氧量高,多不饱和脂肪酸比例高,且直接暴露于紫外线、可见光、电离辐射、化疗药物和环境毒素中[3]。为了应对内源性或外源性氧化剂产生的影响,细胞配备了相应的抗氧化防御系统,可以保护细胞免受氧化应激的损伤,其中Keap1-Nrf2-ARE是调节抗氧化蛋白产生的重要信号通路,其下游基因产物包含超氧化物歧化酶、过氧化氢酶、谷胱甘肽还原酶、谷胱甘肽过氧化物酶、谷胱甘肽转移酶、醌氧化还原酶-1、谷氨酰半胱氨酸连接酶及HO-1等[4-5]。
谷氨酰半胱氨酸连接酶与HO-1均是Keap1-Nrf2-ARE信号通路下游的抗氧化防御酶[10]。GCLM是谷氨酰半胱氨酸连接酶的重要组成部分,而后者是谷胱甘肽(glutathione,GSH)生物合成的限速酶,GSH具有解毒、抗氧化、调节细胞增殖等多种功能[11]。Malone等[12]研究表明GSH可清除慢性氧化应激产物,从而保护视神经;Park等[13]研究则表明通过药物降低GSH水平可诱导视网膜细胞死亡。HO-1是血红素分解代谢过程中的限速酶,其产物在人体内发挥抗炎、抗氧化、抗凋亡等作用[14]。既往研究已证明使用基因转移或药物的方式诱导HO-1可抑制细胞凋亡并在细胞损伤后提供保护[15-17]。通过对GCLM与HO-1进行研究,或许可为青光眼的视神经保护性治疗提供新思路。
姜黄素是从姜科植物姜黄的地下根茎中提取的主要活性物质,具有抗炎、抗氧化、抗肿瘤、抗动脉粥样硬化、抗衰老等多种生物活性[18]。姜黄素是一种有效的ROS自由基清除剂,由于其结构的特殊性,可以激活Keap1-Nrf2-ARE信号通路,诱导GCLM、HO-1等细胞保护性蛋白的表达,发挥抗氧化作用[19-20]。以往大量研究已证明姜黄素的抗凋亡和抗炎等作用可以保护RGCs免受青光眼相关刺激的影响[21-24]。然而,姜黄素的抗氧化生物活性在青光眼治疗中的应用潜力还有待进一步挖掘。
本研究以烧灼巩膜上静脉法制造慢性高眼压大鼠模型模拟青光眼模型,结果显示,高眼压模型组和姜黄素治疗组造模后各时间点眼压与造模前相比差异均具有统计学意义,且均明显高于造模前,提示造模成功。造模后各时间点高眼压模型组和姜黄素治疗组大鼠眼压均高于假手术组,差异均有统计学意义,而高眼压模型组与姜黄素治疗组大鼠眼压相比差异均无统计学意义,提示姜黄素在该模型中降低眼压的效果并不显著,需要进一步通过组织学检测评估姜黄素的神经保护性作用。HE染色结果显示,姜黄素有助于视网膜病理形态的恢复。此外,虽然与假手术组比较可发现姜黄素的治疗效果并不能完全逆转青光眼的损害,但姜黄素治疗组大鼠RGCs数量、GCL厚度、TUNEL染色视网膜总细胞及RGCs凋亡情况均显著优于高眼压模型组,表明姜黄素对RGCs和视网膜具有一定的保护作用,并且对RGCs的凋亡具有抑制作用。
为了进一步验证姜黄素影响RGCs凋亡的机制是否与其抗氧化应激能力有关,本研究观察调控Keap1-Nrf2-ARE信号通路的两个重要抗氧化基因GCLM与HO-1的表达情况,结果显示,无论是从基因还是蛋白水平,姜黄素均促进高眼压大鼠视网膜组织中GCLM与HO-1的表达。结合RGCs的研究结果,推测在慢性高眼压大鼠模型中姜黄素通过激活抗氧化防御系统抑制RGCs凋亡。此外,尽管增幅不如姜黄素治疗组,高眼压模型组抗氧化基因的表达量仍显著高于假手术组,这可能是由于慢性高眼压状态下产生了大量ROS,激活了内源性抗氧化防御系统[4,25]。
本研究初步证明对慢性高眼压大鼠进行姜黄素溶液10mg/kg灌胃治疗3wk后能够减少RGCs凋亡,并进一步证明姜黄素对大鼠RGCs的保护效应可能是通过上调抗氧化基因GCLM与HO-1的表达实现的。然而,若要将姜黄素在动物模型中对青光眼的疗效成果推广到临床,还需要考虑其具体的应用方法。以往姜黄素的应用受到其缺乏水溶性和生物利用率低等特点的影响,为解决这一问题,近年已研发出姜黄素佐剂、脂质体姜黄素、姜黄素纳米颗粒、姜黄素磷脂复合物、姜黄素结构类似物等新型姜黄素制剂[7,26-27]。Davis等[28]研制了一种新型姜黄素纳米载体,应用于模拟青光眼环境中的视网膜前体细胞,结果表明,该姜黄素纳米载体能够发挥神经保护作用,并进一步在大鼠动物模型中发现这种新型载体可以有效减少RGCs损失。氧化应激对青光眼的影响不仅限于RGCs死亡,还能使小梁网房水流出通道受损,从而引起眼压升高。Cheng等[29]开发出一种既含有拉坦前列素也含有姜黄素负载纳米颗粒的热敏水凝胶,可有效减轻人小梁网细胞氧化应激介导的损伤,其中姜黄素对小梁网细胞凋亡发挥了保护作用,同时,热敏水凝胶里含有的拉坦前列素可以增加房水经葡萄膜巩膜途径的流出量,从而降低眼压,这种含有姜黄素的联合用药方式将传统的降眼压治疗和抗氧化应激保护性治疗结合起来,为今后新型姜黄素制剂的研发及临床应用提供了新的思路。

