wARMD抗VEGF治疗应答不良的影响因素及靶向周细胞的治疗策略
郑翰然,胡艳红,叶照达
0 引言
湿性年龄相关性黄斑变性(wet age-related macular degeneration, wARMD)是与年龄相关、以黄斑区反复渗出、出血、瘢痕形成为特征,导致中老年人失明的重要黄斑疾病,常发生在45岁以上,并且随着中国人口老龄化的加快,该病发病率有明显的上升趋势。目前,全球ARMD的总患病率约为 8.69%,预计到 2040年,患者数量将增长至2.88亿例[1-2]。
玻璃体腔注射抗血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前wARMD的一线治疗方法。但临床发现并非所有wARMD患者接受抗VEGF药物干预后都能够取得预期疗效,研究显示有30%患者对抗VEGF药物应答不良或不应答[2]。周细胞作为一种微血管壁的成分细胞,近年来发现其可影响抗VEGF药物治疗的敏感性[3]。因此,本文就抗VEGF药物治疗应答不良或无应答的临床影响因素、周细胞对其影响机制以及解决措施等方面作一综述,以期为临床上治疗wARMD方案选择提供参考。
1 wARMD抗VEGF药物治疗应答不良或不应答的影响因素
1.1年龄wARMD患者的高龄状态被认为是抗VEGF药物治疗无效的独立风险因素[4]。与高龄患者比较,年轻患者在抗VEGF药物注射后视力提高更为显著[5]。经蛋白质组学研究表明与衰老相关的代谢蛋白水平的整体下降、伴侣蛋白和蛋白酶的减少,可能是年龄影响抗VEGF药物治疗疗效的原因[6]。
1.2疗程与注射次数当前抗VEGF药物治疗的主要方案如下:雷珠单抗眼内注射液为3+PRN方案,康柏西普为3+每3mo方案或者3+PRN方案,阿柏西普为3+每8wk方案或者3+治疗并延长(treat and extend,T&E)方案[2]。关于wARMD患者注射次数的最佳上限尚未见报道。有文献报道抗VEGF药物治疗的第1a平均注射针数为4.3±0.2次时,患者最佳矫正视力(best corrected visual acuity, BCVA)尚可维持在治疗前水平或略有提高,此后BCVA逐渐下降,甚至低于基线视力[7]。这说明药物注射次数以及治疗时长是影响抗VEGF药物治疗应答效果的因素之一。疗程越长,注射次数越多,抗VEGF治疗应答越差,可能与长期抗VEGF药物治疗后眼内VEGF生理性水平被抑制,从而引起黄斑区纤维化甚至瘢痕化有关。
1.3黄斑新生血管病灶对wARMD患者抗VEGF治疗应答的影响根据最新的国际ARMD命名专家共识,将脉络膜新生血管(choroidal neovascularization,CNV)更换为黄斑新生血管(macular neovascularization,MNV)。MNV 是指新生血管长入黄斑区视网膜、视网膜下腔或视网膜色素上皮层(retinal pigment epithelium,RPE)下腔,基于新生血管在视网膜组织中的起源和存在部位不同,MNV分为1型、2型和3型[2]。相关研究表明,在3次注射抗VEGF药物后,仍有部分总血管长度较高的MNV以渗液的形式表现其活性,这些存在时间较长的MNV可表现为视网膜下液(subretinal fluid,SRF)和色素上皮脱落(pigment epithelial detachements,PED)等更多形态学改变,可导致其对抗VEGF药物应答不良[8]。另有研究表明,3型MNV血管表现为视网膜深层毛细血管丛的特化,3型MNV病变的胶原鞘能够帮助维持结构稳定有关,导致其对抗VEGF药物治疗的应答不良[9]。总之,不同特征的MNV对抗VEGF药物治疗的应答反应存在差异,临床对wARMD患者MNV进行评估以及定期复查对于预测抗VEGF疗效十分重要,有利于减少不必要的抗VEGF治疗对患者造成的经济负担和心理压力。
1.4黄斑区结构变化对wARMD患者抗VEGF治疗应答的影响
1.4.1视网膜囊样积液研究发现视网膜囊样积液(intraretinal cystoid fluid, IRC)是对抗VEGF治疗反应最快的形态学参数,并且在中断治疗时也最迅速的复发,被认为是最敏感的形态学参数之一[10]。Li等[11]对138例玻璃体腔注射康柏西普的wARMD患者随访12mo,分析ETDRS字母改善的平均变化后发现,存在IRC的患者较平均水平低约2个字母,不存在IRC的患者较平均水平高约2个字母。
1.4.2黄斑中心凹下脉络膜厚度有研究发现,在典型的wARMD患者中,基线的脉络膜厚度、黄斑拱环与抗VEGF药物治疗的反应存在显著相关性,脉络膜厚度越厚,治疗后反应越差[12-14]。这与脉络膜增厚的患者黄斑区脉络膜循环障碍、局部血氧供应增高有关[15]。
1.4.3黄斑区玻璃体视网膜交界面结构异常玻璃体黄斑黏连、玻璃体黄斑牵引、黄斑前膜在wARMD患者中的发病率明显高于健康人,由于这三种异常解剖因素的影响,局部视网膜缺氧程度加重,导致炎性因子的释放。分析抗VEGF治疗无应答的wARMD患者的OCT结果发现,约27.8%~36.0%的患者合并玻璃体黄斑黏连或玻璃体黄斑牵引,约26%~32%的患者合并黄斑前膜[16],恢复解剖结构正常后,能够提高抗VEGF药物的应答效果。
视网膜囊样积液、黄斑中心凹下脉络膜厚度、黄斑区玻璃体视网膜交界面结构异常等黄斑区结构变化均可能导致抗VEGF应答效果不良,临床上可应用OCT等检查手段进行评估,优化治疗方案。
1.5房水分子生物标志物对wARMD患者抗VEGF治疗应答的影响临床存在wARMD患者对抗VEGF治疗应答不良或者无应答,提示了眼内可能存在其他细胞因子与wARMD发生发展有关。研究发现与正常应答的ARMD相比,不完全应答组房水内可溶性血管细胞黏附分子-1 (sVCAM-1)、生物活性白细胞介素-12 (IL-12p40)、白细胞介素-6 (IL-6)、纤溶酶原激活物抑制剂1型(PAI-1) 和肝细胞生长因子(HGF)的信号明显升高[17]。可见持续性炎症可能是wARMD的持续发展和抗VEGF治疗应答不良的原因。
1.6遗传学因素抗VEGF治疗无应答的遗传因素主要包括VEGF相关基因、补体因子H、年龄相关性黄斑病变易感因子2、高温必需因子A及白介素相关基因等[18]。相关研究表示基因治疗是一种安全、有效的治疗手段[19]。临床上对排除其他因素后仍无应答者进行相关遗传学检查,有利于给予个性化治疗,减少无效注射针数。
上述各大因素对wARMD患者抗VEGF药物治疗敏感性均有影响,在治疗过程中应对患者高龄、疗程长或注射次数多、CNV病灶特征、黄斑区异常结构、眼内房水IL-6等细胞因子水平、遗传等因素多方面评估,但目前临床上尚缺乏相关积分量表或指南指导临床工作者对VEGF药物治疗疗效的预测及评估。
2 周细胞在wARMD抗VEGF药物治疗应答不良或不应答中的作用
近年来,研究发现,周细胞作为一种微血管壁的成分细胞,可通过直接作用和旁分泌途径与血管内皮细胞相互作用,对血管重塑和维持视网膜血管完整性至关重要,且周细胞覆盖的微血管对抗VEGF治疗应答不良[3]。周细胞在脉络膜新生血管周围大量存在,能够促进CNV的形成并且影响后期视网膜纤维化[20],这为wARMD抵抗抗VEGF药物提供了条件。因此,揭示血管外周细胞的功能及其在各种新生血管性疾病中的机制成为研究的焦点之一。
wARMD患者眼内微环境不仅与正常人存在差异。同时,其在抗VEGF药物治疗后,局部微环境也随之发生改变[3]。在wARMD中,CNV形成过程中伴随着干细胞因子(stem cell factor,SCF)、白细胞介素- 1β(interleukin- 1β,IL- 1β)、基质衍生因子-1α(stromal-derived factor-1α,SDF-1α)、成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)、胰岛素样生长因子-1(insulin like growth factor,IGF-1)等血管内皮相关因子增加[21-25],这些因子能够与血管内皮细胞上相关受体结合,进一步促进血小板衍生生长因子-BB(platelet derived growth factor-BB,PDGF-BB)、PDGF-DD、人肝素结合性表皮生长因子(human heparin-binding epidermal growth factor,HB-EGF)和内皮素-1(endothelin-1,ET-1)等关键生长因子分泌[26-27],这些因子分别作用于周细胞上相关受体,招募周细胞,促进周细胞增殖和存活,包绕于血管内皮细胞形成的小管结构外表面。其中,PDGF-BB/PDGF受体系统对于维持血管的完整性和稳定性重要作用,也是学者们研究较多的通路[28]。血管内皮细胞分泌和活动性CNV被认为是ARMD患者PDGF-BB水平升高的可能来源,CNV的发生发展可诱导低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)级联,HIF-1级联不仅可诱导视网膜局部的炎症及缺氧,还可导致PDGF和VEGF-B表达上调,VEGF/PDGF相互作用促进CNV抵抗VEGF抑制剂[29]。周细胞覆盖于血管内皮细胞形成的血管后,两者间的相互串扰作用增强。如在抗VEGF治疗应答不良的wARMD患者眼内血管生成素-2(angiopoietin-2,Ang-2)水平增高[30]。另外,有研究表明周细胞可以增强Ang-2表达[31]。因此,周细胞增强的Ang-2可结合血管内皮细胞上的Tie-2,该过程诱导了血管内皮细胞中的促生存信号,导致血管通透性增加,血管渗漏加重,甚至导致病理性新生血管的增加[31],进而影响抗VEGF药物治疗应答效果。血管内皮细胞与周细胞间的生物信息相互通讯,进一步促进细胞外基质、平滑肌细胞包绕于小管外形成成熟的血管(图1)。简而言之,wARMD患者的眼内局部微环境改变促使血管内皮细胞分泌相关因子招募周细胞并覆盖于内皮细胞表面,二者间形成串扰,并促使后续的周细胞-肌成纤维细胞转化发生,影响抗VEGF药物治疗的敏感性[3]。
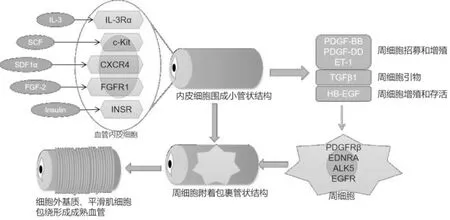
图1 抗VEGF治疗应答不良的血管形成过程。
3 靶向周细胞的wARMD抗VEGF药物治疗应答不良或不应答解决策略
新生血管外周细胞的覆盖促进血管成熟或者以及周细胞-肌成纤维细胞转化诱导视网膜纤维化均可影响wARMD的MNV对抗VEGF药物的敏感性。因此,降低周细胞的覆盖或者抑制周细胞-肌成纤维细胞转化过程是目前提高wARMD患者抗VEGF治疗敏感性的主要策略。
3.1降低周细胞覆盖率
3.1.1通过抑制PDGF信号通路途径降低周细胞覆盖率血小板衍生生长因子(platelet derived growth factor,PDGF)受体信号通路是周细胞募集过程中的重要部分,参与了生理性及病理性新生血管的生成过程,可通过调控周细胞影响抗VEGF药物治疗应答效果[32]。E10030是一种DNA诱导剂,作为PDGF抑制剂,可选择性地与表达在周细胞上的受体相结合,从而对PDGF机制通路产生抑制作用。在一项长达24wk的临床Ⅱb期实验中,研究者们发现PDGF和VEGF的双重作用在剥离周细胞后诱发了新生血管的消退,他们认为,PDGF抑制剂抑制了非血管成分(肌成纤维细胞和炎症、RPE和胶质细胞等),从而协助、加强了VEGF抑制剂的治疗效果[33]。阿西替尼是一种小分子酪氨酸激酶抑制剂,主要针对VEGF受体1-3和PDGF受体[34]。一项体外实验结果显示,阿西替尼能够显著减少周细胞招募,在安全用药剂量下,周细胞增殖的抑制程度依赖于阿西替尼的剂量,能在体内增加新生血管对抗VEGF药物的敏感性,并诱导血管消退;并且阿西替尼与多种眼内细胞具有良好的生物相容性,安全系数较高[31]。上述研究者进行后续研究时发现,虽然阿西替尼联合治疗有调节血管生成的优势,但其导致的基底膜周细胞剥离增多却有可能导致瘢痕物质的沉积,增加病灶纤维化的风险[35]。因此,仍需更多的实验阐明寻找降低纤维化风险的解决方案。
抗体-药物偶联物(antibody-drug conjugates, ADCs)药物是由抗体通过连接子结合细胞毒性药物组成,药物结合靶点后,内吞入细胞,通常在溶酶体释放细胞毒药物,进行细胞杀伤作用,并且能够减少非靶点介导的毒性作用,增加药物利用率[36]。在一项研究[31]中,研究者发现可替宁-多卡霉素的ADCs对小鼠模型中血小板衍生生长因子受体β(PDGFRβ)高表达的周细胞具有特异性消融的作用,可有效抑制CNV形成,促进视网膜血管再建,改善新生血管的情况;而且由于正常视网膜血管和新生血管之间PDGFRβ的表达水平有明显差异,ADCs的毒性被限制,对正常视网膜血管的毒性小,在适宜治疗剂量下,未诱发视网膜的形态或功能异常,也没有引起全身毒性;但剂量过高时,有可能诱发血-视网膜屏障渗漏。
3.1.2通过抑制mTOR通路途径降低周细胞覆盖率哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,其信号通路是细胞生长和增殖的主要调节器[37]。有研究者在对体外nARMD模型的实验中发现,mTOR雷帕霉素能够成功地抑制内皮细胞的形成,与抗VEGF药物相当,能够调节CNV血管生成中的视网膜周细胞的生长,剂量依赖性的减少周细胞的增殖与迁移,同时干扰了周细胞对内皮血管的稳定作用,甚至能使部分周细胞覆盖的血管萎缩[38]。
3.2减少周细胞-肌成纤维细胞转化在一项研究中发现发现,磷酸化信号转导分子2/3(phosphorylated Smad2/3,Smad2/3)可与mTOR途径协同诱导脉络膜周细胞增殖以及周细胞-肌成纤维细胞转化(pericyte-myofibroblast transition,PMT)的发生[39],联合抑制Smad2/3和mTOR信号通路能够靶向作用于周细胞,发挥显著的抗纤维化作用以改善抗VEGF治疗应答效果不良的现象[39-40]。在激光诱导MNV小鼠模型中发现,蛋白激酶B(protein kinase B,Akt)途径可调节脉络膜上部分周细胞中mTOR活性,玻璃体腔内注射Akt抑制剂MK2206联合mTOR抑制剂雷帕霉素能够安全有效地抑制MNV及纤维化,并且早期多次给药的疗效更佳,但其具体机制尚不明确[39]。
3.3针对周细胞的基因治疗如前所述,基因与wARMD抗VEGF治疗应答不良有关,因此,基因治疗靶向视网膜细胞,从而纠正细胞功能障碍,是值得关注的方法。有研究者筛选出了pACG2-Peri-A~G这7个能够转导视网膜周细胞的推定突变体,通过动物实验,确定了这些突变点可能在限制硫酸肝素蛋白聚糖结合、逃避小鼠A20单克隆抗体的中和、调节抗原性和逃避泛素化方面发挥关键作用,最终提高视网膜周细胞的转导效率[41]。虽然目前针对周细胞的基因治疗研究较少,但其却为抗VEGF治疗应答不良或无应答的研究提供了新的思路。
3.4通过低能量立体定向放射抑制周细胞作用低能量立体定向放射是通过低剂量的X线照射ARMD患者的黄斑区,能够减少炎症反应、抑制成纤维细胞。体外模拟实验表明,该方法可以在不诱发周细胞死亡的前提下,降低细胞活力并抑制增殖,从而对病理性新生血管起抑制作用[42]。但由于X线照射对结构有一定的损伤,该疗法有可能影响视网膜微血管的功能及稳定性,甚至有可能导致病灶周围健康组织被破坏,故对于低能量立体定向放射治疗仍需不断研究、改善,密切监测可能造成的不良后果。
4 小结与展望
抗VEGF药物治疗为大多数wARMD患者带来了希望,是目前临床主要治疗手段。但对于抗VEGF药物治疗应答不良或无应答的患者,眼科医师应当结合患者的情况,对患者抗VEGF药物治疗应答效果进行预测,实施个性化治疗方案,降低患者的经济损失。同时,应积极对抗VEGF药物治疗应答不良或不应答机制进行更深入探讨,并重视新药研发以及新治疗策略的研究,中医药作为我国瑰宝,已有研究发现中药单体能够通过调控周细胞-内皮细胞相关PDGF受体、VEGF受体等信号通路而抑制肾组织周细胞-肌成纤维细胞转分化[43-44],这些中药单体是否能够作为抗VEGF药物治疗应答不良或不应答的wARMD患者的候选药物,需要进一步的实验研究证实。因此,还需要积极寻找中医药治疗方法和更多的研究探讨其潜在的机制,为wARMD患者提供更好的帮助。

