肥厚型脉络膜谱系疾病影像特征研究进展
黄 琳,黄 涵,马红婕,2
0 引言
肥厚型脉络膜谱系疾病(pachychoroid spectrum diseases, PSD)是一组以脉络膜充血和高通透性为基础,且具有相同病理过程的疾病,在2013年由Warrow等[1]通过对一系列临床特点相似的病例进行归类分析后首次提出。目前PSD的发病机制尚不明确,对于PSD为何具有相同的病理生理基础,但存在不同临床表现,各家学者所持观点仍有争议。随着影像学技术水平的提高,研究不断深入,越来越多的证据表明这些以前独立的各疾病可能是一个由脉络膜血管功能障碍驱动的疾病的连续进展过程。现就肥厚型脉络膜谱系疾病的临床特点及最新的影像学发现进行综述,为该类疾病发病机制、临床诊断及防治提供参考。
1 健康人眼的脉络膜特点
脉络膜是非常重要的生理结构,位于巩膜和视网膜之间,富含血管、常驻免疫细胞、支持胶原纤维和弹性结缔组织,由玻璃膜(Bruch membrane, BrM)、脉络膜毛细血管层(choriocapillaris layer, CC层)、脉络膜中血管层(Sattler层)、脉络膜大血管层(Haller层)和脉络膜上腔构成。脉络膜具有供血、提供代谢支持、调节温度、分泌生长因子、吸收光线及调节眼压等生理功能。人类中心凹下脉络膜厚度(subfoveal choroidal thickness, SFCT)在出生时约200μm,到90岁时约80μm[2]。脉络膜厚度(choroidal thickness, CT)的正常值尚无统一定论,有研究表明正常值在191~350μm[3],但受年龄、眼轴、屈光度、血压、测量时间及性别等因素影响。在脉络膜血流与昼夜节律的研究中显示SFCT、脉络膜总面积及脉络膜管腔面积与昼夜节律相关[4]。但Lin等[5]的研究显示CC层的血流与昼夜节律无关。在疾病进展过程中,脉络膜外层血管扩张可致脉络膜增厚,进而导致静水压力和血管通透性增高,促使疾病发生,如中心性浆液性脉络膜视网膜病变(central serous chorioretinopathy, CSC);另一方面,脉络膜内层变薄会导致RPE退化和感光细胞丢失,进而导致视网膜营养不足,如脉络膜增厚性色素上皮病变(pachychoroid pigment epitheliopathy, PPE)。
2 肥厚型脉络膜谱系疾病的共同影像学改变特点
2.1局部或弥漫的脉络膜增厚随着OCT成像技术在扫描速度、深度及处理软件等方面的不断进步,检查深度可达脉络膜-巩膜界面,能更好地观察脉络膜的全层厚度及各层特点。研究显示PSD脉络膜呈局部或弥漫性增厚的特点。但不同个体脉络膜厚度差异较大,脉络膜增厚亦可见于正常人,脉络膜厚度正常甚至偏低仍可能具有与厚脉络膜疾病的相同临床改变。许多学者提出SFCT大于300μm,或SFCT正常,但黄斑中心凹外的脉络膜厚度大于SFCT在50μm以上者为厚脉络膜[6]。但上述情况不一定合并病理改变,目前尚无明确阈值定义病理性脉络膜增厚,对于增厚的脉络膜是否具有病理意义,仍需要参考脉络膜各血管层的病理变化[7]。
2.2脉络膜大血管层扩张增厚及中/毛细血管层萎缩变薄PSD患者的OCT上可见局灶性或弥漫性脉络膜低反射腔增大,即Haller层扩张增厚,血管管径最大可达300μm[6,8-9],甚至占据整个脉络膜厚度,通常与脉络膜最厚的区域相对应。其Haller层呈局限性或弥漫性血管扩张,血管呈球杆状,在整个血管长度具有大而恒定的口径[10],对应区域的CC层和Sattler层萎缩变薄。这表明PSD的诊断并不仅与脉络膜厚度有关,同时也依赖于特定的脉络膜形态和结构改变[2]。90%以上的PSD患眼表现出上、下涡静脉的高吻合率,且随病程进展不断加重,在息肉样脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)患眼中程度最重,这可能是由于涡静脉长期充血,因而通过涡静脉吻合代偿以减轻充血所致[11]。在PPE患眼的CC层血流面积弥漫性减少,但与大血管扩张无关[12]。光相干断层扫描血流成像(optical coherence tomography angiography, OCTA)显示CSC黄斑区CC层呈现出粗颗粒状的高反射信号,周围伴随低反射信号,而正常眼则呈现均匀的信号[13]。这些均提示该类疾病CC层出现缺血情况,推测CC层的血流紊乱可能与疾病的严重程度及进展相关。对CC特点进一步深入探索将有助于疾病的诊断及预后的判断。
2.3脉络膜血管高通透性PSD在吲哚菁绿造影(indocyanine green angiography,ICGA)上表现为脉络膜充盈延迟、脉络膜静脉扩张和中晚期点状高荧光,有学者推测这与血管高通透性及脉络膜组织着染有关[14]。这提示PSD患者的脉络膜血管存在通透性增加及缺血的情况。在PSD活动期患眼可见ICGA上高通透性的特征性改变与RPE形态改变及脉络膜增厚区域相对应[15-16],且与眼底血管荧光造影(fundus fluorescent angiography, FFA)渗漏部位相对应,并且在无症状的对侧眼中亦可出现[17-18],这提示患者双眼存在同样的解剖学基础。
2.4肥厚型玻璃膜疣肥厚型玻璃膜疣为单团或簇状的黄白色玻璃膜疣,直径多大于125μm,具有明确的边界,常分布于后极部,对应区域可见脉络膜增厚、内层脉络膜萎缩变薄、脉络膜血管高通透性[19]。这类玻璃膜疣常在CSC、肥厚型脉络膜新生血管病变(pachychoroid neovasculopathy,PNV)及PCV患者中出现,在FFA、眼底自发荧光(fundus autofluorescence, FAF)及ICGA的晚期均呈现高荧光[20]。有研究指出肥厚型玻璃膜疣与脉络膜新生血管(choroidal neovascularization, CNV)的发展密切相关[21],对PCV及CSC具有预测作用[22],但关于这类玻璃膜疣究竟是PSD的亚型还是预测因素仍需要更多研究来证实[23]。
2.5继发性脉络膜新生血管的特点PSD发生CNV的机制尚不明确,但目前认为CNV与CC层萎缩及BrM慢性机械性破坏所致的缺血有关[24]。CNV通常根据其相对于RPE的解剖位置进行分类,PSD易发生1型或2型CNV[25]。在OCTA的enface图像上CNV可表现为“海扇”“美杜莎”“枯树状”“网格样”及“混合型”等形态,根据其生长方式可表现为对称生长、不对称生长、指状突起及囊内生长[26-28]。
3 肥厚型脉络膜谱系疾病中各型的影像学特点
3.1脉络膜增厚性色素上皮病变PPE主要表现为后极部脉络膜增厚及对应区域RPE改变(图1),在Warrow等[1]的研究中显示SFCT在231~625μm不等,常无临床症状,因而难以早期发现。既可表现为斑驳的低自发荧光,也可表现为类似于视网膜营养不良及视网膜色素上皮炎的高自发荧光,这可能与RPE功能受损及萎缩的程度有关。OCT上表现RPE改变或小的不规则色素上皮层脱离,不伴视网膜下积液[1]。患者因此易被误诊为萎缩型ARMD,但RPE脱离的区域伴随着脉络膜增厚及脉络膜血管管腔增大,可与之相鉴别。在ICGA上早期无异常,晚期可出现局灶性高荧光,局限性脉络膜血管高通透性和脉络膜血管扩张[15]。一些单侧CSC患者对侧眼合并PPE,甚至可能出现CNV,这表明PPE可能进一步发展为CSC、PNV等疾病[29]。OCTA上表现为CC层低血流区域增大,高低灌注变异率高[30],血流密度降低,可能因此引发RPE功能异常,进而视网膜的外核层变薄[18,31]。
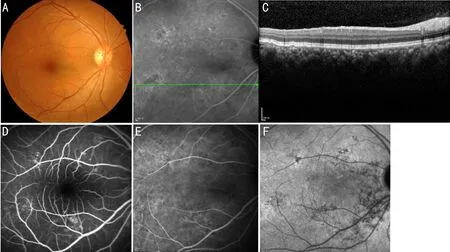
图1 PPE患眼眼底影像
3.2中心性浆液性脉络膜视网膜病变CSC以黄斑区特发性浆液性脱离为主要特征(图2),根据病程长短分为急性(<6mo)及慢性(>6mo)。在急性期,OCT上见黄斑区视网膜下液(subretinal fluid, SRF),可伴RPE浆液性脱离(pigment epithelial detachment, PED)[32],在慢性期,除前述特点外还表现为较浅且广泛PED。FAF上常表现为与视网膜下积液相对应的低自发荧光[7]。FFA表现为一处或多处的“墨迹样”及“蘑菇云样”的渗漏。在ICGA上表现为脉络膜血管充盈延迟及点状强荧光斑点,对应的OCTA上可观察到CC层表现为粗颗粒状的血流高、低信号影[13,33],在疾病活动期及慢性CSC中表现尤甚[34-35]。这些表现提示CC层血流灌注降低进而影响RPE功能,引起外层视网膜血供减少,这可能是促使CSC发生发展的因素之一。慢性CSC常伴随CNV的出现,进一步发展为PNV[36],甚至在晚期转化为PCV[37]。研究发现继发CNV的CSC患者脉络膜血流密度更低[26,38],随着脉络膜缺血时间延长,缺血程度加深将引发疾病的进展。近年来发现二氢睾酮合成抑制剂、盐皮质激素拮抗剂在内的全身性药物治疗有效[39],提示其发病可能与相关受体高敏感性有关。
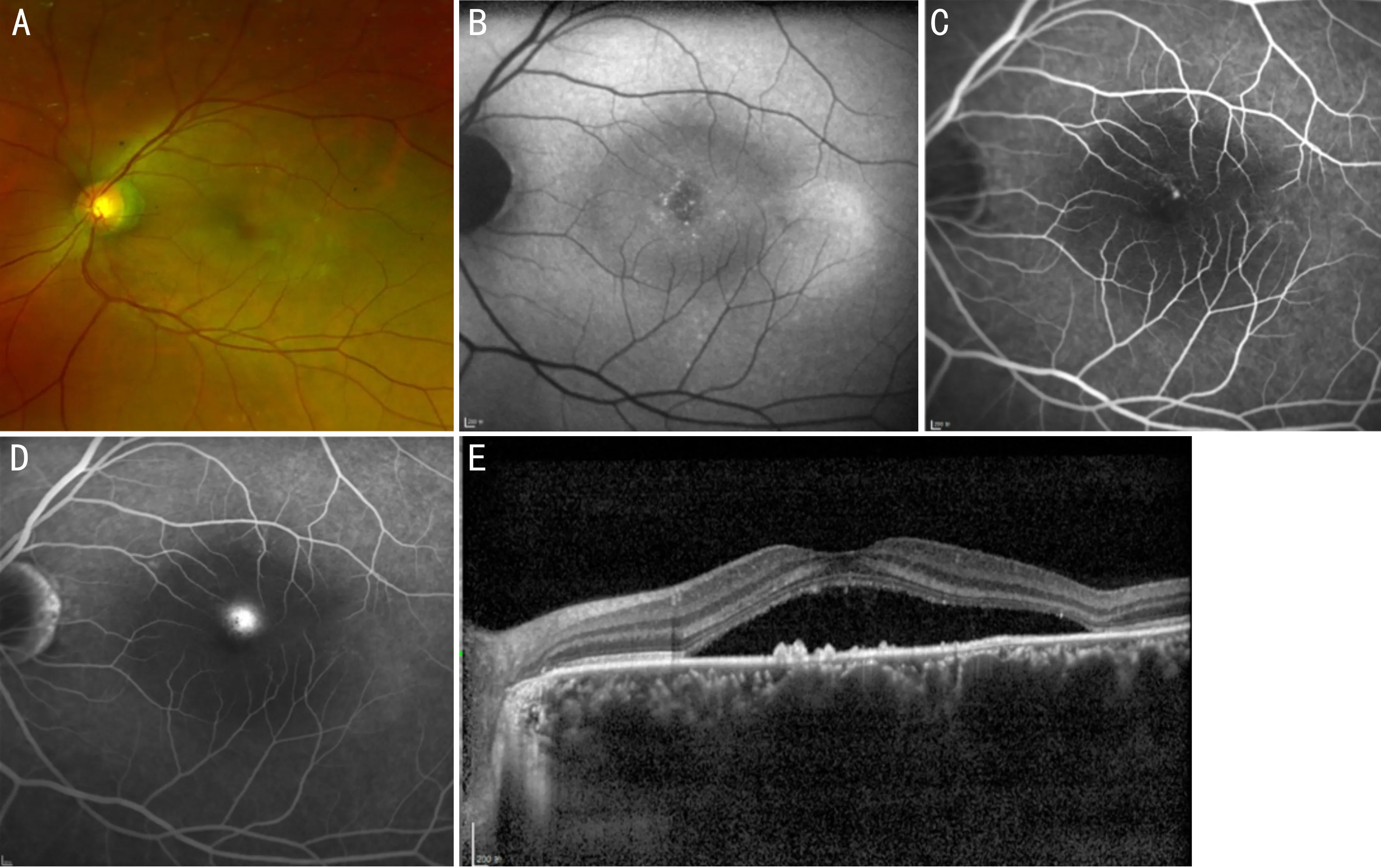
图2 CSC患眼眼底影像
3.3肥厚型脉络膜新生血管病变2015年Pang和Freund[40]首次描述了PNV(图3),目前报道的病例均为中老年人,其特征是1型CNV下方可见增厚的脉络膜和扩张的脉络膜血管[40]。PNV与湿性ARMD的区别在于存在厚玻璃膜疣、脉络膜增厚和发病年龄更早,这些均提示其病因可能不同[29]。在OCT上表现为RPE与BrM浅而不规则的分离,多数在RPE下呈不均匀的高反射,少数呈均匀低反射[26];FAF上与病灶对应区域呈现为周围环绕高自发荧光的点状低自发荧光[7]。在FFA和ICGA上均可见RPE萎缩所致的透见荧光及新生血管的荧光渗漏。OCTA常表现为RPE和BrM之间混杂的血流信号,且能在PED处通常能清晰地观察到CNV的形态[26,38,41]。PNV可能是PPE和慢性CSC患者的晚期并发症[36,42],并且可能进展为PCV[43]。抗VEGF单药治疗对于PNV的疗效湿性ARMD更好[44],对于一些难治的PNV病例联合光动力疗法(photodynamic therapy, PDT)治疗可有明显改善[45]。
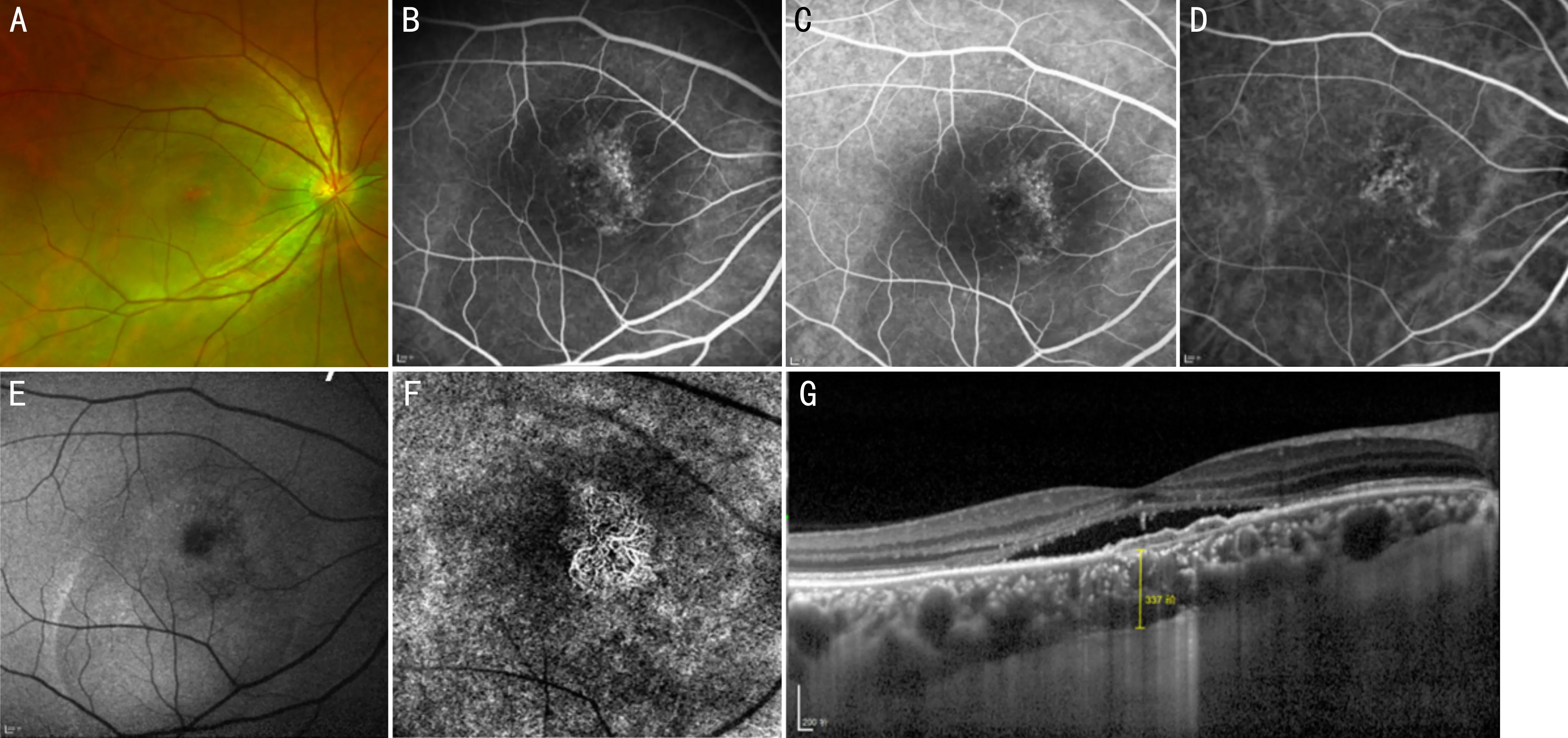
图3 PNV患眼眼底影像
3.4息肉样脉络膜血管病变/动脉瘤样1型新生血管1990年Yannuzzi等[46]首次描述了PCV,多见于50岁以上的亚洲人群,患者多表现为视力下降,是一种以脉络膜异常分支血管网及其末梢的息肉样脉络膜血管扩张为主要特征的疾病(图4)。眼底表现为橘红色病灶,以1型脉络膜新生血管为主要特征,在OCT上常见RPE或视网膜下出血/积液,“双层征”及“息肉样病灶”。研究发现部分PCV脉络膜变薄,类似于湿性ARMD[47],这说明PSD进展至后期,由于脉络膜长期缺血,最终脉络膜可能整体萎缩变薄,但需相关研究进一步验证。在ICGA上见脉络膜异常分支血管网(branching vascular network, BVN)及呈搏动样充盈的结节状血管扩张病灶,周围呈低荧光[48]。目前OCTA检测新生血管的阳性率较ICGA高,且对于病变范围呈像更清晰、立体,但对于末端囊袋样扩张显示不足,无法观察到渗漏及病灶动态发展过程[49]。在OCTA上可见与ICGA上息肉样病灶相对应的结节状或簇状强血流信号[50],可呈“灌木状”“丛状”[51]。根据CNV在OCTA上的形态将BVN分为1型枯树状(视力预后最差)、2型网格状、3型杆状(视力预后最好)[52],也有研究显示BVN的形态与治疗后的视力预后无明显相关性[53]。在FAF上表现为对应息肉样病灶及BVN的弱荧光[54]。厚脉络膜型PCV较薄脉络膜型PCV对治疗更敏感,且弥漫性血管扩张型较局灶性血管扩张型对治疗更敏感[55],这可能与疾病进展的程度相关。
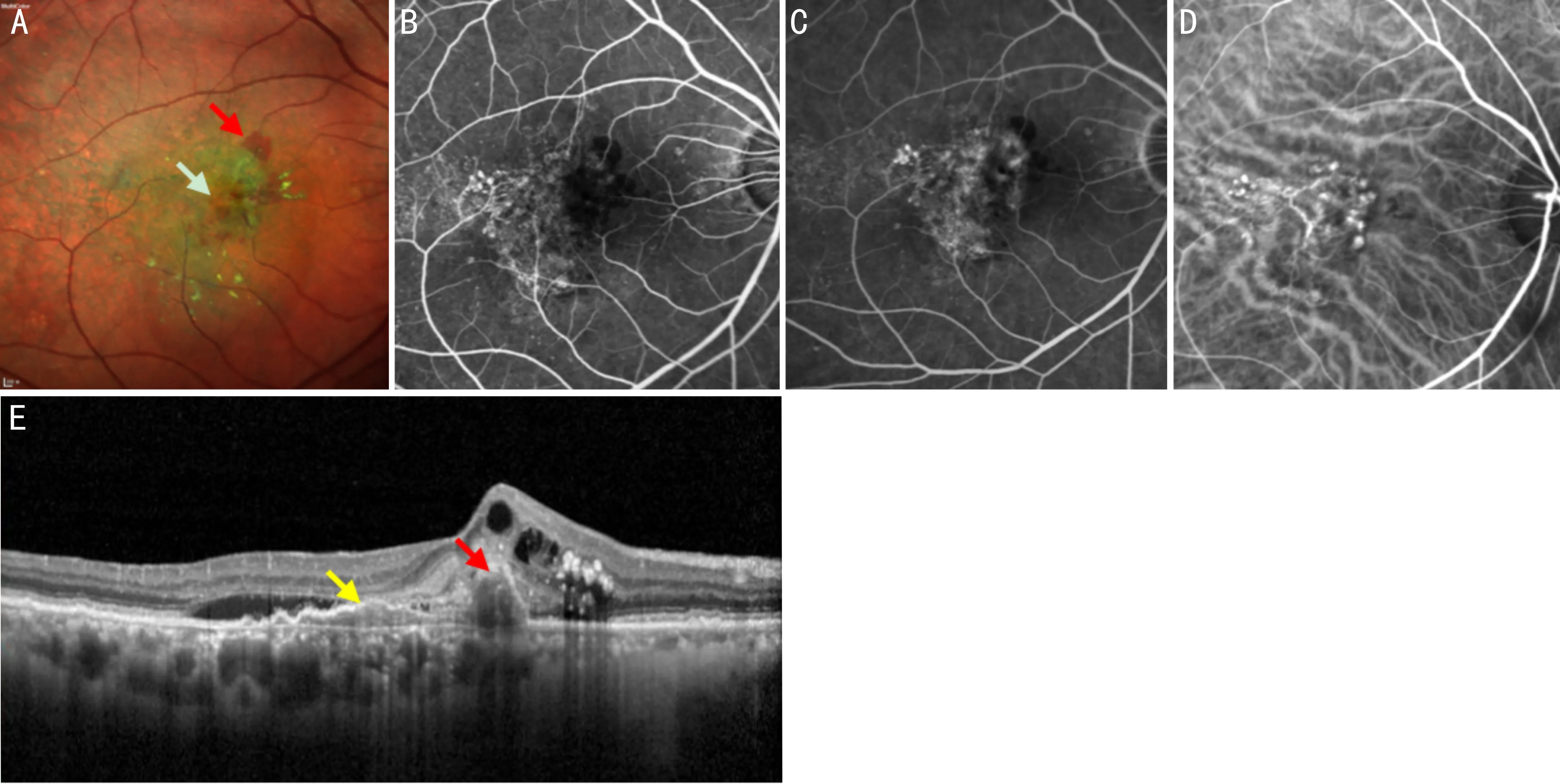
图4 PCV患眼眼底影像
3.5局灶性脉络膜凹陷2006年Jampol等[56]用SD-OCT首次描述了“单侧脉络膜凹陷”,在2011年Margolis等[57]将这类疾病命名为“局灶性脉络膜凹陷(focal choroidal excavation, FCE)”,该病表现为局部脉络膜增厚及凹陷(图5),分为椭圆体带(ellipsoid zone, EZ)与RPE相贴的贴附型及二者分离的非贴附型,这两种类型间可随眼部疾病的活动性相互转化[58]。发病机制尚不明确,有学者认为是先天发育异常[59];但更多的学者认为该疾病与脉络膜骨瘤、多发性一过性白点综合征、多灶性脉络膜炎、Vogt-小柳原田综合征等疾病有关[60-63],推测可能是外层视网膜和内层脉络膜的损伤以及机械干扰脉络膜压力平衡所致[64]。OCT上可见病灶处点状中高反射信号,外界膜和EZ存在不同程度的破坏,可能是炎症导致光感受器细胞等结构的损伤[65]。眼底可无异常,也可表现为病灶处色素脱失或少量黄白色斑点,在FAF上呈现出RPE萎缩所致的局灶性低荧光。FFA上多表现为早期局灶性强荧光,造影期间随背景荧光而改变,晚期荧光强度部分消退;部分FCE造影期间病灶呈现均质强荧光,形态大小不变[63],这些差异可能与外界膜及EZ的完整性相关。ICGA上多表现为病灶处持续低荧光,少数表现为点状高荧光,与病灶处缺血程度相关[66]。在PCV、ARMD和CSC中均不同比例地合并有FCE[67],且FCE可继发CNV[68],这提示FCE可能是PCV、CSC的临床前期,也可能是并发表现,仍需相关研究进一步明确。
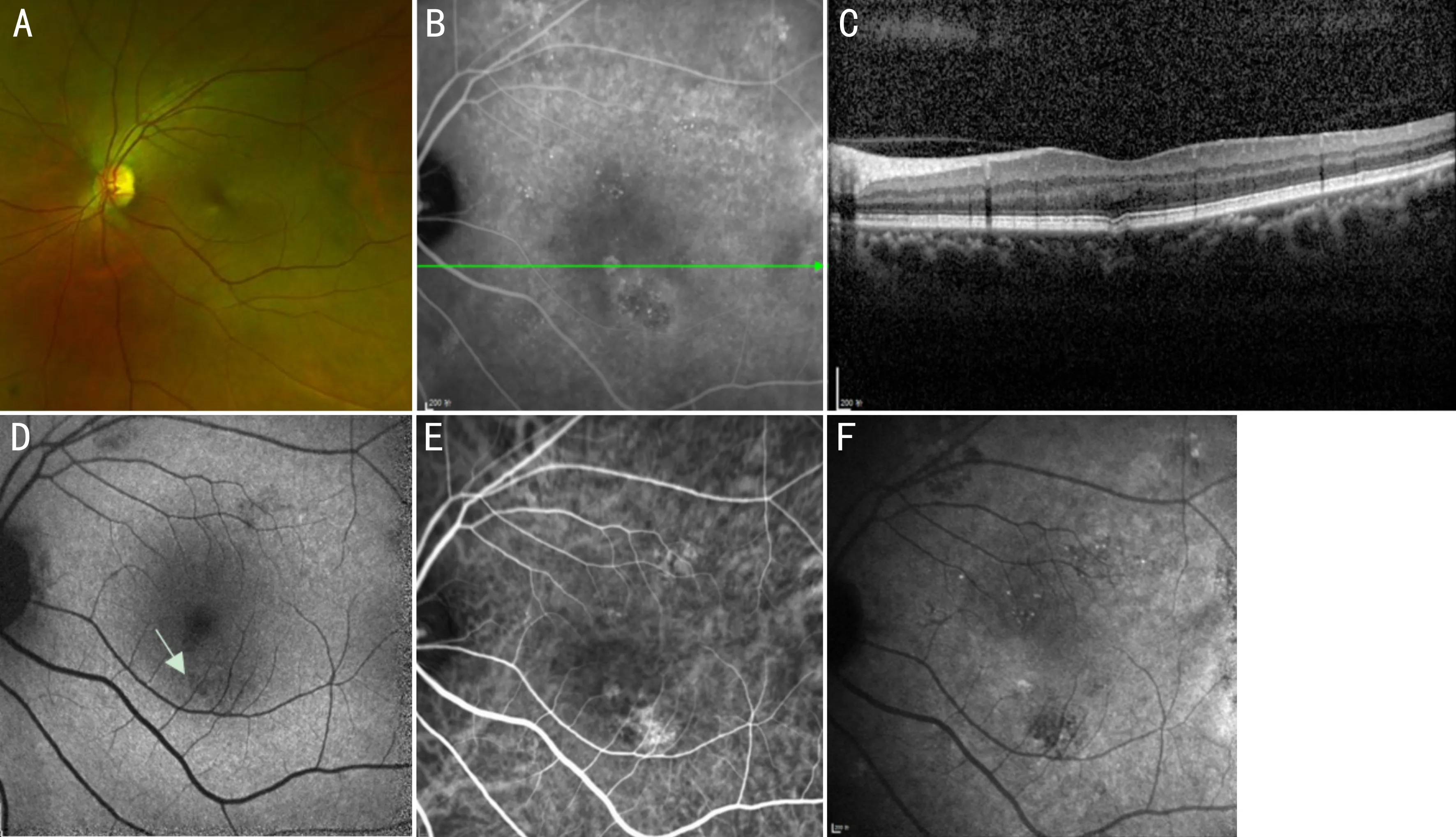
图5 FCE患者眼底影像
3.6视盘周围毛细血管脉络膜肥厚综合征视盘周围毛细血管脉络膜肥厚综合征(peripapillary pachychoroid syndrome, PPS)是近年来由Phasukkijwatana等[9]命名的一种疾病,主要表现为脉络膜皱褶、短眼轴及远视,多见于老年男性。在OCT上主要表现为视盘周围区域脉络膜增厚、视盘周围脉络膜最厚、视网膜内或视网膜下积液。视盘旁脉络膜充血可导致高静水压,压迫视神经致视盘水肿,同时视网膜外层及RPE也可能受损[69]。FAF表现为视盘旁斑驳的低自发荧光;FFA表现为晚期斑驳状强荧光及视盘旁荧光着染;ICGA表现为视盘旁脉络膜血管扩张及渗漏;目前尚缺乏关于OCTA对该疾病的研究。尚不清楚该病是否会进展为其他形式的PSD,但在PCV患者中偶可发现合并PPS[9],提示其可能进展为PCV。图6为PPS患眼影像特征。
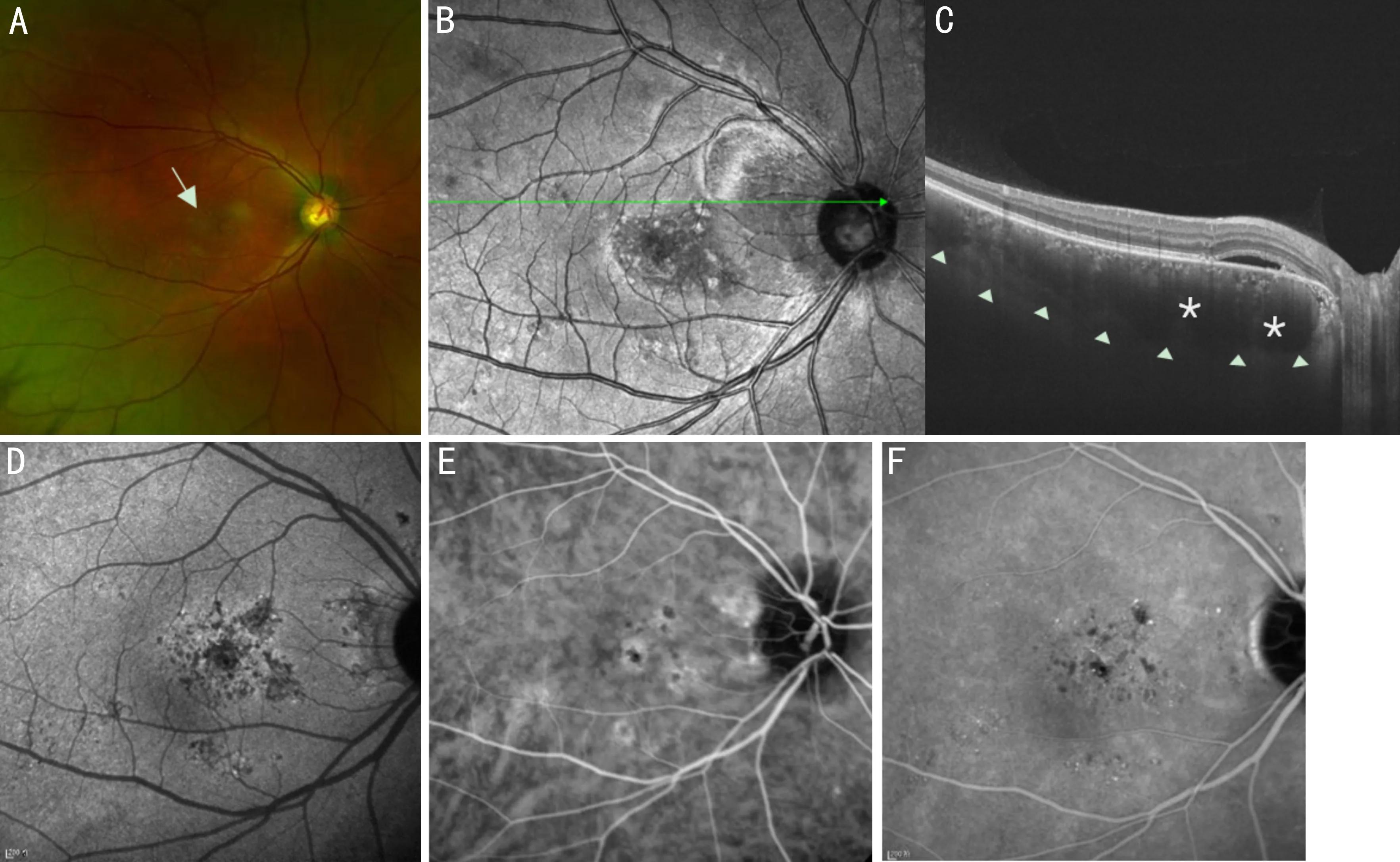
图6 PPS患眼眼底影像
上述肥厚型脉络膜谱系疾病中各疾病的影像学特点汇总,见表1。
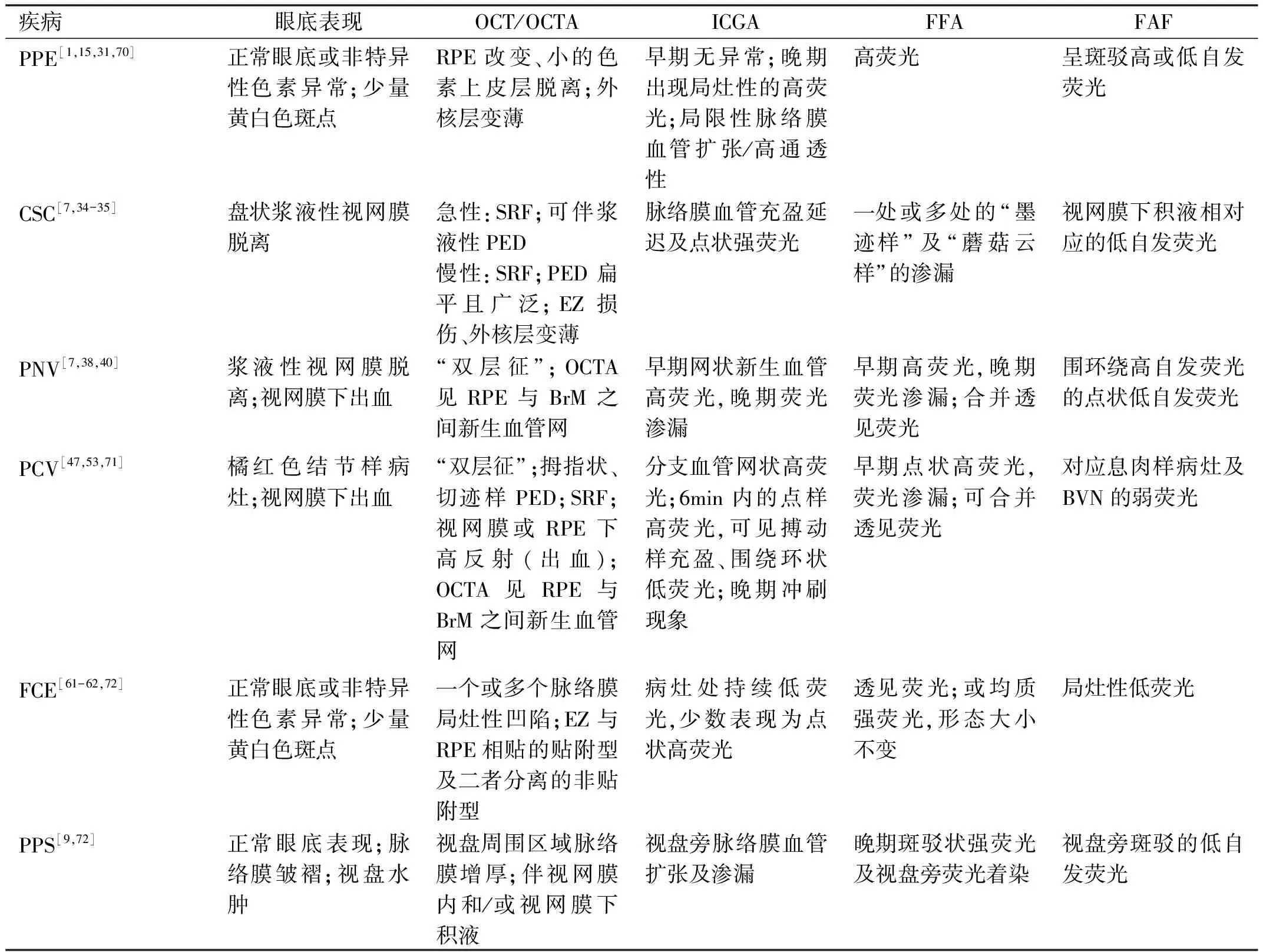
表1 肥厚型脉络膜谱系疾病中各疾病的影像学特点汇总表
4 目前对发病机制的认识
目前PSD病因尚不明确。普遍认为Haller层扩张增厚,引发静脉静水压升高,继而机械性压迫Sattler层及CC层,CC层萎缩缺血引发RPE-BrM复合体受损,最终导致RPE屏障功能异常及新生血管形成。因此提出了PSD各疾病为同一疾病不同发展阶段的假说。PPE可能随着时间推移进展为CSC、PNV[6,40-41,73];PPE及CSC均可进展为PNV,最终进展成PCV[74],推测PPE、PPS、CSC、PNV、FCE均有可能进一步进展为PCV,若能对这些患者进行终身随访,应用多模影像记录患者疾病进展过程,将有助于揭示PSD的发病机制。
此外,有研究表明刺激脉络膜的盐皮质激素受体(mineralocorticoid receptor, MR)会使脉络膜充血增厚,这种作用亦可被MR拮抗剂逆转,MR拮抗剂依普利酮对CSC有效[75],推测MR的过度表达或敏感性升高可能是PSD疾病的始动病因之一。CNV的发生可能是脉络膜缺血及炎症反应使得内层脉络膜结构受损,VEGF表达升高所致。在遗传学方面,近期研究发现CFH及VIPR2是脉络膜增厚及CSC发生的易感等位基因[76],有CFH和ARMS2 ARMD风险等位基因的患者中,CSC也更倾向于发展为PNV,ARMS2和CFH的遗传变异同时增加了PCV的风险[77]。这提示厚脉络膜驱动的病理改变存在着遗传因素的影响。此外,最近的研究显示,视网膜基因表达及炎症调节与节律相关[78],尽管脉络膜的血流与节律紊乱相关性仍有争议,脉络膜的炎症及血流调控基因表达也有待进一步研究证实。
5 展望
由于缺乏可及性高、可重复性强的动物模型,对疾病发生发展过程的研究存在巨大的困难,且缺乏对疾病的大规模连续随访的队列数据,目前仍缺乏直接证据证明上述假说。因此早期发现疾病,建立长期随访的队列研究,探索发病机制和阐明导致非新生血管性脉络膜病(PPE、CSC、FCE和PPS)向新生血管性脉络膜疾病(PNV和PCV)发展的病理生理学机制对寻找有效的治疗方法具有重要意义。多模态、非侵入性的眼底成像技术的不断迭代,提高设备的探及深度、分辨率,将大大易化眼底影像数据采集,为长期随访的疾病队列奠定基础。此外,随着人工智能(artificial intelligence,AI)及各种影像数据处理算法不断发展,近年来应用于厚脉络膜疾病的识别、诊断及分型的人工智能模型均具有较高的准确性[79-80]。通过将呈现分层血流的OCTA、记录动态血流变化的FFA及ICGA及反映RPE脂褐质代谢水平的FAF等多模态眼底成像技术,与AI算法结合,以实现对视网膜及脉络膜血流的高分辨率三维重建,为揭示PSD发生发展机制提供全新的手段,为疾病的临床诊治提供检查及随访工具,同时为预后预测及指导治疗的相关影像生物标记物的提出提供技术支撑,将更加全面地评估PSD病变严重程度,并指导选择最优的治疗方案并评估疗效。

