高脂低碳水化合物饮食对COPD急性加重期老年患者疗效及糖代谢、脂代谢的影响*
于婵 张林芳 张籍方 杨慧玲 习志洁 吴祖骄 谭政
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)急性加重期主要表现为呼吸道症状加重,规范治疗可以有效控制症状、延缓疾病发展[1]。相关研究发现,COPD 急性加重期会引发患者全身性症状如食欲下降,进而造成机体营养不良,间接影响呼吸肌结构和功能,从而致使通气功能障碍,对患者日常生活产生严重影响,因此,COPD 急性加重期患者住院期间还应接受营养支持[2]。既往临床多着重于供给热量和蛋白质,忽略了因糖类供给过多,增加肺部通气负荷,引发呼吸衰竭等并发症,而高脂低碳水化合物饮食可有效控制糖类摄取,并相应提高脂类摄入,以达到改善营养不良的目的[3]。此外,在三大营养素中,碳水化合物的呼吸商最高,作为能量的主要来源,摄入过多的碳水化合物会消耗大量氧气,并产生大量二氧化碳,从而增加通气负担,故低碳水化合物饮食更有助于改善患者呼吸功能,缓解病情[4]。基于此,本研究旨在探讨高脂低碳水化合物饮食对COPD 急性加重期老年患者疗效及糖代谢、脂代谢的影响,现报道如下。
1 资料与方法
1.1 一般资料
依据随机数字表法将2021 年1 月—2022 年1 月成都市第八人民医院收治的80 例COPD 急性加重期老年患者分为对照组(n=40)和观察组(n=40)。纳入标准:(1)与文献[5]《慢性阻塞性肺疾病基层诊疗指南(2018 年)》中的有关诊断标准相符;(2)未使用降脂、调脂药物;(3)无心理、精神障碍,能配合完成研究。排除标准:(1)无法经口进食或消化吸收不良;(2)合并严重肝肾疾病;(3)近期接受过免疫增强抑制剂、糖皮质激素等药物治疗。所有患者均知情同意。本研究获得本院医学伦理委员会的批准。
1.2 方法
两组均采取吸氧、抗感染、解痉平喘、化痰、纠正酸碱失衡及电解质紊乱等常规治疗。对照组接受常规饮食干预,三大营养素比例为碳水化合物︰脂肪︰蛋白质=55︰27︰18。观察组接受高脂低碳水化合物饮食干预,三大营养素比例为碳水化合物∶脂肪︰蛋白质=32︰50︰18。患者依据自身饮食偏好选择食物,营养师按营养素摄入比例制订具体食谱和食量,碳水化合物类食物:谷薯、水果、蔬菜等;蛋白质类食物:蛋、鱼、瘦肉、豆乳类等;脂肪类食物:油脂类、肉类等。餐食由医院食堂统一派送,两组均连续干预3 个月。
1.3 观察指标及判定标准
(1)营养指标。分别于治疗前后抽取两组5 mL空腹静脉血,运用全自动生化分析仪(美国贝克曼库尔特有限公司,AU5811 型)测定总蛋白(total protein,TP)、白 蛋 白(albumin,ALB)、前 白 蛋白(prealbumin,PAB)水平。(2)糖代谢及脂代谢指标。分别于治疗前后抽取两组5 mL 空腹静脉血,运用血糖分析仪(德国EKF 诊断公司,BIOSEN 5030 型) 测 定 空 腹 血 糖(fasting blood glucose,FBG)水平,运用糖化血红蛋白仪(美国Bio-Rad 伯乐,D-10 型)测定糖化血红蛋白(glycated hemoglobin,HbA1c)水平,运用全自动生化分析仪测定总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)、高 密 度 脂蛋 白 胆 固 醇(high-density lipoprotein cholesterol,HDL-C)水平。(3)血气指标。分别于治疗前后采集两组空腹动脉血5 mL,运用动脉血气分析仪(北京普朗医疗设备有限公司,PL 2200 型)测定动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、血氧饱和度(SaO2)水平。(4)肺功能。分别于治疗前后采用肺功能仪(北京麦邦光电仪器有限公司,MSA 99 型)测定两组用力肺活量(forced vital capacity,FVC)、第1 秒用力呼气容积(forced expiratory volume in one second,FEV1)、 一 秒 率(FEV1/FVC)。
1.4 统计学处理
使用SPSS 24.0 软件分析处理数据,计数资料用率(%)表示,比较用χ2检验;计量资料用(±s)表示,组间比较采用独立样本t 检验,组内比较采用配对t 检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 基线资料
两组基线资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组基线资料比较
2.2 营养指标
治疗前,两组血清TP、ALB、PAB 水平对比,差异均无统计学意义(P>0.05);治疗后,两组各项营养指标均高于治疗前,且观察组均高于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组营养指标比较(±s)

表2 两组营养指标比较(±s)
*与本组治疗前比较,P<0.05。
组别 TP(g/L)ALB(g/L)PAB(mg/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 57.60±3.43 60.13±3.76* 31.44±2.02 35.81±2.23* 253.76±17.64 320.84±20.67*观察组(n=40) 57.63±3.27 65.76±4.19* 31.37±2.05 38.47±2.31* 254.31±17.68 376.88±23.37*t 值 0.040 6.325 0.154 5.240 0.139 11.360 P 值 0.968 0.000 0.878 0.000 0.890 0.000
2.3 糖代谢及脂代谢
治疗前,两组FBG、HbA1c、TC、TG、LDL-C、HDL-C 水平对比,差异均无统计学意义(P>0.05);治疗后,两组FBG、HbA1c、TC、TG、LDL-C 水平较治疗前均下降,HDL-C 水平均上升,且观察组均优于对照组,差异均有统计学意义(P<0.05)。见表3。
表3 两组糖代谢及脂代谢比较(±s)
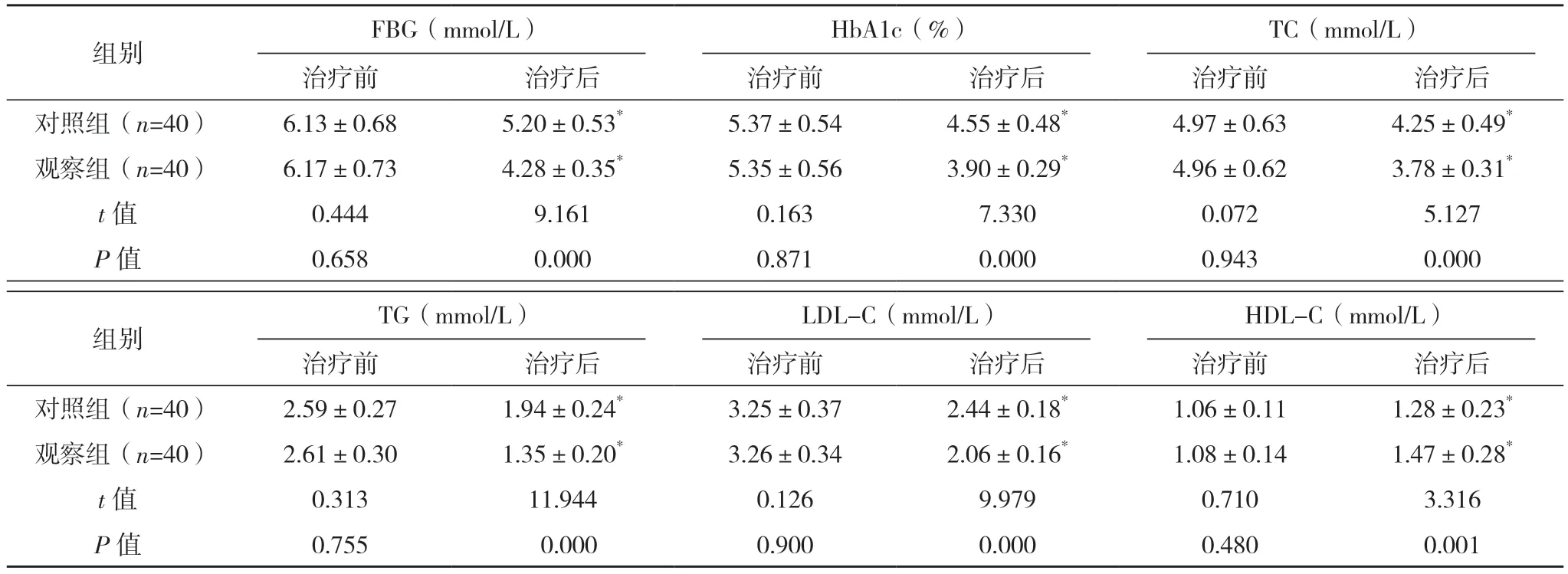
表3 两组糖代谢及脂代谢比较(±s)
*与本组治疗前比较,P<0.05。
组别 FBG(mmol/L)HbA1c(%)TC(mmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 6.13±0.68 5.20±0.53* 5.37±0.54 4.55±0.48* 4.97±0.63 4.25±0.49*观察组(n=40) 6.17±0.73 4.28±0.35* 5.35±0.56 3.90±0.29* 4.96±0.62 3.78±0.31*t 值 0.444 9.161 0.163 7.330 0.072 5.127 P 值 0.658 0.000 0.871 0.000 0.943 0.000组别 TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 2.59±0.27 1.94±0.24* 3.25±0.37 2.44±0.18* 1.06±0.11 1.28±0.23*观察组(n=40) 2.61±0.30 1.35±0.20* 3.26±0.34 2.06±0.16* 1.08±0.14 1.47±0.28*t 值 0.313 11.944 0.126 9.979 0.710 3.316 P 值 0.755 0.000 0.900 0.000 0.480 0.001
2.4 血气指标
治疗前,两组PaO2、PaCO2、SaO2水平对比,差异均无统计学意义(P>0.05);治疗后,两组PaO2、SaO2水平较治疗前均上升,PaCO2水平均下降,且观察组均优于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组血气指标比较(±s)

表4 两组血气指标比较(±s)
*与本组治疗前比较,P<0.05。
组别 PaO2(mmHg)PaCO2(mmHg)SaO2(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 56.14±8.35 67.22±9.34* 57.12±7.22 48.06±5.38* 87.44±5.62 93.53±2.48*观察组(n=40) 56.23±8.28 78.37±10.25* 57.20±7.25 41.22±4.27* 87.42±5.59 97.65±2.24*t 值 0.048 5.085 0.049 6.298 0.016 7.797 P 值 0.962 0.000 0.961 0.000 0.987 0.000
2.5 肺功能
治疗前,两组FVC、FEV1、FEV1/FVC 水平对比,差异均无统计学意义(P>0.05);治疗后,两组各项肺功能指标较治疗前均显著改善,且观察组均优于对照组,差异均有统计学意义(P<0.05)。见表5。
表5 两组肺功能比较(±s)
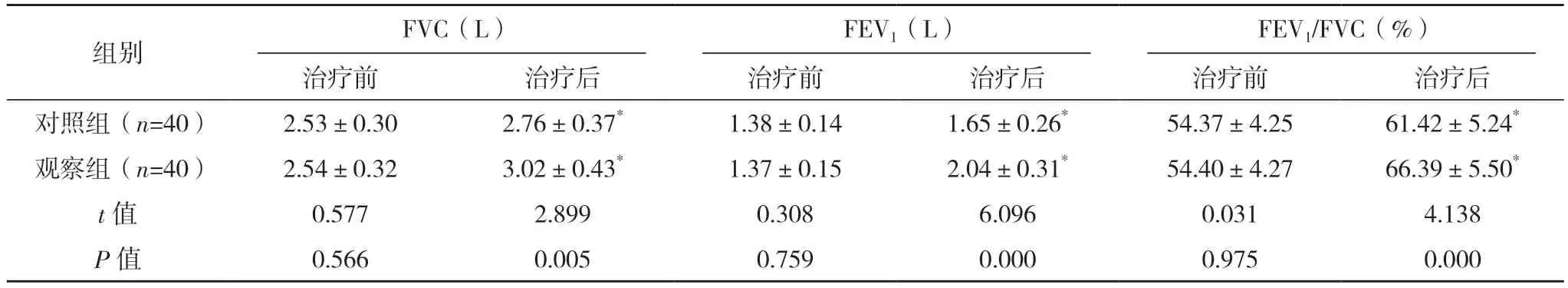
表5 两组肺功能比较(±s)
*与本组治疗前比较,P<0.05。
组别 FVC(L)FEV1(L)FEV1/FVC(%)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=40) 2.53±0.30 2.76±0.37* 1.38±0.14 1.65±0.26* 54.37±4.25 61.42±5.24*观察组(n=40) 2.54±0.32 3.02±0.43* 1.37±0.15 2.04±0.31* 54.40±4.27 66.39±5.50*t 值 0.577 2.899 0.308 6.096 0.031 4.138 P 值 0.566 0.005 0.759 0.000 0.975 0.000
3 讨论
COPD 急性加重期属于呼吸系统危重症,该类患者年龄大、基础病多,且病程迁延,后期多伴有严重营养不良,容易因肌肉能量缺乏引起呼吸功能急速衰退,通常需要呼吸机辅助通气,生活质量不高[6]。因此,应尽早实施营养干预,以提高患者机体免疫力,改善预后效果。
早期常规营养支持下,医师主要关注的是蛋白质和能量方面,对脂肪、碳水化合物的关注较少,随着临床研究的深入,发现碳水化合物比例越高,越容易增加机体内二氧化碳生成,会进一步加重肺部通气负荷,不利于患者症状改善,同时还会促进胰岛素释放,加重病情进展[7-8]。因此,本研究选择高脂低碳水化合物饮食干预,适当补充以脂肪为主的饮食,减少碳水化合物含量,既减轻了肺部通气负担,还能抑制胰岛素释放,对于调节糖代谢及脂代谢、患者康复具有积极意义[9]。同时,适当限制碳水化合物摄入量,不仅能够维持机体基础能量代谢,而且有助于增强体质,提高活动耐力[10]。本研究结果显示,治疗后观察组各项营养指标、糖代谢及脂代谢水平均较对照组更优,说明COPD 急性加重期患者采取高脂低碳水化合物饮食干预不仅能够改善患者机体营养状态,还能调节糖代谢及脂代谢,与邹晓霞等[11]研究结果相似。
血气指标主要反映机体是否存在酸碱失衡及缺氧状况,肺功能检查多用来判断气流受限情况,大部分COPD 患者在患病期间机体抵抗力下降,致使肺部感染反复发生,加重肺功能损伤;并且,COPD 急性加重期患者由于气道阻力过大,活动时氧耗量大幅增加,更容易进入缺氧状态,仅仅使用抗生素、解痉平喘类药物并不能有效缓解[12]。由于COPD 属于慢性消耗性疾病,需要高热量饮食补充能量,但碳水化合物过高可使体内二氧化碳产生增多,加速体内二氧化碳潴留,增加呼吸道感染风险[13]。本研究结果显示,治疗后观察组各项血气指标及肺功能水平均较对照组更优,说明COPD 急性加重期患者采取高脂低碳水化合物饮食干预具有显著疗效,能够促进患者呼吸功能恢复。分析其原因在于,高脂低碳水化合物饮食干预能够加快蛋白质合成,从而增强患者呼吸肌收缩力,通过减少体内二氧化碳潴留能有效改善患者每分通气量、降低碳生成量及氧耗量,从而恢复患者呼吸功能,缓解呼吸衰竭症状[14-15]。
此外,由于我国居民饮食主要以碳水化合物为主,许多老年患者对低碳水化合物饮食无法快速适应,初期可能会伴随饥饿感,故在临床实践中,还应鼓励患者餐前饮水、细嚼慢咽、餐后喝汤、适量加餐等增加饱腹感,多进食鱼、肉、蛋、蔬菜等补充蛋白质和脂肪[16-18]。值得注意的是,碳水化合物依然是人体不可缺失的重要营养素之一,COPD 患者千万不要完全放弃碳水化合物,应选择富含纤维素的碳水化合物,如小米、糙米、燕麦等,以保证营养供给,高脂饮食中应选择富含不饱和脂肪酸的植物油,如茶油、橄榄油等,避免食用过量的动物性脂肪,否则会增加心血管疾病风险[19-20]。
综上所述,COPD 急性加重期患者采取高脂低碳水化合物饮食干预具有显著疗效,不仅能够改善患者机体营养状态,还能调节糖代谢及脂代谢,并促进呼吸功能恢复。但本研究所选时间、样本量有限,关于高脂低碳水化合物饮食干预的长期效果尚需后续研究证实。

