晚期胃癌患者一线使用信迪利单抗联合SOX方案的疗效及疗效预测因子分析
阴明妹 冯江山 赵正 赵伟锋 王朝杰
胃癌(gastric cancer,GC)是常见的胃肠道恶性肿瘤,发病率居全球第5 名,全球每年死于胃癌的患者约有70 多万[1],我国胃癌发病率和死亡率在恶性肿瘤中均居第3 位[2]。一般胃癌确诊时已是中晚期,已错过最佳手术时机,目前化疗是晚期胃癌的主要治疗方式,替吉奥联合奥沙利铂(SOX)方案是常用的化疗方案,但易出现不良反应。CSCO指南推荐,原癌基因人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性晚期胃癌患者以氟尿嘧啶类药物联合铂类和紫杉类的化疗方案为一线治疗,但效果并不理想[3],而又缺乏相应靶向药物。有研究证明,免疫检查点抑制剂联合化疗在HER2 阴性晚期胃癌人群中获益显著[4]。信迪利单抗是我国上市的程序性死亡受体1(programmed death 1,PD-1)抗体,具有高稳定及高亲和力的特点,但在晚期胃癌的治疗中运用较少,缺乏有效数据。近几年,大量文献表明胃癌的预后与疗效预测因子密切相关。目前未有信迪利单抗联合SOX 方案用于治疗HER2 阴性晚期胃癌的相关研究,因此,本研究以河南省人民医院收治的43 例晚期胃癌患者为研究对象,分析信迪利单抗联合SOX 方案的疗效及安全性,并分析疗效预测因子与预后的相关性。
1 资料与方法
1.1 一般资料
回顾性分析2019 年5 月—2022 年5 月在本院一线治疗接受信迪利单抗联合SOX 方案的43 例HER2阴性晚期胃癌患者的临床资料,其中男32 例,女11 例,年龄33~74 岁,中位62(51,67)岁。纳入标准:(1)具有组织学确认的不适合手术治疗的HER2 阴性局部晚期或转移性胃癌;(2)根据免疫治疗实体瘤临床疗效评价标准(immunotherapy response evaluation criteria in solid tumor,iRECIST)[5],有至少1 个可测量或可评估病灶;(3)年龄≥18 岁且≤75 岁,性别不限;(4)预计生存时间>3 个月;(5)根据美国东部肿瘤协作组体力状态(eastern cooperative oncology group performance status,ECOG PS)评分为0~2 分;(6)接受信迪利单抗联合SOX 方案为一线治疗。排除标准:(1)既往接受化疗、靶向治疗或免疫治疗;(2)未经治疗的急性或者慢性活动性乙型肝炎或丙型肝炎感染;(3)妊娠期、哺乳期妇女,育龄期妇女及配偶拒绝采取有效的避孕方式避孕;(4)肿瘤明显侵及大动脉具有较高的出血或穿孔危险;(5)已知异体器官移植史和异体造血干细胞移植史;(6)并发自身免疫性疾病。本研究经本院医学伦理委员会批准。
1.2 方法
1.2.1 收集数据 本研究收集了43 例患者开始使用信迪利单抗联合治疗前2 周内的中性粒细胞与淋巴细胞比值(neutrophil-lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet-lymphocyte ratio,PLR)、预后营养指数(prognostic nutritional index,PNI)=淋巴细胞计数总值×5+血清白蛋白、乳酸脱氢酶(lactate dehydrogenase,LDH)及细胞程序性死亡-配体1(联合阳性分数)[programmed cell death-ligand 1(combined position score),PD-L1(CPS)]、治疗前ECOG PS 评分、肿瘤的分化程度、性别、年龄、免疫治疗不良反应等一般临床资料。
1.2.2 治疗方法 信迪利单抗[生产厂家:信达生物制药(苏州)有限公司,批准文号:国药准字S20180016,规格:10 mL︰100 mg],静脉注射标准剂量200 mg,每周期第1 天给药,联合使用SOX 方案:奥沙利铂(生产厂家:深圳海王药业有限公司,批准文号:国药准字H20031048,规格:20 mL︰40 mg),第1 天给药,130 mg/m2,加入250~500 mL 5%葡萄糖溶液,静脉滴注2 h;替吉奥(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20100135,规格:20 mg︰5.8 mg︰19.6 mg),第1~14 天给药,体表面积<1.25 m2,40 mg 口服,2 次/d,体表面积1.25~1.50 m2,50 mg 口服,2 次/d,体表面积>1.5 m2,60 mg 口服,2 次/d。1 个周期为21 d。
1.3 疗效与安全性评估
评估目标病灶患者的客观肿瘤反应,采用iRECIST 评定,包括完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。计算客观缓解率(overall response rate,ORR)=(CR+PR)例数/总例数×100%、疾病控制率(disease control rate,DCR)=(CR+PR+SD)例数/总例数×100%。从治疗开始到影像学进展或因胃癌死亡为无进展生存期(progression free survival,PFS)。从治疗开始到因胃癌死亡为总生存期(overall survival,OS)。并在第1 次信迪利单抗联合治疗后每隔4~8 周对肿瘤进行CT 或MRI 评估。在安全性分析方面,根据常见不良事件评价标准(common terminology criteria for adverse events,CTCAE)5.0 版记录使用信迪利单抗相关的不良事件并对其分级[6]。
1.4 随访
随访方式包括在本院系统查阅电子病历及电话随访,随访患者现在一般情况、疾病控制情况、不良反应及是否生存。随访截止时间为2022 年12 月31 日。
1.5 统计学处理
本研究采用SPSS 23.0 软件进行统计学分析。对基本特征数据采用描述性统计。生存分布采用Kaplan-Meier 法估算中位PFS 和中位OS,计算其中位数和双侧95%CI,并使用log-rank 检验进行比较,采用COX 单因素和多因素回归模型分析疗效预测因子对胃癌预后的影响,获得独立预测因子,以P<0.05 为差异有统计学意义。
2 结果
2.1 临床资料及疗效
根据患者的临床病理资料进行分组,部分患者未检测PD-L1(CPS)及LDH,故各纳入25 例及38 例,见表1。43 例HER2 阴性晚期胃癌患者,中位随访时间为15.2 个月,治疗周期为5(3,8)个周期,18 例患者死于癌症。根据iRECIST 的最佳肿瘤应答,未观察到CR,21 例达到PR,15 例达到SD,7 例 达 到PD,ORR 为48.84%(21/43),DCR为83.72%(36/43)。43 例患者的中位PFS 为8.6 个月[95%CI(7.916,9.284)], 中 位OS 为16.9 个月[95%CI(14.078,19.722)]。见图1。

图1 43例患者生存期的Kaplan-Meier曲线

表1 胃癌患者的临床病理资料
2.2 疗效预测因子生存期比较
2.2.1 分化程度生存分析 低分化组患者的中位PFS 为7.2 个 月[95%CI(4.821,9.579)], 中 高分 化 组 患 者 中 位PFS 为9.6 个 月[95%CI(7.513,11.687)],差异有统计学意义(P=0.033);低分化 组 患 者 的 中 位OS 为15.0 个 月[95%CI(4.698,25.302)],中高分化组的中位OS 为17.3 个月,差异无统计学意义(P=0.074)。见图2。
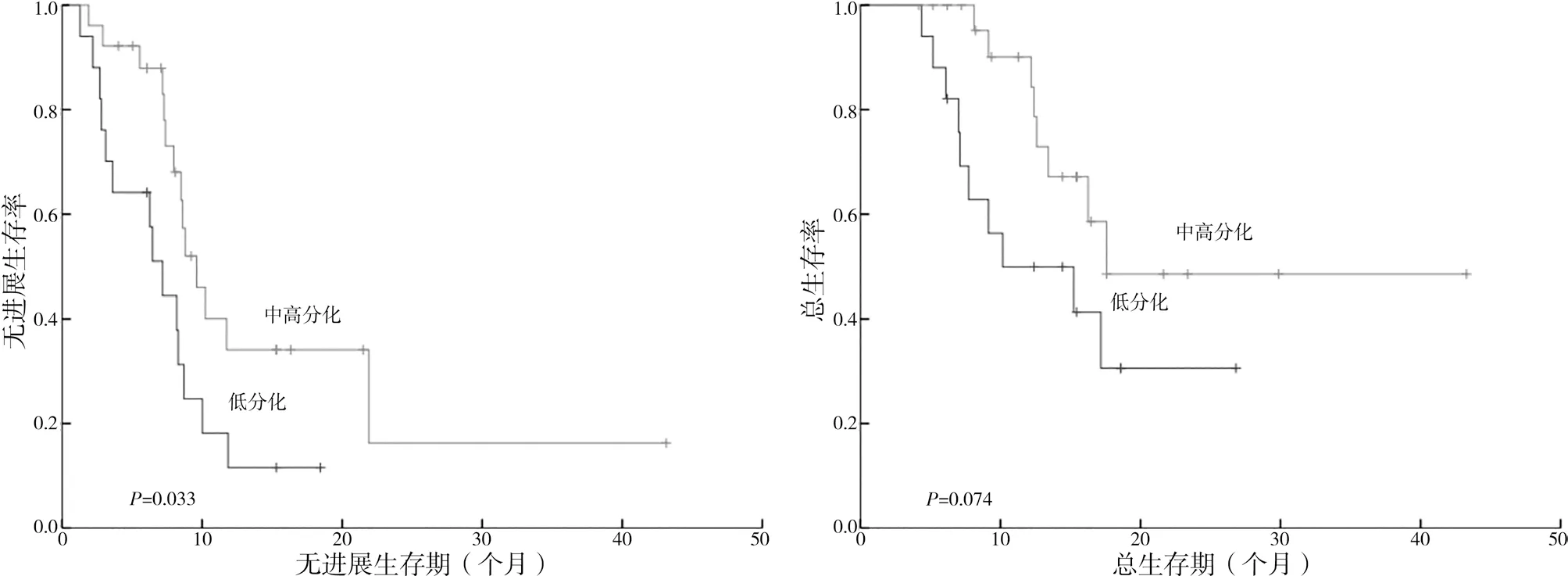
图2 中高分化组及低分化组患者的生存期的Kaplan-Meier曲线
2.2.2 LDH 表达生存分析 LDH 水平正常组与水平升高组患者的中位PFS 分别为8.7 个月[95%CI(8.274,9.126)]与6.5 个月[95%CI(5.167,7.833)],差异无统计学意义(P=0.065);LDH 水平正常组患者中位OS 为17.3 个月[95%CI(15.522,19.078)],
LDH 水平升高组患者中位OS 为9.0 个月[95%CI(0.828,17.172)],差异无统计学意义(P=0.071)。见图3。

图3 LDH正常水平组与LDH水平升高组患者的生存期的Kaplan-Meier曲线
2.2.3 PLR 表达生存分析 PLR<198.0 患者的中位PFS 为10.0 个 月[95%CI(8.067,11.933)],PLR≥198.0 患 者 的 中 位PFS 为7.3 个 月[95%CI(5.488,9.112)],差异有统计学意义(P=0.024);PLR<198.0 患者的中位OS 未达到,PLR≥198.0 患者的中位OS 为12.4 个月[95%CI(6.094,18.706)],差异有统计学意义(P=0.049)。见图4。

图4 PLR<198.0组与PLR≥198.0组患者的生存期的Kaplan-Meier曲线
2.2.4 NLR 表达生存分析 NLR<2.6 患者的中位PFS 为9.6 个 月[95%CI(7.650,11.550)],NLR≥2.6患者的中位PFS 为7.2 个月[95%CI(4.752,9.648)],差异无统计学意义(P=0.062);NLR<2.6 与NLR≥2.6患者的中位OS 分别为17.3 个月与13.2 个月[95%CI(5.891,20.509)],差异无统计学意义(P=0.134)。见图5。
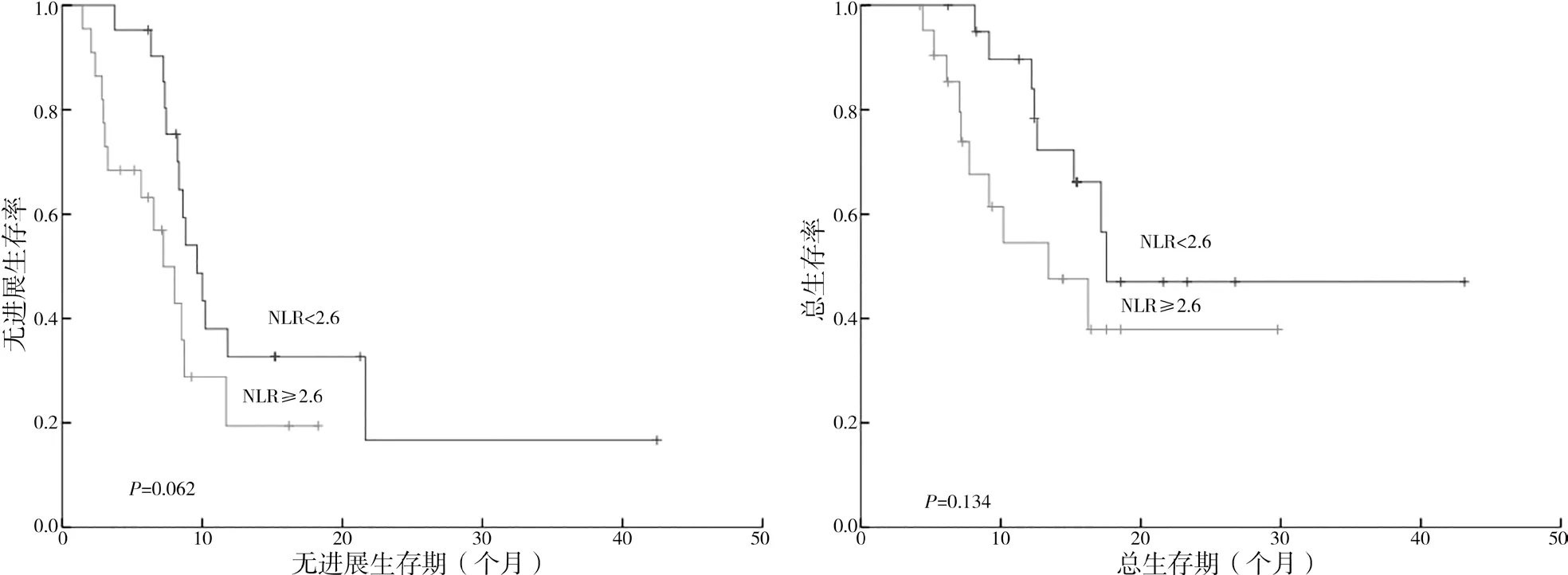
图5 NLR<2.6组与NLR≥2.6组患者的生存期的Kaplan-Meier曲线
2.2.5 PNI 表达生存分析 PNI<45.4 与PNI≥45.4患 者 的 中 位PFS 分 别 为8.2 个 月[95%CI(6.528,9.872)]与10.0 个 月[95%CI(5.637,14.363)],差异无统计学意义(P=0.066);PNI<45.4 患者的中位OS为12.4 个 月[95%CI(5.787,19.013)],PNI≥45.4 患者的中位OS 未达到,差异有统计学意义(P=0.038)。见图6。
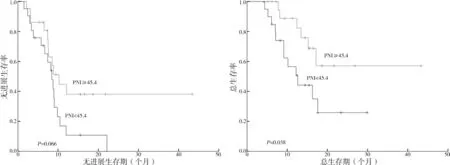
图6 PNI<45.4组与PNI≥45.4组患者的生存期的Kaplan-Meier曲线
2.2.6 PD-L1(CPS)表达生存分析 PD-L1(CPS)<5 与PD-L1(CPS)≥5 的患者中位PFS 分别为5.6个月[95%CI(0.000,11.541)]与10.0 个月[95%CI(6.963,13.037)],差异无统计学意义(P=0.072);PD-L1(CPS)<5 患者中位OS 为12.4 个月[95%CI(11.932,12.868)],PD-L1(CPS)≥5 的患者中位OS 未达到(P=0.032)。见图7。
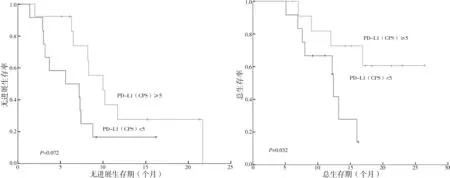
图7 PD-L1(CPS)<5组与PD-L1(CPS)≥5组患者的生存期的Kaplan-Meier曲线
2.2.7 ECOG PS 评分生存分析 ECOG PS 评分为0~1 分与2 分患者的中位PFS 分别为8.8 个月[95%CI(7.451,10.149)]与6.3 个月[95%CI(2.089,10.511)],差异有统计学意义(P=0.002);评分为0~1 分的患者的中位OS 为17.3 个月,ECOG PS 评分为2 分的患者的中位OS 为7.6 个月[95%CI(6.060,9.140)],差异有统计学意义(P=0.027)。见图8。
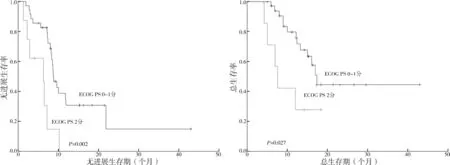
图8 ECOG PS评分为0~1分组与2分组患者的生存期的Kaplan-Meier曲线
2.3 COX 回归分析
单因素生存分析结果显示,PD-L1(CPS)、ECOG PS、PNI 与OS 有关(P<0.05);分化程度、ECOG PS、PLR 与PFS 有关(P<0.05)。多因素分析结果显示,PD-L1(CPS)、ECOG PS 是影响晚期胃癌患者OS 的独立因素(P<0.05),PLR、ECOG PS 是影响晚期胃癌患者PFS 的独立因素(P<0.05)。见表2、3。
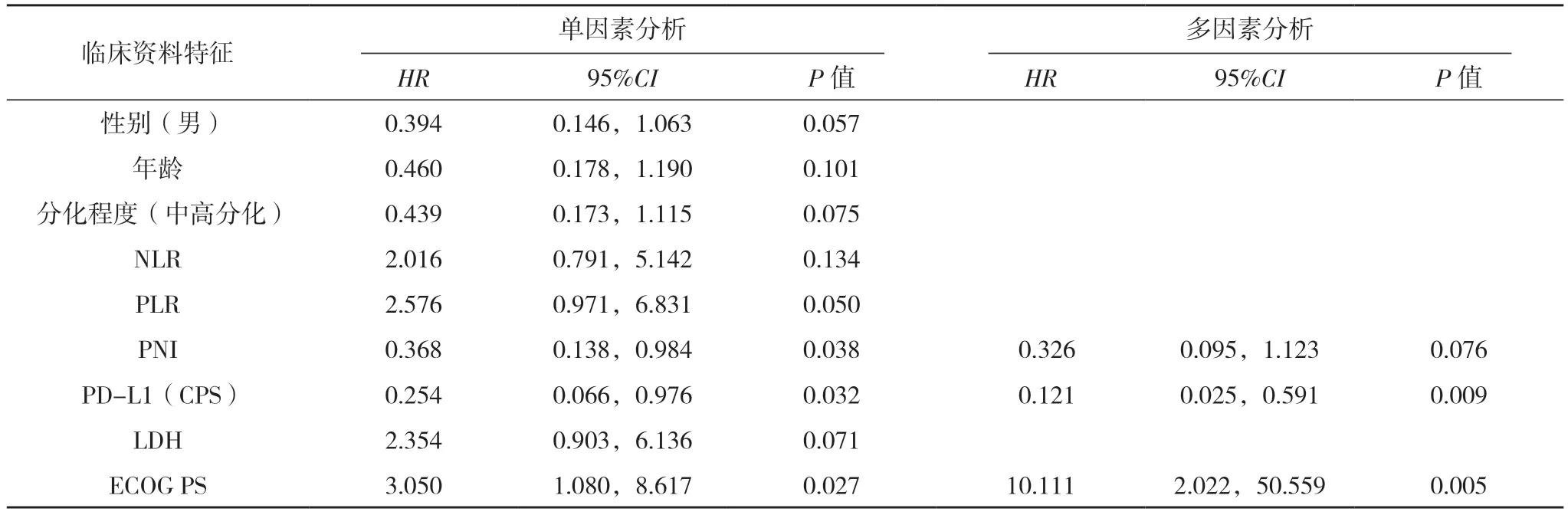
表2 影响晚期胃癌患者OS的单因素与多因素COX回归分析
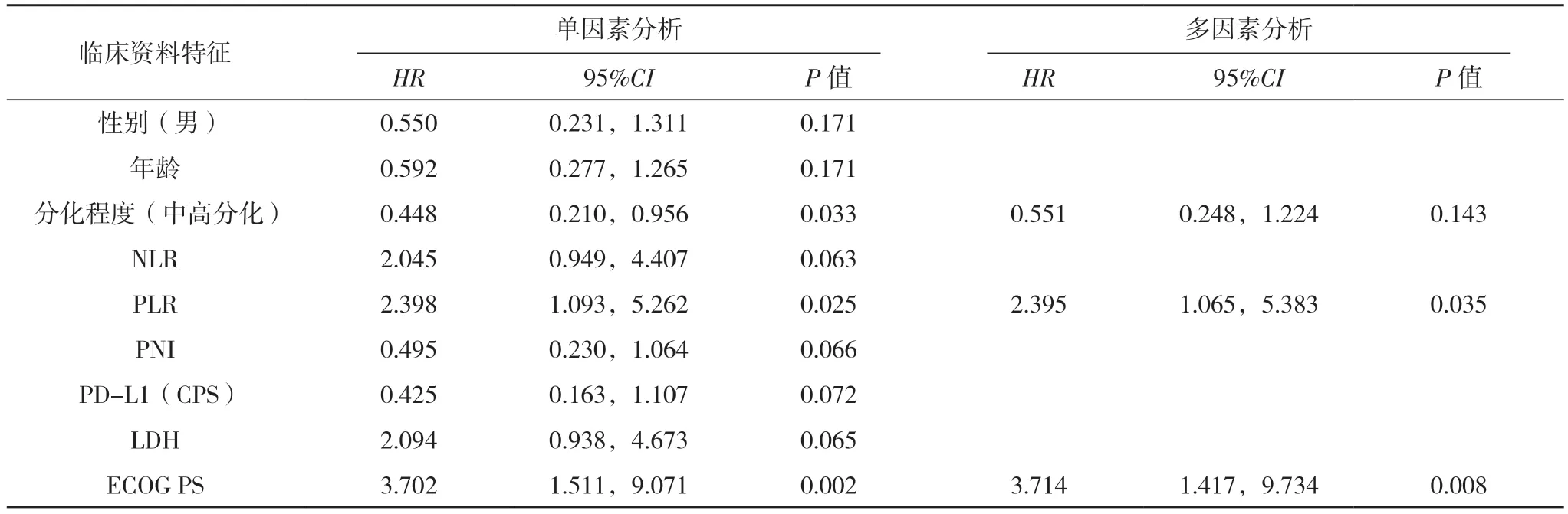
表3 影响胃癌患者PFS的单因素与多因素COX回归分析
2.4 不良反应
治疗中常见的不良反应基本与相关文献一致,严重的治疗相关的不良反应报告患者4 例(3 级及以上,不统计重复患者),无不良反应致死情况,见表4。

表4 患者随访过程中的不良反应分析[例(%)]
3 讨论
胃癌是全世界第五位常见的恶性肿瘤,也是癌症死亡的第三大原因[7],化疗是治疗晚期胃癌的主要手段,可使患者中位OS 延长6.7 个月[8]。HER2是表皮生长因子受体家族的成员,我国胃癌患者HER2 表达阳性率为12%~13%[9]。有研究表明在HER2 阳性晚期胃癌患者使用曲妥珠单抗较安慰剂组中位OS 显著延长2.7 个月[10],但HER2 阴性晚期胃癌一线治疗仍以化疗为主,因此探讨新型方案为现在医学界研究重点。近几年,免疫治疗联合化疗逐渐成为热点,文献[11]研究表明在晚期中国胃癌患者中的纳武利尤单抗联合化疗较单独化疗的中位OS 延长4.0 个月,中位PFS 延长2.7 个月,免疫治疗联合化疗显著改善了HER2 阴性晚期胃癌患者预后。信迪利单抗(商品名:达伯舒®)是由国内研发的一种新型免疫抑制剂,2018 年正式批准上市,已获批肿瘤类别包含食管鳞癌、胃或胃食管交界处腺癌等[12-13],目前已被批准用于晚期胃癌的一线治疗[14],这也为本研究选择信迪利单抗联合SOX 方案提供了依据。研究ORIENT-16 表明HER2 阴性晚期胃癌患者使用信迪利单抗联合XELOX 方案较单用化疗的中位OS 明显延长2.9 个月,证明了免疫治疗联合化疗能使胃癌患者明显受益,为胃癌的治疗方面取得了突破性进展。与其他文献发布的传统治疗或单一新型治疗应用相比,本研究中位PFS 延长至8.6 个月,中位OS 达到16.9 个月,且显示出良好的疾病缓解率及控制率,有生存获益趋势。
本研究进一步分析了营养因子、炎症反应等疗效预测因子与胃癌预后的相关性。有研究表明低分化胃癌术后5 年死亡率是高分化及中分化胃癌患者的2.01 倍及1.58 倍[15]。本研究中高分化较低分化患者的中位PFS 延长2.4 个月,说明低分化胃癌与预后不良密切相关。现发现炎症与营养状态在肿瘤发展中具有重要影响,大量文献表明LDH、NLR、PLR 等炎症标志物、营养因子与患者预后有关[16-17]。NLR 显示肿瘤患者的炎症/免疫状态,NLR 升高会促进炎症发展、抑制抗肿瘤免疫反应,预后差[18]。PLR是用于预测恶性肿瘤预后的全身免疫炎症指数,血小板及其衍生物等可使肿瘤细胞逃避免疫系统攻击,因此,PLR 越高,肿瘤细胞具有更强侵袭性。有研究证明,高NLR 和高PLR 的患者的总体生存率较差[19],本研究中低PLR 的生存期较高PLR 显著延长(P<0.05)。恶性肿瘤细胞在充足的氧供应下会发生糖酵解,即瓦氏效应[20],LDH 是一种糖酵解酶,通过拮抗细胞凋零,使肿瘤细胞对外界耐受,因此LDH 越高预后越差。本研究中虽然差异无统计学意义,但LDH 水平正常组显示出更好的疗效。白蛋白分解代谢为肿瘤生长的主要来源,胃肠道恶性肿瘤会导致患者白蛋白水平降低,导致PNI 降低[21]。本研数据也证明了高PNI 组患者的预后更好(P<0.05)。PD-L1 是Ⅰ型穿膜蛋白,通过作用于细胞膜并激活致癌基因活性,促进肿瘤进展,同时也发现肿瘤微环境中PD-L1 表达的淋巴细胞,可以协助肿瘤细胞免疫逃逸[22]。Wang 等[23]报道过PD-L1(CPS)表达越高,胃癌获益越明显。本研究也证明了PD-L1(CPS)表达与胃癌的预后相关,多因素分析显示高PD-L1(CPS)是延长患者OS 的一个独立因素。本研究中ECOG PS 为2 分的预后较差(P<0.05),通过多因素分析也证明了ECOG PS 评分为是患者的总生存期[HR=10.111,95%CI(2.022,50.559),P=0.005] 和 无 进 展 生 存 期[HR=3.714,95%CI(1.417,9.734),P=0.008]的独立良好预测因子。这与国内文献[24]报道的ECOG PS 评分预后影响因素基本一致。有研究表明年龄、性别也与胃癌预后存在相关性[25-26],本研究未得出相应的结果,可能与数据量较少、存在偏倚等情况有关。
本研究中,有43 例患者发生相关不良反应,最常见的治疗相关不良反应多为1、2 级,恶心呕吐是最常见的。本研究不良反应的发生率和严重程度与文献[27]是大致一致。但临床实践中曾报道过信迪利单抗相关免疫性心肌炎[28]、紫癜样血管炎[29],这需要临床医生警惕相关情况发生并能及时处理。本研究存在局限性,例如样本量相对较少,单一机构的经验,观察时间有限。
综上所述,本研究展示了一线使用信迪利单抗联合SOX 化疗方案的有效性及安全性的回顾性分析,并通过进一步分析证明ECOG PS 评分为胃癌的独立影响因素。最后,还需进一步扩大样本量,同时也更加期待Ⅲ期的临床研究能够证实本研究的发现。

