内吞适配蛋白Epsin3在乳腺癌中的表达及预后分析
赵小芳 凌存保 颜声祥 张虎
基金项目:盐城市科技局项目(YK2018066)
作者简介:赵小芳,女,硕士研究生,讲师。
【摘要】 目的 基于癌症基因组图谱(the cancer genome atlas,TCGA)数据库,分析内吞适配蛋白Epsin3(EPN3)在乳腺癌中的表达及临床意义。方法 应用TCGA数据库门户网站UALCAN、cBioPortal、Oncomine等分析EPN3在乳腺癌中的表达变化及预后关系;应用癌症多组学分析数据平台LinkedOmics分析在乳腺癌中EPN3的表达变化与临床指标的关系。结果 乳腺导管癌中EPN3基因表达较正常乳腺组织显著上调(P<0.01)且EPN3高表达不利于患者预后;乳腺癌中EPN3的表达受组织学类型、病理阶段、病理T阶段、病理N阶段、原癌基因人类表皮生长因子受体、雌激素受体、孕激素受体、PM50类型、患者种族、肿瘤纯度、年龄和淋巴结数量的影响(P<0.05)。结论 EPN3高表达不利于乳腺癌预后,可作为筛选和治疗乳腺癌的相关靶点。
【关键词】 乳腺癌;内吞适配蛋白Epsin3;预后
Expression and prognosis of endocytic adaptor protein Epsin3 in breast cancer
Zhao Xiaofang,Lin Cunbao,Yan Shengxiang,Zhang Hu. Jiangsu Vocational College of Medicine,Yancheng, Jiangsu 224005
【Abstract】 Objective To investigate the expression,prognostic significance and functional mechanism of Epsin3 (EPN3) based on TCGA analysis. Methods The expression and prognostic significance of EPN3 in breast cancer was analyzed by TCGA portal UALCAN.Analysis of the changes of EPN3 in breast cancer and its relationship with clinical prognosis through LinkedOmics. Results EPN3 is highly expressed in breast cancer (P<0.01) and is not conducive to prognosis .The expression of EPN3 in breast cancer is affected by histological type,pathological stage,pathological T stage, pathological N stage, proto-oncogene human epidermal growth factor receptor, estrogen receptor, progesterone receptor, PM50 type, patient ethnicity, tumor purity ,age and the number of lymph nodes(P<0.05). Conclusion EPN3 is highly expressed in breast cancer and is not conducive to prognosis. EPN3 can be used as a target for screening and treatment of breast cancer.
【Key words】Breast cancer;Epsin3;Prognostic
中图分类号:R581.9 文献标识码:A 文章編号:1672-1721(2023)31-0010-04
DOI:10.19435/j.1672-1721.2023.31.004
乳腺癌(breast cancer,BC)是严重危害女性健康的恶性肿瘤之一。据世界卫生组织国际癌症研究机构(international agency for research on cancer,IARC)
2020年发布的全球最新恶性肿瘤负担数据显示,全球乳腺癌新发病例高达226万例,是全球第一大恶性肿瘤[1]。随着医疗科技水平的提高,乳腺癌治疗预后效果良好,但术后复发转移仍是导致乳腺癌病人死亡的主要因素。我国乳腺癌发病率高达25.89/10万,占所有女性恶性肿瘤发病率的 16.83%[2]。我国乳腺癌患病人数占总人数的比例不断增加,且患病年龄呈下降趋势,对女性的健康、生活造成严重威胁,给医疗保健和社会经济带来巨大的挑战。寻找和研究新的乳腺癌发生和预后相关靶分子对乳腺癌患者具有重要意义。
内吞适配蛋白Epsin3(EPN3)是网格蛋白介导的内吞适应蛋白家族Epsin的成员之一[3]。Epsin是一种保守的内吞性网格蛋白适配器,其网格蛋白膜动力学中的重要功能尚不明确[4]。据报道,Epsin在皮肤癌、肺癌、前列腺癌几种恶性肿瘤中被上调,且通过抑制内吞网格蛋白包被小窝的肌动蛋白依赖性,抑制细胞内吞作用[5]。重要的是Epsin的缺失或下调可减少肿瘤的发生,从而证明Epsin具有致癌作用[6]。已有研究表明,Epsin家族促进纤维肉瘤迁移和侵袭[7],且其与Notch信号通路的激活有关[8]。
EPN3是一种蛋白质编码基因,又称EPS-15相互作用蛋白3,它主要定位于细胞膜、细胞外与细胞核内。有文献报道,EPN3可作为一种细胞外基质诱导的针对损伤上皮细胞的转录物[9],且EPN3基因的异位表达可影响足叶乙甙诱导的衰老表型[10]。其相关途径与PAK和上皮生长因子受体(epidermal growth factor receptor,EGFR)的内吞有关。但是,在乳腺癌发生发展过程中,EPN3的具体作用机制尚不清楚。通过研究乳腺癌中靶分子EPN3的作用,补充乳腺癌发生发展机制,为乳腺癌在患者预后时提供候选标志物和对于提高患者生存率至关重要。
1 材料和方法
1.1 数据来源 数据通过肿瘤基因组图谱(the cancer genome atlas,TCGA)门户网站UALCAN、cBioPortal,癌症芯片数据库Oncomine获得,深入分析TCGA基因表达谱数据,可查询肿瘤和正常组织中基因的差异表达。通过癌症多组学分析数据平台LinkedOmics可分析基因表达与临床指标的相关性。
1.2 分析方法 打开cBioPortal网站首页,选择“breast invasive carcinoma (TCGA Provisional)”数据集,病例组选择“tumor samples with mRNA data (RNA Seq V2)(1100)”,分别分析EPN3基因的突变、拷贝数畸变、mRNA水平变化以及EPN3表达上调与患者预后的关系。进入 UALCAN网站首页,选择“breast invasive carcinoma” 数据库类型,输入基因名称“EPN3”,分析在乳腺癌中EPN3基因表达变化及它与预后生存率的关系。进入LinkedOmics网站首页,癌症类型选择“TCGA_BRCA”,继而选择“HiSeq RNA”检索数据集,输入 基因“EPN3”,选择“Clinical”数据集,统计方法选择“non-parametrict test”,下载P<0.05的结果。
2 结果
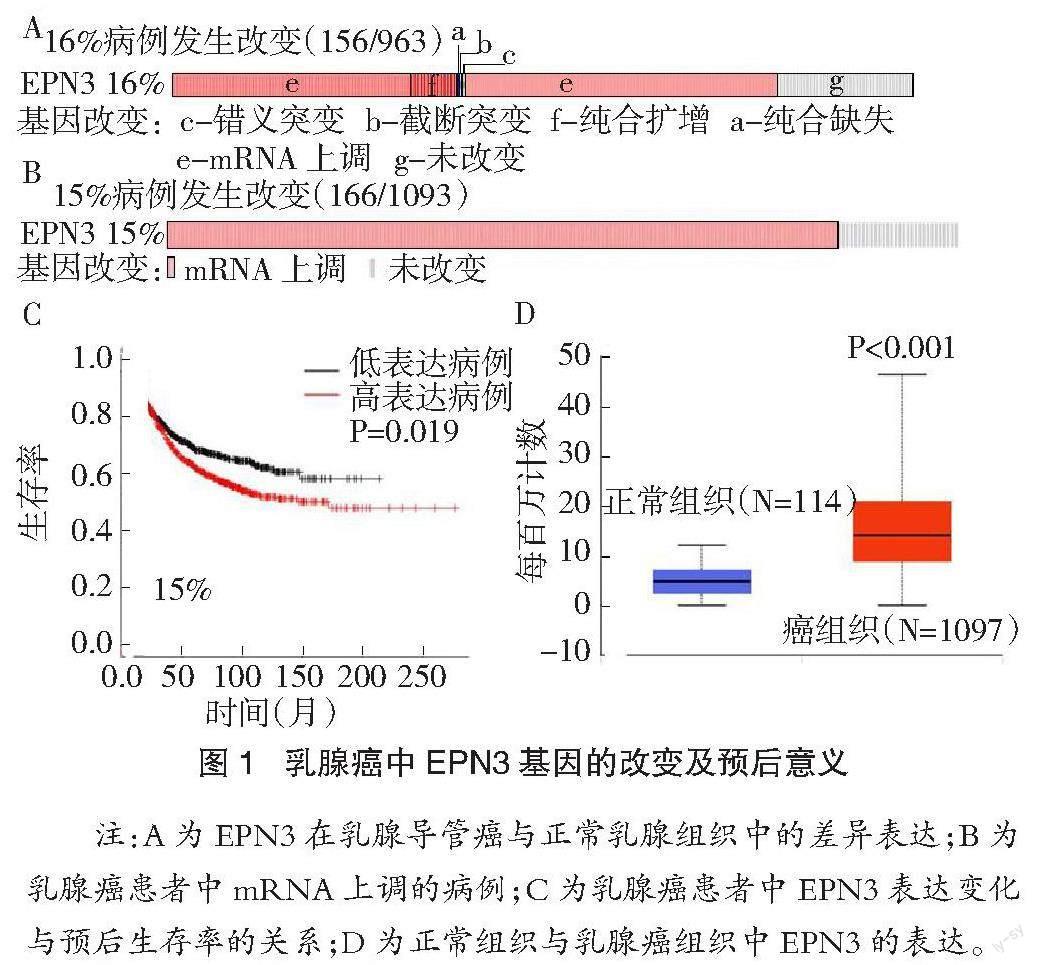
2.1 乳腺癌组织中EPN3基因的表达 cBioPortal筛选出EPN3基因在乳腺癌患者中呈高表达且不利于预后。基于TCGA多组学高通量数据筛选,研究发现乳腺导管癌EPN3基因的表达较正常乳腺组织明显上调(P<0.01)(图1D)。其中,15%的乳腺癌患者中 EPN3(EXP≥2)基因呈高表达(图1B),且EPN3高表达不利于患者预后(P<0.01)(图1C);而16%的乳腺癌患者发生EPN3基因改变,包括基因突变(错义突变、截断突变)、拷贝数变化和 mRNA 的变化(图1A)。
2.2 乳腺癌中EPN3表达与临床指标的相关
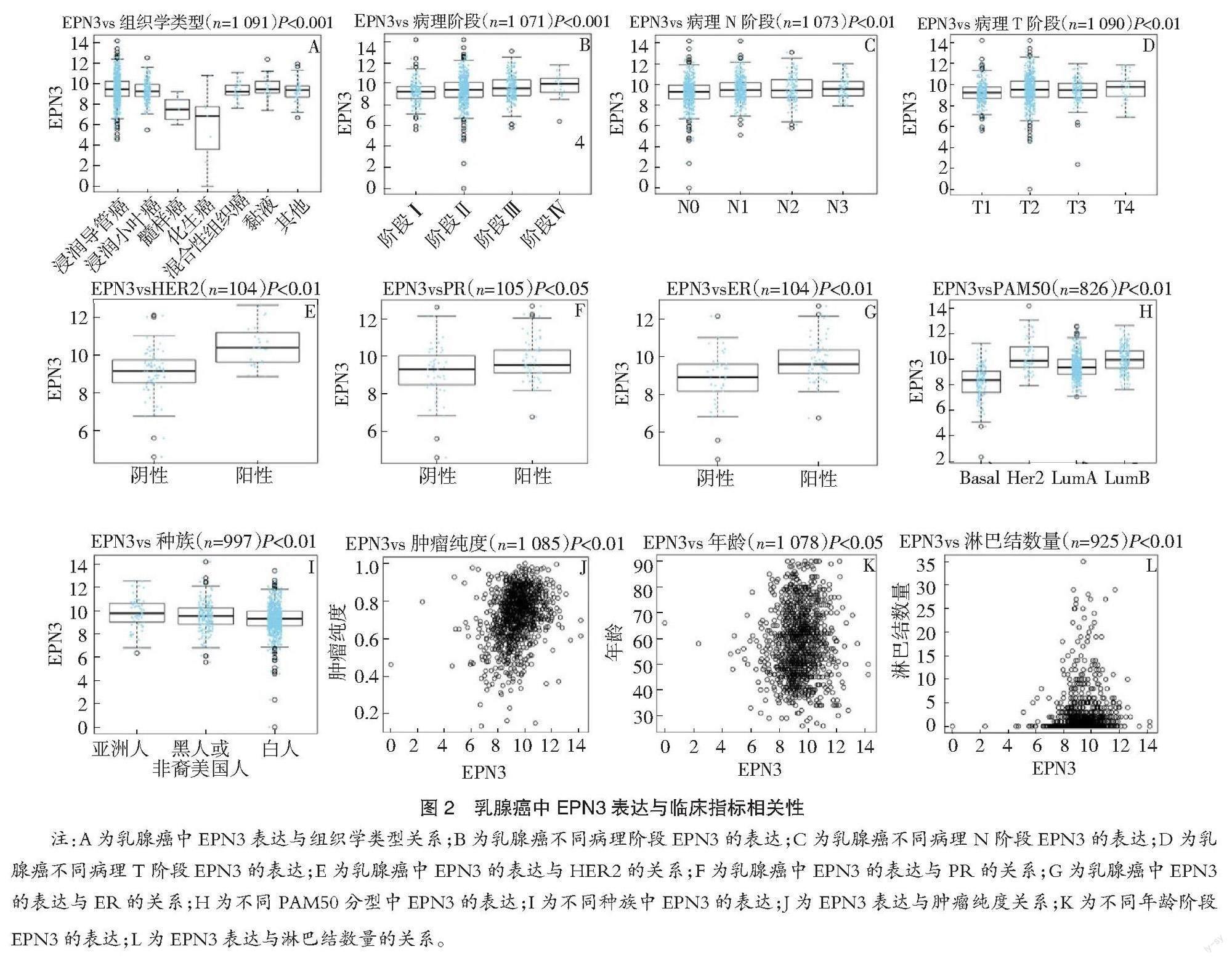
性 通过筛选发现乳腺癌中EPN3的表达受到组织学类型、病理阶段、病理T阶段、病理N阶段、患者种族、肿瘤纯度、年龄和淋巴结数量的影响(P<0.05)(图2A、B、C、D、I、J、K、L);原癌基因人类表皮生长因子受体阳性患者中EPN3的表达显著高于阴性患者,差异有统计学意义(P<0.01)(图2E);孕激素受体阳性患者中EPN3的表达显著高于阴性患者,差异有统计学意义(P<0.05)(图2F);雌激素受体阳性患者中EPN3的表达显著高于阴性患者,差异有统计学意义(P<0.01)(图2G);不同PAM50亚型乳腺癌中EPN3的表达差异有统计学意义(P<0.01)(图2H)。
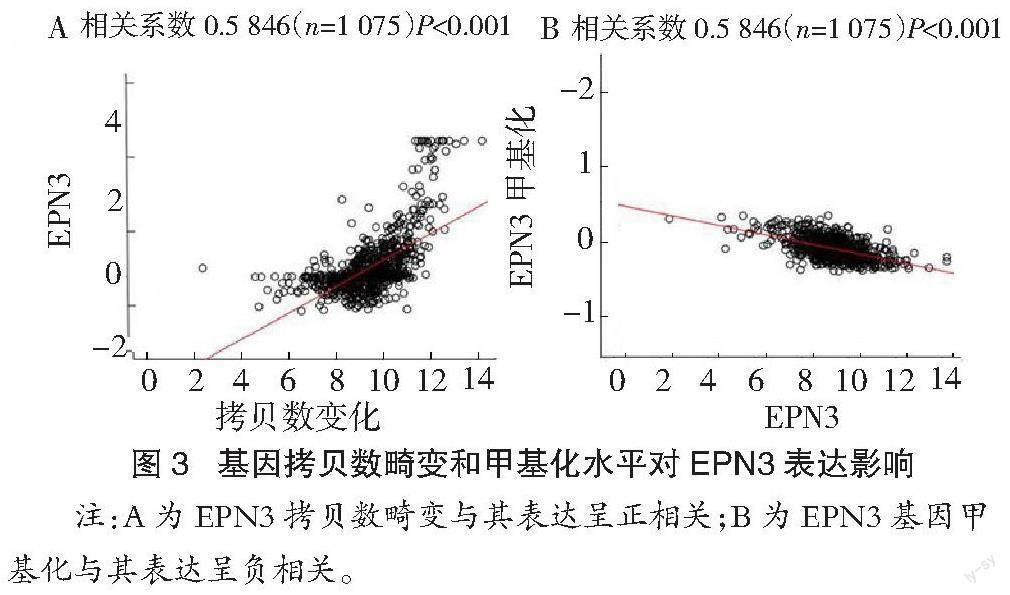
2.3 基因拷贝数畸变和甲基化水平对EPN3表达的影响 Linkedomics筛选TCGA多组学高通量数据发现,EPN3的表达与其基因拷贝数增加呈显著正相关,而与其DNA甲基化水平呈显著负相关(图3)。
3 讨论
Epsins作为内吞辅助蛋白或替代受体(用于EGFR和VEGFR2等蛋白受体),在网格蛋白介导的内吞和网格蛋白非依赖性的货物内化中起着关键的生理作用,作为内吞作用的补充,Epsins还具有信号功能并参与多种细胞活动[11]。Epsins可参与包括细胞增殖、黏附、凋亡以及血管形成等,不仅在正常的组织生长发育过程中起重要作用,在各种肿瘤的发生发展中也发挥着重要作用。研究表明,Epsins与多种肿瘤的细胞增殖、转移、侵袭等生物学行为密切相关[4]。已有不少研究表明,Epsin蛋白家族可作为致癌调节因子参与恶性肿瘤的发生和进展过程[5]。Epsins家族成员EPN1、EPN2 在前列腺癌、肺癌及人類皮肤癌中的表达上调[6-7,12],并发现在胃癌、结肠癌及基底细胞癌中EPN3的表达升高[13]。
另外,相关研究发现,EPN与P53存在相关性,Epsins可负向调节IFN-α-p53途径下游的乙型肝炎病毒RNA的表达[14],并且有促进细胞衰老的作用。然而另有研究指出,细胞的内吞作用负向调控衰老是在细胞正常的生长状态下进行的[15],但Epsins介导的细胞内吞作用可促进细胞自噬,有助于诱导细胞衰老[16-17]。有研究表明,EPN3通过激活转录因子Slug、Twist和ZEB1而不是Snail 1或ZEB2来增强胶质母细胞瘤细胞的迁移和侵袭,从而在胶质瘤细胞中诱导EMT[18]。
综合以上研究,提示EPN3可能在细胞的增殖、侵袭以及迁移的过程中起着非常重要的作用。本研究发现EPN3在乳腺癌中呈高表达,其原因可能在于EPN3的高表达会促进乳腺癌细胞的生长和转移,并促进了乳腺癌的发生发展。有文献指出,EPN3可通过调节ER阳性乳腺癌中的NF-κB信号通路促进细胞增殖并抑制细胞凋亡。另有文献报道,在乳腺癌细胞中,乳腺癌复发的风险因素增加与Notch 信号通路的激活呈正相关,而EPN3可能参与胶质瘤细胞Notch 1 信号的激活[18-19] ,从而激活相关信号通路。这与EPN3的高表达不利于患者预后结果相一致。
通过LinkedOmics数据分析,结果发现,乳腺癌在不同的病理阶段或不同的组织学类型中,EPN3的表达变化也不同。这提示EPN3可能在乳腺癌发生和发展的不同阶段起作用。在乳腺癌患者中,原癌基因人类表皮生长因子受体阳性患者中EPN3的表达显著高于阴性患者,雌激素受体阳性患者中EPN3的表达显著高于阴性患者,这与Hellwig在非小细胞肺癌和雌激素受体阳性的乳腺癌中,EPN3的高表达与晚期转移的风险增加相关的研究结果一致[6]。而不同种族和年龄的乳腺癌患者中EPN3的表达也具有差异,表明EPN3的表达可能具有地域和时间的特异性。乳腺癌在不同种族、不同年龄及不同病理表现中EPN3表达变化不同,提示乳腺癌发生和发展具有个体差异,即肿瘤的异质性。
為了揭示靶分子EPN3表达增加的上游调节机制,研究分别进行了基因拷贝数畸变CNA、DNA甲基化的分析和验证工作。结果显示,基因拷贝数畸变CNA、DNA甲基化在肿瘤发展中起重要作用。肿瘤相关基因的拷贝数畸变可以激活癌基因促进或抑制抑癌基因的表达。基因的拷贝数畸变可使基因剂量发生改变或者调节基因的表达活性,从而促进或抑制基因的表达,在肿瘤的发生和进展中起作用[20]。研究表明,在表观遗传学中DNA的甲基化有重要作用,特别是基因启动子区,其甲基化可影响基因的表达。DNA的低甲基化可以促进癌基因的表达,而DNA的高甲基化可以沉默肿瘤抑制基因。在临床上,通过检测特定癌基因的拷贝数畸变可以指导疾病的治疗和预后,而药物干预基因的甲基化也是恶性肿瘤治疗中的重要研究方向。研究发现,在乳腺癌患者中,EPN3的基因拷贝数畸变与DNA甲基化具有相关性。
迄今为止,EPN3在癌症的病理发展或对组织和细胞特异性的具体作用仍未知。此次项目研究了EPN3在乳腺癌组织中的表达及EPN3在乳腺癌发生发展中的潜在作用。研究结果显示,EPN3作为致癌基因编码的蛋白质可能促进肿瘤的生长和发展。抑制EPN3可能会激活或抑制某种机制,以抑制乳腺癌的发病及进展。尽管此次研究结果只是基于高通量数据库的分析,但也为乳腺癌的治疗及其预后复发风险的检测提供了相关思路,后续将继续研究临床乳腺癌患者EPN3高表达的具体机制。
参考文献
[1] SUNG H,FERLAY J,SIEGEL R L,et al.Global cancer statistics 2020:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J
Clin,2021,71(3):209-249.
[2] CAI T,QIAN J,YUAN C,et al.Dyadic coping in couples with breast cancer in China[J].Cancer Nurs,2021,44(6):E458-E466.
[3] DONG Y,LEE Y,CUI K,et al.Epsin-mediated degradation of ip3r1 fuels atherosclerosis[J].Nat Commun,2020,11(1):3984.
[4] HELLWIG B,MADJAR K,EDLUND K,et al.Epsin family member 3 and ribosome-related genes are associated with late metastasis in estrogen receptor-positive breast cancer and long-term survival in non-small cell lung cancer using a genome-wide identification and validation strategy[J].PLoS One,2016,11(12):e0167585.
[5] JOSEPH J G,CARLOS O,YEE V,et al.Complimentary action of structured and unstructured domains of epsin supports clathrin-mediated endocytosis at high tension[J].Commun Biol,2020,(1)3:743.
[6] TESSNEER K L,PASULA S,CAI X,et al.Endocytic adaptor protein epsin is elevated in prostate cancer and required for cancer progression[J].ISRN Oncol,2013(4):420597.
[7] WANG Y,SONG W,KAN P,et al.Overexpression of epsin3 enhances migration and invasion of glioma cells by inducing epithelial-mesenchymal transition[J].Oncol Rep,2018,40(5):3049-3059.
[8] COON B G,DIRENZO D M,KONIECZNY S F,et al.Epsins' novel role in cancer cell invasion[J].Commun Integr Biol,2011,
4(1):95-97.
[9] OVERSTREET E,FITCH E,FISCHER J A.Fat facets and liquid facets promote delta endocytosis and delta signaling in the signaling cells[J].Development,2004,131(21):5355-5366.
[10] NAGANO T,NAKANO M,NAKASHIMA A,et al. Identification of cellular senescence-specific genes by comparative transcriptomics[J].Sci Rep,2016,1(6):31758.
[11] WANG Y,PEDIGO C E,INOUE K,et al.Murine epsins play an integral role in podocyte function[J].J Am Soc Nephrol,2020,31
(12):2870-2886.
[12] KO G,PARADISE S,CHEN H,et al.Selective high-level expression of epsin 3 in gastric parietal cells,where it is localized at endocytic sites of apical canaliculi[J].Proc Natl Acad Sci of USA,2010,107(50):21511-21516.
[13] SPRADLING K D,MCDANIEL A E,LOHI J,et al.Epsin 3 is a novel extracellular matrix-induced transcript specific to wounded epithelia[J].J CHEM-NY,2001,276(31):29257-
29267.
[14] LI X,WANG Z,ZHOU W,et al. Interferon-alpha responsible EPN3 regulates hepatitis B virus replication[J].Front Med
(Lausanne),2022(9):944489.
[15] MORI J,TANIKAWA C,OHNISHI N,et al.EPSIN 3,a novel p53 target,regulates the apoptotic pathway and gastric carcinogenesis[J].Neoplasia,2017,19(3):185-195.
[16] GARCIA-ALAI M M,HEIDEMANN J,SKRUZNY M,et al.Epsin and Sla2 form assemblies through phospholipid interfaces[J].Nat Commun,2018,9(1):328.
[17] RAVIKUMAR B,MOREAU K,RUBINSZTEIN D C.Plasma membrane helps autophagosomes grow[J].Autophagy,2010,6(8):1184-1186.
[18] 王亞茹.Epsin3通过诱导EMT过程促进胶质瘤细胞迁移和侵袭[D].天津:天津医科大学,2018.
[19] ABRAVANEL D L,BELKA G K,PAN T C,et al.notch promotes recurrence of dormant tumor cells following her2/neu-targeted therapy[J].J Clin Invest,2015,125(6):2484-2496.
[20] 张虎,杜欣娜,庄莹,等.乳腺癌中跨膜蛋白81基因高表达不利于患者预后[J].中国临床解剖学杂志,2018,36(5):
586-589.(收稿日期:2023-08-21)