基于B7-H3靶点的分子影像技术在肿瘤诊断方面的研究进展①
郑 梦 王 燕 傅丰庆 缪丽燕(苏州大学附属第一医院,苏州 215006)
癌症的发生率和病死率逐年上升,严重威胁人们的身体健康和生命安全。虽然免疫治疗等疗法取得了重大突破,但癌症患者病情的晚期诊断和有限的治疗时间是导致其低生存率的主要原因[1]。早期、准确地发现肿瘤可显著提高患者生存率,如乳腺癌在原位癌阶段时,患者五年生存率约为90%,而在区域转移阶段时,其五年生存率仅有约27%[2]。因此早期诊断是治疗癌症的关键因素之一。
目前用于癌症早期诊断的方法以组织病理学和分子影像诊断为主。虽然病理学诊断是公认的“金标准”,但仅能提供组织局部情况,而各种现代分子影像技术,包括光学成像(生物荧光或荧光)、计算机断层扫描(computed tomography,CT)、磁共振成像(magnetic resonance imaging,MRI)、正电子发射断层扫描(positron emission tomography,PET)、单光子发射计算机断层扫描(single photon emission computed tomography,SPECT)和超声(ultrasound,US)等,已广泛应用于监测癌症组织的结构、功能和分子变化,结合特异性治疗靶点可更准确地发现病变并确定早期病变的性质[3-7]。
最近,既可用于癌症早期诊断,又可用于治疗癌症和预后评估的治疗靶点备受关注。根据文献报道,负性B7 家族分子B7-H3,又称CD276,在多种肿瘤(如胃癌、胰腺癌、成神经细胞瘤、子宫内膜癌、胶质瘤、黑色素瘤、肺癌、卵巢癌和前列腺癌)细胞、肿瘤血管内皮细胞、肿瘤浸润树突细胞和巨噬细胞中广泛异常高丰度表达,而在正常组织中表达极低或几乎不表达[8];20 世纪80 年代,一株识别肿瘤相关抗原的单抗(克隆号:376.96)被鉴定出其识别的分子就是B7-H3,因此B7-H3 被认为是一个广泛表达在肿瘤细胞表面的标志,被称为“肿瘤相关抗原”,为肿瘤分子影像诊断提供相应的临床应用靶点,有望成为肿瘤诊断型药物研发中极具价值的明星分子[9]。
综上,基于分子影像实时、无创、精准癌症诊断与治疗的特点,本文结合B7-H3 分子的结构与表达特点,综述近年来以B7-H3 为靶点的肿瘤分子影像诊断的研究进展(图1),并对未来靶向B7-H3 分子诊断型药物的研发进行讨论与展望。

图1 从临床前到临床靶向B7-H3的分子影像Fig.1 Targeted molecular imaging of B7-H3 from preclinical to clinical studies
1 B7-H3的分子结构与表达特点
源于B7 家族成员的B7-H3 在各物种间普遍表达,但最早在人类中发现,其次是小鼠[10-12]。B7-H3有两种存在形式(图2):①可溶性B7-H3(sB7-H3),由基质金属蛋白酶(matrix metallopeptidase,MMP)将膜蛋白从表面切割或通过内含子的选择性剪接产生[13]。在外泌体和其他细胞外囊泡也发现了B7-H3蛋白[14]。PURVIS 等[15]发现B7-H3 可诱导更多的外泌体分泌,例如:刺激D283髓母细胞瘤细胞,促进外泌体的分泌增加;②B7-H3也是一类Ⅰ型跨膜蛋白,在人类中,由第15 号染色体编码的唯一在人表达2IgB7-H3 和4Ig B7-H3 两种剪切体的B7 家族分子;在小鼠中,由第9 号染色体编码,仅表达2Ig B7-H3,与人类2Ig B7-H3 亚型具有88%的氨基酸同源性。2Ig B7-H3 和4Ig B7-H3 的生物学功能有明显不同:2Ig B7-H3 主要介导炎症反应,而4Ig B7-H3 介导负性调节作用。4Ig B7-H3 优势性表达于人肿瘤细胞[16]。

图2 B7-H3的结构Fig.2 Structure of B7-H3
虽然B7-H3 作为配体,其受体/相互作用分子尚未发现,生物学功能也在很大程度上尚未确定,但可以明确的是,肿瘤组织中高表达B7-H3(表1)与其发展进程、转移、放化疗耐药及恶性肿瘤的不良预后有关[17-18]。最近,由DU 等[19]构建的针对B7-H3 分子的CAR-T 细胞(B7-H3.CAR-Ts)在胰腺导管腺癌、卵巢癌和神经母细胞瘤的体外和原位及皮下移植瘤小鼠中显著抑制肿瘤细胞生长,具有卓越的治疗作用;多株以B7-H3 为靶点的单克隆抗体也进入临床试验,并已显示出临床的抗肿瘤疗效。B7-H3靶点已成为肿瘤靶向诊断和治疗药物的理想候选者。见表1。
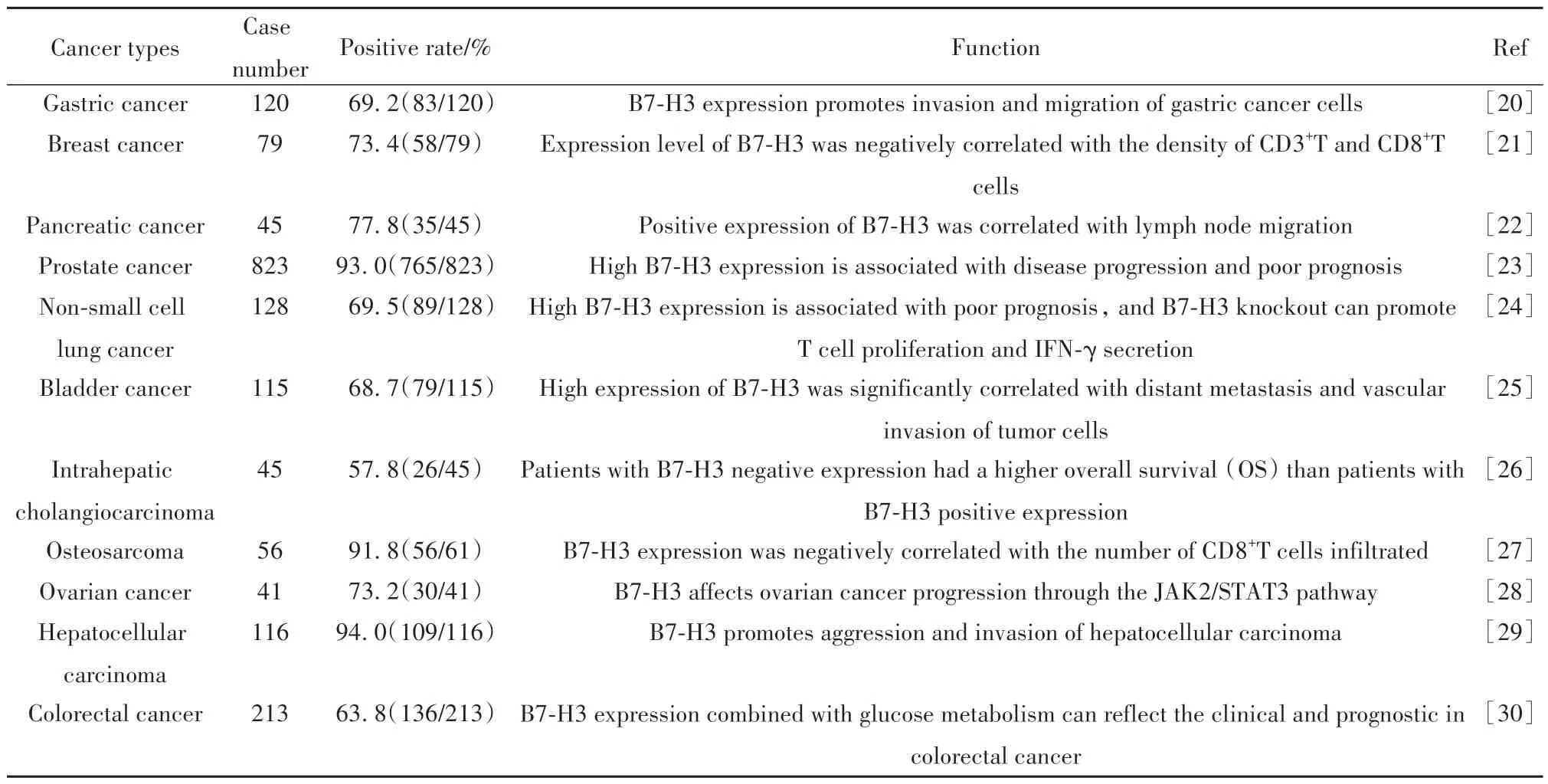
表1 B7-H3在人类肿瘤组织中的表达情况及作用Tab.1 B7-H3 expression in human cancers and its roles
2 基于B7-H3 靶点的肿瘤分子影像诊断的研究和应用
目前,以B7-H3 为靶点的分子影像显像形式有超声、光学显像及放射性核素显像。本部分主要结合B7-H3的特点,对靶向B7-H3的超声分子成像、光学成像及放射性核素成像在肿瘤诊断中的研究现状进行概述(表2)。

表2 以B7-H3为靶点的分子影像在肿瘤诊断中的临床前研究Tab.2 Preclinical studies in vivo molecular imaging of B7-H3-targeted in context of tumor diagnostic
2.1 以B7-H3 为靶点的超声成像在肿瘤诊断中的研究 超声(ultrasound,US)成像技术是基于对声脉冲反射的检测。脉冲由换能器产生并传播到组织中,在组织中根据组织的密度和可压缩性反射出不同的图案[7]。US 成像具有多种优势,如高时空分辨率、实时成像、无创性、无辐射及便携性等[40]。在乳腺癌患者中,虽然US 有助于检测乳腺病变,但其诊断准确性较低,阳性预测值较低(5.6%~8.6%),灵敏度也低至17%[41-42]。因此开发这种方式的分子靶向探针,使其以更高的精确度和高灵敏度发挥癌症的早筛作用,具有重要应用价值。
一般来说,这种分子靶向探针分为微泡型(microbubble,MB)和非微泡型。MB分子探针主要通过肿瘤血管内皮细胞上的特定标志物来成像血管生成。因此,结合B7-H3 高丰度表达于肿瘤血管内皮细胞,而正常内皮细胞不表达的特性,BACHAWAL等[33]利用新型B7-H3抗体功能化微泡造影剂在转基因小鼠中对超声分子成像检测乳腺癌的可行性进行了评估。发现体内B7-H3靶向超声分子成像信号[(49.4±5.3)a.u.,n=146]在乳腺癌中显著增加(P<0.001),而在正常组织中较低[仅为(5.0±0.5)a.u.,n=37],且与B7-H3 的体外定量免疫荧光表达水平高度相关(R2=0.77,P<0.001),说明B7-H3 是一种有前途的分子成像靶点。但较小的配体[如affbodies(ABY)]可能更适合于临床级靶向MB 的设计。BAM 等[32]发现MBABY-B7-H3在与人B7-H3表达(MS1hB7-H3)细胞共移植的原位肿瘤中成像信号[(8.4±3.3)a.u]明显高于MS1WT细胞移植的肿瘤[(1.4±1.0)a.u]。在转基因小鼠肿瘤中,MBABY-B7-H3[(9.6±2.0)a.u]的成像信号高于MBNon-targeted[(1.3±0.3)a.u],而在正常乳腺和B7-H3 阻断肿瘤中,MBABY-B7-H3的成像信号明显降低(P<0.02),说明MBABY-B7-H3增强乳腺肿瘤中B7-H3 分子信号。因此,结合ABYB7-H3尺寸小、易生产、靶向性好的优势,MBABY-B7-H3提高癌症检测灵敏度,更适用于临床成像。综上所述,B7-H3靶向超声分子成像在提高US 对乳腺癌患者的诊断准确性方面具有很大潜力。
2.2 以B7-H3 为靶点的光学显像在肿瘤诊断中的研究 光学分子影像是利用光学检测手段结合光学检测分子对细胞或组织甚至生物体进行成像,从而获取生物信息的一种方法。光学成像在可见光和近红外范围内,生物光学成像方法可分为荧光成像、生物发光成像、光声成像和光学层析成像[43]。
光谱光声(spectroscopic photoacoustic,sPA)分子成像在识别针对特定标志物的外源性造影剂方面具有很高的应用潜力。最近,抗体染料偶联物广泛应用于临床前sPA 和其他光学成像模式[43]。然而,抗体类药物体内循环时间长,因此,成像特异性受 限。故 而,BAM 等[34]利用靶向B7-H3 ABY(ABYB7-H3)偶联一种近红外荧光染料吲哚菁绿(indocyanine green,ICG)(ABYB7-H3-ICG),合成一种新型造影剂,用于乳腺癌的高特异性分子成像。结果发现sPA 和荧光成像技术相结合,对乳腺癌细胞表达受体B7-H3(CD276)进行成像,可以区分小鼠浸润性肿瘤与正常腺体。与正常小鼠的腺体相比,给予ABYB7-H3-ICG 在乳腺肿瘤中的信号明显更高。伴随PA/US 联合成像系统的不断发展,ABYB7-H3-ICG 可能是一种可靠的人类乳腺癌检测造影剂,用于早期筛查乳腺癌患者。目前,对于乳腺癌早期患者,一般采用保留乳房的手术治疗,但由于癌症边缘不明显,引起患者预后较差,因此,WILSON 等[35]合成B7-H3 抗体偶联ICG(B7-H3-ICG)造影剂,使用sPA 和荧光成像(fluorescence molecular imaging,FMI)用于指导术中疑似乳腺癌组织切除。在转基因小鼠乳腺癌模型研究中发现乳腺原位导管癌(ductal carcinoma in situ,DCIS)和浸润性癌组织(n=63),sPA 平均信号为(23.98±4.88)a.u.,平均荧光信号为(7.56E07±1.44E06)(p/s)/(µW/cm²),而正常或增生组织(n=17)显示较低的sPA[(3.17±0.48)a.u]和荧光信号[(6.83E07±2.00E06)(p/s)/(µW/cm²)],说明sPA 和荧光分子显像结合B7-H3-ICG 试剂具有较高的诊断准确性、术中分辨率、敏感度和特异度,可用于评估组织的疾病状态。
2.3 以B7-H3 为靶点的放射性核素显像在肿瘤诊断中的研究 放射性核素显像(radionuclide molecular imaging,RMI)是指将放射性核素标记的某种化合物引入(口服或静脉注射)人体,使用放射性显像仪器进行检测,从而获得脏器和病变组织的图像。目前以B7-H3 抗体为载体的RMI 常用显像方式为PET显像[44]。
2016 年,NAGASE-ZEMBUTSU 等[45]对第一三共公司合成的一株人源化B7-H3抗体(DS-5573a)进行了性能及药效评估,认为该单克隆抗体有望用于广泛表达B7-H3 的肿瘤患者的抗肿瘤治疗。随后,BURVENICH 等[38]对用锆89(89Zr-)标记的DS-5573进行诊断性能评估,在B7-H3 阳性乳腺癌皮下瘤模型(B7-H3-MDA-MB-231)中,利用PET/MRI 进行了体内生物分布和成像研究,结果显示,注射89Zr-DS-5573 第7 天后,B7-H3-MDA-MB-231 在BALB/c 裸鼠中肿瘤摄取率为(32.32±6.55)% ID/g,在SCID 小鼠中肿瘤摄取率为(25.76±1.79)% ID/g;另外,在B7-H3阴性小鼠结肠癌(CT26)SCID 皮下瘤中肿瘤摄取率为(10.07±0.79)% ID/g,而B7-H3-MDA-MB-231肿瘤摄取率为(35.90±3.59)% ID/g,P<0.000 5,表明89Zr-DS-5573a可特异性靶向表达B7-H3的异种移植肿瘤,且提示89Zr-DS-5573a 具有非侵袭性量化癌症患者肿瘤中B7-H3 靶标的表达潜力。将89Zr 标记DS-5573a 联合DS-5573a 治疗分子显像研究中发现,DS-5573a 治疗4 周后肿瘤生长抑制率(%TGI)为89.8%,展示了DS-5573a 良好的抑瘤作用,也为进一步基于B7-H3为靶点结合分子影像的诊疗一体化药物发展提供了前期基础。
3 讨论
随着医学影像技术的发展,毫无疑问,分子成像技术对癌症的诊断和手术治疗具有巨大的潜在价值,其中分子成像的特异度和灵敏度很大程度上取决于分子成像探针的设计。因此,提高分子成像的特异度和灵敏度以便能够发现乃至最小的恶性病变,对于癌症的诊断和分期至关重要,从而提高癌症的早期筛查率及癌症患者的生存期。
近年来,肿瘤免疫治疗取得了显著进展,尤其是B7 家族分子PD-L1 及其受体PD-1 抑制剂临床药物的成功为肿瘤免疫治疗开拓了里程碑式的进展,但在其他肿瘤中行之有效的免疫治疗方法,包括免疫检查点抑制剂等,由于肿瘤的异质性和其他特性导致治疗获益甚少[46]。B7 家族的另一成员B7-H3最早由CHAPOVAL 等[12]在2001 年发现,虽然其确切的生物学功能和介导免疫逃逸的机制尚需进一步探索,但其在肿瘤组织和肿瘤血管上高丰度表达,如在RCC 血管中表达高达98%[47],提示B7-H3可以作为一种新的有效的肿瘤血管特异性载体,既可成为一种造影剂,用于辅助疾病诊断和预测使用不同靶向药物治疗病变组织的临床结果,也可选择性地将抗血管生成或血管破坏药物递送到病变组织,最大限度地减少潜在的副作用。鉴于其与肿瘤生物学特征的密切相关性,B7-H3 有望成为新的肿瘤诊断标志物显像靶点,逐渐进入到人们的视野中。
目前,基于B7-H3 为靶点的肿瘤分子影像研究主要集中在超声、光学及放射性显像方面。与正常乳腺组织和接受手术切除或活检为多种乳腺病变为良性的组织相比,B7-H3 在乳腺癌的新生血管高度表达,且具有显著差异。在转基因小鼠中,与正常乳腺组织相比,针对B7-H3 的微泡型分子探针超声分子成像信号也显著增加。因此,未来的临床转化工作可开发针对B7-H3 的临床分级造影剂,这将最终有助于提高超声筛查在乳腺致密组织中乳腺病变的诊断准确性[33]。在乳腺导管内原位癌(ductal carcinoma in situ,DCIS)<1 mm 的病灶中,与正常组织和增生性乳腺组织相比,B7-H3 的表达明显增加。sPA 成像具有足够高的分辨率和特异性来区分亚毫米级别病灶,术中sPA B7-H3 靶向分子成像可用于乳腺癌转基因小鼠模型的疾病状态评估,再次提示B7-H3 可能是一种很有前景的分子成像靶点,用于术中边缘检测,以帮助指导外科医生在肿瘤切除时尽量减少阳性切缘[35]。靶向多模态探针的发展,如超声、光声和荧光分子成像技术结合适当的B7-H3靶向造影剂能够检测乳腺癌发展小鼠模型中的DCIS,这些成像策略可能允许主动监测DCIS 或在术中检测DCIS,不仅最大限度地减少不必要的外科干预,且有助于诊断和分期、手术计划、术中指导和手术过程的术后评估,具有良好的协同效益。未来可能在靶向探针上添加特定的化疗药物。在理想情况下,抗癌药物可直接沉积到目标细胞中,使分子探针(结合治疗和诊断特性)真正成为治疗药物,从而达到诊疗一体化的作用。虽然微泡型超声成像在体外具有皮克级别的灵敏度,然而,对于全身成像,放射性核素PET 显像仍然是当今最灵敏的成像方式,优于分子造影剂的MR 成像,比分子CT成像的灵敏度高几个数量级。89Zr-DS-5573a优异的靶向性和特异性有潜力成为一种理想的PET 显像示踪剂,提供实时定量、异质性检测和动态变化B7-H3表达有助于指导和监测治疗反应,从而选择最有可能从免疫治疗中受益的患者;DS-5573a 良好的抑瘤作用,结合分子影像的优势,为开发诊断与治疗一体化的肿瘤免疫药物打下坚实的基础。
B7-H3 以其独特的优势性表达特点,成为肿瘤免疫治疗药物开发热潮中的研究热点,以B7-H3 为靶点开发的小分子、单抗、双抗、抗体偶联药物(ADC)、CAR-T/NK 以及放射免疫疗法等形式的药物相继涌现。根据临床试验注册数据库,与B7-H3相关的正在进行的临床试验共有85 项,其中,国内首家——豪森药业(HS-20093)B7-H3 抗体启动1 期临床研究,证明了以B7-H3 靶点进行肿瘤药物研究的可行性及安全性,说明B7-H3 分子及其抗体开发具有广泛的研究前景。结合目前分子影像在肿瘤免疫中的无创性、定量、可视化的独特优势,以B7-H3为靶点的诊断及治疗一体化药物开发,将在未来取得更大的突破,为肿瘤患者带来新的福音。
4 致谢
感谢江苏省临床免疫研究所所长张学光教授对本文撰写的悉心指导和修改。

