IL-33及其受体ST2L在银屑病患者外周血T细胞及皮损组织中的表达①
张丽丽 刘霄霄 孙瑞雪 王 菲 杜红阳(锦州医科大学附属第一医院皮肤科,锦州 121012)
银屑病是一种由遗传与环境共同作用诱发的免疫介导的慢性、复发性、炎症性、系统性疾病。对患者的皮肤、心理健康甚至全身器官均可造成损害。目前其确切病因尚不清楚,但Th17 细胞及IL-23/IL-17轴在银屑病发病机制中可能处于关键地位,并且针对IL-17A、IL-23、TNF-α 治疗靶点的生物制剂已在临床治疗中广泛应用。IL-33 是IL-1 细胞因子超家族成员,组成性地表达于多种人类组织细胞上,在皮肤组织细胞上呈现一定表达。其受体ST2 基因在结构上与其他IL-1 受体(IL-1R)相似,而ST2L是IL-33的跨模型受体。IL-33与ST2L结合,并与IL-1 受体辅助蛋白(IL-1RAcP)形成复合物结合后发挥重要的生物学功能。但目前IL-33 及其受体ST2L 在银屑病患者和正常人表皮角质形成细胞、外周血T 细胞中的表达水平尚不清楚。因此,本研究分析了寻常型银屑病和脓疱型银屑病患者血清和皮损组织中IL-33 及其受体ST2L 的表达水平,旨在说明这些分子可能与银屑病的发生发展有关,为未来寻找银屑病的潜在治疗靶点提供理论依据。
1 资料与方法
1.1 资料
1.1.1 一般资料 选择2022 年1 月至2022 年8 月在锦州医科大学附属第一医院初次就诊的寻常型银屑病(PV组)患者20例和脓疱型银屑病(PP组)患者20 例,同时收集20 例行体表色素痣切除者作为对照组(CON 组)。各组在年龄、性别上差异均无统计学意义(P>0.05)。PV 组和PP 组纳入标准:①符合《银屑病诊疗指南》寻常型银屑病和脓疱型银屑病的诊断标准,部分临床表现不典型者行病理检查,根据银屑病典型组织病理改变进行确诊;②近3 个月来未经任何系统和局部治疗;③排除其他皮肤疾病、合并其他自身免疫性疾病或其他系统性疾病等。CON 组纳入标准:无全身各系统疾病。本研究经锦州医科大学附属第一医院伦理委员会同意,患者签署知情告知书,伦理审批号:2022015。
1.1.2 主要试剂 人Jurkat T 细胞株(中国科学院上海细胞生物所);HaCat 角质形成细胞(空军总医院中心实验室);兔抗人ST2L 抗体(Bioreagents公司)。
1.2 方法
1.2.1 皮损组织提取及处理 在银屑病患者皮损区常规消毒后,用手术刀切取梭形皮肤组织,大小约1.5 cm×0.5 cm,取材深度0.2 cm~0.4 cm,缝合切口,对照组非皮损区按照同样方法进行取材。将获取的组织标本进行石蜡包埋制作石蜡切片。采用免疫组织化学Envision 2步法,操作方法按说明书进行。IL-33 和ST2L 抗体稀释倍数均为1∶100,一抗4 ℃过夜。二氨基联苯胺(DAB)显色,苏木素复染,中性树胶封片。
1.2.2 Jurkat T 细胞和HaCat 角质形成细胞培养
Jurkat T 细胞置于T 细胞的培养液(RPMI 1640,15% 小牛血清、2%Na2CO3、1%HEPES、青霉素100 U/ml、庆大霉素100 U/ml),5%CO2、37 ℃、30%湿度条件下培养。HaCat 角质形成细胞在含10%胎牛血清及1%青链霉素的改良DMEM 培养基中,37 ℃、5%CO2条件下培养,待细胞单层铺满培养瓶后,磷酸盐缓冲液(PBS)漂洗1 次,加0.25%胰蛋白酶消化液,待镜下细胞圆缩时,DMEM 培养液终止消化,细胞收集于离心管中,600 g 离心5 min,弃上清,将细胞悬液分别移至冷冻管中,每管1.5 ml,将冻存管先置于4 ℃冰箱2 h,再移至-80 ℃低温冰箱24 h,置于-196 ℃液氮中保存备用。
1.2.3 外周血T 细胞的分离 圆底试管中放入淋巴细胞分离液2 ml。在另一试管中加静脉抗凝血(每毫升血液加20 单位肝素)2 ml,再加入同等量的Hanks 液使血液稀释。用毛细吸管将抗凝稀释的血液沿管壁滴入分离液试管中。放入离心机中,20 ℃条件下2 000 r/min 离心20 min。取出试管,将一毛细吸管伸入界面白色细胞层,将细胞吸出后移到另一试管中,加入1 ml Hanks液,悬浮细胞。
1.2.4 纯化T 细胞 将全血加入1 个离心管中,加入抗凝剂,在800 g、4 ℃下离心15 min,将血浆吸取至另一个洁净的离心管中,在56 ℃灭火30 min,再以相同的条件离心30 min,去除沉淀物,收集上清液完成分离。在一个洁净的试管中,用0.9%NaCl 溶液稀释全血,使其混合均匀,然后将上清液抽取到另一洁净的离心管中,加入分离液,将稀释过的全血铺在分离液液面上部,在300~500 g、20 ℃下离心30 min,直到形成白膜层,将白膜层抽取至一离心管中,加入0.9%NaCl注射液稀释至适当浓度,混合均匀后在400~500 g、20 ℃下离心10 min,弃上清液,再重复此过程,以清洗淋巴细胞;将细胞转移至离心管中,加入磁珠分离液重悬,根据每1×107个细胞对应2~20 µl CD3 reagent 的比例加入所需CD3 Reagent,混合均匀,在4 ℃下静置15 min,取出混匀后,在 300 g、20 ℃下离心10 min,弃上清液,加入磁珠分离液重悬,以此纯化T 细胞,采用层析柱分离出来,完成T淋巴细胞的纯化。
1.2.5 蛋白免疫印迹(Western blot)法检测经IL-17A 诱导后Jurkat T 细胞、HaCat 角质形成细胞、T细胞中IL-33、ST2L 蛋白表达水平 配制上层和下层胶并插入梳子,待胶凝固后加入5 µl 蛋白样品和Marker 进行电泳,电泳结束后取出凝胶,剪相应大小的PVDF 膜,加入电转液中进行电转,牛奶封闭,加入IL-33(1∶1 000)、β-actin(1∶1 000)一抗4 ℃孵育过夜,洗膜后分别加入二抗(1∶1 000)孵育1 h,采用化学发光法检测目的条带的灰度值,以目的蛋白与β-actin 灰度值比值作为蛋白表达水平。所有实验重复3次。
1.2.6 RT-PCR 测定经IL-17A、IL-33 诱导后Jurkat T 细胞、HaCat 角质形成细胞中IL-33 mRNA 表达
提取培养48 h 后Jurkat T 细胞、HaCat 角质形成细胞和各组T 细胞总RNA,逆转录合成 cDNA,目的基因IL-33正向引物:5´-AATCAGGTGACGGTGTTG-3´,反向引物:5´-TGAAACACAGTTGGAGTGC-3´;ST2L正向引物:5´-CCCACATTCAATAGGACTG-3´,反向引物:5´-AAGAGGTGCTGTCCAGTTG-3´;GAPDH 正向引物:5´-CTCCTCCACCTTTGACGCTG-3´,反向引物:5´-TCCTCTTGTGCTCTTGCTGG-3´。采用逆转录试剂盒将其逆转录得到cDNA。PCR 反应体系为25 µl,扩增条件为:95 ℃ 预变性 30 s,循环1 次;95 ℃ 变性5 s,55 ℃ 退火30 s,72 ℃延伸30 s,95 ℃30 s,循环40 次。熔解曲线分析:将样品放置在67 ℃中保温15 s,接着以1 ℃/5 s 速度升温至95 ℃。利用EASY Dilution 将cDNA 溶液按10、100、1 000、10 000、100 000 梯度稀释(10 倍浓度稀释)后,各取2 µl 进行Real-time PCR 反应。20 µl PCR 反应液中cDNA添加量分别相当于重100 ng、10 ng、1 ng、100 pg、10 pg 的总RNA 逆转录得到的cDNA 量。通过使用实时定量PCR 对各组细胞中IL-33、ST2L 和GAPDH基因表达进行实时定量分析,采用双标曲线法来评估相互关系。采用GAPDH 作为内参,各个样品的同一个基因经过3 次重复实验,并使用去离子水取代模板作阴性对照。计算出目的基因的相对表达量,采用2-ΔΔCt表示。
1.3 统计学分析 利用SPSS25.0 和GraphPad Prism 6 软件对数据进行统计分析并制图。采用Image J 软件计算免疫组化图片的光密度值和各种染色图片中阳性细胞数,计量资料以表示。当某一组样本量<5时,采用Fisher检验,结果方差齐两样本间比较采用t检验,多组间比较以方差分析q检验,相关分析采用Pearson 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 免疫组织化学染色结果 在CON 组皮损组织中,IL-33蛋白仅少量表达于血管内皮细胞的细胞核中,表皮层中的角质形成细胞内无阳性表达,且ST2L 蛋白在CON 组的表皮角质形成细胞膜上无阳性表达,在真皮浸润的细胞膜上有极少量表达;在PV组和PP组患者的皮损中,IL-33及其受体ST2L蛋白在表皮和真皮细胞中均有不同密度的阳性染色,见图1。免疫细胞化学染色结果显示,IL-33 蛋白主要在HaCat 角质形成细胞的细胞核和部分胞质有表达,见图2。
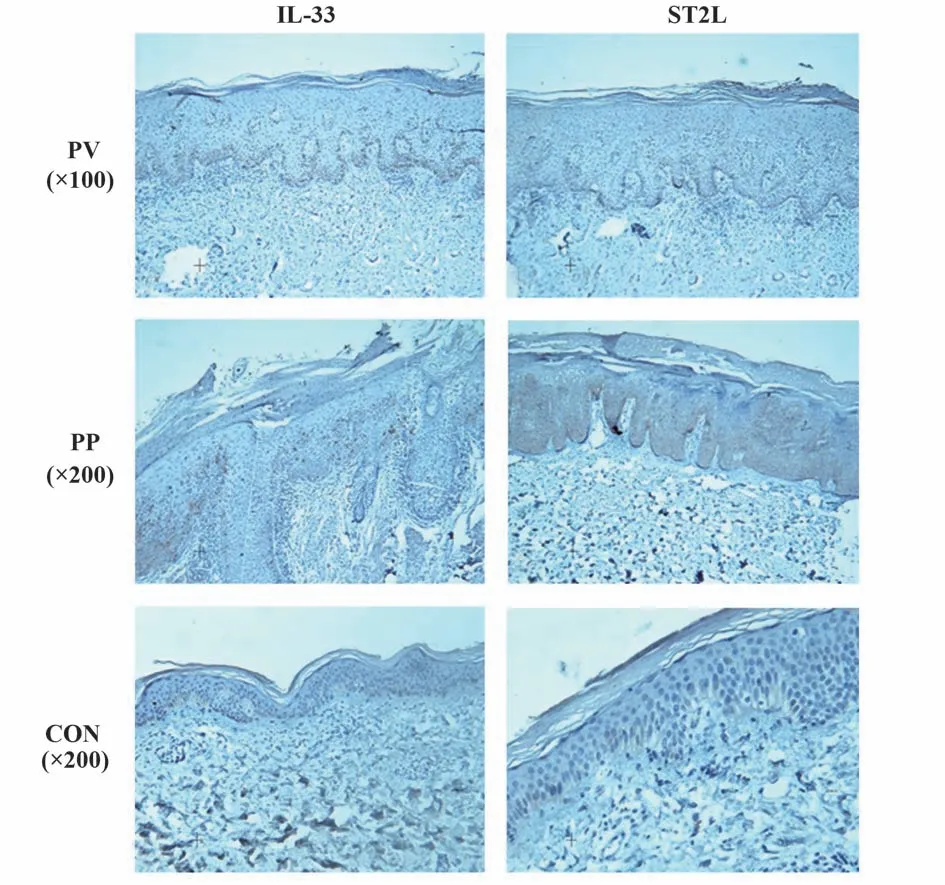
图1 免疫组织化学染色检测各组皮损组织中IL-33及其受体ST2L表达Fig.1 Expressions of IL-33 and its receptor ST2L in each groups of skin lesions were detected by immunohistochemical staining

图2 免疫细胞化学技术检测HaCat角质形成细胞中IL-33的表达(×40)Fig.2 Expression of IL-33 in HaCat keratinocytes was detected by immunocytochemistry(×40)
2.2 Western blot 法检测经IL-17A 诱导Jurkat T 细胞中IL-33 蛋白表达 不同浓度IL-17A 诱导Jurkat T 细胞表达IL-33 蛋白量不同,呈剂量依赖性,见图3A;IL-17A(200 ng/ml)诱导Jurkat T 细胞表达IL-33蛋白量在24 h为最高,见图3B。

图3 Western blot 法检测经IL-17A 诱导Jurkat T 细 胞中IL-33蛋白表达Fig.3 Expression of IL-33 protein in Jurkat T cells induced by IL-17A was detected by Western blot
2.3 Western blot 法检测IL-17A 诱导HaCat 角质形成细胞IL-33 蛋白表达情况 不同浓度IL-17A 诱导HaCat 角质形成细胞表达IL-33 蛋白量不同,呈剂量依赖性,结果见图4A。不同浓度IL-17A 诱导HaCat角质形成细胞的细胞核表达IL-33 蛋白量呈浓度依赖性,结果见图4B。
2.4 Western blot法检测各组T细胞中IL-33蛋白表达量 与CON 组比较,PV 组、PP 组T 细胞中IL-33蛋白表达量差异有统计学意义(P<0.01),其中PP组表达量明显高于PV组,结果见图5。
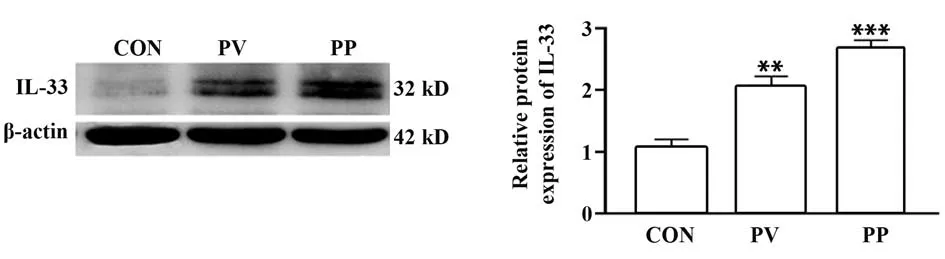
图5 Western blot 法检测各组和CON 组T 细胞中IL-33蛋白表达量Fig.5 Expression of IL-33 protein in T cells in each group was detected by Western blot
2.5 Western blot 法检测IL-33 诱导Jurkat T 细胞后各组T 细胞中ST2L 蛋白表达情况 IL-33 诱导Jurkat T细胞后PV 组和PP组患者T细胞均可表达一定量ST2L 蛋白,呈剂量依赖性,见图6;PV 组和PP 组中ST2L 蛋白表达高于CON 组在同一浓度IL-33 诱导产生的ST2L 水平;其中PP 组在IL-33(100 ng/ml)和IL-33(200 ng/ml)浓度诱导下产生的ST2L 水平均高于PV组。

图6 Western blot 法检测IL-33 诱导Jurkat T 细胞后各组T细胞ST2L蛋白表达量Fig.6 Expression of ST2L protein in Jurkat T cells after IL-33 induction was detected by Western blot
2.6 RT-PCR 检 测IL-17A 诱 导Jurkat T 细胞后IL-33 mRNA 表达量 不同浓度IL-17A 诱导Jurkat T细胞后IL-33 mRNA 表达量不同,呈剂量依赖性,见图7A;IL-17A(200 ng/ml)诱导Jurkat T 细胞后在24 h时IL-33 mRNA表达量最高,见图7B。
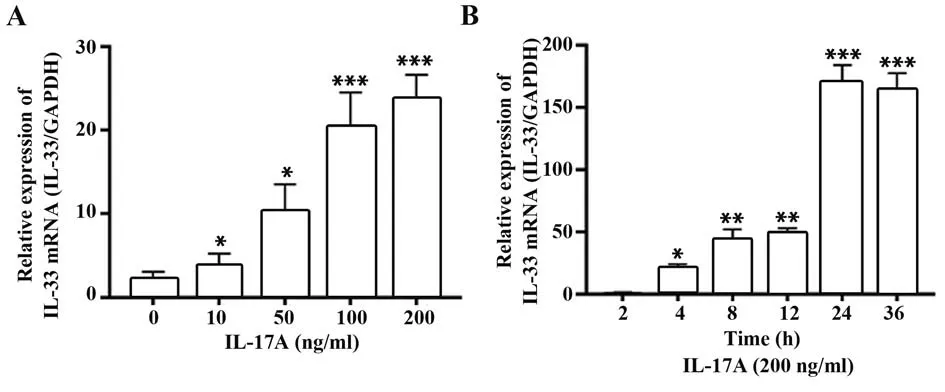
图7 RT-PCR 检测IL-17A 诱导Jurkat T 细胞后IL-33 mRNA表达Fig.7 Expression of IL-33 mRNA in Jurkat T cells induced by IL-17A was detected by RT-PCR
2.7 RT-PCR检测IL-17A诱导后HaCat角质形成细胞中IL-33 mRNA 表达量 不同浓度IL-17A 诱导HaCat 角质形成细胞后IL-33 mRNA 表达量不同,且呈剂量依赖性,见图8。
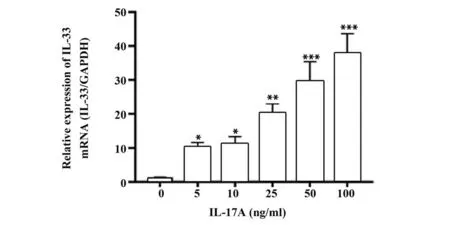
图8 RT-PCR 检测IL-17A 诱导HaCat 角质形成细胞IL-33 mRNA表达量Fig.8 IL-33 mRNA expression in HaCat keratinocytes induced by IL-17A was detected by RT-PCR
2.8 RT-PCR 检测各组T 细胞中IL-33 表达情况PV组和PP组中IL-33 mRNA有明显表达,PP组表达量高于PV组,且均高于CON组,见图9。
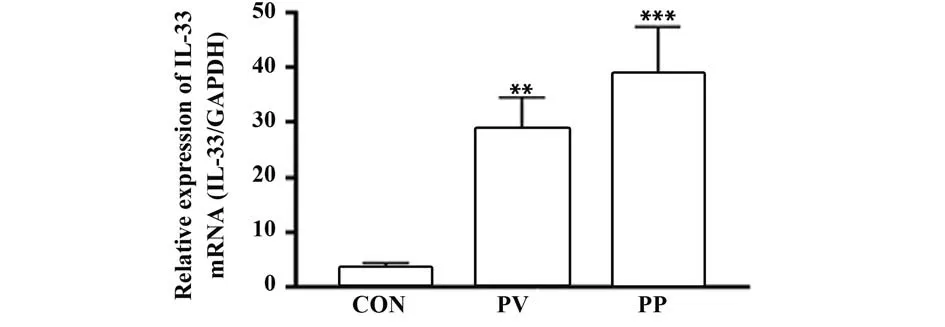
图9 RT-PCR检测各组T细胞中IL-33表达量Fig.9 RT-PCR detected expression of IL-33 in T cells in each group
2.9 RT-PCR 检测IL-33 诱导Jurkat T 细胞后各组T细胞中ST2L mRNA 表达情况 不同浓度IL-33诱导Jurkat T 细胞后PV 组和PP 组患者的T 细胞均可表达一定量ST2L mRNA,呈剂量依赖性,PV组和PP组中ST2L mRNA 表达高于在同一浓度CON 组IL-33诱导产生的ST2L mRNA 水平,见图10A;以50 ng/ml终浓度IL-33 诱导各组细胞,从0 h 至12 h 各组细胞表达ST2L mRNA 呈上升趋势,12 h 至24 h 呈下降趋势,其中PV 组和PP 组表达ST2L mRNA 显著高于同一时间点CON组水平,见图10B。

图10 RT-PCR检测IL-33诱导Jurkat T细胞后各组T细胞中ST2L mRNA表达Fig.10 Expression of ST2L mRNA in Jurkat T cells after IL-33 induction was detected by RT-PCR
3 讨论
银屑病的确切病因尚未清楚,目前认为遗传因素与环境因素相互作用,从而导致银屑病发生或加重。TNF-α 和 IFN-γ 已被证实是银屑病发病的关键因子,与疾病的严重程度具有相关性[1-2]。目前临床上应用的生物制剂主要针对炎症因子包括TNF-α、IL-12/23和IL-17A 等。为了发现更多的银屑病治疗靶点,本研究对IL-33/ST2L 在银屑病发病机制的作用进行讨论。
IL-33 是IL-1 家族的新成员,研究表明IL-33 在体内多种细胞中均可表达,其在皮肤组织细胞中高表达的特性受到关注;同时IL-33 在多种自身免疫性疾病的发病中起重要的作用,包括银屑病、系统性红斑狼疮、特应性皮炎和系统性硬化症等[3]。本研究结果表明,在PV 组和PP 组皮损中,IL-33 及其受体ST2L 蛋白在表皮和真皮细胞中有不同密度的阳性染色,与ZENG 等[4]、DONG 等[5]的研究结果一致。IL-33 通过与其受体ST2L 结合转导信号于细胞内,其后通过下游的NF-κB 转录因子在细胞的增殖和分化中发挥重要的调节作用[6]。Th17 作为CD4+效应T细胞,可以分泌IL-17A、IL-17F、IL-22等,研究发现IL-17A 是银屑病生理发病机制的关键,IL-17A具有诱导趋化、抑制中性粒细胞凋亡、促进新生血管形成、促进活化的角质形成细胞产生更多趋化因子、促进其他细胞因子(TNF-α、IL-6、IL-8)生成等作用[7]。IL-17A 能够诱导上皮细胞、内皮细胞、成纤维细胞合成分泌IL-6、IL-8 等炎症因子。角质形成细胞核中表达IL-33 受到IL-17A 刺激后可以通过一定的调节机制,发挥减弱免疫反应的作用[8]。Jurkat T细胞是来源于T 淋巴细胞和急性T 细胞白血病的细胞株,在血液病研究、基础免疫研究以及药理学研究方面有重要的作用[9]。人永生化角质形成细胞(HaCaT)的增殖、凋亡和炎症反应与银屑病的发生发展关系密切[10-11]。本研究结果发现Jurkat T 细胞、HaCat 角质形成细胞在IL-17A 诱导下IL-33 蛋白和IL-33 mRNA 呈高表达。IL-33 被认为具有抗炎和促炎作用,IL-33/ST2 轴在自身免疫性疾病中可以促进炎症细胞因子的释放,但在糖尿病等一些代谢性疾病中,IL-33 可被认为其发挥了抗炎细胞因子的作用[12]。本研究中Jurkat T细胞、PV组、PP组T细胞在IL-33 诱导下ST2L 蛋白和ST2L mRNA 呈高表达,与DONG 等[5]的研究结果一致。这些结果说明IL-33及其受体ST2L 在银屑病的发病机制中可能发挥了重要作用。
目前生物制剂治疗银屑病已取得良好的疗效,但在生物制剂治疗银屑病的过程中,患者发生湿疹样改变的情况也常有报道,其机制可能与免疫漂移、微生物定植、皮肤屏障破坏及遗传因素有关[13]。既往研究显示IL-33 及其受体ST2L 在AD 的发生发展过程中扮演重要角色,并且其在银屑病中也起重要作用,但是否是生物制剂引起免疫漂移的分子机制有待进一步研究[14]。本研究初步证实了IL-33 及其受体ST2L表达与银屑病发生发展密切相关,但在本研究中由于病例数量较少,尚未对关节病型银屑病和红皮病型银屑病患者外周血T细胞和皮损进行相关检测,故结果可能存在一定局限性,未来需要扩大样本量,并且对各种类型银屑病及其严重程度与IL-33/ST2L的相关性进行更加深入的研究。从而进一步明确IL-33/ST2L 受体与银屑病的发生、发展的关系,探讨其信号转导通路,为治疗银屑病寻找新的靶点。

