CD39 分子在子痫前期患者外周血CD4+T 细胞及脐静脉内皮细胞的表达及临床意义①
胡鑫童 凌佳怡 苏秋弟 杜 婷 沈 宇 瞿秋霞 黄 沁(苏州大学附属第一医院,苏州 215026)
全球妊娠期高血压发病率为5%~10%,其中2%~5%妊娠合并子痫前期,全球每年约76 000多名女性和50 万名新生儿因该病死亡。子痫前期的发展原因及病理生理机制特点尚未阐明,可能发生机制和病理生理学特点包括很多种复杂因素,包括滋养细胞侵袭不足、胎盘浅着床、子宫螺旋动脉重铸不良、血管内皮损伤、免疫系统失衡导致过度炎症反应等[1-3]。研究表明子痫前期是一种免疫相关性疾病,机体呈现固有免疫和适应性免疫过度激活,其发病与母体免疫失衡密切相关[4-8]。CD4+T淋巴细胞在妊娠期健康免疫环境建立中的研究已引起普遍重视,CD4+T淋巴细胞中Treg细胞群对其他效应T细胞(Foxp3-CD4+T 细胞)的免疫调控及对免疫平衡的维持具有关键意义[9]。已有研究发现,正常妊娠女性外周血Treg 水平较非妊娠女性明显升高,形成以Treg 为主的优势免疫应答,而特发性不孕症、复发性流产、子痫前期和胎儿生长受限等胎盘源性疾病均与Treg 数量或功能缺陷有关[10-11]。细胞外三磷酸二磷酸核苷酸水解酶-1(ectonucleoside triphosphate diphosphohydrolase-1,NTPDase-1,即CD39)是Treg 发挥免疫抑制作用的重要分子,主要负责将作为循环系统“危险”信号,促炎、促血栓形成的细胞外ATP、ADP(二者在组织细胞,如胎盘受损、凋亡、缺血缺氧时被大量释放到细胞外)水解为AMP,在CD73(ecto-5′-nucleotidase,细胞外5´-磷酸-核苷酸酶)作用下,AMP 去磷酸化形成具有抗炎、抗血栓作用的腺苷,CD39分子这种可将细胞外核苷酸的促炎促血栓环境转变为腺苷的抗炎抗血栓环境的独特作用使其成为调节炎症反应和血栓形成的重要“开关”[12-13]。CD39 分 子和CD73 分 子均表 达于Treg,Treg 可高效水解ATP 产生腺苷发挥免疫抑制作用,在抑制其他效应T 细胞功能方面发挥关键作用[14-15]。此外,血管内皮细胞高表达CD39 分子,在抑制血管界面血小板聚集形成血栓和炎症激活上起重要作用,对内皮细胞起保护作用[12]。本研究旨在探索子痫前期患者外周血Treg 数量及其CD39 分子表达率、脐静脉内壁细胞CD31+CD39+细胞群变化。
1 资料与方法
1.1 资料
1.1.1 研究对象 本研究为非干预性研究,病例组研究对象为2021 年1 月至2021 年12 月苏州大学附属第一医院产科收治的妊娠期高血压患者88例,其中妊娠期高血压组(GH)23 例、子痫前期组(PE)65 例,入选标准参考中华妇产科杂志《妊娠期高血压疾病诊治指南(2020)》,年龄18~45 岁,入组子痫前患者中37 例出现严重表现(如收缩压≥160 mmHg和/或舒张压≥110 mmHg、胎儿生长受限、胎儿窘迫、肝酶升高、血小板减低、腹水、胸腔积液等)归为重度子痫前期(Severe PE)组;28 例未合并严重表现的子痫前期患者归为轻度子痫前期(Mild PE)组。妊娠20周后首次出现高血压、尿蛋白阴性者纳入妊娠期高血压组。排除标准:慢性高血压合并妊娠者;慢性高血压并发子痫前期者;具有近期感染证据者;妊娠合并自身免疫性疾病者;妊娠合并肿瘤性疾病者;妊娠合并血栓性疾病者;妊娠合并糖尿病者;胎膜早破、临产及先兆早产者;有既往不良妊娠史者。另外选取2021 年1 月至2021 年12 月在苏州大学附属第一医院产科分娩的无妊娠期内外科并发症的健康妊娠妇女59 例作为正常妊娠(NP)组,年龄18~45岁,知情同意。排除标准:妊娠合并内外科疾病者;妊娠合并传染病及感染性疾病者;胎膜早破、临产及先兆早产者;有既往不良妊娠史者。入组人群全部签署知情同意书,本课题经苏州大学附属第一医院伦理委员会批准,伦理审核编号:(2021)伦研批第011号;(2021)伦研批第012号。
1.1.2 主要试剂与仪器 荧光抗体FITC anti-humman CD4、PE/Cyanine7 anti-humman CD39、PE/Cyanine7 anti-human CD45、APC anti-human CD31、PE anti-humman CD45、PE anti-humman Foxp3 均购自美国BioLegend 公司;Stem cell 分离液购自美国Alere Technologies AS 公司;C6885-Ⅱ型胶原酶购自美国Sigmaaldrich 公司;eBioscience Fixation/Permeabilization Concentrate、eBioscience Fixation/Permeabilization Diluent、Bioscience Permeabilization Buffer(×10)均购自美国Invitrogen 公司;FACS Calibur 型流式细胞仪购自美国Beckman公司。
1.2 方法
1.2.1 主要溶液配制 固定破膜工作液:实验开始前30 min 将固定破膜浓缩液和固定破膜稀释液按照1∶3 比例混合,配制1×固定破膜工作液。破膜缓冲液:实验开始前30 min 使用蒸馏纯化水稀释10×破膜缓冲液为1×破膜缓冲液。Ⅱ胶原酶溶液:100 mg Ⅱ型胶原酶粉剂溶解于100 ml DMEM 溶液配制0.01%浓度胶原酶溶液,-20 ℃储存。
1.2.2 外周血处理 Ficoll密度梯度离心法获取外周全血单个核细胞,制作600 µl单个核细胞悬浊液,分装至96 孔板的6 个微孔(100 µl/孔),按顺序加入荧光抗体各1 µl,4 ℃避光孵育30 min,抗体标记顺序:①空白对照;②CD4 FITC;③CD45 PE;④CD45 PC7;⑤CD4 FITC+Foxp3 PE;⑥CD4 FITC+Foxp3 PE+CD39 PC7;Foxp3 PE抗体为胞内抗原标记,细胞经固定及破膜处理后标记,流式细胞术检测外周血CD4+T 细胞比例及CD39 表达率、Foxp3+CD4+T 细胞(Treg)比例及CD39 表达率、Foxp3-CD4+T 细胞比例及CD39表达率。
1.2.3 脐静脉内皮细胞提取及处理 将脐带放入医用弯盘,剪去脐带上有钳夹痕及血肿部分,生理盐水清洗表面及脐静脉内血液;止血钳夹住脐带一端,用小鼠胃管向脐静脉另一端注入0.01%Ⅱ型胶原酶溶液至脐静脉充盈,结扎脐带两端,37 ℃恒温水浴消化15 min。收集脐静脉消化液和冲洗液共同放入15 ml 离心管,吹匀消化细胞,1 800 r/min 离心5 min,去上清,留取脐静脉内壁细胞沉淀,制作细胞悬浊液400 µl,将细胞悬液分别加入96 孔板的4 个微孔中各100 µl,按下列顺序加入相应荧光抗体各1 µl 进行标记:①空白对照;②CD45 PC7;③CD31 APC;④CD31 APC+CD39 PC7,4 ℃避光孵育30 min,1 800 r/min离心5 min,洗涤1次,流式细胞检测脐静脉血管内壁细胞CD31+CD39+内皮细胞群比例。
1.3 统计学处理 采用SPSS25.0软件进行统计学分析,将所有结果资料进行正态分布检验,满足正态分布的连续型数值变量采用两个独立样本t检验或K 个独立样本单因素方差分析,不满足正态分布的连续型数值变量资料使用两独立样本Man-WitneyU检验或K 个独立样本Kruskal-WallisH检验,分类资料进行卡方检验。以α=0.05为检验水准。Graph Pad Prims 9.0软件绘图,FlowJo v10.7.2软件进行流式分析。
2 结果
2.1 入组人群一般资料及临床资料比较 各组年龄、孕次、产次差异无统计学意义(表1)。NP 组收缩压、舒张压明显低于GH 组、轻度PE 组及重度PE组(P<0.05)。重度PE 组24 h 尿蛋白量明显高于GH 组及轻度PE 组(P<0.05),轻度PE 组高于GH 组(P<0.05)。重度PE组分娩孕周明显小于NP组、GH组及轻度PE 组(P<0.05);轻度PE 组分娩孕周明显小于NP 组(P<0.05)。重度PE 组新生儿出生体重明显低于NP 组、GH 组及轻度PE 组(P<0.05)。各组小于育龄儿出生比例存在明显差异,重度PE组小于育龄儿出生比例明显高于其他各组(P<0.05)。

表1 观察对象一般资料及临床资料Tab.1 General and clinical data of four groups of subjects
2.2 各组外周血比较
2.2.1 正常妊娠组、妊娠期高血压组、子痫前期组三组间比较 正常妊娠组、妊娠期高血压组、子痫前期组母体外周血CD4+T 淋巴细胞比例及CD39 表达率差异无统计学意义(P>0.05)。正常妊娠组Treg 比例及CD39 表达率明显高于子痫前期组(P<0.01),而妊娠期高血压组与正常妊娠组、子痫前期组差异均无统计学意义(P>0.05);正常妊娠组Foxp3-CD4+T 细胞比例明显低于子痫前期组(P<0.05),但CD39 表达率差异无统计学意义(P>0.05);妊娠期高血压组Foxp3-CD4+T 细胞比例及CD39表达率与正常妊娠组、子痫前期组差异无统计学意义(P>0.05,图1、图2)。

图1 NP 组、GH 组、PE 组外周血CD4+T 细胞、Treg、Foxp3-CD4+T细胞比例比较Fig.1 Comparison of proportions of CD4+T cells,Treg and Foxp3-CD4+T cells in peripheral blood of NP group,GH group and PE group
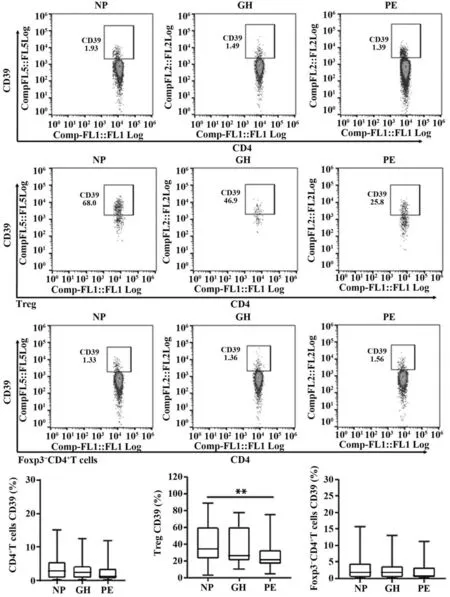
图2 NP 组、GH 组、PE 组CD4+T 细胞、Treg、Foxp3-CD4+T细胞CD39表达率比较Fig.2 Comparison of CD39 expression rates of CD4+T cells,Treg and Foxp3-CD4+T cells in NP group,GH group and PE group
2.2.2 轻度子痫前期组及重度子痫前期组比较
轻度子痫前期组和重度子痫前期组外周血淋巴细胞中CD4+T 细胞、Treg、Foxp3-CD4+T 细胞比例差异无统计学意义(P>0.05);轻度子痫前期组CD4+T细胞、Treg、Foxp3-CD4+T 细胞CD39 表达率均明显高于重度子痫前期组(P<0.01,图3、图4)。

图3 轻度PE 组与重度PE 组外周血CD4+T 细胞、Treg、Foxp3-CD4+T细胞比例比较Fig.3 Comparison of proportions of CD4+T,Treg and Foxp3-CD4+T cells in peripheral blood between mild PE group and severe PE group

图4 轻度PE 组与重度PE 组外周血CD4+T 细胞、Treg、Foxp3-CD4+T细胞CD39表达率比较Fig.4 Comparison of CD39 expression rates on CD4+T cells,Treg and Foxp3-CD4+T cells in peripheral blood between mild PE group and severe PE group
2.3 脐静脉血管内壁细胞CD31+CD39+内皮细胞群占比分析 以CD31 分子作为内皮细胞特异性标志分子,重度子痫前期组脐静脉血管内壁细胞CD31+CD39+内皮细胞群比例明显低于正常妊娠组[6.32(3.27~10.55)vs18.95(9.90~27.48),P=0.020,图5]。
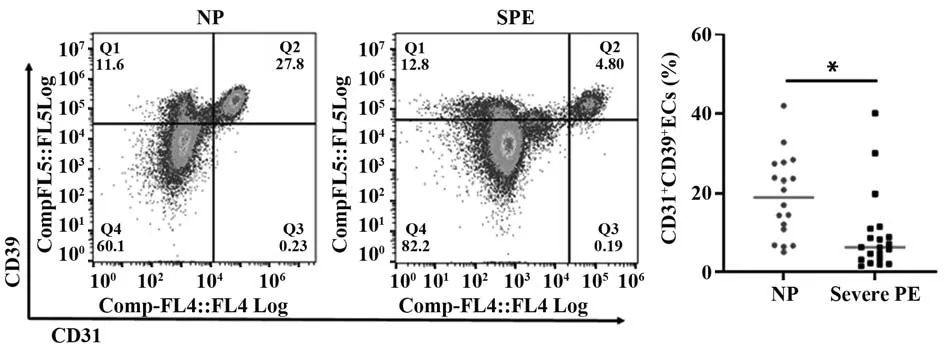
图5 NP 组与重度PE 组脐静脉血管内壁细胞CD31+CD39+内皮细胞群比例比较Fig.5 Comparison of proportions of CD31+CD39+ endothelial cells in inner wall cells of umbilical vein between NP group and severe PE group
3 讨论
子痫前期是妊娠期妇女最常见妊娠期特有的并发症,是引起孕产妇、围产儿死亡的最重要原因,与母体免疫失衡状态密切相关,表现为机体免疫抑制功能受损,促炎反应过度激活[6-7]。对正常妊娠维持来说,Treg 介导的母体对胎儿抗原的免疫耐受和母体免疫平衡是必不可少的[16-18]。本研究中,子痫前期患者体内发挥免疫抑制功能的Treg 水平较正常妊娠妇女明显下降,而外周血Foxp3-CD4+T 细胞水平(主要包括Th1、Th17、Th2 等效应T 细胞)较正常妊娠妇女升高,说明子痫前期患者机体可能长期处于炎症不受控制的免疫失衡状态。DARMOCHWAL-KOLARZ 等[19]、EGHBAL-FARD 等[20]也得到了一致结果,子痫前期患者外周血Treg 减少,且存在促炎CD4+T效应细胞如Th17细胞增加,Treg/Th17细胞比例失衡。子痫前期的慢性炎症学说、内皮功能障碍学说、螺旋动脉重铸不足学说可能与这种不平衡有关[21]。研究显示,子痫前期大鼠(RUPP)补充IL-10 因子可使外周血Treg 增加,降低RUPP 大鼠平均动脉压、促炎因子IL-6 和TNF-α 和AT1-AA(血管紧张素受体自身抗体,可作用于自身AT1 受体引起高血压)表达,减轻氧化应激[22]。CORNELIUS 等[23]将正常妊娠小鼠Treg 注射至RUPP 大鼠体内,发现RUPP+NP Tregs 大鼠平均动脉压较未接受NP 小鼠Treg 注射的RUPP 大鼠显著下降,且外周血促炎因子TNF-α、IL-17水平及胎盘和肾脏ROS水平也明显降低。可见Treg 减少可能是子痫前期母体免疫失衡的重要原因。
除Treg 减少外,子痫前期患者外周血Treg CD39表达阳性率也较正常妊娠妇女明显降低,循环中Treg 可能还存在免疫抑制功能减弱。虽然重度子痫前期与轻度子痫前期相比,Treg 在CD4+T 细胞中的比例无明显差异,但Treg CD39 表达阳性率上,重度子痫前期患者明显低于轻度子痫前期患者,因此Treg CD39 分子表达阳性率可能与子痫前期严重程度有关。实验证明CD39 在Treg 中持续而丰富地表达,与CD73 组成完整的核苷酸代谢环,通过将外周环境中的ATP 高效率代谢产生具有抗炎效应的腺苷,并作用于其他免疫细胞及自身A2A/A2B 受体,发挥且放大其免疫抑制、抗炎功能[14,24];CD39/CD73分子机制改变可破坏由Treg 主导的自身抗原免疫耐受的复杂机制,从而导致一些自身免疫性疾病发展[25-26]。如BORSELLINO 等[24]发现MS 患者外周血中CD39+Treg 数量明显低于健康对照者。也有研究证明系统性红斑狼疮患者Tregs 中CD39 表达降低,而非Treg数量减少[27]。
但Treg CD39 分子表达与妊娠期高血压发生发展是否相关知之甚少。Treg CD39 表达下降或功能受损可导致局部ATP积累,动物实验中,ATP积累可抑制大鼠滋养层细胞浸润和螺旋动脉重铸能力[28]。亦有学者表示子痫前期患者循环中被作为危险信号的ATP 水平较正常妊娠者明显升高,子痫前期妇女血浆中ATP/腺苷是健康孕妇的1.5 倍,意味着子痫前期患者ATP/腺苷向血管收缩和炎症方向转变,可能是CD39 分子表达降低水解ATP 能力下降所致[29-30]。本研究结果进一步说明子痫前期患者Treg功能受损可能是导致母体免疫失衡的原因之一。
除免疫失衡机制外,子痫前期另一重要的病理生理机制是内皮细胞损伤,血小板易被激活形成微血栓[3]。本研究结果提示重度子痫前期患者CD31+CD39+脐静脉内皮细胞群比例与正常妊娠者明显降低。CD39 是内皮细胞表面最重要的细胞外核苷酸水解酶,可水解致血小板激活的重要调节信号细胞外ATP 和ADP,生成抗血小板募集的腺苷,是内皮细胞主要的抗血栓因子[31-33]。GOEPFERT 等[34]用人CD39cDNA(RAdCD39)构建重组复制缺陷腺病毒转染人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),发现人HUVEC 细胞外核苷三磷酸二磷酸水解酶活性明显升高,CD39分子高表达抑制ATP 诱导的内皮细胞对血管性血友病因子(von willebrand factor,vWF)、E-选择素(E-selectin,介导白细胞对内皮细胞黏附)表达。其次是内皮细胞表达的CD39 对血管炎症的调节,通过调节内皮细胞和免疫细胞周围嘌呤浓度影响免疫细胞与内皮细胞黏附。高浓度ATP 可使这种黏附作用增强,而增加的腺苷可抑制这种黏附作用[35]。ANYANWU等[36]的实验结果显示CD39 基因缺陷小鼠在深静脉血栓模型中会形成较野生型小鼠更大的血栓,同时显著增强白细胞激活、趋化运动及与内皮细胞黏附。高血压小鼠模型动脉内皮细胞中发现CD39 表达和活性降低,可加剧动脉损伤、重塑和血小板活化[37]。子痫前期患者循环中血小板活化也是重要的病理生理机制,不仅促进胎盘微血栓形成,还可能加重子痫前期患者血管功能障碍[38]。
综上,子痫前期患者Treg 数量减少及其CD39表达率降低可能与免疫失衡机制密切相关;血管CD31+CD39+内皮细胞群减少可能与血管内皮损伤机制有关。

