STAT3调控P13K/Akt信号通路对食管癌细胞增殖、侵袭、迁移的影响①
南海峰 何 明 李海霞 程明菲 黄国胜
(南阳医学高等专科学校第一附属医院消化内科,南阳 473000)
食管癌是世界范围内常见的恶性肿瘤,目前我国居民生活方式的改变和医疗技术的改善已经开始对食管癌的患病率和病死率产生积极的影响,但由于食管癌早期症状不明显,一般发现时患者已经处于中晚期,往往存在不受控制的瘤体增大以及向喉返神经、气管、支气管甚至肝、脑等脏器转移,严重影响患者的生活质量与预后[1-3]。目前食管癌患者的五年生存率仍处于较低水平,这意味着在食管癌的诊治方面仍存在挑战[4]。STAT3 是信号转导和转录激活因子家族成员,该家族在机体内调控多种生物学进程的信号传递与基因表达中发挥重要作用,并且在肿瘤的发展过程中也扮演关键角色[5-6]。P13K/Akt 信号通路在肿瘤中常常呈现异常表达,且在促进肿瘤细胞增殖、迁移、侵袭以及抑制凋亡等过程中具有正向调节作用,目前国内尚无关于STAT3-P13K-Akt轴在食管癌中作用的相关研究[7-8]。为进一步研究STAT3 在食管癌细胞中的功能以及其具体机制,本研究计划利用慢病毒介导的shRNA和过表达质粒在食管癌细胞系EC106 中进行一系列实验,为食管癌的治疗和靶向药物的开发提供实验依据。
1 材料与方法
1.1 材料 人食管癌EC106 细胞株购自中国吉妮欧生物公司;RPMI1640 培养基购自Procell 公司(美国,PM150110);Lipofectamine 3000 转染试剂购自Thermo Fisher 公司(美国);STAT3、p-P13K、p-AKT、β-actin 引物由吉凯公司(上海)设计合成;Ki67、PCNA、E-cadherin、Vimentin 及β-actin 抗体购自西格玛奥德里奇贸易有限公司(上海,P6834、05-347、07-697、V6389、A5316);细胞周期检测试剂盒购自雅吉生物科技有限公司(上海,S0186);STAT3 shRNA 慢病毒载体、STAT3 过表达慢病毒载体购自科瑞斯生物科技股份有限公司(南京);总RNA 提取试剂盒及Transwell 小室购自赛默飞公司(美国,15596026、78833);Western blot 凝胶电泳仪购自六一仪器厂(北京,DYCZ-24DH);显影仪购自嘉鹏科技有限公司(上海,JP-K300);实时荧光定量PCR 仪、Transwell小室购自Thermo Fisher Scientific(美国,4453543);流式细胞仪购自BD 公司(美国,COO446);高速离心机购自日立公司(日本,CP100WX);细胞孵育箱购自川宏实验仪器有限公司(上海,CHSQ-50-Ⅲ);恒温孵育床购自米欧有限公司(杭州,ES-60E)。本研究经南阳医学高等专科学校第一附属医院消化内科伦理委员会批准(2023-xxgnk027)。
1.2 方法
1.2.1 细胞培养 将人食管癌EC106 细胞株置于适宜的生长温度细胞培养箱,随时监测细胞状态以确保其正常生长。当其处于对数生长期时进行STAT3 shRNA 慢病毒载体与STAT3 过表达慢病毒载体感染,分为对照组、沉默组及过表达组。
1.2.2 CCK-8 检测细胞增殖活性 各组EC106 细胞以5×103个/孔在96 孔细胞培养板上培养,同时用等量的无水乙醇溶剂作为溶剂空白组。在每个样品的孔中加入10 µl CCK-8溶液,并进行避光处理后进行孵育。随后,使用双波长(450 nm 和630 nm)的酶标仪测量孔中的光密度(OD)。
1.2.3 细胞周期分布 收集各组细胞,PBS清洗后离心,固定过夜,第2天离心弃上清后加入细胞周期检测试剂盒试剂,避光孵育30 min,经滤网过滤后转移至流式管中,上机检测。
1.2.4 细胞划痕实验 使用无菌吸头沿着直尺在培养细胞中划出一道直线,在划痕处用PBS 缓冲液进行两次洗涤。随后,加入不含血清的培养基,并选择0 h 和48 h 两个时间点,在显微镜下对固定点进行拍照。
1.2.5 Transwell 实验 按1∶8 稀释后的Matrigel 基质胶40 µl 加入Transwell 小室上室,在恒温孵育床上在37 ℃下恒温孵育4 h,在下室中加入500 µl含有10%FBS 的培养基,将各组细胞浓度调整至5×105个/ml 细胞。随后,取200 µl 细胞悬液添加到上室中。取出Transwell 小室,将培养基倒掉并使用PBS 缓冲液洗涤2 次。接下来,在室温下使用甲醇进行固定,然后使用0.1%结晶紫进行染色。最后,再次使用PBS 轻轻清洗小孔上方的细胞层,显微镜下对各组细胞观察计数以计算其侵袭情况。
1.2.6 RT-PCR 检测各项指标mRNA 水平 收集各组细胞通过试剂盒提取总RNA,反转录为cDNA,按照SYBR∶cDNA∶各引物∶DEPC处理水=10∶2∶0.2∶7.2 的比例配制反应体系,加入反应管中后低速离心,随后上机按照每个循环95 ℃ 15 s、60 ℃ 1 min进行40 次循环。循环完成后做溶解曲线。分析目的mRNA的相对表达量。各基因引物序列见表1。

表1 所选基因引物序列Tab.1 Sequences of selected gene primers
1.2.7 Western blot 检测增殖相关基因与上皮间质转化相关基因的蛋白水平 先采集各组细胞并加入蛋白酶抑制剂和蛋白质裂解液以提取整体蛋白。接着对蛋白浓度进行定量,将按比例将SDS 蛋白样品缓冲液添加到样品中彻底混合均匀。将样品进行上样、电泳、转膜、孵育一抗、孵育二抗等步骤,其中Ki67、PCNA、E-cadherin 及Vimentin 一抗浓度为1∶1 000,β-actin 浓度为1∶800。二抗孵育完成后洗膜,在显影仪上进行显影操作。
1.3 统计学处理 数据分析采用SPSS22.0软件分析,组间差异的比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 STAT3 对食管癌EC106 细胞增殖的影响 与对照组相比,沉默组细胞在48 h 及72 h 增殖水平显著降低(P<0.05),过表达组细胞在48 h 及72 h 增殖水平升高(P<0.05),见表2、图1。与对照组相比较,沉默组细胞被阻滞在G0/G1期,而S 期细胞数量显著减少(P<0.05)。另一方面,过表达组细胞在G0/G1期中的分布减少,而S期细胞数量增加,见图2。

图1 各组细胞增殖情况Fig.1 Cell proliferation in each group
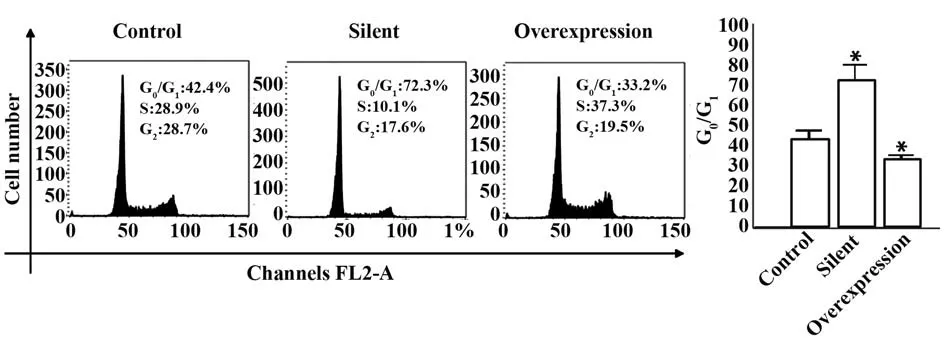
图2 各组细胞周期分布情况Fig.2 Cell cycle distribution in each group
表2 各组细胞增殖情况()Tab.2 Cell proliferation in each group()

表2 各组细胞增殖情况()Tab.2 Cell proliferation in each group()
Note:Compared with control group,1)P<0.05.
2.2 STAT3 对食管癌EC106 细胞迁移和侵袭的影响 对照组与过表达组细胞迁移数量显著增加,细胞迁移面积增大(P<0.05),沉默组细胞迁移情况不明显,见图3。Transwell 实验数据表明,与对照组相比,沉默组细胞侵袭能力显著降低(P<0.05),过表达组细胞侵袭能力增强,见表3。
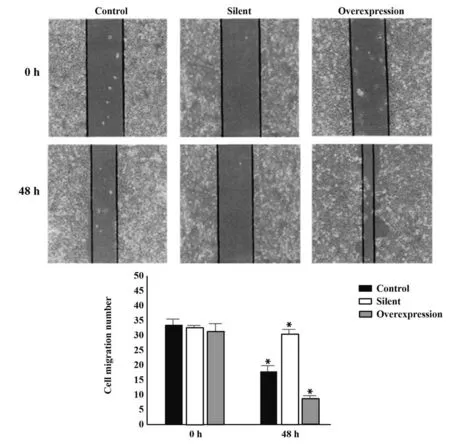
图3 各组细胞迁移情况Fig.3 Cell migration in each group
表3 各组细胞侵袭数目()Tab.3 Cell invasion numbers in each group()

表3 各组细胞侵袭数目()Tab.3 Cell invasion numbers in each group()
Note:Compared with control group,1)P<0.05.
2.3 STAT3 对食管癌EC106 细胞PI3K/Akt 的影响 RT-PCR 结果显示,与对照组相比,沉默组细胞中STAT3、P13K、Akt mRNA 表达显著降低,过表达组STAT3、P13K、Akt mRNA 表达增加(P<0.05),见图4。
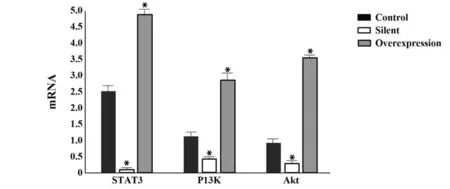
图4 各组细胞中STAT3、P13K、Akt的mRNA水平Fig.4 mRNA levels of STAT3,P13K and Akt in cells of each group
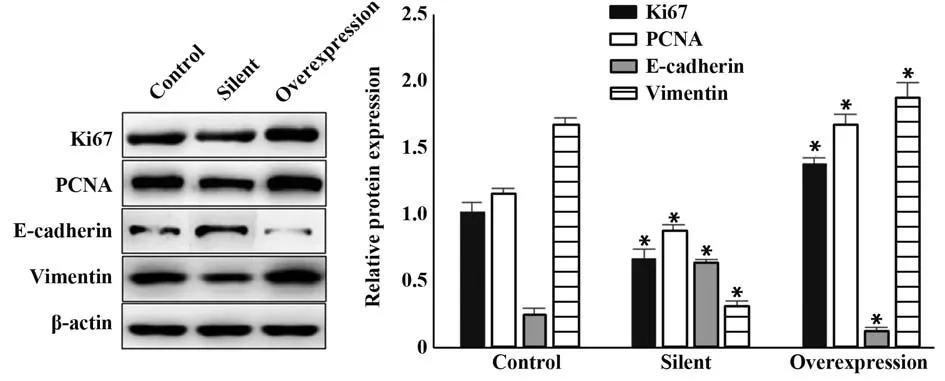
图5 各组细胞中Ki67、PCNA、E-cadherin 及Vimentin 的蛋白水平Fig.5 Protein levels of Ki67,PCNA,E-cadherin and Vimentin in each group of cells
2.4 STAT3 对食管癌EC106 细胞运动能力相关蛋白的影响 与对照组相比,沉默组细胞中Ki67、PCNA及Vimentin蛋白相对表达显著降低,E-cadherin表达显著升高(P<0.05),过表达组Ki67、PCNA及Vimentin蛋白相对表达增加,E-cadherin 表达显著降低(P<0.05)。
3 讨论
STAT3在细胞周期进程、细胞凋亡、细胞迁移与侵袭等方面的功能提示STAT3 的异常表达可能对癌症的发生发展起到关键作用[9-10]。细胞增殖是衡量细胞生物学活性的关键指标之一,与细胞异常增殖和肿瘤发生发展密切相关。多项体外实验研究结果显示,STAT3 在癌症恶化过程中具有显著的调控作用,其通过刺激肿瘤细胞增殖、减弱免疫应答和促进转移扩散等方式促进癌症进展[11]。此外,值得注意的是,STAT3在多种实体瘤中高水平表达,且其与患者不良预后之间存在显著相关性,这种关联性可能归因于其在促进癌细胞增殖、抵抗治疗和诱导转移等方面的重要作用。如STAT3 能够通过产生化学耐药性来帮助胃癌肿瘤,在另一项研究中,STAT3能够通过介导肿瘤相关巨噬细胞募集从而促进结直肠癌进展[12-13]。在本研究中,高表达STAT3的EC106 细胞增殖活性异常升高,而沉默EC106 后细胞增殖活性抑制提示STAT3 在食管癌细胞中仍是关键的促癌基因。通过以往的研究发现,肿瘤的形成与细胞周期密切相关[14]。为了探究STAT3 基因与细胞周期之间的关系,进行了一系列细胞周期实验。实验结果显示,当静默STAT3基因时,EC106细胞被阻滞在G0/G1期,从而抑制了有丝分裂过程。这个结果与细胞增殖的观察结果一致,这一结果能够解释STAT3影响细胞增殖的能力。
食管癌晚期生存率较低的原因主要在于其向正常器官的迁移与侵袭,本研究通过划痕实验及Transwell 小室实验发现STAT3 基因可以促进细胞的迁移及侵袭能力[15]。上皮间质转化(epithelialmesenchymal transition,EMT)是一种复杂的细胞生物学过程,涉及通过调节上皮型基因表达和启动间充质型基因表达程序来实现的。该过程可能引起细胞形态学的显著变化,并导致生物学行为特性的重新塑造。这些变化与恶性肿瘤中的肿瘤迁移、侵袭、干细胞活性、化疗耐药和免疫耐受等紧密相关[16]。为进一步探究STAT3 对食管癌EC106 细胞的作用,通过Western blot 观察不同表达水平的STAT3 对EMT 间质表型分子标志物Vimentin 与细胞上皮表型分子标志物E-cadheirn 的调控作用。研究表明,在肿瘤细胞的浸润与侵袭过程中,Vimentin高表达则会让细胞失去黏附加强细胞的运动能力,Vimentin 正向参与了上皮间充质转化过程[17]。Ecadherin 是一种跨膜糖蛋白,主要在细胞间发挥黏附作用。研究表明,当E-cadherin 的表达水平异常下调时,会触发上皮间质转化过程的启动,进而导致肿瘤细胞向周围组织和器官进行侵袭和转移。换言之,E-cadherin 低表达与肿瘤的浸润和转移密切相关[18]。Western blot 结果显示,STAT3 可以促进Vimentin,并下调E-cadheirn 表达,即促进食管癌细胞的EMT过程。
研究表明,P13K/Akt 信号通路在肿瘤发生和发展中扮演重要角色,并被确认为STAT3 的下游通路。该信号通路的异常表达与肿瘤的恶性增殖和转移密切相关[19]。当P13K/Akt 信号通路被激活时,其中的关键分子P13K 和Akt 会被磷酸化[20]。P13K属于脂质激酶家族,能够合成磷脂酰肌醇第二信使,与其下游的Akt发生相互作用。Akt的磷酸化作用可以抑制一些促细胞凋亡的蛋白质,同时抑制肿瘤细胞中的Akt 会明显减弱细胞的增殖能力[21]。Akt 调节对于细胞增殖的影响与其在细胞生长和分裂循环中干扰重要蛋白质的作用密切相关。P13K/Akt 信号通路在肿瘤发生过程中异常激活,其信号通路阻断剂是抗肿瘤药物研究的热门方向[22]。在本研究中,沉默STAT3 后P13K/Akt 通路的关键基因P13K 与Akt 磷酸化水平受到了显著抑制,使P13K/Akt 信号通路信号传导被阻断,而过表达STAT3 后P13K 与Akt 磷酸化水平显著增加,提示STAT3 能够调控P13K/Akt信号通路表达。
综上所述,STAT3 在食管癌EC106 细胞中作为一个促癌基因,一旦受到抑制,就能够通过阻断P13K/Akt信号通路抑制细胞周期进程与EMT 进程,从而发挥抑制增殖、侵袭及迁移的功能,可能成为食管癌治疗的潜在靶点。

