基于网络药理学分析冬虫夏草防治急性肾损伤的分子机制①
洪 涛 李晓宇 李尚妹 刘华锋③(广东医科大学附属医院肾内科,湛江 524000)
急性肾损伤(acute kidney injury,AKI)是多种原因造成的肾功能急性下降,是临床常见危重症。据报道,AKI 患病率为1.0%(社区)~7.1%(医院),医院获得性AKI病死率为40%~80%,需要肾脏替代治疗的AKI 病死率高达80%[1]。存活的AKI 患者部分经治疗后逐步恢复肾功能,但仍有少部分AKI 患者病情迁延转化为慢性肾脏病甚至演变为终末期肾脏病,需终身肾脏替代治疗。可见AKI 已成为严重威胁公共健康的问题。
尽管近年针对AKI 发病机制、诊断等有许多研究,但防治方面并无突破。目前AKI 治疗包括纠正可逆病因、维持液体电解质平衡、必要时肾脏替代治疗等;尚无循证医学证据显示某个现代药物防治AKI效果确切。近年中医药对AKI的防治研究取得了一些可喜进展。一些单味中药及其提取物可用于AKI 的动物实验或临床研究,冬虫夏草(Cordyceps sinensis,CS)是较早用于AKI 临床及动物实验的中药之一[2]。
CS 味甘性温,归肺肾二经,具有补肺益肾作用。目前临床多以人工发酵生产的菌丝体代替野生CS用于多种肾脏疾病治疗。近年多个研究报道CS 在AKI 动物模型中具有减轻肾损伤的作用[3-4]。也有多篇CS 制剂在AKI 应用的临床研究报道[5]。课题组前期曾做过AKI 患者CS 制剂的临床应用效果系统评价,提示CS 制剂可改善AKI 患者肾功能,促进肾小管功能恢复,从而改善临床治疗效果[6]。本研究采用网络药理学方法挖掘CS 多成分、多靶点、多通路防治AKI 的分子机制,为进一步研究中药防治AKI的作用机制提供参考。
1 材料与方法
1.1 CS 有效活性成分筛选 通过中药系统药理学数据库和生物信息学分析工具TCMSP(http://tcmspw.com/index.php)筛选CS 的化学成分。根据TCMSP 数据库建议的筛选条件(https://old.tcmsp-e.com/load_intro.php?id=29)并参考既往文献,以口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18 为筛选条件[7-8],得到CS的口服有效活性成分;同时查阅CNKI 及Pubmed 中关于CS的中英文文献,得到其有效单体成分数据信息,最终确定CS口服有效活性成分纳入后续分析。
1.2 CS 活性成分作用靶点预测 通过TCMSP 数据库检索以上活性成分对应靶点,并通过Uniprot(http://www.uniprot.org)数据库将靶点蛋白转化为相应基因名。
1.3 AKI 相关疾病靶点数据构建 在DisGeNET(http://www.disgenet.org/home)、GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、TTD(http://db.idrblab.net/ttd/)4 个数据库中检索“acute kidney injury”,检索人类AKI 相关基因,得到AKI治疗靶点。
1.4 “药物-成分-靶点-疾病”网络构建 将CS成分靶点基因数据集与AKI相关靶点基因数据集进行对比分析,取二者重叠,得到CS 作用于AKI 的靶点数据集,并以Venn 图形式绘制。通过STRING 数据库(http://string-db.org)构建CS 有效成分作用于AKI靶点的相互作用网络图。
1.5 药物疾病靶网蛋白相互作用筛选 通过Cytoscape 3.8.0 对各味中药“活性成分-AKI 疾病靶点网络”蛋白互作关系进行分析,得到靶蛋白度值,筛选得到核心蛋白互作网络图。
1.6 基因功能聚类和富集分析 DAVID 是高通量的生物数据功能挖掘工具,旨在系统全面地为大规模基因或蛋白列表提供生物学意义,可对单个基因进行分析注释构建GO 富集,包括生物学过程(biological process,BP)、分子功能(molecular function,MF)、细胞成分(cellular component,CC)。将CS 与AKI 共同靶点数据集信息导入DAVID(https://david.ncifcrf.gov/)进行GO 富集分析,得到显著富集的主要功能注释。KEGG 数据库整合了基因组、化学和系统功能信息,最核心的是KEGG PATHWAY数据库,可利用图形介绍众多信号通路及各通路间的关系。将CS 与AKI 共同靶点数据集信息导入KEGG 数据库(https://www.kegg.jp)进行“药物-AKI疾病作用靶点”通路富集分析,得到显著富集的信号通路。
2 结果
2.1 CS有效活性成分筛选及靶点预测 在TCMSP数据库中以OB≥30%、DL≥0.18为筛选条件,得到CS有效化合物7 个:arachidonic acid(花生四烯酸,TCMSP 数据库分子号:MOL001439)、Linoleyl acetate(乙酸亚油醇酯,TCMSP 数据库分子号:MOL0-01645)、beta-sitosterol(β-谷甾醇,TCMSP 数据库分子号:MOL000358)、Peroxyergosterol(过氧麦角甾醇,TCMSP 数据库分子号:MOL011169)、cerevisterol(酒酵母甾醇,TCMSP 数据库分子号:MOL008998)、cholesteryl palmitate(胆甾醇软脂酸酯,TCMSP 数据库分子号:MOL008999)、CLR(胆甾醇,TCMSP 数据库分子号:MOL000953);查阅既往文献发现许多研究认为虫草素是CS 的主要活性成分,具有抗肿瘤、免疫调节、保护肾脏等药理学活性[9-11]。虫草素及其异构体在TCMSP 数据库中的分子编码为MOL00-9000、MOL009001,OB 均>30%,但DL 分别为0.16及0.17,故以DL≥0.18 为筛选条件时未将其纳入筛选结果,为避免遗漏重要成分,将这两个分子一并纳入分析。以上9 种有效活性成分中仅有6 种在TCMSP 中有对应作用靶点,其他3 个有效成分目前在数据库中无对应靶点信息,对应靶基因共84 个(图1)。
2.2 AKI 相关靶点数据构建 在DisGeNET 数据库、GeneCards、OMIM、TTD 数据库检索人类AKI 相关基因,获得AKI治疗靶点信息。其中DisGeNET数据库以Score≥0.8 为筛选条件得到1 148 个基因信息,GeneCards 以relevance Score≥1 得到7 149 个基因信息,OMIM 得到93 个基因信息,TTD 得到2 个基因信息。利用R 软件将以上4 个数据库所得AKI 相关靶标信息取并集,共得到7 370 个基因信息,Venn图见图2。

图2 DisGeNET、GeneCards、OMIM、TTD 4 个数据库的AKI相关靶基因数据集合Fig.2 AKI-related target genes got through DisGeNET,GeneCards,OMIM and TTD databases
2.3 CS-AKI共同靶点数据构建 使用R语言将CS的有效成分靶点基因数据集与AKI相关靶点基因数据集进行对比,取交集,得到CS 作用于AKI 的靶点数据集,共63个基因信息,Venn图见图3。

图3 CS有效成分与AKI作用靶点交集Venn图Fig.3 Venn diagram of CS bioactive components and AKI-related genes
2.4 CS活性成分-AKI相应靶点调控网络构建 运用Cytoscope3.8.0 软件构建中药“活性成分-靶点”网络,可见CS 中6 种有效成分通过网络协同作用于63个靶标发挥对AKI的作用(图1)。
2.5 CS-AKI 共同靶点的PPI 网络构建与核心靶点筛选 将上述共同靶点导入String数据库评估蛋白-蛋白互作信息,以相互作用分值可信度(interaction score confidence≥0.9)为筛选条件,隐藏与其他基因无相互作用的靶点,构建靶点蛋白-蛋白互作网络图(图4),节点表示靶点蛋白,每条边表示靶点蛋白间的相互作用,线条越多表示关联度越大。借助Cytospace 计算连接节点数最多的基因,前10 位核心基因为RXRA、MAPK1、CASP3、CASP8、TNFRSF1A、RELA、JUN、PRKCA、TGFB1、PPARG,核心靶标网络见图5。
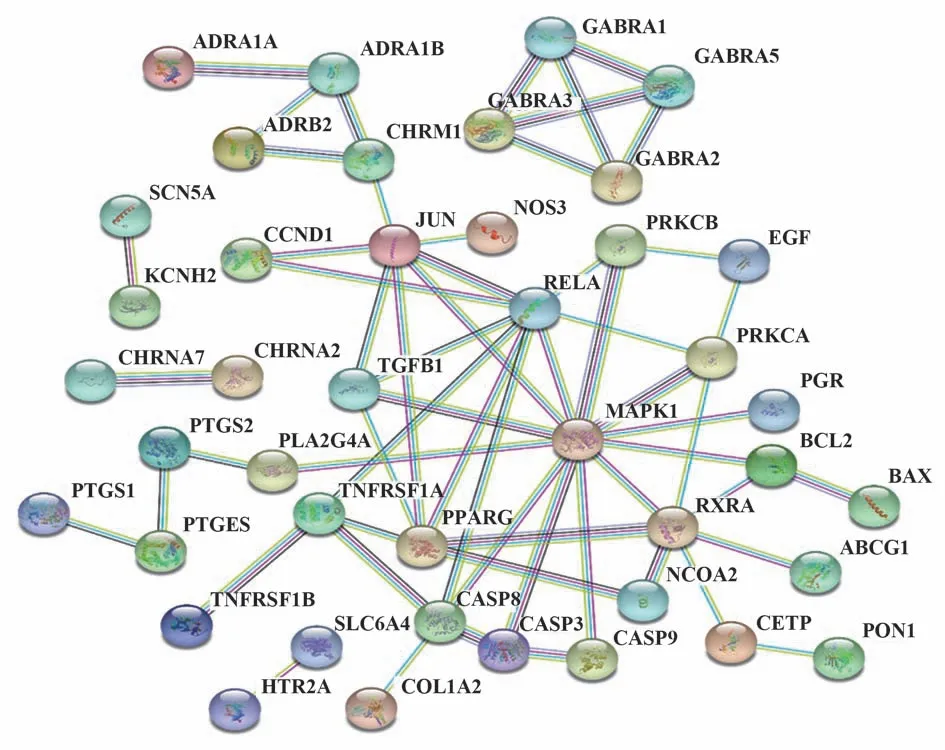
图4 CS与AKI共同靶点的蛋白互作网络Fig.4 Protein-protein interaction network of CS and AKI targets
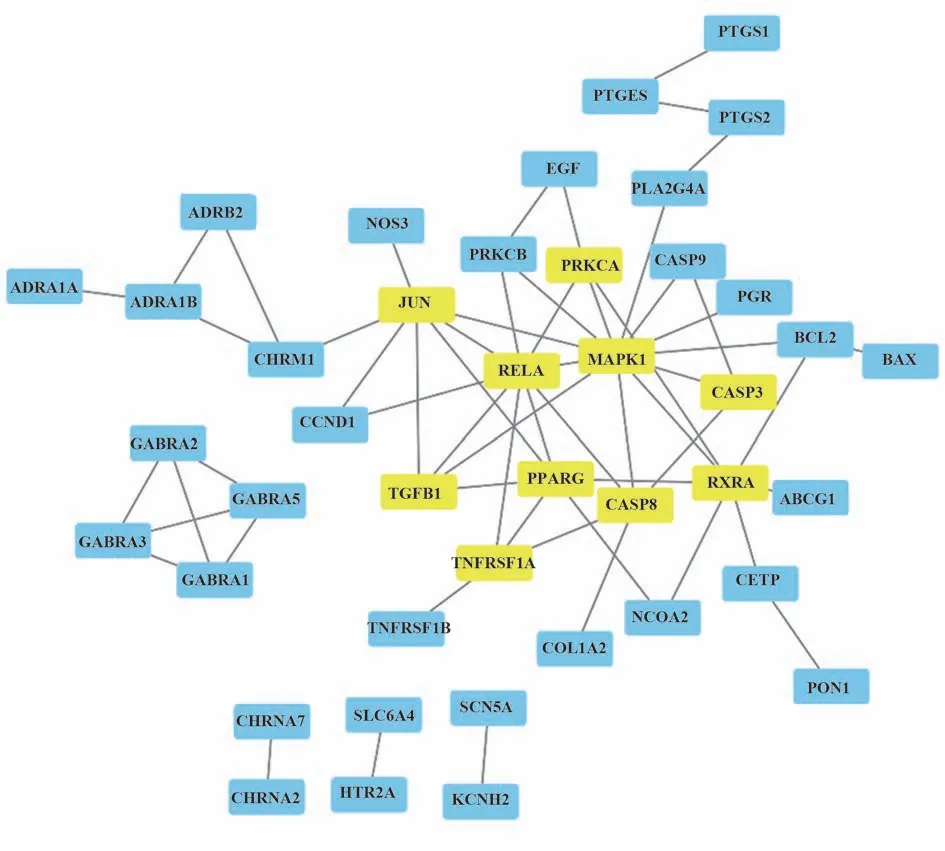
图5 CS与AKI核心靶点的网络图Fig.5 Network of CS and AKI core targets
2.6 GO 功能富集分析 将CS 作用于AKI 的靶点导入DAVID 数据库平台进行GO 富集分析,CS 对AKI 作用的BP 主要富集于细胞增殖调控、细胞凋亡、炎症反应、衰老等(表1)。应用R 语言根据Enrichment score(-logP)对富集的前10 个BP、CC、MF进行柱状图可视化(图6)。

表1 CS作用于AKI的GO聚类富集结果(前17位)Tab.1 GO enrichment of CS in treatment of AKI(Top 17)

图6 GO富集分析Fig.6 GO enrichment analysis
2.7 KEGG 功能富集分析 将药物与疾病交集靶点导入KEGG 数据库进行KEGG 通路富集分析,共得到143条信号通路,主要富集通路见表2。对其中的PI3K-Akt 信号通路进行可视化以呈现靶点及其上下游分子的调控关系(图7)。

表2 CS防治AKI的KEGG主要富集通路Tab.2 KEGG enrichment pathway of CS protecting AKI
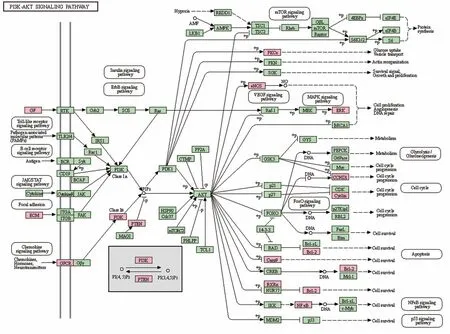
图7 PI3K-Akt信号通路中CS作用于AKI的靶点分布图Fig.7 Target distribution map of CS acting on AKI in PI3K-Akt signaling pathway
3 讨论
网络药理学近年已成为中药药理学的研究热点,从分子水平预测药物治疗疾病的靶点、通路,揭示中药治疗疾病多通路多靶点起作用的复杂方式。本研究运用该方法分析CS防治AKI的分子机制,构建相应的“药物-成分-靶点-疾病”作用网络图以及这些潜在靶点蛋白间相互作用的网络图,并对治疗靶点进行了GO 功能富集分析和KEGG 通路富集分析。CS 主要有9 种有效活性成分:TCMSP 数据库分子号分别为MOL001645、MOL000358、MOL001439、MOL000953、MOL011169、MOL008998、MOL008999、MOL009000、MOL009001,通过63 个靶点发挥对AKI的防治作用。
本研究发现CS保护AKI的核心靶点主要包括:
RXRA、MAPK1、CASP3、CASP8、TNFRSF1A、RELA、JUN、PRKCA、TGFB1、PPARG,这些靶点可能通过影响对药物的反应、信号转导、衰老调控、细胞增殖和凋亡调控、炎症反应、对缺氧的反应等参与AKI发生。
本研究发现CS 作用于AKI 的靶点富集通路主要包括:PI3K-Akt 信号通路、MAPK 信号通路、细胞凋亡通路、TNF 信号通路、P53 信号通路、HIF-1 等,可能涉及细胞生长与凋亡、炎症反应、细胞自噬、铁死亡等多种生物学过程。其中PI3K-Akt 信号通路是富集程度较高的通路和关键信号通路。近期CS药理作用及机制研究发现CS 可通过调控NF-κB 通路发挥抗肿瘤作用[12];可通过抑制PI3K-Akt 通路调节肾小管上皮细胞凋亡[13];通过调控mTOR 通路诱导肿瘤细胞凋亡和自噬[14];通过Nrf2 调控HO-1 通路增强肺上皮细胞对缺氧的耐受性[15]。这些体内外研究报道与本研究结果一致,表明CS对肾脏保护作用的分子机制值得进一步研究和系统挖掘。
PI3K 是由调节亚基P85 和催化亚基p110 构成的二聚体,与生长因子受体结合可改变Akt 蛋白结构并使其活化,并以磷酸化作用激活或抑制下游一系列底物,如凋亡相关蛋白Bad/Caspase9活性,从而调节细胞增殖、分化、凋亡及迁移等生物学行为。Akt 也可激活IKK,与NF-κB 通路存在交叉。PI3K/Akt 下游靶点为雷帕霉素靶蛋白(mTOR),而mTOR下游转录因子则包括HIF1α、c-Myc 等。抑癌蛋白PTEN 作为磷酸酶可使Akt去磷酸化而减少活化,阻止所有Akt 调控的下游信号传导事件,是PI3K 的负向调控因子。近年大量研究发现PI3K/Akt/mTOR信号通路在肿瘤发生和治疗具有重要作用[16-18],也有报道其在阿尔茨海默病发生和治疗中有重要作用[19]。本研究通过网络药理学分析推测CS 对AKI的防治作用可能与多条信号通路相关,其中PI3K/Akt/mTOR 信号通路是核心通路,与炎症通路TNF、NF-κB 信号通路、MAPK 信号通路、细胞凋亡通路等均存在交叉相关,在AKI 中的作用及治疗价值尚待进一步研究。
综上,本研究从网络药理学角度发现了CS防治AKI 的主要有效成分和关键靶点,通过对作用靶点的GO 和KEGG 通路富集分析推测CS可能通过调节PI3K-Akt 信号通路等多条信号通路介导细胞凋亡、细胞自噬、铁死亡、炎症反应等病理生理过程,从而发挥对AKI的肾脏保护作用。但本研究单纯从网络药理学角度对现有数据库进行了挖掘,存在一定局限性,为后续进一步研究CS防治AKI的作用机制提供了理论依据。

