T 细胞免疫球蛋白黏蛋白分子3 对宫颈癌细胞生物学行为及肿瘤免疫微环境的影响①
陈秀敏 吴熊军 许文彬 邓乾葆(海南医学院第二附属医院妇产科,海口 570311)
宫颈癌是全世界女性第二大常见恶性肿瘤,发病率仅次于乳腺癌,发病率和病死率均呈上升趋势,且发病人群逐渐年轻化[1-3]。随着诊断技术和医疗水平不断提高,宫颈癌患者预后得到了明显改善,但发生远处转移的患者预后仍很差。此外,部分治愈的宫颈癌患者也会出现局部复发或远处转移,导致患者生存期严重缩短[4]。具有共刺激和共抑制信号的免疫检查点受体是机体免疫系统的重要调节剂,抑制免疫检查点受体的T 细胞表达是降低肿瘤逃避或削弱宿主免疫力的关键机制。Tim-3是一种新鉴定的免疫检查点受体,在多种细胞中表达,如NK 细胞、T 细胞、Treg 细胞、肥大细胞及肿瘤细胞[5-6]。越来越多的证据表明,Tim-3 在肿瘤细胞中的表达可能直接或通过抑制免疫作用促进肿瘤发生和转移[7]。肿瘤免疫微环境在肿瘤中起重要作用,并与肿瘤进程密切相关。本研究通过检测宫颈癌组织Tim-3 表达,进一步探究其对宫颈癌体内外生长的影响以及对肿瘤微环境的作用,以期为宫颈癌诊治提供新思路。
1 资料与方法
1.1 资料
1.1.1 临床资料 选择海南医学院第二附属医院2018年6月至2020年6月收治且病理学检查确诊为宫颈癌的肿瘤组织30例,并取距宫颈癌组织3 cm以上的组织作为癌旁组织标本。患者年龄32~69 岁,平均(49.62±4.12)岁。所有患者临床资料完整,手术前未经过化疗、放疗及免疫治疗等任何治疗,并排除转移性宫颈癌或患有其他系统恶性肿瘤患者,本研究经海南医学院第二附属医院伦理委员会批准:K20180524152。
1.1.2 主要材料与试剂 4周龄SPF级雌性BALB/c裸鼠30 只,体质量18~20 g,标准饲料喂养,自由饮水摄食,每日光照/黑暗交替12 h。人宫颈癌细胞系HeLa 购自中国科学院典型培养物保藏委员会细胞库;胰蛋白酶、胎牛血清、青-链霉素双抗、DMEM 培养液(美国Gibco 公司);免疫组化染色试剂盒、HE染色试剂盒、ELISA 检测试剂盒(南京凯基生物公司);RNA 抽提试剂盒、反转录试剂盒和荧光定量检测试剂盒(日本TaKaRa 公司);CCK-8 试剂盒(美国eBiosence 公司);EdU 染色试剂盒(南京诺唯赞生物公司);TUNEL 试剂盒、Transwell 小室(美国Invitrogen 公司);PVDF 膜、ECL 及BCA 测定试剂盒(上海碧云天生物研究所);兔抗人Tim-3、Ki-67 单克隆抗体(美国Santacruz 公司);鼠抗人GAPDH 单克隆抗体和辣根过氧化物酶标记的山羊抗兔IgG(武汉博士德生物公司);其他试剂均为国产分析纯;基因引物序列合成、Tim-3 shRNA 慢病毒质粒及阴性对照NC shRNA 慢病毒质粒设计构建均由上海吉玛生物技术有限公司完成。
1.2 方法
1.2.1 免疫组化染色检测宫颈癌组织及癌旁组织Tim-3 表达 将收集的宫颈癌组织及癌旁组织置于4%多聚甲醛固定24 h,常规石蜡包埋,制备组织切片。切片经脱蜡脱水处理后,PBS冲洗,加入柠檬酸钠修复抗原,0.3%过氧化氢液室温孵育10 min,10%山羊血清封闭,滴加兔抗人Tim-3(1∶100)一抗4 ℃孵育过夜。次日PBS 冲洗,滴加辣根过氧化物酶标记的山羊抗兔IgG(1∶5 000)二抗,室温孵育1 h,DAB显色,流水冲洗,苏木精复染,脱水透明,中性树胶封片,光学显微镜下随机选择6 个视野观察并评分,以染色强度(未染色为0 分,浅黄色为1 分,棕黄色为2分,黄褐色为3分)和阳性细胞占比(每个视野100 个细胞中染色细胞百分比,<25%为1 分,25%~49%为2分,50%~74%为3分,≥75%为4分)综合得分进行判定,<4分为阴性,≥4分为阳性。
1.2.2 qRT-PCR 检测宫颈癌组织、癌旁组织及各组HeLa 细胞Tim-3 mRNA 表达 采用RNA 抽提试剂盒并严格按照说明书步骤提取总RNA。收集RNA 样品,逆转录合成cDNA,qRT-PCR 检测Tim-3 mRNA 表达,PCR 扩增体系根据试剂盒说明书进行配制,在BioRad CFX96系统设置程序进行扩增。扩增结束后,2-ΔΔCt计算基因相对表达,β-actin 为内参,引物序列为Tim-3 F:5´-CCAAATCCCAGGCATAAT-3´,R:5´-AAGCGACAACCCAAAGGT-3´;β-actin F:5´-ATGGTGGGAATGGGTCAGA-3´,R:5´-TCTCCATGTCAGCCAGTTG-3´。
1.2.3 细胞培养、分组与转染 取人宫颈癌HeLa细胞复苏,添加含10%胎牛血清、1%青霉素/链霉素的DMEM 培养液,37 ℃、5%CO2培养,每2~3 d 进行换液,传代培养。细胞以2×104个/孔接种于96 孔板,恒温过夜培养,随机分为3 组并进行相应处理:对照组(正常培养)、NC shRNA 组(转染阴性对照NC shRNA慢病毒质粒)、Tim-3 shRNA组(转染Tim-3 shRNA 慢病毒质粒),MOI=100,加入5 µg/ml Polybrene 试剂,培养12 h,更换为新鲜培养液,后续使用0.5 mg/L 嘌呤霉素筛选,每隔1 d 换液,2 周后得到稳定转染的HeLa细胞。
1.2.4 Western blot 检测各组HeLa 细胞Tim-3 蛋白表达 收集转染后HeLa 细胞,PBS 清洗,使用新鲜配制的RIPA 裂解缓冲液提取总蛋白,冰上裂解30 min,BCA 定量,制备10%SDS-PAGE 凝胶,取稀释的各组等量蛋白样品加入上样孔,恒压电泳分离,转至PVDF 膜,5%脱脂奶粉封闭2 h,TBST 洗膜,加入兔抗人Tim-3 一抗(1∶500),4 ℃孵育过夜。次日TBST 洗膜,加入对应二抗(1∶5 000),室温孵育1 h,TBST 再次洗膜,ECL 显色,凝胶成像系统拍照,以GAPDH 为内参,Image Pro-Plus 系统分析各蛋白条带灰度值。
1.2.5 CCK-8 检测各组HeLa 细胞增殖活性 转染后的HeLa 细胞分别于培养24 h、48 h、72 h 时,每孔加入10 µl CCK-8,轻轻混匀,继续孵育2 h,酶联免疫检测仪测定各孔细胞450 nm处吸光度。
1.2.6 EdU 染色检测各组HeLa细胞增殖水平 收集转染后的HeLa 细胞,调整密度按1×105个/孔接种于24 孔板,37 ℃、5%CO2培养24 h,弃原培养液,使用含终浓度为10 µmol/L的EdU培养2 h,弃培养液,PBS洗涤,4%多聚甲醛室温固定20 min,甘氨酸孵育5 min,PBS洗涤,滴加0.5%Triton X-100透膜10 min,PBS 再次洗涤,加入Apollo567 荧光染料,室温避光染色30 min,DAPI 避光染核30 min,封片,激光共聚焦显微镜下观察,蓝色荧光为细胞核,红色荧光为EdU标记的阳性细胞。
1.2.7 Transwell 检测各组HeLa 细胞迁移与侵袭
基质胶包被Transwell 小室上层底部,静置形成基质膜。将转染后HeLa 细胞密度调整为1×105个/ml,Transwell 小室上层移入100 µl 细胞悬液,下层加入500 µl含10%胎牛血清的新鲜培养液恒温孵育36 h,取出小室,4%多聚甲醛固定下层穿出细胞,0.1%结晶紫染色,PBS清洗后晾干,光学显微镜下观察侵袭细胞数并拍照,随机选取5个高倍视野计数,结果取平均值。Transwell 检测细胞迁移实验除不铺基质胶外,其他步骤均与上述侵袭检测步骤相同。
1.2.8 宫颈癌裸鼠皮下移植瘤模型建立 将30只SPF 级裸鼠随机分为NC shRNA 组和Tim-3 shRNA组,每组15只,背部皮肤常规消毒。取转染NC shRNA和Tim-3 shRNA的HeLa细胞,调整密度为2×107个/ml,两组裸鼠分别注射转染NC shRNA、Tim-3 shRNA 的HeLa 细胞,右侧腋窝皮下接种进针,将0.2 ml 单细胞悬液推注于皮下,夹紧针孔以防渗漏。注射完毕后将裸鼠放入笼中继续饲养,每日观察接种部位移植瘤生长,背部皮下出现硬结节表明肿瘤长出。定时用游标卡尺测量瘤体,计算移植瘤体积,21 d后处死裸鼠,抽取腹主动脉血,解剖取其肿瘤组织和脾脏组织,测量瘤体体积、称重,将组织一部分固定于10%甲醛,一部分置于液氮迅速冷冻后-80 ℃保存。
1.2.9 HE 染色检测各组裸鼠肿瘤组织病理学变化 取固定于10%甲醛的两组裸鼠肿瘤组织,修剪,常规石蜡包埋,切4 µm石蜡片,脱蜡去水,HE染色。苏木精染色4~8 min,流水冲洗,1%盐酸/乙醇溶液分化,洗净,曙红染色2~3 min,脱水透明后封片,晾干,光学显微镜下观察病理组织变化并拍照。
1.2.10 TUNEL 检测各组裸鼠肿瘤组织细胞凋亡 肿瘤组织石蜡切片脱水透明,加入20 µg/ml Proteinase K,37 ℃恒温孵育30 min,室温继续孵育20 min,PBS冲洗,滴加50 µl TUNEL 检测液,室温孵育1 h,加过氧化物酶转化剂继续孵育30 min,PBS冲洗,DAB 显色,苏木素复染,脱水透明,中性树胶封片,光学显微镜观察并拍照,随机选择5个视野计数该视野下200 个细胞中阳性细胞数,计算TUNEL阳性细胞率。
1.2.11 ELISA检测各组裸鼠血清相关因子水平将抽取的两组裸鼠血液分别置入EDTA 抗凝管,室温静置,4 000 r/min 离心5 min,收集血清,ELISA 检测血清TNF-α、IL-1β、IL-6、IL-12 水平,实验严格按照试剂盒说明书执行。
1.2.12 流式细胞术检测各组裸鼠脾脏组织CD4+、CD8+细胞比例 将分离的裸鼠脾脏组织使用生理盐水洗净,分离脾脏细胞,添加细胞培养液培养,调整细胞浓度为1×105个/ml,取100 µl 置于无菌离心管,依次加入10 µl CD4-FITC 单克隆抗体、CD8-PE单克隆抗体,混匀,室温避光孵育30 min,1 000 r/min离心5 min,弃上清,加入500 µl固定液保存30 min,流式细胞仪检测脾脏组织CD4+T、CD8+T细胞表达。
1.3 统计学分析 采用SPSS23.0软件进行统计分析,计量资料均用表示,单因素方差分析进行多组间数据比较,组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 宫颈癌组织及癌旁组织Tim-3 表达比较
qRT-PCR 结果显示,宫颈癌组织Tim-3 mRNA 表达较癌旁组织显著升高(P<0.05,图1A)。免疫组化染色结果显示,癌旁组织无明显阳性染色,而宫颈癌组织有大量阳性着色胞核和胞质,宫颈癌组织Tim-3蛋白表达率(90.00%,27/30)较癌旁组织Tim-3蛋白表达率(6.67%,2/30)显著升高(P<0.01,图1B)。

图1 宫颈癌组织及癌旁组织Tim-3表达Fig.1 Tim-3 expression in cervical cancer tissues and adjacent tissues
2.2 转染后HeLa 细胞Tim-3 表达变化 将Tim-3 shRNA 慢病毒质粒转染至HeLa 细胞,qRT-PCR 和Western blot 检测发现,与对照组比较,Tim-3 shRNA组HeLa 细胞中Tim mRNA 和蛋白表达均显著下降(P均<0.01),而NC shRNA组与对照组Tim-3 mRNA和蛋白表达差异均无统计学意义(P=0.214、P=0.259,图2)。
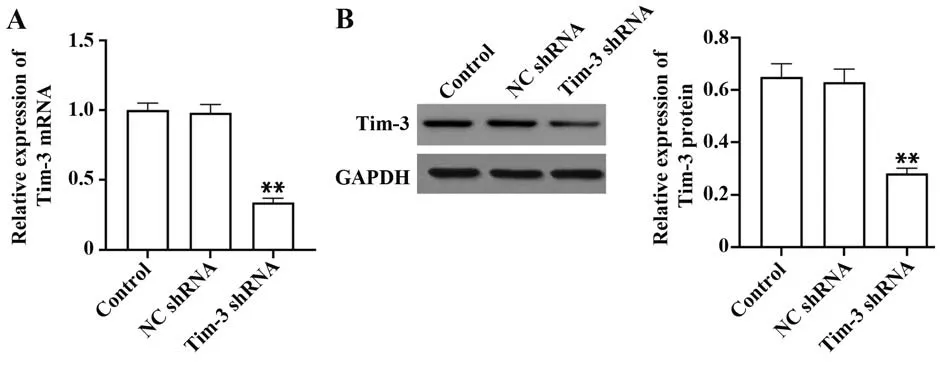
图2 转染后HeLa细胞Tim-3 mRNA与蛋白表达Fig.2 Tim-3 mRNA and protein expression in HeLa cells after transfection
2.3 抑制Tim-3 表达对HeLa 细胞增殖的影响
CCK-8 检测结果显示,转染48 h 和72 h 后,Tim-3 shRNA 组HeLa 细胞活性显著低于对照组(P均<0.01),NC shRNA 组与对照组细胞活性差异无统计学意义(P=0.241、P=0.426,图3)。EdU 染色结果显示,对照组和NC shRNA 组有大量EdU 标记的阳性细胞表达,两组间差异无统计学意义(P=0.108),而Tim-3 shRNA 组EdU 标记的阳性细胞较对照组显著减少(P<0.01,图4)。
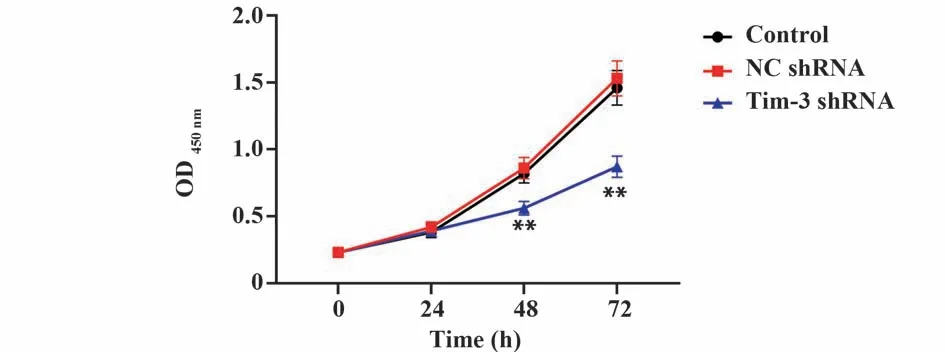
图3 CCK-8检测各组HeLa细胞活性Fig.3 CCK-8 detects activity of HeLa cells in each group

图4 EdU染色检测各组HeLa细胞增殖Fig.4 EdU staining detects proliferation of HeLa cells in each group
2.4 抑制Tim-3 表达对HeLa 细胞迁移与侵袭的影响 Transwell 检测结果显示,Tim-3 shRNA 组HeLa细胞迁移数和侵袭数均少于对照组(P均<0.01),而NC shRNA 组和对照组细胞迁移数和侵袭数差异均无统计学意义(P=0.067、P=0.120,图5)。

图5 Transwell检测各组HeLa细胞侵袭与迁移Fig.5 Transwell detects invasion and migration of HeLa cells in each group
2.5 裸鼠宫颈癌移植瘤生长情况 两组裸鼠肿瘤长出后测量肿瘤体积大小,测量的第6、9、12、15、18、21 天,注射转染Tim-3 shRNA 的HeLa 细胞组裸鼠肿瘤体积显著小于注射转染NC shRNA 的HeLa细胞组裸鼠肿瘤体积(P均<0.01,图6)。

图6 裸鼠移植瘤体积比较Fig.6 Comparison of volume of transplanted tumors in nude mice
2.6 裸鼠宫颈癌移植瘤质量 肿瘤长出后第21天时解剖两组裸鼠肿瘤组织,可见注射转染Tim-3 shRNA 的HeLa 细胞组裸鼠肿瘤组织小于注射转染NC shRNA 的HeLa 细胞组(图7A);注射转染Tim-3 shRNA 的 HeLa 细胞组裸鼠肿瘤质量显著低于注射转染NC shRNA的 HeLa细胞组裸鼠(P<0.01,图7B);HE 染色、TUNEL 染色和免疫组化染色观察发现,相较于注射转染NC shRNA 的HeLa 细胞组裸鼠肿瘤组织,注射转染Tim-3 shRNA 的HeLa 细胞组裸鼠肿瘤组织细胞凋亡数较多,增殖数较少(图7C)。

图7 裸鼠宫颈癌移植瘤质量比较Fig.7 Comparison of quality of cervical cancer xenografts in nude mice
2.7 宫颈癌移植瘤裸鼠血清相关因子及T 淋巴细胞亚群分布比较 ELISA 结果显示,与注射转染NC shRNA 的HeLa 细胞组裸鼠比较,注射转染Tim-3 shRNA 的HeLa 细胞组裸鼠血清TGF-β1、IL-10 含量显著下降(P均<0.01),IL-2、IL-6 含量显著升高(P均<0.01,表1)。流式细胞术结果显示(图8、表2),与注射转染NC shRNA 的HeLa 细胞组裸鼠比较,注射转染Tim-3 shRNA 的HeLa 细胞组裸鼠脾脏CD4+T 细胞和CD8+T 细胞比例均显著升高(P均<0.01)。
表1 两组裸鼠血清TGF-β1、IL-2、IL-6、IL-10 含量比较(,pg/ml)Tab.1 Comparison of TGF-β1,IL-2,IL-6,IL-10 contents in serum of two groups of nude mice(,pg/ml)

表1 两组裸鼠血清TGF-β1、IL-2、IL-6、IL-10 含量比较(,pg/ml)Tab.1 Comparison of TGF-β1,IL-2,IL-6,IL-10 contents in serum of two groups of nude mice(,pg/ml)
Note:Compared with NC shRNA group,1)P<0.01.
表2 两组裸鼠脾脏CD4+T、CD8+T细胞比例比较()Tab.2 Comparison of proportions of CD4+T and CD8+T cells in spleen of nude mice between two groups()

表2 两组裸鼠脾脏CD4+T、CD8+T细胞比例比较()Tab.2 Comparison of proportions of CD4+T and CD8+T cells in spleen of nude mice between two groups()
Note:Compared with NC shRNA group,1)P<0.01.

图8 流式细胞术检测裸鼠脾脏CD4+、CD8+细胞比例Fig.8 Flow cytometry to detect proportions of CD4+ and CD8+ cells in spleen of nude mice
3 讨论
宫颈癌是威胁全世界妇女生命健康的常见恶性肿瘤之一,多数宫颈癌病例均由HPV 引起。目前宫颈癌主要治疗手段包括外科手术治疗、放射治疗和化学药物治疗,多数患者在疾病早期可通过手术治愈,但中期和晚期因肿瘤出现局部或大面积转移治疗效果不佳,且肿瘤细胞耐药性导致患者预后差、生存率降低[4]。宫颈癌发展的分子机制尚未明确,因此迫切需要探索新的生物标志物或治疗靶标更好地揭示宫颈癌进展的分子机制,从而开发出有效的宫颈癌治疗方法。
尽管多个证据表明HPV 感染是引发宫颈癌的先决条件,但不足以导致宫颈癌发生,因为致癌作用还取决于个体遗传变异和表观遗传修饰[8]。近年绘制整个系统复杂的基因调控网络已得到深入发掘,并极大地增进了研究者对包括肿瘤进展在内的多种生物学过程分子机制的兴趣,探索表达异常的生物学标志物对各种疾病诊治至关重要。Tim-3 最初被确定为调节Th1细胞介导的免疫应答的免疫检查点受体,在固有免疫细胞上表达,并在多种肿瘤和包括慢性病毒感染在内的各种炎症性疾病中发挥多种调节作用[7,9]。研究表明,Tim-3 在不同疾病中表现出不同的表达模式和功能。如在一些非肿瘤性肾脏疾病中,Tim-3 表达增加,并与慢性肾脏疾病患者病理症状和血清学指标呈正相关[10];Tim-3能够加速足细胞损伤,通过触发巨噬细胞NF-κB/TNF-α信号通路促进糖尿病肾病进程[11];Tim-3在胰腺癌组织中高表达,其高表达可能与胰腺癌细胞浸润、转移和复发密切相关[12];肝细胞癌中Tim-3 可用作预后生物标志物和判断治疗效率的指标[13]。本研究显示,宫颈癌组织中Tim-3表达较高,推测Tim-3可能参与宫颈癌发生与发展。
抗肿瘤效果可归因于改变生化机制,包括抑制肿瘤细胞增殖、阻滞细胞周期进程、促进细胞凋亡以及调节相关信号转导途径,以上几种机制已成为抗癌作用的主要指标。本研究中,通过转染Tim-3 shRNA慢病毒质粒至人宫颈癌HeLa细胞降低Tim-3表达,结果显示HeLa 细胞增殖、迁移与侵袭能力均下降。将转染Tim-3 shRNA 慢病毒质粒的HeLa 细胞注射到裸鼠中,通过体内实验发现降低Tim-3 表达能够抑制裸鼠肿瘤生长。说明Tim-3 在宫颈癌进展中发挥作用,降低其表达能够抑制肿瘤生长。
肿瘤微环境(tumor microenvironment,TME)是由肿瘤细胞、成纤维细胞、免疫细胞、信号分子和细胞外基质组成的细胞生态位[14]。大量研究表明TME 是抗肿瘤免疫发挥效应的主要场所,更好地了解TME 对免疫应答的影响有助于提高免疫疗法功效。肿瘤细胞衍生的细胞因子、趋化因子和代谢产物等均 对TME 有重要影响,如TGF-β、IL-10 和CXCL15 能够抑制自然杀伤性CD8+T 细胞和细胞毒性T 淋巴细胞,帮助肿瘤细胞逃避免疫系统的识别和攻击[15-16]。多数肿瘤细胞表达高水平的干细胞因子,通过与c-kit 蛋白相互作用诱导肥大细胞迁移至肿瘤部位,此外,肥大细胞通过表达促炎因子使T细胞和NK 细胞失活,并抑制其抗肿瘤活性[17-18]。可见肿瘤免疫微环境的组成决定了对肿瘤免疫疗法的反应能力。本研究显示,通过注射转染Tim-3 shRNA慢病毒质粒的HeLa 细胞构建的宫颈癌移植瘤裸鼠血清TGF-β1、IL-10 含量下降,IL-2、IL-6 含量升高,同时裸鼠脾脏CD4+T 细胞和CD8+T 细胞比例均升高,说明Tim-3 可能参与调控宫颈癌肿瘤免疫微环境相关因子及CD4+T、CD8+T细胞亚群分布。
综上,Tim-3在宫颈癌组织中高表达,降低Tim-3表达能够体外抑制宫颈癌细胞增殖与转移,并在体内抑制移植瘤裸鼠肿瘤组织生长,促进组织细胞凋亡,并下调肿瘤免疫微环境因子TGF-β1与IL-10,上调IL-2与IL-6,上调脾脏CD4+T、CD8+T 细胞比例,为宫颈癌的诊治方案提供了理论基础,也为改善宫颈癌TME中的免疫抑制提供了新途径。

