基于纳米生物条形码和杂交链式反应构建电化学生物传感器用于蛋白激酶活性分析
张慧莲,苏爱雯,吴永菊,张艳丽*,王红斌,杨文荣,2,庞鹏飞*
(1.云南民族大学 化学与环境学院,云南省教育厅环境功能材料重点实验室,云南 昆明 650504;2.迪肯大学生命与环境科学学院,澳大利亚维多利亚州 吉朗 3217)
蛋白激酶(PKA)催化蛋白质磷酸化是生物体内最普遍和最重要的翻译后修饰方式之一,在许多细胞生理过程中发挥着重要作用,如细胞周期进展、基因表达、信号转导、分化和凋亡等[1-4]。磷酸化过程的异常和激酶活性的过度表达与许多人类疾病密切相关,如糖尿病、阿尔茨海默病、心血管疾病和癌症等[5-7]。此外,由于许多疾病与PKA介导的细胞信号通路的扰动有关,找到下调蛋白激酶活性的潜在抑制剂对于发现新的药物具有重要作用[8-10]。因此,蛋白激酶活性测定及其抑制剂筛选对于基础生物医学研究、临床诊断以及酶靶药物的开发均具有重要意义。传统测定蛋白激酶活性的方法有放射性同位素标记法[11]、质谱法[12-13]、拉曼光谱法[14]、荧光法[15-18]、比色法[19-22]和电化学法[23-28]等。这些检测方法和技术在一定程度上促进了对蛋白激酶活性的研究,然而也普遍存在一定的局限性,如放射性危害、专用仪器昂贵和操作繁琐耗时等缺点。电化学方法因具有响应快速、易于小型化以及良好的灵敏度和选择性等突出优点,受到研究者的广泛关注,并成为测定激酶活性的替代方法[29-31]。
生物条形码(Bio-barcode)是指DNA 分子序列中四种碱基按照一定的排列规则表达一组信息,可对目标物进行标注和识别的DNA 分子片段[32-33]。作为一种新型的分析诊断工具,生物条形码技术具有灵敏度高、检测快速、操作简单及重复性好等优点,可用于蛋白质、核酸、细胞、病毒及小分子的检测[34]。利用生物条形码技术的间接信号放大作用,可改善和提高传统免疫检测方法的缺陷和不足,实现对DNA 和蛋白质的超高灵敏检测[35-37]。随着纳米技术和纳米材料的发展,将生物条形码技术和纳米技术相结合,并将生物条形码和识别元件修饰在纳米材料(如金纳米粒子)表面形成具有识别和放大功能的纳米生物条形码技术,在药物控释、体内筛选、基因调控、生物成像和纳米生物传感等方面受到极大关注[38-39]。作为一种生物信号放大技术,杂交链式反应(HCR)是一种立足点介导的链置换(Toehold- mediated strand displacement)反应,其级联放大杂交反应由目标分析物引发,形成长的双链DNA 产物[40-41]。HCR 由于其无酶、简单、高效的扩增特点,受到越来越多研究者的关注,已被用来构建不同种类的生物传感器,用于核酸、小分子、细胞和蛋白质等检测[26,42-44]。此外,HCR 在生物成像和生物医学领域也引起了极大的关注[45]。目前,基于生物条形码和杂交链式反应双重信号放大策略构建的生物传感检测方法鲜有报道[46]。因此,本研究以MoS2/AuNPs纳米复合材料作为电极修饰材料,结合纳米生物条形码(S1-AuNPs-Ab)和HCR 双重信号放大策略构建了一种电化学生物传感器用于蛋白激酶A(PKA)活性分析。底物肽链通过Au-S键修饰到MoS2/AuNPs电极表面,当存在目标物条件时,底物肽链被磷酸化,并与S1-AuNPs-Ab 探针特异性结合,S1-AuNPs-Ab 探针中S1 链作为引发链,可诱导发夹DNA(H1 和H2)在电极表面发生HCR 反应。HCR 反应产物吸附亚甲基蓝(MB)电活性分子,产生放大的电化学响应信号,从而实现对PKA活性的灵敏检测。
1 实验部分
1.1 仪器与试剂
Autolab PGSTAT302N 电化学工作站(瑞士万通中国有限公司);UV-2600i 紫外可见分光光度计(日本岛津制作所);JEM-2100 透射电子显微镜(日本JEOL);Sigma 300 场发射扫描电子显微镜(德国Zeiss);DYCP-31BN 琼脂糖水平电泳仪(北京六一生物科技有限公司);ChemiDoc XRS 凝胶成像系统(Bio-Rad,美国);TGL-16G离心机(上海安亭科学仪器厂)。
蛋白激酶A(PKA,催化亚基来自牛心脏)购自New England Biolabs 公司(NEB,广州);半胱氨酸修饰的底物肽链(Peptide,CLRRASLG)购自吉尔生化(上海)有限公司;磷酸化丝氨酸抗体(Phosphoserine antibody)购自亚科因(武汉)生物技术有限公司;牛血清白蛋白(BSA)和四氯金酸(HAuCl4•4H2O)购自上海阿拉丁生化科技股份有限公司;三磷酸腺苷(ATP)、T4 多聚合核苷酸激酶(T4 PNK)、碱性磷酸酶(ALP)、辣根过氧化物酶(HRP)、溶菌酶(Lysozyme)、L-半胱氨酸(L-cysteine)购自生工生物工程(上海)股份有限公司;N-[2-[p-溴苯丙烯盐基氨基]乙基]-5-异喹啉磺酰胺二盐酸盐(H-89)购于美国EMD Biosciences 公司;六氰合铁酸钾(K3Fe(CN)6)、六氰亚铁酸钾(K4Fe(CN)6·3H2O)、柠檬酸三钠(C6H5Na3O7·2H2O)、钼酸钠(Na2MoO4·2H2O)购于天津市丰川科技有限公司。DNA 寡核苷酸链由宝生物工程(大连)有限公司合成并纯化,碱基序列详见表1。所用试剂均为分析纯,使用时未经进一步纯化,溶液采用水配制。实验用水均为去离子水。

表1 DNA寡核苷酸链碱基序列Table 1 Base sequences of the designed DNA oligonucleotides
1.2 MoS2的制备
采用水热合成法制备MoS2纳米片[47-48],称取2.4 g Na2MoO4·2H2O 超声溶解于50 mL 水中,用0.1 mol/L HCl 调节溶液pH 值至6.5,加入3.6 gL-cysteine,搅拌混匀5 min 后,将上述混合溶液转移至100 mL 高压釜中,200 ℃加热48 h。自然冷却至室温后,离心分离,收集沉淀产物,再用无水乙醇和水反复洗涤产物数次,70 ℃下真空干燥12 h,得到MoS2纳米片。
1.3 AuNPs的制备
利用柠檬酸钠还原HAuCl4方法制备AuNPs,量取50 mL 1.0 mmol/L 的HAuCl4溶液并搅拌煮沸,迅速加入5 mL 40 mmol/L 柠檬酸三钠溶液,继续煮沸并搅拌15 min,酒红色溶液自然冷却至室温,得到AuNPs溶液,4 ℃下储存,备用。
1.4 纳米生物条形码S1-AuNPs-Ab的制备
根据文献报道方法[32,49]改进后制备生物条形码S1-AuNPs-Ab 探针:量取30 μL 上述制备的AuNPs溶液,分别各加入10 μL 70 μmol/L S1 和1 μmol/L Ab,轻微振荡过夜,得到S1-AuNPs-Ab 探针。S1 和Ab 使用前需经TCEP 活化,制备的S1-AuNPs-Ab 在盐溶液(0.1 mol/L NaCl,25 mmol/L Tris-HCl)中老化24 h 后,12 000 r/min 离心30 min,去除多余的残余物。S1-AuNPs-Ab 用水洗涤和离心3 次,溶解于25 mmol/L pH 7.4 Tris-HCl缓冲液中,保存于4 ℃,备用。
1.5 生物传感器的制备
将玻碳电极(GCE,直径为3 mm)依次用粒径为0.3和0.05 μm 的Al2O3粉在抛光布上打磨抛光,再依次用水、乙醇、水超声清洗,氮气吹干,备用。在GCE 表面滴涂5 μL MoS2溶液(2 mg/mL),自然晾干后,再滴涂5 μL 上述制备的AuNPs 溶液,自然干燥。取10 μL 500 μmol/L 底物肽溶液(10 mmol/L PBS,pH 7.4,15 mmol/L TCEP)滴涂于修饰电极表面,室温孵育过夜。然后,将电极浸入100 μmol/L ATP和不同浓度PKA溶液进行磷酸化60 min。之后,在修饰电极表面滴涂5 μL 1% BSA溶液和5 μL S1-AuNPs-Ab 探针,室温孵育60 min。最后,在电极表面分别滴涂5 μL H1 和H2 溶液,室温孵育80 min后,滴加5 μL MB溶液,用PBS缓冲液淋洗电极,得到电化学生物传感器。
1.6 细胞裂解液样品的制备
选择人乳腺癌细胞(MCF-7)和肝癌细胞(HepG-2)为实际样品,在含10%胎牛血清的DMEM 培养基中,于37 ℃和5% CO2条件下的培养箱中孵育。培养细胞样品中加入1 mL 细胞裂解缓冲液(4 ℃预冷),放置反应30 min,待细胞全部裂解后,于12 000 r/min离心20 min,取上清液于20 ℃储存,备用。
1.7 电化学测量
采用循环伏安法(CV)和电化学阻抗谱法(EIS)对传感器的制备过程进行表征,CV 电位扫描范围为-0.2 V 至0.6 V,扫速为100 mV/s,EIS 频率范围为0.1 Hz~100 kHz,电位振幅为10 mV。利用差分脉冲伏安法(DPV)在0.1 mol/L PBS(pH 7.4,0.1 mol/L MgCl2)缓冲液中对PKA 活性进行定量检测,DPV电位扫描范围为-0.5 V 至0 V,振幅设置为0.05 V,调制时间为0.02 s,间隔时间为0.5 s。所有电化学测量均在室温条件下进行。
2 结果与讨论
2.1 传感器的设计原理
基于纳米生物条形码和杂交链式反应双重信号放大策略构建PKA 电化学生物传感器的制备过程和设计原理如图1 所示。依次在GCE 表面修饰MoS2纳米片和AuNPs 以增强电极的电催化活性。半胱氨酸修饰的底物肽链(Peptide)通过Au-S 键固定到修饰电极表面。当存在PKA 和ATP 时,底物肽链被磷酸化(P-peptide),生物条形码S1-AuNPs-Ab 探针通过Ab 抗体与P-peptide 特异性结合,修饰到电极表面。S1-AuNPs-Ab 探针中的S1 作为引发链,诱发H1 和H2 发夹结构打开,并产生HCR。最后,HCR产物长链dsDNA通过吸附MB电活性分子,实现电化学响应信号放大,实现PKA活性的定量分析。
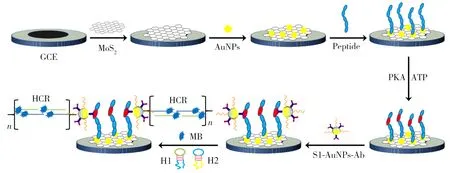
图1 电化学生物传感器的制备过程和检测PKA活性的原理示意图Fig.1 Schematic illustration of fabrication process and detection principle of electrochemical biosensor for detection of PKA activity
2.2 电极修饰材料的表征
采用扫描电子显微镜(SEM)、透射电子显微镜(TEM)和能量色散谱法(EDS)对电极修饰材料MoS2和AuNPs 的形貌和结构进行表征。由图2A 可见,制备的MoS2呈现类石墨烯的二维纳米片状结构,平均直径为200 nm。图2A 中插图为MoS2高分辨TEM 图,可观察到类石墨烯的褶皱结构,其晶格间距为0.68 nm。EDS 能谱分析表明(图2B),除基底硅片中Si 元素外,仅出现Mo 和S 元素的特征峰,也说明MoS2纳米片成功制备。图2C 为AuNPs 的TEM 图,由图可见,制备的AuNPs 粒子呈均匀分散的球形,平均粒径为15 nm。
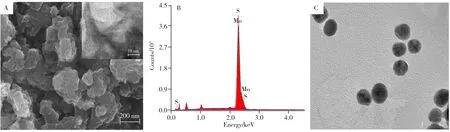
图2 MoS2的扫描电镜图(A)、X射线能谱图(B),以及AuNPs的透射电镜图(C)Fig.2 SEM image(A) and EDS spectrum(B) of MoS2,and TEM image of AuNPs(C)
2.3 纳米生物条形码S1-AuNPs-Ab的表征
图3A 为AuNPs(曲线a)及S1-AuNPs-Ab(曲线b)的紫外-可见吸收光谱。由图可见,AuNPs 在520 nm处有一特征吸收峰,AuNPs表面修饰DNA S1和Ab后,其特征吸收峰红移至527 nm,且在258 nm处出现DNA的特征吸收峰,表明成功制备了S1-AuNPs-Ab探针。
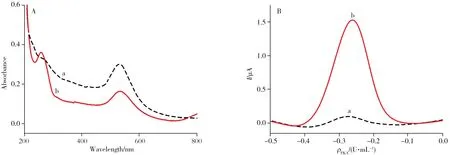
图3 AuNPs(a)及S1-AuNPs-Ab(b)的紫外-可见吸收光谱图(A),以及传感器在加入20 U/mL PKA前(a)后(b)的DPV响应曲线(B)Fig.3 UV-Vis absorption spectra of AuNPs(a) and bio-barcode S1-AuNPs-Ab(b)(A) and DPV curves of fabricated biosensor before(a) and after(b) adding 20 U/mL PKA(B)
2.4 可行性研究
为了验证所设计传感器的可行性,本实验测试了传感器在加入目标物PKA 前后的DPV 响应。如图3B 显示,加入PKA 前,传感器仅呈现弱的背景电流信号(曲线a);当加入20 U/mL PKA 后,DPV 的峰电流响应信号显著增强(曲线b)。实验结果表明,底物肽链被PKA 磷酸化后,结合S1-AuNPs-Ab 探针和HCR可放大电化学响应信号,实现PKA活性的定量测定。
此外,通过琼脂糖凝胶电泳实验进一步验证了杂交链式反应的可行性(图4)。泳道1 为20 bp Marker,泳道2 为DNA 引发链S1,泳道3 和泳道4 分别为H1 和H2,泳道5 为H1 + H2,泳道6 为S1 +H1+H2。泳道6中出现新的连续条带,表明在引发链S1的存在下产生HCR 反应,说明本实验结合生物条形码和HCR反应技术放大电化学响应信号是可行的。

图4 不同反应过程中的琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of different reaction processes
2.5 修饰电极的电化学表征
采用循环伏安法(CV)和电化学阻抗谱(EIS)对传感器的修饰过程进行电化学表征,结果如图5 所示。通过CV 峰电流、峰电位(ΔE)和EIS 等效电路中的电荷转移阻抗(Rct)研究了传感器的制备和修饰过程。由图5A 所示,GCE(曲线a)表面修饰MoS2后,CV 曲线的峰电流明显增大(曲线b),进一步修饰AuNPs 后,由于其优良导电性和大比表面积,CV 曲线中的氧化还原峰电流显著增强(曲线c)。修饰底物肽链后,生物分子的惰性本质阻碍了电极表面电子传递,CV 曲线峰电流减小(曲线d)。底物肽链发生磷酸化(曲线e)和结合S1-AuNPs-Ab 探针(曲线f),由于磷酸基团和DNA 表面所带负电荷与电活性分子的静电排斥作用,使得CV 曲线峰电流继续下降。S1-AuNPs-Ab 探针中S1 发生HCR 后(曲线g),CV 曲线峰电流进一步降低。EIS 谱图中(图5B),电子转移阻抗(Rct)变化过程与CV相反。修饰AuNPs后,Rct减小(曲线b),之后随修饰步骤增加,Rct逐渐增大。以上实验结果表明,该电化学传感器成功制备。
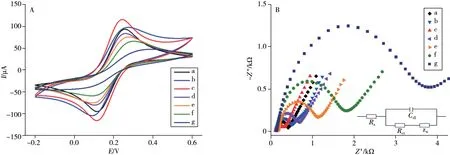
图5 不同修饰电极的循环伏安图(A)和电化学阻抗谱(B)Fig.5 CV(A) and EIS(B) curves of different modified electrodes
2.6 实验条件的优化
为获得最佳的传感分析检测性能,对传感器制备过程和测试条件(如MoS2和AuNPs 物料比、ATP浓度、磷酸化时间、S1-AuNPs-Ab 孵育时间和HCR 时间)进行优化(如图6 所示)。随MoS2和AuNPs 物料比从3∶1 变化到1∶3,在二者物料比为1∶1 时,得到最大峰电流响应(图6A)。ATP 浓度从0 增加到200 mmol/L,传感器响应电流逐渐增加,且在100 mmol/L 时达到饱和(图6B)。底物肽链磷酸化时间从0 增加到120 min,响应电流在60 min 时趋于饱和(图6C)。底物肽链磷酸化后与S1-AuNPs-Ab 探针的孵育时间为60 min 时,传感器响应电流达到饱和值(图6D)。对不同HCR 时间(0、20、40、60、80、100、120 min)的优化结果表明,当HCR时间为80 min时,响应峰电流达到稳定和最大值。因此,本实验选择MoS2和AuNPs 物料比为1∶1,ATP 浓度为100 mmol/L,底物肽链磷酸化时间为60 min,S1-AuNPs-Ab 孵育时间为60 min,HCR 时间为80 min 作为最佳实验条件,此时传感器呈现出最佳的分析性能。
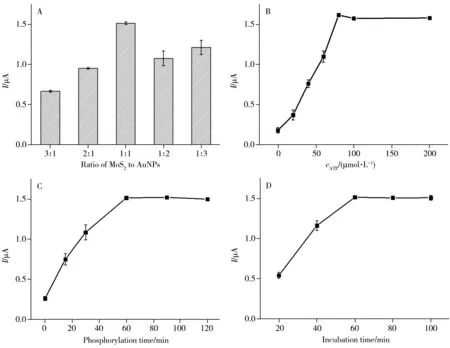
图6 实验条件的优化Fig.6 Optimization of the experimental conditions
2.7 PKA活性检测
在上述最优实验条件下,采用DPV 法测定电化学传感器对不同浓度PKA 的响应峰电流,如图7A所示。随着PKA 浓度的增加(0、10-3、10-2、10-1、1、2、5、10、20 U/mL),DPV 峰电流增大。DPV 峰电流与PKA浓度在10-3~20 U/mL范围内呈良好线性关系(图7B),其线性方程为I(μA) = 0.24lgρ(U/mL)+1.18,检出限(S/N=3)为3×10-4U/mL,相关系数(r2)为0.993 6。表2 对比了本工作与已报道方法检测PKA 活性的分析性能,由表2 可见,该传感器具有线性范围宽和检出限低的优点,本工作为PKA 的检测分析提供了一种新的传感分析平台。
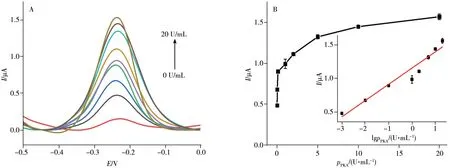
图7 传感器对不同浓度PKA的DPV响应曲线(A)及DPV峰电流与PKA浓度的关系曲线(B)Fig.7 DPV curves of biosensor to different concentrations of PKA(A),and relationship between DPV current and PKA concentration(B)
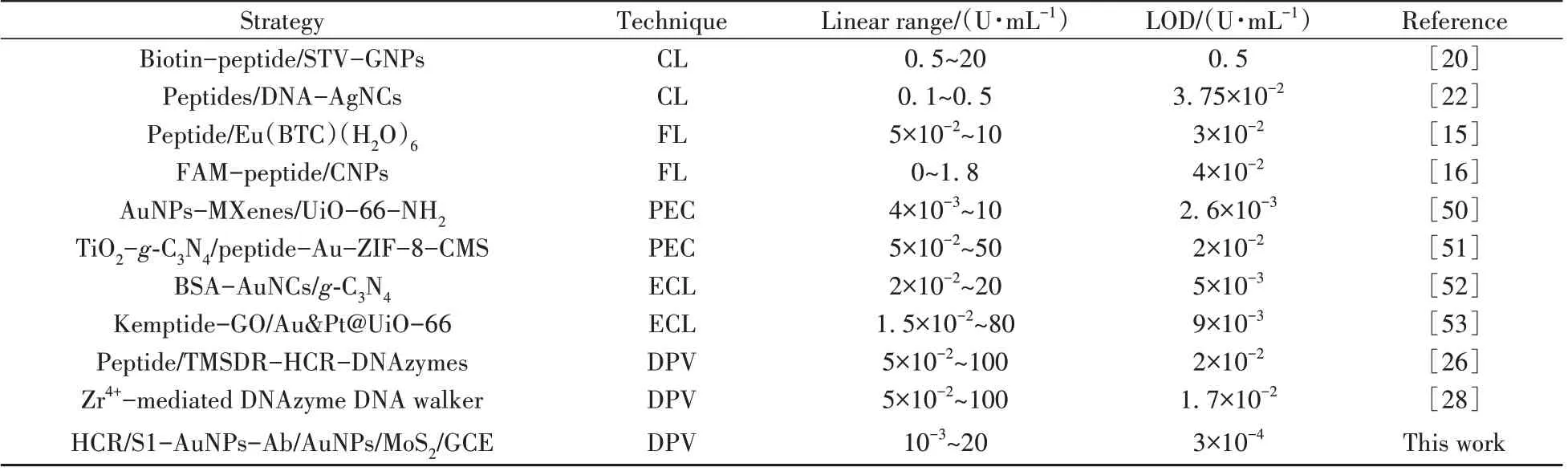
表2 不同方法检测PKA活性的分析性能比较Table 2 Comparison of analytical performance of the proposed electrochemical biosensor with other reports for PKA activity assay
2.8 抑制剂分析
为了进一步验证该方法对PKA 抑制剂的筛选和分析能力,在上述相同实验条件下,加入不同浓度的H-89 作为抑制剂,测定传感器对PKA 的电化学响应。如图8 所示,随着磷酸化过程中H-89 浓度的增加,传感器的电化学响应信号逐渐减小,表明PKA 活性受到的抑制作用增强,其半数最大抑制浓度(IC50)为91 nmol/L,与文献报道一致[25,54]。实验结果表明,该传感分析方法可用于PKA 抑制剂的分析和筛选,为PKA相关药物的发现提供帮助。
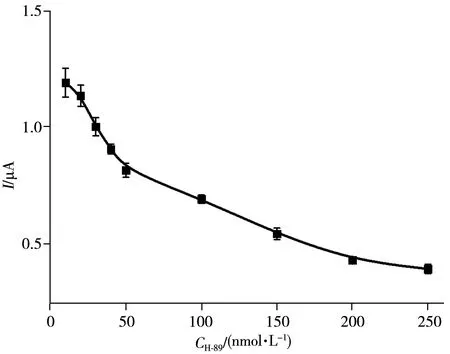
图8 H-89对PKA活性的抑制实验Fig.8 Inhibition effect of different concentrations of H-89 on PKA activity
2.9 传感器的选择性、重现性与稳定性
为评价传感器的选择性和抗干扰能力,考察了传感器对其它不同蛋白和激酶的电化学响应。如图9所示,相较于其它干扰物,传感器对10 U/mL PKA 呈现明显的电化学响应信号,而对于过量的干扰物T4多聚合核苷酸激酶(T4 PNK,40 U/mL)、牛血清白蛋白(BSA,1 mg/mL)、辣根过氧化物酶(HRP,1 mg/mL)、溶菌酶(Lysozyme,5 mg/mL)和碱性磷酸酶(ALP,2 mg/mL)均无明显的响应电流变化。为了考察传感器的重现性,采用相同的修饰过程制备5 支修饰电极,分别测试其对10 U/mL PKA 的DPV 峰电流响应信号。结果显示,5 支修饰电极对相同浓度的PKA 响应电流相近,相对标准偏差(RSD)均小于4.5%。通过测试修饰电极不同储存时间(4 ℃)后对PKA的电流响应信号以考察传感器的稳定性。实验结果表明,当传感器储存3周后,其对PKA的电流响应信号仍保持在初始值的92%以上。以上结果说明,本实验构建的电化学传感器具有良好的选择性、重现性和稳定性,可用于实际样品中PKA活性的分析。
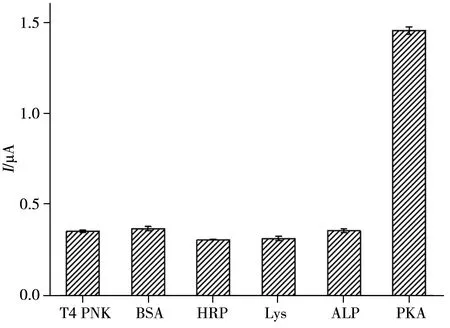
图9 传感器的选择性Fig.9 Selectivity of the proposed electrochemical biosensor
2.10 实际样品的测定
为验证该方法对实际样品中PKA 活性检测的可行性,选取人乳腺癌细胞(MCF-7)和肝癌细胞(HepG-2)的裂解液作为实际样品,采用加标回收法测定电化学响应和回收率。2种细胞裂解液中分别加入不同浓度的PKA,测定其电化学响应信号,实验结果如表3 所示。该电化学传感器测定实际细胞裂解液中PKA 的回收率为92.4%~101%,RSD 为2.7%~4.2%,表明该方法对细胞裂解液中PKA 活性的测定具有可行性。
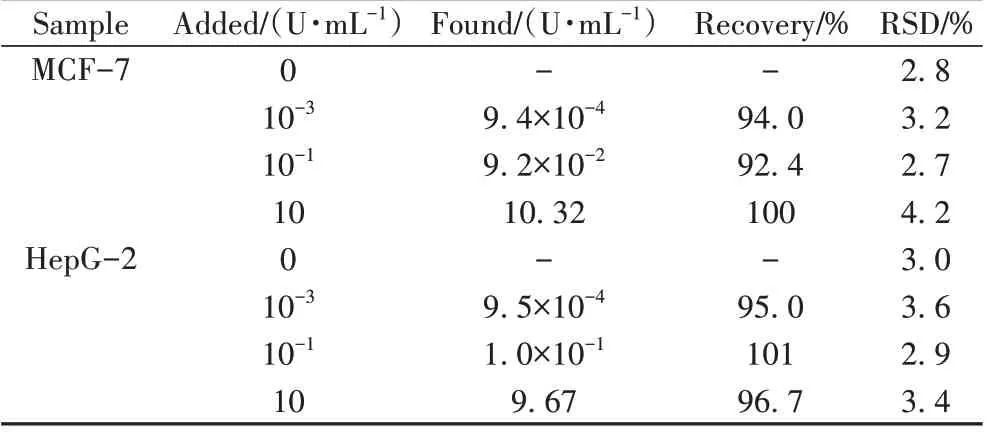
表3 人乳腺癌细胞(MCF-7)和肝癌细胞(HepG-2)裂解液中PKA活性的测定结果Table 3 Determined results of PKA activity in cell lysates of MCF-7 and HepG-2(n=3)
3 结 论
本文结合纳米生物条形码和杂交链式反应的双重信号放大策略构建了一种电化学生物传感器用于蛋白激酶活性的灵敏测定。以MoS2/AuNPs纳米复合材料作为电极修饰材料,增强电极的电催化活性。底物肽链通过Au-S键修饰到电极表面,当存在目标物PKA 时,底物肽链发生磷酸化,与纳米生物条形码S1-AuNPs-Ab 探针特异性结合。S1-AuNPs-Ab 探针中S1 作为引发链,诱发HCR。HCR 产物吸附MB 电活性分子,产生放大的电化学响应信号,从而实现对PKA 活性的定量分析。该电化学传感器具有良好的选择性、重现性和稳定性,可用于实际样品细胞裂解液中PKA 的测定,该方法同样对蛋白激酶抑制剂筛选和激酶相关药物的发现具有参考价值。

