基于UPLC-Q/TOF MS 技术探讨竹节参总皂苷对HepG2细胞脂质代谢的改善作用
徐 睿,钟品菲,周昌园,胡雪黎,袁小鹿,胡泽华,张淇淞,杨 宝*
(1.风湿性疾病发生与干预湖北省重点实验室(湖北民族大学),湖北 恩施 445000;2.湖北民族大学 武陵山中药材检验检测中心,湖北 恩施 445000;3.湖北民族大学 医学部,湖北 恩施 445000;4.广州中医药大学中药学院,广东 广州 510006;5.广西大学 医学院,广西 南宁 530004)
细胞是生物体结构和功能的基本单位,在生命活动中扮演了重要角色。细胞代谢组学能够针对性地研究药物对单细胞或单细胞株的代谢调控过程,直观反映药物刺激后的影响,与药物作用机制研究更加契合,且与机体整体水平的代谢组学相比受干扰更小。应用代谢组学技术研究药物作用于细胞后代谢谱的变化,对于体外研究药物的作用机制具有重要意义。竹节参来源于五加科植物竹节参Panax japonicusC.A.Mey.的根茎,能够散瘀止血、祛痰止咳、补虚强壮、消肿止痛[1]。竹节参收载于《中国药典》,恩施地区的资源丰富,土家族民间医生常用其治疗心脑血管疾病,疗效显著[2-3]。竹节参富含三萜皂苷,总皂苷是其改善糖脂代谢的活性物质[4]。肝脏是机体脂质代谢的场所,HepG2 细胞与正常肝细胞的代谢功能较为接近,目前HepG2细胞脂质沉积模型广泛应用于降脂药物的体外活性筛选及分子机制研究,并为后续的体内研究提供参考依据。相关文献报道,竹节参总皂苷可以显著抑制HepG2细胞脂质沉积模型的甘油三酯合成,减少细胞内脂质累积,表现出较好的体外降脂活性[5]。目前未有文献从细胞代谢角度研究竹节参总皂苷改善HepG2细胞脂质代谢的作用机制。
本研究采用改良的Bligh-Dyer法提取HepG2细胞内源性代谢物,基于超高效液相色谱-四极杆飞行时间质谱(UPLC-Q/TOF MS)技术和多元统计分析筛选差异代谢物,并结合通路分析初步阐明了竹节参总皂苷改善HepG2细胞脂质代谢的机制。本研究有望在细胞代谢水平上更加深入地阐述竹节参总皂苷的降脂作用机制,为后续的体内降脂作用机制研究和新药开发提供参考资料,同时也为其他降脂中药的研究提供思路。
1 实验部分
1.1 药品与试剂
甘油三酯(TG)试剂盒(南京建成生物制品研究所);胎牛血清、高糖DMEM 培养基、磷酸盐(PBS)缓冲液、牛血清白蛋白、0.25%胰蛋白酶、青霉素、链霉素(Gibco 公司);油酸钠、棕榈酸钠(生工生物工程有限公司);油红O染色液(Sigma公司);甲醇、乙腈、异丙醇、二氯甲烷(质谱级,默克公司)。竹节参总皂苷为自制,采用紫外-可见分光光度法测得其皂苷含量为84.1%。HepG2 细胞购自ATCC 细胞库。
1.2 仪 器
ACQUITY UPLC I-Class 色谱仪、Xevo G2-XS Q-TOF 高分辨质谱仪、Progenesis QI 软件(沃特世公司);Eppendorf 真空离心浓缩仪(德国艾本德公司);多功能酶标仪(赛默飞世尔科技公司);荧光倒置显微镜(麦克奥迪实业集团公司)。
1.3 细胞培养、分组及处理
HepG2 细胞用含10%胎牛血清、1%青霉素-链霉素的高糖DMEM 培养基,在5% CO2、37 ℃条件下培养,生长至铺满瓶底80%左右时弃去培养液,加入0.25%的胰酶消化液消化,每3 天按1∶3 比例传代1 次,取对数生长期的细胞进行实验。将细胞混悬液接种于6 孔板,分为对照组(Control)、模型组(Model)、竹节参总皂苷组(PJTS,50 mg/L),模型组、竹节参总皂苷组另加入1 mmol/L 的油酸和棕榈酸混合液(2∶1,体积比)刺激24 h,竹节参总皂苷组再加药物培养24 h。弃去培养液后用4%多聚甲醛固定30 min,处理后进行油红O染色分析。另收集各组细胞,检测TG含量。
1.4 样品收集与处理
按“1.3”方法处理细胞,每组平行12份,培养结束时弃去培养液,用PBS缓冲液清洗2次,然后采用液氮迅速淬灭细胞。加入500 μL 甲醇-水(4∶1,体积比),刮下细胞并转移至离心管中,重复2次。低温真空浓缩干燥,残渣中加入400 μL甲醇-水(2∶1)和400 μL二氯甲烷,冰浴超声5 min。13 000 r/min 离心15 min,分别吸取上层(极性部位)和下层(非极性部位)溶液,低温真空浓缩干燥。上层加入100 μL 乙腈-水(3∶1,体积比)溶解,下层加入600 μL 异丙醇-乙腈-水(2∶1∶1,体积比)溶解,13 000 r/min离心15 min,取上清液进样分析。质控样品由各样本吸取30 μL混合得到。
1.5 色谱与质谱条件
Acquity HSS T3 色谱柱(100 mm×2.1 mm,1.8 μm)。非极性部位:乙腈/水(3∶2,A)-异丙醇/乙腈(9∶1,B)(正模式:均含0.1%甲酸和10 mmol/L 甲酸铵;负模式:均含0.01%甲酸),洗脱程序为:0.0~3.5 min,65%~57% A;3.5~3.6 min,57%~48% A;3.6~11.0 min,48%~30% A;11.0~17.5 min,30%~1% A;进样量为6 μL。极性部位:乙腈(A)-水(B)(正模式:均含0.1%甲酸;负模式:均含0.01%甲酸),洗脱程序为:0.0~4.0 min,2% A;4.0~7.0 min,2%~8% A;7.0~13.0 min,8%~30% A;13.0~20.0 min,30%~100% A;进样量为7 μL。流速为0.4 mL•min-1,柱温为40 ℃。
Xevo G2-XS Q-TOF 高分辨质谱仪,配备电喷雾电离源,源温度为110 ℃,毛细管电压为3.0 kV(-3.0 kV),锥孔电压为40 V(-40 V),脱溶剂气为900 L•h-1,温度为550 ℃,锥孔气为50 L•h-1,扫描范围m/z50~1 200,亮氨酸脑啡肽实时校正,全信息串联质谱数据采集模式。
1.6 数据处理及生物标志物筛选
采用Progenesis QI 软件进行峰识别、峰提取、归一化,然后将数据导入SIMCA-P 软件中进行主成分分析(PCA)和正交偏最小二乘判别分析(OPLS-DA),根据差异变化倍数(≥1.50或≤0.67)、t检验(P<0.05)、变量投影重要性指标(VIP≥1.0)筛选差异代谢物,使用MetaboAnalyst软件进行代谢通路分析。
2 结果与讨论
2.1 竹节参总皂苷对HepG2细胞脂质沉积模型脂质代谢的影响
如图1所示,与对照组相比,模型组细胞内的红色脂滴显著增多,出现脂质沉积现象,TG 显著升高(P<0.01),提示诱导脂质沉积模型成功。与模型组相比,竹节参总皂苷组细胞内的红色脂滴显著减少,TG显著降低(P<0.01),提示竹节参总皂苷显著改善了HepG2细胞脂质沉积模型的脂质代谢。

图1 对照组(A)、模型组(B)、竹节参总皂苷组(C)细胞的油红O染色图及对TG水平的影响(D)Fig.1 Oil red O staining of HepG2 cells in control(A),model(B) and PJTS(C) groups,and effect of PJTS on TG level(D)
2.2 典型基峰色谱图
质控样品极性和非极性部位的基峰色谱图如图2所示,色谱峰的数目较丰富,分离度和响应较好。经过降噪、峰识别、峰提取等处理后,最终导出的数据矩阵结果显示,极性部位在正离子模式下检测到7 171个色谱峰,负离子模式下检测到3 394个色谱峰;非极性部位在正离子模式下检测到1 959个色谱峰,负离子模式下检测到3 747个色谱峰。本研究在Bligh-Dyer法的基础上考察了不同体积比的二氯甲烷-甲醇-水作为提取溶剂、冰浴超声5 min或冻融循环3次的提取效率,以代谢特征峰数目、峰面积的相对标准偏差(RSD)为评价指标,优选最佳的样本处理方法。结果显示,二氯甲烷-甲醇-水(2∶2∶1)冰浴超声5 min的提取效果最好,代谢物的种类交叉较少,特征峰数最多,重复样本的90%以上特征峰峰面积的RSD 小于15%。针对脂质同分异构体较多、保留时间较接近,普通色谱条件分离难度较大的特点,本研究在分析包含脂质的非极性部位时选择乙腈/水(3∶2)-异丙醇/乙腈(9∶1)流动相体系[6],并优化了梯度洗脱程序,结果显示不同类型的脂质依次被洗脱,分离度和响应较好(图2)。在经典的脂质分析色谱条件中,ESI 负离子模式下流动相中会添加10 mmol/L 甲酸铵[6]。但本课题组在前期的多批次脂质分析实验中发现,ESI负离子模式下流动相中添加10 mmol/L 甲酸铵会严重抑制部分脂质的响应。因此本研究最终改为添加0.01%甲酸,在保证响应的同时兼顾了峰形和分离度。
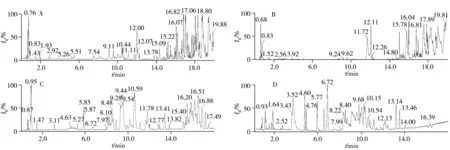
图2 极性(A、B)和非极性部位(C、D)质控样品的基峰色谱图Fig.2 Representative base peak chromatograms for the polar(A,B) and nonpolar(C,D) fraction of QC sample A,C:positive mode;B,D:negative mode
2.3 方法可靠性评估
PCA分析得分图(图3)中质控样本(n=12)聚集良好,均在标准偏差的2倍范围内。经过降噪、峰识别、峰提取等处理后,导出的数据矩阵结果显示,质控样本极性部位在正、负离子模式下峰面积的RSD 小于15%的色谱峰分别占87%和88%,非极性部位在正、负离子模式下峰面积RSD 小于15%的色谱峰分别占86%和89%,所有变量保留时间的RSD 均小于2.0%,表明仪器和样品的稳定性及重复性良好,所得数据可靠。
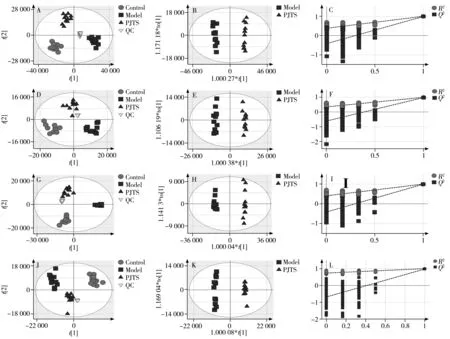
图3 4组极性(A、D)和非极性部位(G、J)的PCA得分图,模型组和竹节参总皂苷组极性(B、C、E、F)和非极性部位(H、I、K、L)的OPLS-DA得分图和200次置换检验图Fig.3 PCA score plots for the polar(A,D) and nonpolar fraction(G,J) of 4 groups,OPLS-DA score plots and 200 times permutation test for the polar(B,C,E,F) and nonpolar fraction(H,I,K,L) of model and PJTS groups A,B,C,G,H,I:positive mode;D,E,F,J,K,L:negative mode
2.4 代谢轮廓分析
采用PCA 模型进行代谢轮廓分析,如图3A、D、G、J 所示,3 组各自聚为一类且完全分离,所有样本均处于95%置信区间内。对照组和模型组分别位于得分图两侧,提示造模较为成功。竹节参总皂苷位于对照组和模型组之间,且有向对照组靠近的趋势,表明竹节参总皂苷改善脂质代谢作用显著。
2.5 差异代谢物筛选与鉴定
为更好地获取组间差异信息、筛选差异代谢物,在PCA分析的基础上进行OPLS-DA分析,部分结果见图3B、E、H、K。所有模型的R2Y(cum)≥0.992、Q2(cum)≥0.971,表现出良好的拟合度和预测能力。200 次置换检验结果(图3C、F、I、L)显示,所有模型R2的截距≤0.713、Q2的截距≤-0.416,表明模型未过拟合,然后输出各变量的VIP值。根据峰面积差异变化倍数(Fold)和t检验P值构建火山图(图4),筛选出Fold≥1.50或≤0.67、P<0.05的代谢物,结合VIP≥1.0确定差异代谢物。基于保留时间、精确分子量、二级碎片鉴定差异代谢物,结果见表1 和表2。从极性部位鉴定出34 个差异代谢物,主要为脂肪酸、氨基酸类成分;从非极性部位鉴定出28 个差异代谢物,主要为磷脂酰胆碱、磷脂酰乙醇胺、神经酰胺。为了直观比较上述差异代谢物在各组中的变化,将其相对峰面积转化为可视化热图,并进行聚类分析。结果见图5,红色代表高浓度,蓝色代表低浓度,竹节参总皂苷显著恢复HepG2 细胞脂质沉积模型中紊乱代谢物的水平,且有向对照组水平接近的趋势。聚类分析显示,极性部分代谢物(图5A)被划分为两大类群,分别包含14 种和20 种代谢物;非极性部分代谢物(图5B)被划分为三大类群,分别包含3、17、8种代谢物。每个类群中的代谢物在对照组、模型组、竹节参总皂苷组中的变化趋势基本一致,表明筛选出的代谢物具有代表性。
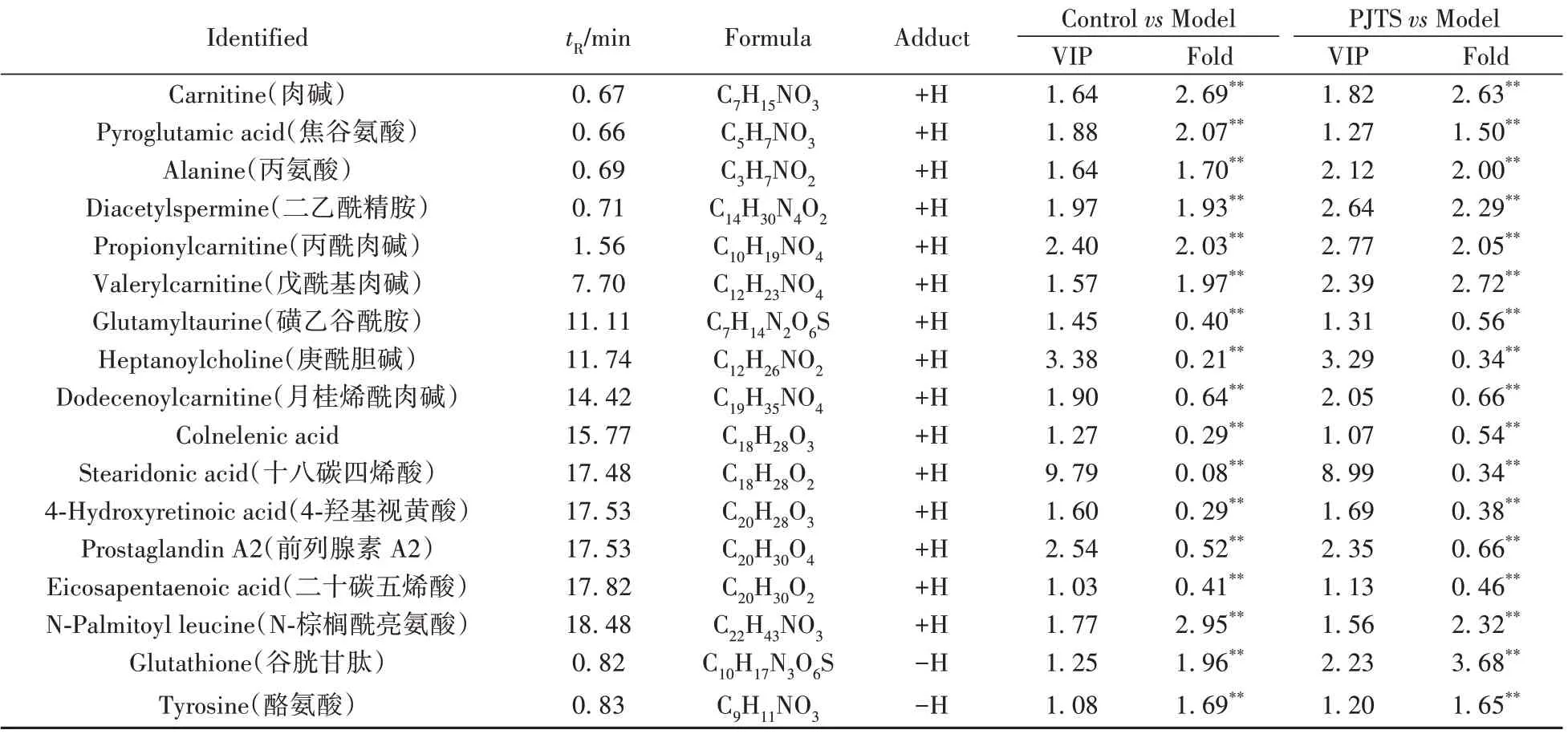
表1 极性部位中鉴定的差异代谢物信息Table 1 Specific informations of biomarkers in polar fraction

表2 非极性部位中鉴定的差异代谢物信息Table 2 Specific informations of biomarkers in nonpolar fraction

图4 极性(A、B、C、D)和非极性(E、F、G、H)部位代谢物的火山图Fig.4 Volcano plots for metabolites in polar(A,B,C,D) and nonpolar(E,F,G,H) fractions

图5 极性(A)和非极性(B)部位中差异代谢物相对峰面积的热图及聚类分析Fig.5 Heatmap and cluster analysis of the metabolites in polar(A) and nonpolar(B) fractions
2.6 代谢通路分析
采用MetaboAnalyst 进行通路富集分析,以通路影响值>0.1 作为目标。结果表明,竹节参总皂苷改善HepG2细胞脂质沉积模型脂质代谢的作用与调节鞘脂代谢、甘油磷脂代谢、不饱和脂肪酸合成密切相关。
鞘脂是鞘氨醇的衍生物,主要分为鞘磷脂和鞘糖脂。鞘脂代谢是肝脏细胞内重要的脂质代谢途径,其代谢异常与多种慢性疾病密切相关[7]。鞘脂作为细胞器和细胞膜的基本组分,在肝脏细胞中的含量和种类丰富,在细胞膜的形成、物质交换、信号传导等方面发挥着重要作用[7-8]。神经酰胺是鞘脂代谢的中心分子,发挥着第二信使作用,介导了细胞凋亡、炎症反应和胰岛素抵抗等,参与肝脏脂质代谢的多个环节[9-10]。神经酰胺也是肝脏脂质代谢异常相关疾病的重要介导因素[11]。鞘磷脂是神经酰胺头部连接一个磷酸胆碱的代谢产物,在维持肝脏脂质代谢,尤其是神经酰胺代谢平衡中发挥着重要作用。本研究中植物鞘氨醇、SM(d18∶0/16∶0)、Cer(d18∶1/18∶0)在模型组中的水平显著升高,SM(d17∶1/16∶1)、Cer(d18∶0/26∶0)的水平显著降低,在竹节参总皂苷干预后均有恢复至正常水平的趋势(表2和图5),其中Cer(d18∶1/18∶0)的变化趋势与文献[12]报道一致,提示竹节参总皂苷改善HepG2细胞脂质沉积模型脂质代谢的作用与调节鞘脂代谢密切相关。
甘油磷脂是细胞膜不可缺少的组成构架,也是细胞进行物质交换的通道,在调节细胞功能、维持脂质代谢平衡中扮演着重要角色[13]。本研究中筛选的甘油磷脂类代谢物主要为磷脂酰胆碱和磷脂酰乙醇胺。磷脂酰胆碱是机体内最丰富的甘油磷脂,其特性由所含的脂肪酸种类决定,在细胞膜中起保护层作用,同时也与鞘磷脂一起形成了不同大小、密度的脂蛋白,对胆固醇的代谢和转运起重要作用[14]。本研究中模型组PC(18∶3-OH/2∶0)、PC(17∶2/0∶0)、PC(22∶6/18∶2)、PC(20∶4/15∶0)、PC(22∶6-2OH/15∶0)的水平显著上调,PC(14∶0/14∶0)和PC(16∶1/14∶0)的水平显著下调,除PC(14∶0/14∶0)、PC(16∶1/14∶0)外,其余5 个在竹节参总皂苷干预后均有恢复至正常水平的趋势(表2 和图5)。分析上述磷脂酰胆碱的结构发现,在模型组中显著上调的磷脂酰胆碱均含多不饱和脂肪酸侧链,对细胞脂质代谢具有较好的保护作用,推测可能是HepG2 细胞为了应对脂质沉积损伤的自身调节结果。溶血磷脂酰胆碱和溶血磷脂酰乙醇胺与细胞炎症过程和免疫反应密切相关,同时还会诱导细胞凋亡[15-16]。本研究中模型组LysoPC(18∶2/0∶0)、LysoPE(18∶2/0∶0)、LysoPE(20∶5/0∶0)的水平显著上调,在竹节参总皂苷干预后均有恢复至正常水平的趋势,推测竹节参总皂苷在调节HepG2细胞脂质沉积模型脂质代谢的同时还能改善其炎症反应。
本研究还筛选到11个不饱和脂肪酸、5个饱和脂肪酸(表1和2)。除十五碳二烯酸、硬脂酸、二十烷酸外,其余13个脂肪酸在模型组中的水平显著上调,在竹节参总皂苷干预后均有恢复至正常水平的趋势(表1和2、图5)。模型组中16个脂肪酸的总含量较对照组显著升高,在竹节参总皂苷干预后显著降低。脂肪酸整体代谢水平升高是油酸和棕榈酸诱导的HepG2细胞脂质沉积模型的重要特点,提示下调脂肪酸代谢水平可能是竹节参总皂苷调节HepG2 细胞脂质代谢的重要途径。前列腺素A2、白三烯A4 是花生四烯酸的重要代谢产物,是重要的炎症反应介质。本研究中模型组前列腺素A2、白三烯A4的水平显著升高(表1),提示HepG2 细胞脂质沉积模型存在炎症反应,且在竹节参总皂苷干预后均有恢复至正常水平的趋势,再次确认竹节参总皂苷能够改善HepG2细胞脂质沉积模型的炎症反应。
3 结 论
本研究首次基于UPLC-Q/TOF MS结合细胞代谢组学技术探讨了竹节参总皂苷对HepG2细胞脂质沉积模型脂质代谢的改善作用,发现竹节参总皂苷可显著改善HepG2细胞的脂质代谢,并筛选了62个潜在生物标志物,主要为脂肪酸和磷脂酰胆碱类成分,可能与调控鞘脂代谢、甘油磷脂代谢、脂肪酸代谢、炎症反应密切相关。所得结果为后期深入研究HepG2细胞脂质沉积模型的代谢轮廓及竹节参总皂苷的降脂作用提供了参考。

