基于qPCR技术的黄东海沙海蜇时空分布特征研究❋
柳怡帆, 甄 毓, 米铁柱, 王建艳
(1. 中国海洋大学海洋环境与生态教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学环境科学与工程学院, 山东 青岛 266100; 3. 北京自然博物馆科学研究部, 北京 100050)
近年来,全球多地海域频发水母暴发现象,这逐渐成为一种海洋生态灾害,严重危及海洋生态系统平衡和人类的生产生活安全[1-3]。水母暴发会损坏渔具、减少渔获量,以致海洋捕捞活动受到严重影响[4]。水母暴发会通过生物间的相互作用,如捕食关系、空间竞争等改变海洋生物群落结构[5]。如印度西南海岸科钦港口在季风后期水母暴发,增加了甲壳类浮游生物、鱼卵和幼鱼被捕食的压力,导致浮游食物网中的营养级联,使得浮游植物丰度达到高值[6]。水母和鱼类具有相似的食性,水母数量的急剧增加会导致鱼类数量大幅下降[7-8]。另外,水母大量暴发时还会堵塞海水核电站的冷却入口,导致发电被迫中断,严重时会影响近岸地区的生活和生产[9]。
自20世纪90年代末,在东亚海域频繁发生沙海蜇(Nemopilemanomurai)暴发灾害。2003年日本青森县因沙海蜇暴发损失约2 000万美元,韩国每年因沙海蜇暴发损失6 820万至20 460万美元[10]。沙海蜇暴发对中国渔获量也造成了严重影响,2003年中国东海北部和黄海沙海蜇的年渔获量增加了250%,与此同时年渔获量下降了64%[11]。沙海蜇成体个体较大,直径可达2 m,种群分布受温度、盐度、饵料等多种因素影响[12]。在黄东海海区,沙海蜇通常于5月下旬和6月上旬出现在30°30′N—33°00′N,122°00′E—122°45′E的部分区域,6月扩展到31°30′N—36°00′N,在32°00′N—34°00′N范围内大量聚集,8月继续向北向南扩展到30°00′N—37°00′N海域,8月末及9月几乎遍布黄海,10月其分布区域收缩至34°00′N—37°00′N海域[13]。
已有对水母数量和分布的研究多是基于传统的现场调查方法,通过对拖网中或一定面积海平面上水母体进行形态鉴定和计数完成[14-16]。传统的分类方法对鉴定者的专业要求较高,且当水母大量暴发时拖网操作难度较大甚至会导致爆网。另外,这些方法多局限于水母体,对水母浮浪幼虫、螅状体、碟状体等微小个体的观测则较困难[17]。目前少有研究涉及沙海蜇早期个体(如浮浪幼虫、螅状体、碟状体)的分布动态,关于我国近海沙海蜇螅状体栖息地也尚无定论。
随着现代科技的发展,分子生物技术逐渐应用于水母鉴定中。如王建艳等[18]利用实时荧光定量PCR技术(Quantitative real-time PCR,qPCR)对中国近海常见的海月水母(Aureliaspp.)、沙海蜇、白色霞水母(Cyaneanozakii)和海蜇(Rhopilemaesculentum)进行了种类鉴定,并将该方法应用于胶州湾海域水母的现场调查中。杜崇等[19]基于16S rDNA基因片段对我国海南海口和广东茂名附近海域暴发的水母进行分子鉴定,认为肇事种分别为鞭腕水母(Acromitusflagellatus)和端棍水母(Catostylusmosaicus)。Daglio等[20]依据部分细胞色素氧化酶I(COI)的DNA序列对印度尼西亚泗水东部沿岸海域水母进行鉴定,共鉴定出7个物种,进一步完善了该海域水母的分类学研究。Gaynor等[21]利用qPCR技术研究了巴内加特海湾早期阶段的海刺水母(Chrysaoraquinquecirrha)的分布,发现碟状幼体季节丰度最高值出现在巴内加特湾北部,且海湾北部的东部站点浮浪幼虫丰度高于西部站点。
为调查中国近海沙海蜇的分布和来源,本文利用qPCR技术对黄东海海域中沙海蜇mt-16S rDNA进行检测,检测结果与已有的沙海蜇水母体分布研究结果相比较[13],分析海水中沙海蜇的浓度与分布特征,为分析影响水母分布的因素与水母溯源研究提供基础数据。
1 材料与方法
1.1 样品采集
于2012年10月、2013年8月和2013年9月搭乘“北斗号”科考船在黄东海海域进行大面调查,每个站位现场采集10 L表层海水样品,通过肉眼观察后剔除其中可能的水母体组织块,用76 μm的筛绢过滤收集浮游生物,过滤后的筛绢置于液氮罐后运回实验室,于-80 ℃保存样品,用于DNA提取和qPCR实验。2013年5月分别于3—7日、11—15日、19—22日、28—31日搭乘“浙普渔23012”渔船对长江口及其邻近海域进行采样,每个站位现场采集10 L表层海水样品,通过肉眼观察后剔除其中可能的水母体组织块,用200 μm的筛绢过滤收集浮游生物(因此时海水中的沙海蜇为碟状体和水母幼体,直径>500 μm,故选取200 μm筛绢过滤收集)。
采样站位见图1,其中2012年10月(9个断面,40个站位)和2013年9月(7个断面,22个站位)航次为黄东海大面检测,2013年5月(5个断面,22个站位)和2013年8月(4个断面,16个站位)为长江口及其邻近海域的重点检测。另外,于2013年8月和2013年9月航次中选取部分站位利用采水器分层采集海水,分析不同深度海水中沙海蜇DNA的分布情况。
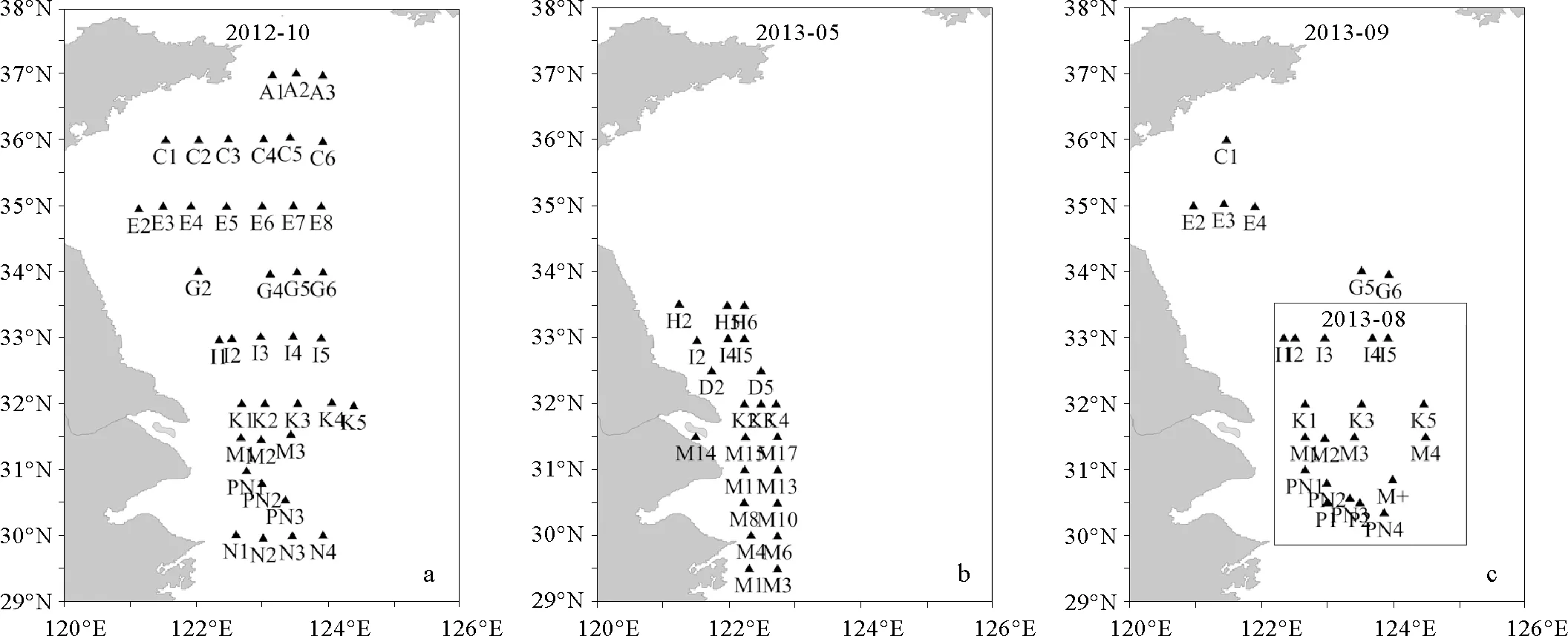
(c图中框表示2013年8月的采样站位。Boxes in figure c indicate the sampling stations in August, 2013.)
1.2 DNA提取
将-80 ℃保存的过滤样品置于1.5 mL离心管中,按照DNeasy®Blood &Tissue Kit(Qiagen,Hilden,Germany)试剂盒说明书步骤提取筛绢上的DNA,获得的DNA置于-20 ℃保存。
1.3 qPCR检测
参照王建艳等[22]建立的沙海蜇qPCR检测方法,检测所采样品中沙海蜇的mt-16S rDNA。反应体系为30 μL,包括15 μL 1×Fast Start Universal SYBR Green Master (ROX),0.9 μL正向引物NS1-F(5′-GTAGGATATAATGACCCGTTGA)(终浓度0.3 μmol/L),0.9 μL反向引物NS1-R(5′-CGAGGTGGCAAACATCAT)(终浓度0.3 μmol/L),3 μL稀释100倍的样品DNA以及10.2 μL ddH2O,并向体系中添加最终浓度为0.2 μg/μL的牛血清白蛋白以减少DNA样品中其他物质的干扰。反应在ABI7500荧光定量PCR仪(Applied Biosystems,USA)上进行。反应程序:50 ℃ UNG酶激活2 min,95 ℃热启动10 min,随后40个循环,包括95 ℃ 15 s,60 ℃ 1 min。以定量曲线y=-3.396x+36.983(x表示质粒拷贝数的对数(lgNplasmid),y表示Ct值)[22]计算样品中沙海蜇mt-16S rDNA的拷贝数。
2 结果
2.1 黄东海表层水体中沙海蜇mt-16S rDNA的时空分布特征
为探明沙海蜇早期个体的来源,本研究在5月航次中对长江口近海海域进行了4次采样检测。结果发现,沙海蜇mt-16S rDNA最早于5月上旬在靠近近岸的M15(31°30′N,122°15′E)、M8(30°30′N,122°15′E)站位出现较高值(191.86 copies/L、192.60 copies/L)(见图2a),随后向北分布。至5月下旬,高值区出现在H2(33°30′N,121°15′E)、D5(32°30′N,122°30′E)、D2(32°30′N,121°45′E)站位,浓度分别为1 121.12、1 897.64和2 342.88 copies/L(见图2d)。

图2 2013年5月黄东海表层海水中沙海蜇mt-16S rDNA的丰度和分布
对夏秋季航次中沙海蜇mt-16S rDNA的检测结果表明,2013年8月,16个站位中均检测出沙海蜇mt-16S rDNA,其浓度范围为(4.59~124.46)×104copies/L、平均值为9.80×104copies/L。其中,高值区出现在M断面和PN断面(29°30′N—31°30′N),高值站位为PN1、PN3、M+和M3,浓度分别为2.75×104、3.04×104、3.39×104和4.59×104copies/L(见图3a)。2013年9月,24个调查站位中均检测出沙海蜇mt-16S rDNA,其浓度范围为(4.58~9.49)×103copies/L、平均值为6.91×103copies/L;高值区出现在I断面(33°N),浓度平均值为1.91×103copies/L(见图3b)。2012年10月,黄东海沙海蜇mt-16S rDNA在32个站位中检出,其浓度范围为7.90~533.67 copies/L、平均值为94.94 copies/L;高值区主要出现在34°N及其以北的海域的C、A、E断面,平均浓度为172.98、201.98和224.32 copies/L;高值站位为E4、A1、C4,沙海蜇mt-16S rDNA浓度分别为4.32×102、4.66×102和5.34×102copies/L(见图3c)。综合3个月的调查可见,8月沙海蜇mt-16S rDNA浓度最高,9月和10月浓度值较8月依次降低一个数量级;从8月到10月沙海蜇mt-16S rDNA高值区呈由南向北移动的趋势。

图3 2013年8月、9月和2012年10月黄东海表层海水中沙海蜇mt-16S rDNA的丰度和分布
2.2 黄东海沙海蜇mt-16S rDNA的垂直分布特征
2013年8月PN1、PN2、P1和P2共4个站位分层次样品中,除PN1站位沙海蜇mt-16S rDNA在表层水体中占比最高且浓度呈显著高值(2.75×104copies/L)外,其他3个站位沙海蜇mt-16S rDNA均为底层占比高于表层占比,离岸最远的P2站位在底层水体中沙海蜇mt-16S rDNA浓度最高,为8.44×103copies/L(见图4)。2013年9月,16个调查站位中均检测出沙海蜇mt-16S rDNA,其中有10个站位沙海蜇mt-16S rDNA底层占比高于表层占比。I5站沙海蜇mt-16S rDNA浓度在底层水体中出现显著高值,为2.56×104copies/L(见图5)。

图4 2013年8月黄东海海域沙海蜇mt-16S rDNA的垂直分布
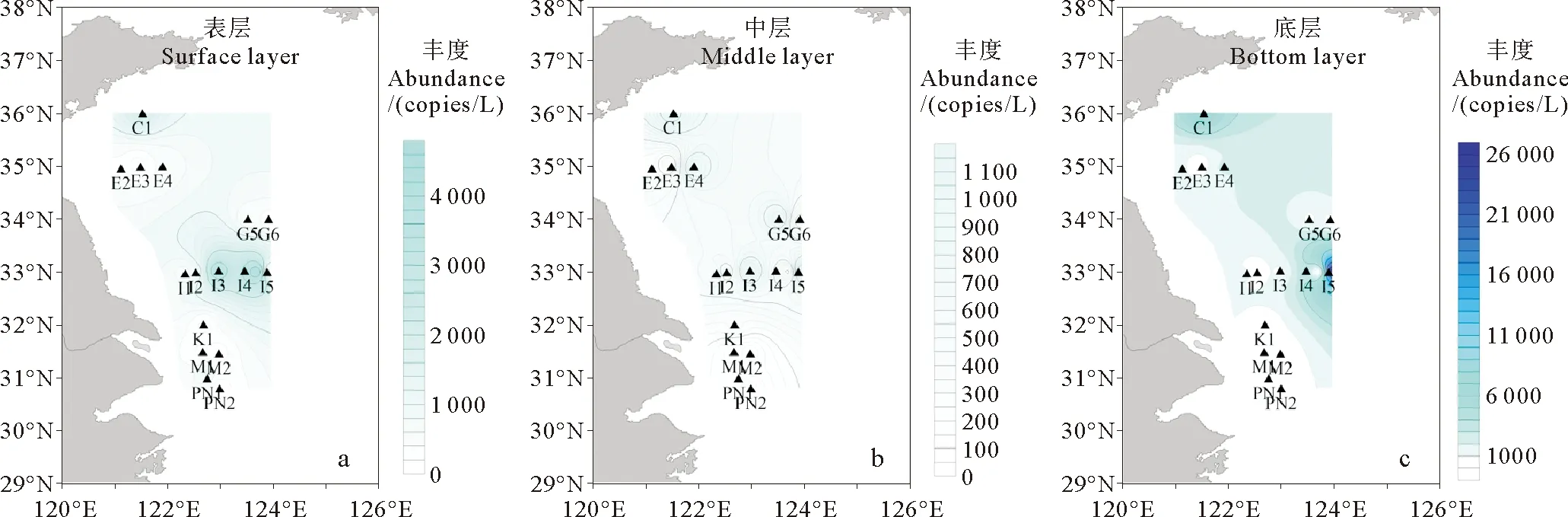
图5 2013年9月黄东海海域沙海蜇mt-16S rDNA的垂直分布
2.3 黄东海沙海蜇mt-16S rDNA浓度与温度、盐度的相关关系
2013年5月,在长江口及其邻近海域站位进行的4次采样中,5月初温度和盐度平均值分别为15.62 ℃和24.60,温度高值区和盐度低值区均出现在M断面(31°N),这与5月上旬最早检出较高mt-16S rDNA的位置相一致(见图6、7)。

图6 2013年5月黄东海表层海水温度等值线图
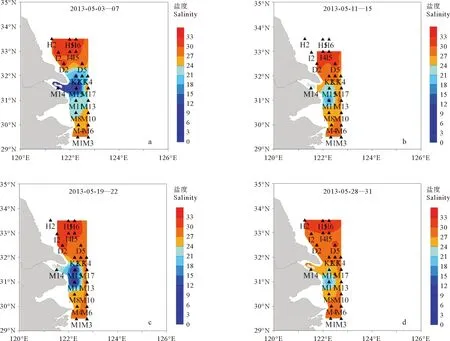
图7 2013年5月黄东海表层海水盐度等值线图
2013年8月,调查海区的温度变化范围为7.95~29.45 ℃,盐度变化范围为22.65~33.69,温度高值区出现在I、PN、G断面(30°N—35°N),温度平均值分别为27.80、28.30、28.46 ℃,这与2013年8月沙海蜇mt-16S rDNA高值区位置相一致(见图8a、图9a)。2013年9月,调查海区的温度变化范围为9.24~27.95 ℃,盐度变化范围为25.30~33.91,温度高值区出现在PN、Q断面(30°N—31°N),温度平均值分别为26.59、27.64 ℃,沙海蜇mt-16S rDNA较高的I断面温度和盐度平均值分别为25.6 ℃和31.6,I断面的由这4个月的调查结果可知,5月初长江口附近海域温度高值区和盐度低值区与5月最早检出较高mt-16S rDNA的位置相一致,8月黄东海沙海蜇mt-16S rDNA高值区与温度高值区位置大致相同,而10月黄东海沙海蜇mt-16S rDNA高值区与温度低值区位置一致。

图8 2013年8月、9月和2012年10月黄东海表层海水温度等值线图

图9 2013年8月、9月和2012年10月黄东海表层海水盐度等值线图
温度平均值明显低于2013年8月(见图8b、图9b)。2012年10月,调查海区的温度变化范围为17.89~23.82 ℃,盐度变化范围为23.07~34.30。温度高值区出现在PN断面(30°N—31°N),温度平均值为23.30 ℃。温度低值区位于A、C、E断面(34°N—37°N),温度平均值分别为18.11、19.60、19.70 ℃。温度低值区与2012年10月沙海蜇mt-16S rDNA高值区位置相一致(见图8c、图9c)。
3 讨论
沙海蜇在中国黄东海海域出现的时间为5月到12月。5月开始在黄东海交界处出现少量的水母幼体,6月沙海蜇在南黄海的分布区域有所扩大,8月末到9月初,沙海蜇几乎遍布黄海,此时其丰度和生物量达到最高值。沙海蜇水母体在秋季9月、10月达到性成熟,10月到12月沙海蜇的分布区域逐渐向北转移,生物量逐渐减少至零[23]。因此,5月海水中沙海蜇mt-16S rDNA应来自沙海蜇的碟状体和水母幼体,8—9月,海水中沙海蜇mt-16S rDNA主要来源为成体水母及其产生的精子、卵子和浮浪幼虫。本次研究结果显示,5月在长江口及其邻近海域检测到沙海蜇mt-16S rDNA,8月到10月,沙海蜇mt-16S rDNA高值区的分布区域依次为临近长江口海域、苏北浅滩外海海域和南黄海北部海域,高值出现的时间呈“先南后北”的趋势,且8月和9月沙海蜇mt-16S rDNA浓度明显高于10月。Sun等[13]对2012年和2013年黄东海海域沙海蜇水母体分布的研究表明,8月和9月沙海蜇水母体丰度和生物量明显高于10月,分布上,8月沙海蜇水母体分布范围覆盖30°00′N—37°00′N,9月沙海蜇水母体的分布已经开始向北收缩,32°00′N以北海域沙海蜇水母体丰度较高,10月水母体收缩至34°00′N以北的南黄海北部海域,沙海蜇水母体丰度高值区整体呈“由南向北”的趋势。本研究中沙海蜇mt-16S rDNA高值区变化趋势与沙海蜇水母体的分布规律相一致。
沙海蜇幼体对外界环境适应力较弱,主要生活在暖水区或冷暖水交汇区[12]。长江口近海由于临近河口和陆地,富营养化导致微型生物的生物量较高,春末夏初该海域有一个快速升温的过程,且受冲淡水的影响海水盐度较低,这些都为沙海蜇幼体的生存和生长提供了较为有利的理化条件和饵料基础[12]。Sun等[13]研究发现,沙海蜇于5月下旬至6月上旬在31°30′N—33°00′N、122°00′E—122°45′E的小区域出现,推测长江口近海区域可能是沙海蜇主要繁殖地之一。本次调查中,5月末和6月初沙海蜇mt-16S rDNA高值区出现在32°00′N—33°00′N、122°00′E—123°00′E,且在该区域观察到较高数量沙海蜇碟状体和幼水母,这与已有研究结果一致,从分子证据上支持长江口近海海域是沙海蜇的主要繁殖地之一的结论。沙海蜇的产卵期为8—9月或9—10月[23-24]。本次调查中,2012年10月在34°00′N的北部海区沙海蜇mt-16S rDNA的平均浓度为200.9 copies/L,表层海水温度平均值为19 ℃,而南部海区沙海蜇mt-16S rDNA的平均浓度为24.3 copies/L,表层海水温度平均值为22 ℃,北部海区比南部海区的沙海蜇mt-16S rDNA浓度高一个数量级,表层海水温度也明显低于南部海区,这进一步证实了秋末沙海蜇趋向分布于黄海冷水团区[25]。2013年9月沙海蜇mt-16S rDNA高值区出现在I断面(33°00′N),该断面位置处于黄海南部中央水区,沙海蜇mt-16S rDNA高值区与黄海冷水团区相吻合,推测该区域是沙海蜇的产卵区。
本次调查中黄东海海区沙海蜇mt-16S rDNA的时空分布规律与已有研究的水母体分布总体相一致,从8月到10月高值区均呈由南向北移动的趋势,但具体到每个站位却不一定吻合。相较于近岸站位,离岸的P2、I5站位底层海水中沙海蜇mt-16S rDNA更高。沙海蜇为雌雄异体,体外受精,受精卵经1~1.5 d便可发育成为浮浪幼虫[24,26],通过对海水中沙海蜇mt-16S rDNA垂直分布分析发现,沙海蜇mt-16S rDNA在底层水体中浓度较高。腔肠动物的浮浪幼虫可以在水体中以昼夜节律升降,在下降过程中碰到海底,搜索合适的基质,附着并变态为螅状体[27],浮浪幼虫可能更趋向于向有利于其附着的区域分布[28]。
通过产卵期沙海蜇mt-16S rDNA的数量可以推测水母浮浪幼虫大量聚集的区域,结合该区域的理化条件进一步推测浮浪幼虫及螅状体的栖息区域,进而可追溯水母的生存环境、追踪种群来源及动态。本研究通过沙海蜇mt-16S rDNA在5月最早检出站位和秋末产卵期高值检出站位推测,30°30′N—31°30′N、122°30′E—124°00′E部分区域可能具备有利于沙海蜇浮浪幼虫附着的基质或理化条件,是我国沙海蜇的潜在栖息地。
4 结语
本研究应用qPCR技术对2012年10月、2013年5月、2013年8月和2013年9月黄东海海区中沙海蜇进行定量检测,检测结果发现:(1)4个调查月份均检测到沙海蜇mt-16S rDNA,其中2013年8月的浓度最高,2013年9月、2012年10月依次降低一个数量级;(2)沙海蜇mt-16S rDNA最早于5月上旬在长江口近岸海域出现较高检出值(随后向北分布),秋末检出高值区主要位于34°N以北的黄海海域;(3)相较于近岸站位,长江口离岸站位底层海水中沙海蜇mt-16S rDNA更高。本研究克服了传统采样和形态学鉴别方法的局限,实现了对环境中沙海蜇DNA的快速定量研究,进一步分析了黄东海沙海蜇DNA的时空分布特征,可为追溯沙海蜇的起源、聚集和栖息地研究提供参考。
致谢:诚挚感谢中国科学院海洋研究所张芳研究员提供的现场网采沙海蜇丰度数据,天津大学魏皓教授提供的现场站位的温度、盐度以及深度数据。

