高效石油降解菌的筛选及表征*
查代巧 贝 琪 康子桐 朱小杰 李东晓 和文祥 田海霞
(西北农林科技大学资源环境学院,陕西 杨凌 712100)
微生物可以利用石油污染物为碳源进而分解污染物降低其毒性,因此微生物技术在石油污染修复中备受关注[1]。获得高效石油降解微生物对于强化微生物在石油污染修复中的应用具有重要意义。研究表明,纺缍形赖氨酸芽孢杆菌(Lysinibacillusfusiformis) 23-1在石油为2%(质量分数)的条件下对石油的降解率达到了57%[2];代尔夫特菌(Delftiasp.) FM6-1和无色杆菌(Achromobactersp.) FM6-1均能降解多环芳烃(萘、菲、荧蒽和芘)和脂肪烃(C12、C16、C20和C32)[3];好氧芽胞杆菌(Aeribacilluspallidus) UCPS2能在50 ℃条件下降解蒽(降解率92%~96%)、芴(降解率83%~86%)、菲(降解率16%~54%)和芘(降解率51%~71%)[4];红串红球菌(Rhodococcuserythropolis) CD130和CD167对土壤中石油的降解率分别达到了29.8%和38.4%[5]。以上微生物均表现出较好的石油降解效果,但在实际应用中,微生物的活性易受到环境因素的影响,导致修复效果受到影响。杨立琼[6]的研究表明石油降解菌在最适生长温度、pH、氮源、磷源等条件下,微生物对石油的降解率提高了20~30百分点。CUI等[7]对温度、pH、氧气等条件优化后,微生物对石油的降解率提高了10~30百分点。因此分离高效石油降解菌并探明其最适生长条件,对提高它在原位复杂环境中的定殖、降解效果至关重要。
微生物对石油的降解机理探究不仅可以判断微生物对石油的潜在降解能力,还有助于探索修复方法[8-9]。目前认为微生物降解石油的机理首先是石油与微生物充分接触或者进入微生物细胞内,后在微生物酶的作用下被催化氧化,最终经过三羧酸循环被彻底分解为二氧化碳和水。部分微生物在石油污染胁迫条件下,会产生生物表面活性剂等具有两亲性(亲水性和疏水性)的物质来改变微生物细胞表面特性,或者增加石油在水中的溶解度,进而增加微生物细胞与石油接触的可能性,从而提升石油的生物利用度[10]。因此对微生物产生物表面活性剂及石油降解基因的探索是研究石油降解菌降解石油的基础。
本研究旨在从石油污染土壤中筛选出高效石油降解菌,优化其石油降解条件,同时对其石油降解机理进行初步探究,以评估菌株的石油降解能力,为石油污染的微生物修复技术研究和应用提供基础数据。
1 材料与方法
1.1 土壤样品的采集
选择延长和南阳油田废弃油井和油泥堆放点的石油污染土壤,采集5~20 cm深处的土样,充分混匀后采用四分法将土样分装于洁净的自封袋中,4 ℃冷藏备用。土壤石油含量(以总石油烃计)测定参考文献[5]的方法,采样点信息见表1。

表1 采样点信息1)Table 1 Sampling points information
1.2 石油降解菌的筛选及降解能力监测
称取3 g土样,分别加入到30 mL的4种培养基(培养基成分及添加石油浓度见表2)中,置于恒温摇床(180 r/min、30 ℃)培养7 d。吸取1 mL,再次接入到对应培养基中,同时增加石油浓度,在相同条件下培养,此驯化步骤重复3次后,采用平板划线分离法进行菌株的纯化,培养基为LB培养基(成分:酵母粉5 g,胰蛋白胨10 g,NaCl 10.0 g,琼脂20 g,蒸馏水1 L)。将纯化好的单菌株保存于-20 ℃冰箱中。

表2 石油降解菌筛选培养基Table 2 Petroleum degrading bacteria screening medium
将待测菌株接种于LB液体培养基(LB培养基中不加琼脂)中活化至600 nm下的吸光度(OD600)为0.9~1.0时,于10 000 r/min离心1 min收集菌体。将菌体重悬于无菌生理盐水,按体积分数2%接种至含3 g/L石油的BSM培养基中,置于恒温摇床(180 r/min、30 ℃)培养。以接种无菌生理盐水为空白对照,所有处理均设置3个平行。培养10 d后,利用盐酸酸化混合培养液,使其pH≤2,置于分液漏斗中并用正己烷重复萃取多次后进行旋转蒸发。加入25 mL正己烷,用紫外分光光度计(UV-2800)测定其中的剩余石油浓度,计算石油降解率[11]。
1.3 石油降解菌的鉴定
对获得的石油降解菌株进行16S rRNA序列鉴定。引物为27F(5’-AGAGTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGTTACCTTTTACGACTT-3’)。脱氧核糖核酸(DNA)经纯化后利用pClone007试剂盒进行克隆。测序工作由某生物技术有限公司完成,序列已提交至国家生物技术信息中心(NCBI)数据库并获得登录序列号。在Lifemap上查询并下载相近的模式菌株16S rRNA序列,利用MEGA 7.0构建系统发育树。
1.4 石油降解条件优化
参照1.2节制备菌株接种液,培养基组分初始条件设置与表2中BSM培养基条件一致,其他组分优化条件如表3所示。在180 r/min、30 ℃条件下培养5 d,以接等体积的无菌生理盐水为对照。利用紫外分光光度计测定OD600并绘制生长曲线。采用单因素实验,即仅改变需要优化的条件,其他条件保持不变。
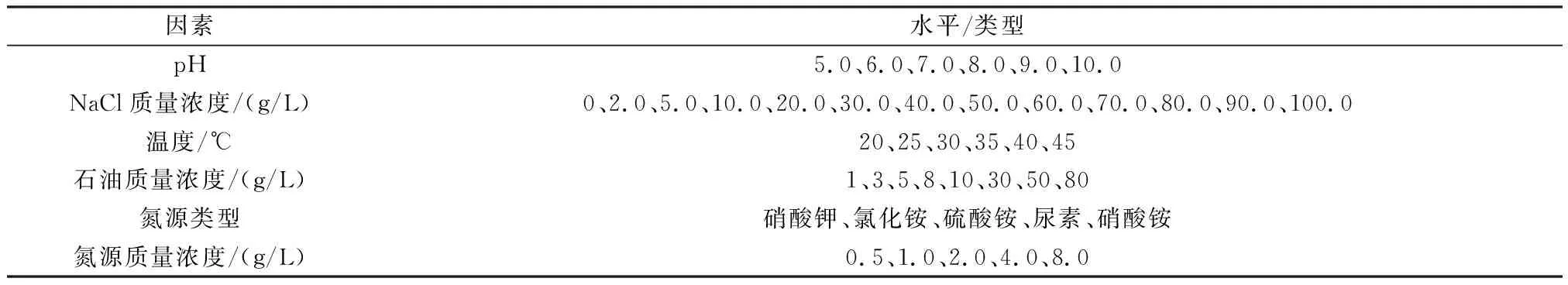
表3 因素及水平Table 3 Factors and levels
1.5 高效石油降解菌的降解机理
1.5.1 菌株产生物表面活性剂的鉴定
采用驱油实验对菌株进行产生物表面活性剂功能鉴定[12],具体如下:将待测菌株接种液按2%(体积分数)接种量接入LB培养基中,30 ℃、180 r/min条件下培养3 d后收集上清液备用。取一个洁净的培养皿,先加入20 mL蒸馏水,再加入100 μL石油,使其形成均匀油膜,加入40 μL无细胞上清液。以等体积的蒸馏水作为阴性对照,聚乙二醇辛基苯基醚(Triton-X-100)作为阳性对照。
利用6 mol/L 盐酸将上述混合液pH调至2,置于4 ℃冷藏过夜。取出后,于10 000 r/min离心20 min,加入氯仿和甲醇混合液(体积比为1∶1)萃取。静置15 min后取下层液体进行旋转蒸发,减压蒸馏后即得到粗的生物表面活性剂。将上述提取的生物表面活性剂用少量氯仿溶解,并按照文献[4]的方法进行薄层分析鉴定生物表面活性剂的种类。
1.5.2 石油降解功能基因的扩增
石油降解菌功能基因引物信息见表4。

表4 本研究涉及的石油降解功能蛋白及相应基因的扩增引物Table 4 The petroleum degradation function protein and amplified primers of related gene involved in this study
2 结果与分析
2.1 石油降解菌的筛选与鉴定
本研究获得3株石油降解率大于30%的菌株Y183、Y187和N47,石油降解率分别为35%、30%和49%。它们的16S rRNA序列与不动杆菌(Acinetobactersp.) mkj-33、铜绿假单胞菌(Pseudomonasaeruginosa) strain B19和枯草芽孢杆菌(Bacillussubtilis) strain BS1的相似性大于97%(见表5)。构建系统发育树(见图1)并进行分析,将菌株Y183、Y187和N47分别命名为Acinetobactersp. Y183、假单胞菌(Pseudomonassp.) Y187和芽孢杆菌(Bacillussp.) N47。它们的16S rRNA序列在NCBI数据库中的序列号分别为Acinetobactersp. Y183(OM838406)、Pseudomonassp. Y187(OM838407)、Bacillussp. N47(OM838405)。

注:括号内编码为菌株的NCBI登录序列号。图1 系统发育树Fig.1 Phylogenetic tree

表5 3株菌的石油降解率及其16S rRNA鉴定结果Table 5 Petroleum degradation rate and 16S rRNA identification results of three strains
2.2 石油降解菌的最适环境条件
利用含3 g/L石油的BSM培养基进行3株菌的生长曲线测定。如图2(a)所示,菌株Y183在0~1 d处于迟缓期,1~5 d处于对数生长期,之后进入平稳期;菌株Y187在0~7 d处于迟缓期,7~9 d处于对数生长期,之后进入平稳期;菌株N47在0~2 d处于对数生长期,之后进入平稳期。
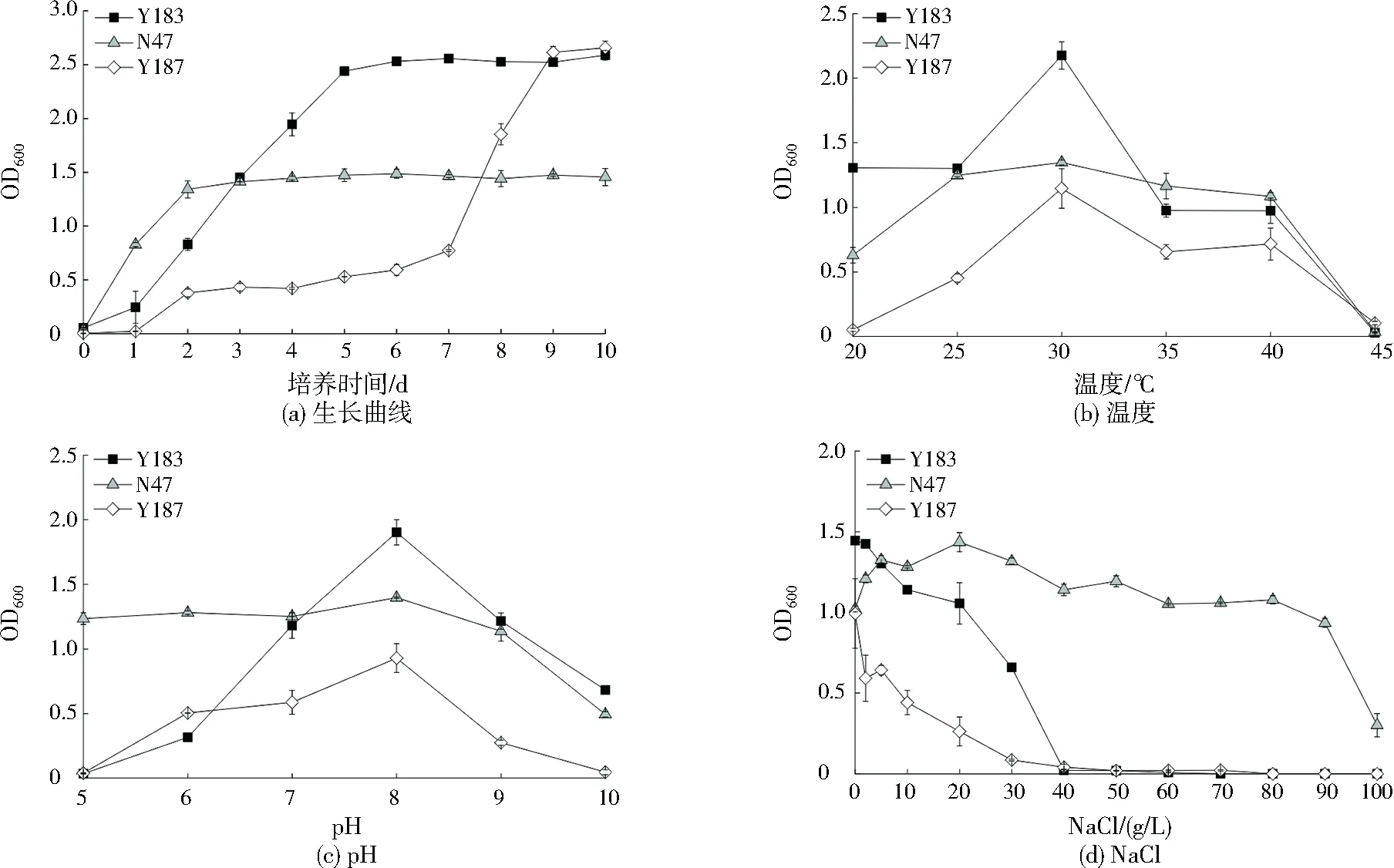
图2 3株菌生长的基本特性Fig.2 The basic physicochemical properties of three strains
对其他培养条件进行优化时,采用单因素实验。优化温度时其他条件如下:pH为7.2,NaCl为0.5 g/L,石油为3 g/L,氮源为3.0 g/L硝酸铵。如图2(b)所示,菌株Y183、N47和Y187最适生长温度均为30 ℃,与文献[11]、[17]、[18]的研究结果一致。在低温下,菌株Y183表现出良好的适应能力;温度高于45 ℃时,3株菌均不能生长。优化pH时其他条件如下:温度为30 ℃,NaCl为0.5 g/L,石油为3 g/L,氮源为3.0 g/L硝酸铵。如图2(c)所示,菌株Y183、N47和Y187生长pH范围分别为6.0~10.0、5.0~10.0、6.0~9.0,且均在pH为8.0时生长状况最好。优化NaCl浓度时其他条件如下:温度为30 ℃,pH为8.0,石油为3 g/L,氮源为3.0 g/L硝酸铵。如图2(d)所示,菌株Y183和Y187在NaCl为0~40.0 g/L时均能生长,最佳生长NaCl为0 g/L。菌株N47在NaCl为0~100.0 g/L时均能生长,最佳生长NaCl为20.0 g/L。菌株N47较其他两株有较好的耐盐性,可能是由于芽孢杆菌为避免在高盐下失水死亡,其细胞可以吸收外界氯离子和钾离子维持细胞内外渗透压或者调整自身蛋白结构,形成功能蛋白,以保证酶的活性,或者通过微生物体内自身合成有机物来调节细胞渗透压[19-20]。
优化石油浓度时其他条件如下:温度为30 ℃,pH为8.0,NaCl为0 g/L(菌株Y183和Y187)或20.0 g/L(菌株N47),氮源为3.0 g/L硝酸铵。由图3可知在1~80 g/L石油质量浓度范围内,3株菌均能生长。菌株Y183生长的最适石油质量浓度为10 g/L,相应的石油降解量与微生物生长的变化趋势一致,5 d石油最大降解量为3.231 g。菌株N47的生长随石油浓度增长而加快。当石油质量浓度≥30 g/L后生长进入平台期,同时5 d石油降解量达到最大为2.149 g。菌株Y187在石油质量浓度<10g/L时,生长较为缓慢。当石油质量浓度增加至50 g/L时,其生长达到峰值,同时5 d石油降解量达到最大为8.987 g。表明菌株N47和Y187对高浓度石油环境具有较强的适应能力,且在高浓度石油环境中对石油具有较强的降解能力。而在低浓度石油环境中,菌株Y187生长情况欠佳。菌株N47、Y183和Y187分别在石油质量浓度为30、10、50 g/L时生长状况最佳,菌株Y187对于高浓度石油表现出较高的需求,因此在3株菌中表现出最大的石油降解量。而李彦辰[21]和姜义等[22]分离的芽孢杆菌、不动杆菌和假单胞菌最适生长石油质量浓度分别为5、1.5、3.5 g/L,远远低于本研究结果。由此证实本研究所获菌株在石油降解能力方面具有明显的优越性。
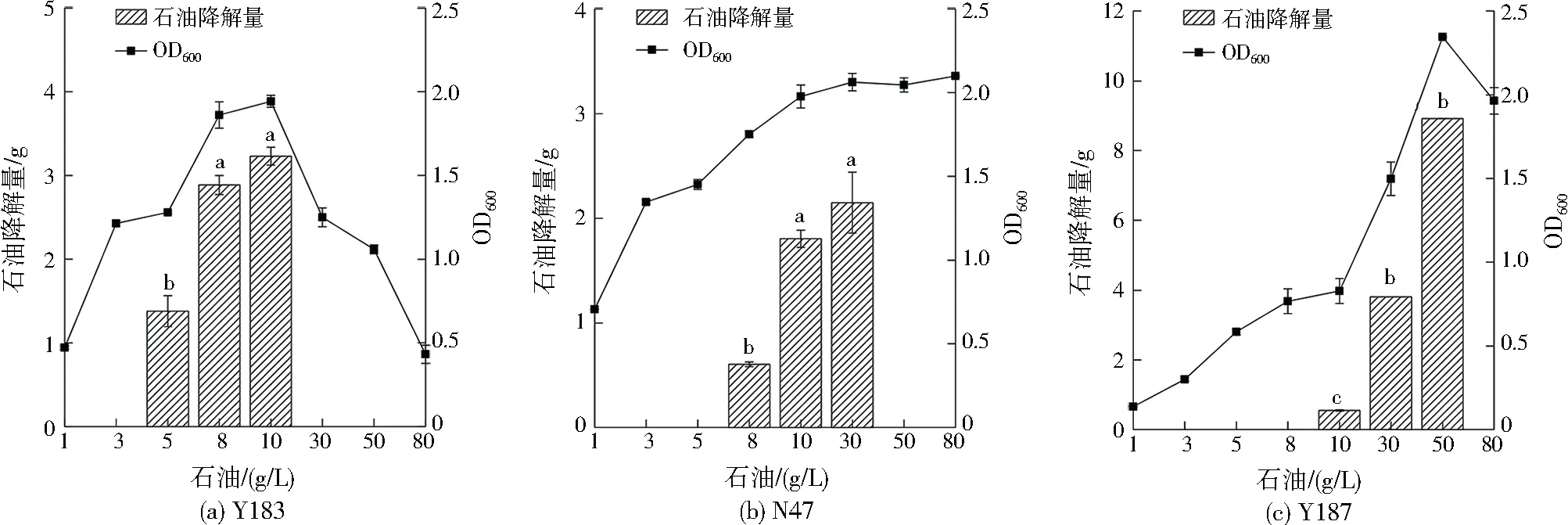
注:基于前期预试验,根据OD600,仅对3个石油浓度下的石油降解量进行了测定;不同小写字母表示石油降解量之间具有显著差异(p<0.05)。图3 石油质量浓度对微生物生长和5 d石油降解量的影响Fig.3 Effect of petroleum mass concentration on microbial growth and petroleum degradation (5 d)
优化氮源类型和浓度时其他条件如下:温度为30 ℃,pH为8.0,NaCl为0 g/L(菌株Y183和Y187)或20.0 g/L(菌株N47),石油为30 g/L(菌株N47)、10 g/L(菌株Y183)或50 g/L(菌株Y187)。如图4(a)所示,菌株Y183和Y187在5种氮源条件下,均能较好地生长。氮源对菌株Y183的适宜性表现为氯化铵>硝酸铵、硫酸铵、尿素>硝酸钾。通过设置不同浓度的氯化铵,研究菌株Y183的最适生长氮源浓度,如图4(b)所示,当氯化铵为1.0、2.0 g/L时,生长状况最好。氮源对菌株Y187的适宜性表现为硫酸铵、硝酸铵>硝酸钾>尿素>氯化铵。选择硝酸铵作为氮源,研究菌株Y187的最适生长氮源浓度,发现它在低氮质量浓度(0.5 g/L)下生长最好,随着浓度的增大,生长出现下降趋势。在5种供试氮源中,菌株N47仅对3种氮源(氯化铵、硝酸铵和硫酸铵)有较好地利用。以硝酸铵为氮源,研究菌株N47的最适生长氮源浓度,发现在0.5~4.0 g/L范围内,菌株N47的生长无显著差异。8.0 g/L时,生长受到显著影响。文献[11]、[17]、[23]、[24]分离出的芽孢杆菌、不动杆菌、假单胞菌其最佳生长氮源类型分别为硫酸铵、硝酸钾或硝酸钠。这表明多数菌株的最适生长氮源类型可能为硝酸盐型,其原因可能是在含有石油的培养基中,培养基表面的油膜会隔绝氧气,造成缺氧环境,而硝酸盐在缺氧环境中有较高的还原电位,导致其容易被利用。文献[18]也证实了富集培养分离出的大多数菌株对硝酸盐的利用优于硫酸盐。

注:不同小写字母表示同一菌株在不同条件培养下,其生长状况具有显著差异(p<0.05)。图4 氮源类型及其质量浓度对微生物生长的影响Fig.4 Effect of nitrogen source type and mass concentration on microbial growth
2.3 高效石油降解菌的表征
通过与阴性和阳性对照比较,菌株Y187所产生的驱油圈较大,其可能产生生物表面活性剂。提取生物表面活性剂后,利用薄层分析进行初步鉴定,显色结果为红色,表明该生物表面活性剂为脂肽类。菌株Y183和N47所产生的驱油圈较小,表明在该培养条件下其菌株不产生物表面活性剂或者产生的生物表面活性剂活性较低。
经鉴定,菌株Y187含有苯甲酸1,2-双加氧酶基因(benA)和环羟基化双加氧酶基因(rhdα);菌株N47含有烷烃羟化酶(alkMb)和烷烃单加氧酶(alkB)基因;菌株Y183没有扩增出相关的石油降解基因。通过构建氨基酸序列系统发育树(见图5),发现烷烃羟化酶和烷烃单加氧酶聚为一组,且与钙酸不动杆菌烷烃单加氧酶(Acinetobactercalcoaceticusalkane monooxygenase)同源性均为99%;苯甲酸1,2-双加氧酶基因与铜绿假单胞菌苯1,2-双加氧酶基因(Pseudomonasaeruginosabenzene 1,2-dioxygenase gene)聚为一组,且同源性为100%;环羟基化双加氧酶与铜绿假单胞菌芳香环羟基化双加氧酶(Pseudomonasaeruginosaaromatic ring-hydroxylating dioxygenase)聚为一组,且同源性为82%。

图5 氨基酸序列系统发育树Fig.5 Phylogenetic tree of amino acid sequences
本研究发现菌株Y187具有较强的石油降解能力,一方面由于它可以产生脂肽类生物表面活性剂,能诱导微生物的外膜变化,促进细胞与石油接触[25];另一方面由于它含有环羟基化双加氧酶和苯甲酸1,2-双加氧酶基因。研究表明好氧菌对芳香族化合物的生物降解主要由环羟基化双加氧酶催化芳香环的二羟基化引发,双加氧酶可以从还原型辅酶Ⅰ(NADH)转移两个电子以激活活性位点中的氧原子并生成二羟基产物[26]。苯甲酸1,2-双加氧酶是大多数芳烃化合物微生物降解的中间产物苯甲酸代谢过程中较为常见的酶,它能将苯甲酸降解为中间产物儿萘酚,最终降解为水和二氧化碳。菌株N47的石油降解能力较菌株Y187弱,主要由于菌株N47没有显著的产生物表面活性剂能力。菌株Y183在本实验条件下既没有检测到产生物表面活性剂的能力也没有扩增出相关石油降解基因,可能是因为该菌株具有其他的石油降解途径。
3 结 论
本研究获得3株石油降解率大于30%的菌株Y183、Y187和N47,其最适生长温度均为30 ℃,最适pH均为8.0,最适NaCl分别为0、0、20.0 g/L,最适生长石油质量浓度分别为10、50、30 g/L,最适生长氮源类型及质量浓度分别为1.0~2.0 g/L氯化铵、0.5 g/L硝酸铵和0.5~4.0 g/L硝酸铵。菌株Y187能通过产生脂肽类生物表面活性剂提高对石油的摄取,并在细胞内通过环羟基化双加氧酶基因和苯甲酸1,2-双加氧酶基因调控相关石油降解酶的合成来降解石油。菌株N47主要通过烷烃单加氧酶基因和烷烃羟化酶基因来调控石油中烷烃的降解。菌株Y183可能存在其他石油降解机制。本研究加强了对高效石油降解菌的认知,可为石油污染土壤的修复提供重要的菌株资源。

