银杏单倍体的蛋白质组学分析
万 柔,胡亚平,景文轩,胡 博,郭起荣
(南京林业大学 a.林学院;b.南方现代林业协同创新中心,江苏 南京 210037)
单倍体(Haploid)是指体细胞染色体数为本物种配子染色体数的生物个体。相较于多倍体,单倍体因为单纯的遗传特性、独特的表型特性以及材料难获得而长期受到研究工作者的特殊重视。自1922年在曼陀罗Daturastramonium中首次发现天然单倍体植物以来[1],单倍体的研究一直是研究的热点。在自然界中,特别是裸子植物由于受到内、外刺激而形成单倍体植株的频率极低,很不易见[2]。应用于人工诱导单倍体的方法主要有花药培养、孤雌生殖等[3]。单倍体一则可以显著地缩短育种年限,加快育种进程[4-5],二则对纯系的单倍体种质材料的遗传改造更具实践意义,更是解密高度杂合的植物基因组的理想材料[6-9],吸引着越来越多的研究人员致力于单倍体的工作。
随着倍性的改变,植物基因组的结构和基因的表达会发生一系列的变化,如DNA序列消除、染色体重组、基因的非加性表达、表观遗传修饰等。现有研究表明,植物中不同物种的倍性效应都不一样,倍性材料间的生物效应并非简单地表现为倍数关系,而是表现出复杂的剂量效应关系[10]。与高倍性的植物相比,一些物种的低倍性植物往往表现出较弱的生长活力,这种活力的降低反映在较小的体型,较慢的生长速度和较少的次级代谢物方面。在作物方面,多倍体技术已被用于开发更多的优势品种,如新型四倍体水稻(Neotetraploid rice)、十倍体草莓Fragariaananassa等。但是四倍体苹果(Malus×homea)和四倍体黎檬Citruslimonia的体型都比二倍体小[11-12]。
银杏Ginkgobiloba是第四纪冰川运动后遗留下来的裸子植物中最古老的孑遗植物,被称为“活化石”。从18世纪开始,银杏从中国经过日本和韩国传到欧洲[13],作为重要的经济树种广泛应用于日常生产和生活中,在观赏、食用、生态、经济、医疗等方面都具有很高的应用价值[14-15]。2016年,通过大规模流式细胞仪筛查,银杏的不同倍性在2016年由萨里克大学Petr教授等[16-17]发现,随后与其合作,多份倍性材料在中国被发现,也引进了多份资源。其中,银杏单倍体表现为叶片面积较小,光合作用、糖酵解/糖异生和类黄酮生物合成途径等的基因集显著下调表达,表现为净光合速率、类黄酮含量也显著低于二倍体,PAL、PAM和OTM1可能是其类黄酮调控的枢纽基因[18-19]。
本研究采用DIA定量蛋白质组学技术,开展银杏天然单倍体和二倍体的蛋白质组学差异分析,以揭示单倍体银杏种质性状变异的内在机制。这是继银杏倍性发现之后,首次对银杏单倍体进行蛋白质组学探索。
1 材料与方法
1.1 植物材料
2019年底,从马萨里克大学植物园获得银杏单倍体‘Rocky’和二倍体‘Maronia’的穗条,接穗长度一致,保留两芽,于2020年3月在南京林业大学银杏种质资源圃中的同一批实生苗砧木上进行嫁接。2021年8月底,此时银杏功能叶生长成熟,生物量、类黄酮含量等经济性状表现最旺盛,采集嫁接成活后的单倍体、二倍体的接穗成熟叶片,重复采样3次,立即投入液氮中冷冻保存备样。
1.2 蛋白质处理
选取经过iST样本前处理试剂盒(PreOmics,德国)处理好的样品,液氮研磨,取适量磨样,加入50 μL裂解液,在95 ℃、1 000 rpm转速下加热10 min。待样品冷却至室温,加入胰蛋白酶消化缓冲液,于37 ℃、500 rpm转速下振荡孵育2 h后,加入终止缓冲液结束酶解反应。再用试剂盒中的iST cartridge进行肽段除盐,2×100 µL缓冲液洗脱,洗脱后的肽段真空抽干,-80 ℃下保存。
1.3 建立谱图数据库
肽段物用缓冲液A(20 mM甲酸铵水溶液,用氨水调节pH至10.0)重新溶解后,用Ultimate 300系统(ThermoFisher scientific,MA,USA)连接反向柱(XBridge C18 column,4.6 mm×250 mm,5 µm,(Waters Corporation,MA,USA)进行高pH分离,分离使用的缓冲液B线性梯度为40 min内5%升至45%(缓冲液B由80%ACN中加入20 mM甲酸铵,用氨水调节pH至10.0)。柱流速维持在1 mL/min,柱温维持在30 ℃。收集fractio 6个,在真空浓缩仪中干燥,待用。
将除盐冻干后的肽段重溶于solvent A(0.1%甲酸水溶液)后,经由配备在线纳喷离子源的LC-MS/MS分析。Orbitrap Lumos质谱仪在数据依赖采集模式下运行,采集自动在MS和MS/MS间切换。原始数据通过Spectronaut X(Biognosys AG)合并,用Uniprot进行搜库分析。同时,设置母离子、肽段水平的假阳性率(FDR)都为1%,搜索污染序列库,判断样本是否存在污染,设置Trypsin酶解。
1.4 DIA数据采集
各样品加入30 µL solvent A(0.1%甲酸水溶液),制成悬浮液。取出9 µL,加入1 µL 10×iRT肽段,混合,用nano-LC分离,经串联EASYnLC 1200系统的Orbitrap Lumos质谱仪(Thermo Fisher Scientific,MA,USA)分析。总共上样3 µL(分析柱Acclaim PepMap C18,75 µm×25 cm),在5%~35%的缓冲液B(0.1%甲酸ACN溶液)中梯度分离2 h。柱流量控制在200 nL/min,电喷雾电压2 kV。质谱参数:1)MS扫描范围350~1 500 m/z,分辨率120 000,AGC target 4e6,最大注入时间50 ms;2)HCD-MS/MS分辨率30 000,AGCtarget 1e6,碰撞能量32,能量增加5%;3)可变窗口采集设置60个,每窗口串口重叠1 m/z。
1.5 生物信息学分析
采用Biognosys的QuiC软件对原始质谱数据进行质控;采用Pulsar软件对DDA采集模式得到的数据进行建库[20]。根据DDA参考数据库,对得到的DIA数据进行蛋白鉴定,差异蛋白GO注释在http://www.geneontology.org网站,KEGG分析在http://www.kegg.jp网站进行。亚细胞定位使用Wolfpsort(https://www.genscript.com/wolf-psort.html)系统,采用String构建蛋白质互作网络[21],使用Cytoscape进行可视化[22],使用GSEA V2.2.4软件进行蛋白富集分析。
2 结果与分析
2.1 蛋白质的定量鉴定
在“1% FDR”过滤标准下,统计蛋白及肽段数量,一共鉴定到27 250条肽段和6 036个蛋白。鉴定到的蛋白质所含肽段的数量分布情况如图1。从图1可见,肽段的数目与蛋白质的匹配数量呈反向关系,肽段1~10匹配的蛋白质数量依次减少,最多的是1肽段的1 311个,占总鉴定蛋白质数量的22.69%;大于10个肽段的蛋白质数量有571个。
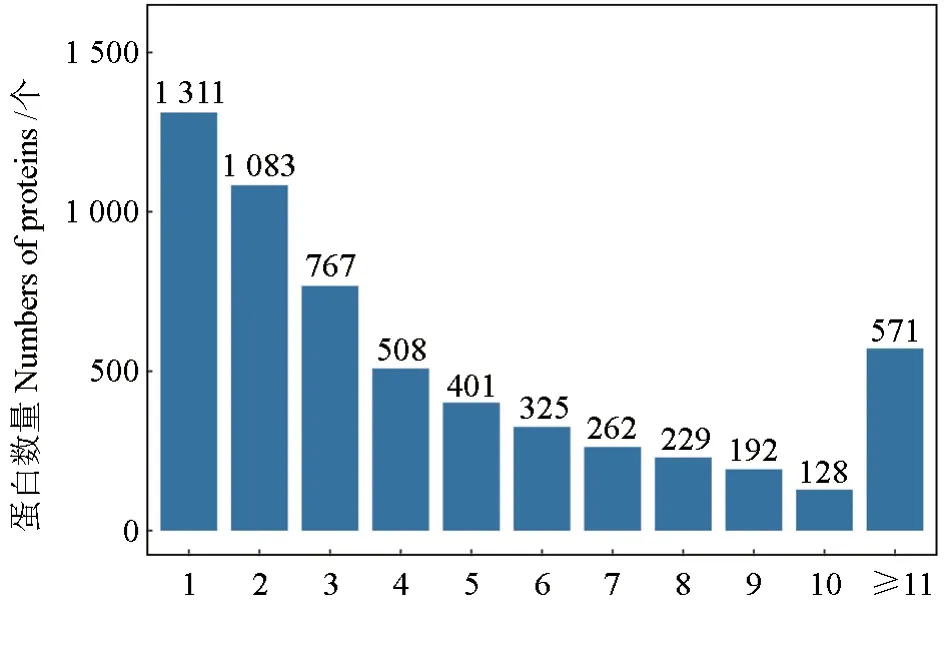
图1 肽段数量分布Fig.1 Distribution of number of peptide segments
对6个试验样品的蛋白质丰度值进行皮尔森(Pearson)相关性分析,结果表明重复样本之间的皮尔森相关系数较高,说明生物学重复中存在高度的相关性,保证了试验结果的可靠性(图2)。

图2 Pearson相关系数热图Fig.2 Heat map of Pearson correlation coefficient
2.2 差异蛋白及其功能分析
本次试验从单倍体银杏中鉴定到6 012个蛋白,二倍体银杏鉴定到6 005个蛋白。其中,有5 981个共有蛋白,31个蛋白是单倍体所特有的,24个蛋白是二倍体所特有的。
以二倍体为对照,选取|log2FC|≥1,FDR<0.05的蛋白作为差异表达蛋白(DEPs),可见在单倍体银杏中共鉴定出686个差异表达蛋白,其中的397个(占57.87%)蛋白的表达上调,289个(占42.13%)蛋白的表达下调(图3)。GO富集分析结果表明,DEPs富集在137个生物过程(Biological process,BP),38个细胞成分(Cellular component,CC)和78个分子功能(Molecular function,MF)中。进一步分析发现主要富集于DNA模板的转录和起始(DNAtemplated transcription,initiation)、叶绿素代谢过程(Chlorophyll metabolic process)、含卟啉化合物的代谢过程(Porphyrin-containing compound metabolic process)(图4)。
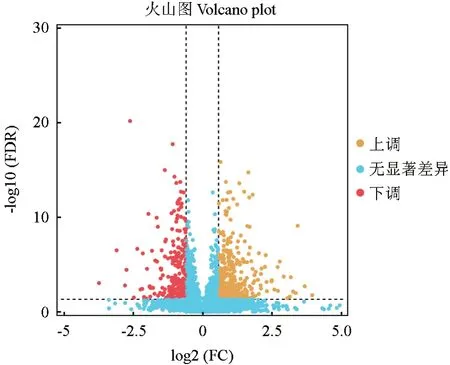
图3 差异蛋白分析Fig.3 Differential proteins analysis

图4 差异蛋白GO富集Fig.4 Differential protein GO enrichment
通过KEGG Pathway显著性富集分析,可了解DEPs参与的最主要生化代谢通路和信号转导途径。分析显示,有通路注释的263个候选蛋白富集在97个KEGG通路中,注释蛋白数目最多的通路是代谢途径(Metabolic pathways),蛋白显著富集在核糖体(Ribosome),有25个下调和3个上调蛋白,其次是单萜生物合成(Monoterpenoid biosynthesis)、角质栓质和蜡质合成(Cutin,suberine and wax biosynthesis)和卟啉与叶绿素代谢(Porphyrin and chlorophyll metabolism)(图5)。
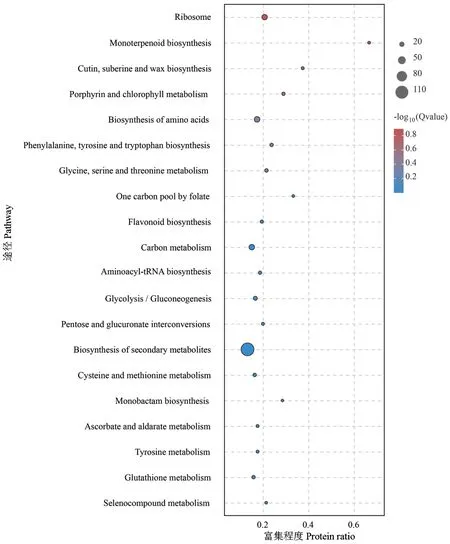
图5 差异蛋白KEGG富集Fig.5 Differential protein KEGG enrichment
2.3 亚细胞定位预测
将筛选出来的差异表达蛋白通过细胞定位来预测蛋白质发挥功能的运作环境。由图6可知,差异蛋白亚细胞定位主要在10个亚细胞区室中:叶绿体、细胞质、细胞核、线粒体、细胞质膜、细胞外、液泡膜、细胞骨架、内质网、过氧物酶。其中,叶绿体和细胞质所占的比例大,分别为37%和29%,为差异表达蛋白主要的亚细胞定位分布点;其次是细胞核,线粒体等亚细胞结构,这些细胞结构的蛋白表达水平也容易受倍性变化的影响,而这些场所是光合作用、蛋白质合成、细胞复制、活性氧产生的主要场所。
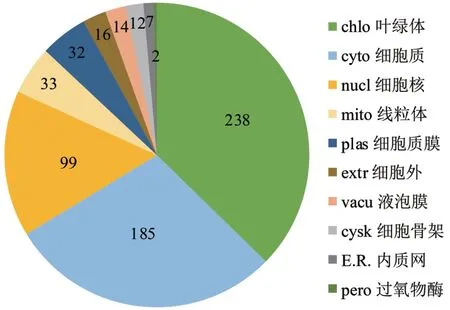
图6 差异蛋白亚细胞定位Fig.6 Subcellular localization of differential proteins
2.4 蛋白互作网络分析
为进一步揭示银杏单倍体与二倍体差异蛋白质的调控功能,探究其分子机制,根据差异富集结果绘制了蛋白互作网络图(图7)。由图7可知,差异蛋白的互作网络涉及26个蛋白的226条相互作用关系,分布在3个代谢通路上。其中,大部分蛋白属于核糖体(Ribosome)通路,FAR5与CYP86B1属于角质、栓质和蜡质合成(Cutin,suberine and wax biosynthesis)通路,CBR3与MNR1属于单萜生物(Monoterpenoid biosynthesis)合成通路。角质、栓质和蜡质合成通路与单萜生物合成通路通过CYP86B1互作。核糖体通路中3个蛋白质上调,其余19个蛋白质均下调,说明核糖体代谢通路互作的蛋白质表达量下降。

图7 差异蛋白互作网络Fig.7 Interaction network diagram of differential proteins
2.5 GSEA分析
GSEA富集分析能弥补传统富集分析对微效蛋白的有效信息挖掘不足等问题,可以更全面地解释功能通路的调节作用。为此,本研究对单倍体银杏中上调表达的蛋白质进行了GSEA-KEGG富集分析,发现氨基酸的生物合成(Biosynthesis of amino acids)、代谢途径(Metabolic pathways)和次生代谢物合成(Biosynthesis of secondary metabolites)3条代谢通路被富集,且均显示出上调表达的趋势(图8);此外,还发现代谢途径、碳素代谢(Carbon metabolism)、次生代谢物合成和内质网蛋白加工(Protein processing in endoplasmic reticulum)4条在单倍体银杏中下调表达的富集蛋白质(图9)。
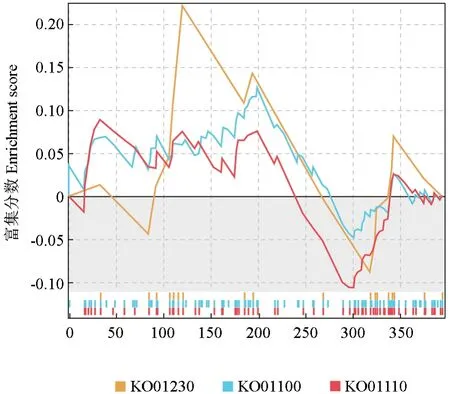
图8 上调蛋白GSEA分析Fig.8 GSEA of up-regulated DEPs

图9 下调蛋白GSEA分析Fig.9 GSEA of down-regulated DEPs
代谢途径、次级代谢产物的生物合成途径的富集差异蛋白在上调、下调表中均有富集,是银杏单倍体蛋白组的重要调控特征。
3 讨 论
蛋白质组是基因表达的直接产物,执行细胞的生物功能并体现蛋白质的表达规律[23],蛋白质组学的研究有助于揭示研究对象的特殊形态和性状的相应机制。最近,将蛋白质组学技术应用于白花泡桐Paulowniafortunei四倍体、青杨‘哲引3号杨’(P.pseudosimonii×nigra)ב北京杨’(P.×beijingensis)杂种三倍体、橡胶树Hevea brasiliensis四倍体等[24-26],林木单倍体的研究少,数据库不完整,对银杏单倍体进行蛋白质表达特性研究具有重要的科学意义。
植物倍性变化后往往能引起生理代谢物质含量和成分的改变[27],已有转录组研究发现,单倍体银杏的类黄酮含量较二倍体低,差异基因在类黄酮生物合成通路中下调表达[18]。蛋白质组研究结果表明,银杏单倍体差异蛋白主要富集于代谢途径、次级代谢产物的生物合成中。本研究发现的蛋白质组变化趋势与生理指标与转录水平表达的变化趋势是一致的,从蛋白组学角度阐明了银杏单倍体的类黄酮含量低的机理。
单倍体一般表现为叶片窄薄、色浅等[28],冬枣Ziziphusjujube单倍体与其二倍体对比就表现为叶片窄薄,叶色浅且生长缓慢[28]。叶绿体的发育是影响叶色的最主要因素之一,叶绿体中叶绿素改变会导致叶色发生变化,从而影响到光合作用。已有研究发现,单倍体银杏的叶面积(7.9±0.5 cm2)显著小于二倍体(17.6±1.1 cm2),单倍体银杏光合作用的净光合速率显著低于二倍体[18]。本研究进一步发现,差异蛋白定位主要集中在叶绿体中,而蛋白质的功能与其在细胞中的亚细胞定位密切相关[30],认为是银杏单倍体叶片叶绿体中的蛋白质影响了叶色。
核糖体由核糖体蛋白与核糖体RNA共同组成,负责蛋白质的合成,与DNA修复和调控细胞分裂、增殖、分化有关。单倍体银杏核糖体途径在差异蛋白质互作网络表达中下调,表明单倍体银杏的核糖体途径受到抑制,可能与单倍体生长势弱的性状相关。在玉米H99、B73单倍体叶片的可溶性糖含量和可溶性蛋白含量的研究中,也表现出这样的核糖体途径差异基因表达结果。
在本试验的蛋白组学分析中,获得了大量的银杏单倍体差异蛋白质信息,但只是对单倍体银杏最终呈现的蛋白表达量进行定性定量研究,分析了银杏单倍体的表型及生理差异的调控机制。事实上,植物倍体差异的生物学过程受到很多因素影响,如染色质重塑、组蛋白变异、翻译后修饰等[31]。蛋白质组学研究的深入对揭示蛋白质的磷酸化、糖基化和甲基化等修饰调控植物生长发育至关重要,都需要在下一步的研究中予以关注。
利用表观基因组学、表型组学和基因组编辑等方法可以对银杏单倍体特征进行系统深入研究。选取重要的功能或者通路相关的蛋白进行研究,探究重要蛋白质表达量与植物生长表型、代谢物含量之间的变化关系以及这些变化关系在植物体内的作用机制,对候选蛋白进行基因克隆和功能验证,以确定调控单倍体银杏的关键蛋白,为基因工程育种提供分子基础。
单倍体种质资源的基因组学研究正在大力开展,单倍体是基因组测序、序列拼接、演化分析等遗传学研究和基因组学研究的优良材料。使用单倍体植物材料破译复杂的参考基因组已经在马铃薯、杜仲和甘蔗等上实现,特别是在高度复杂的基因组树种中,利用单倍型基因组解析复杂的性状调控机制和调控位点的精细定位已经取得了成功,为银杏单倍体基因组的破解和应用提供了重要参考[6,32]。单倍体是完善银杏高度杂合、超大巨型基因组的完美材料,通过破译银杏单倍体材料的T2T基因组,可以进一步提高银杏现有的参考基因组的质量,有助于研究银杏的长寿命、高材质、优景观,以及珍贵药用功能成分如黄酮类、萜类、聚戊烯类等的生物代谢与合成机制。
4 结 论
本研究从蛋白质组水平分析了银杏单倍体的蛋白质差异表达情况,在银杏单倍体中鉴定到6 012个蛋白,31个蛋白是单倍体所特有的;获得686个表达差异蛋白,其中57.87%的蛋白表达上调,42.13%的蛋白表达下调,主要富集在参与代谢途径、叶绿素代谢过程和核糖体途径;37%的差异蛋白定位在叶绿体和细胞质亚细胞区域,差异蛋白的互作网络涉及26个蛋白的226条相互作用关系,分布在3个代谢通路上;发现了核糖体途径的差异蛋白质网络作用,GSEA富集表明差异蛋白参与代谢途径、次级代谢产物的生物合成途径;单倍体银杏叶小、类黄酮低等性状的关键原因是调控通路如代谢途径、叶绿素代谢过程和核糖体途径发挥作用。

