结实与不结实紫薇花芽发育形态及生理特性
周 围,陈建华,王晓明,陈亮明,曾惠杰,乔中全
(1.中南林业科技大学 林学院,湖南 长沙 410004;2.湖南省林业科学院,湖南 长沙 410018)
花芽发育是一个高度复杂的生理生化和形态发生过程,不仅受外界环境因子的影响,而且植物体内各种生理因素也必须共同作用、相互协调,从而对成花进行调控。作为结构物质和能量物质的碳水化合物在花芽发育中起着重要的作用,它的积累与花芽分化密切相关。罗允等[1]研究发现,草莓植株在成花前可溶性糖、还原糖和淀粉含量均处于高水平,随着顶芽转入花芽分化状态,碳水化合物被大量消耗,在第二花序分化前又升高,进入第二花序原始体大量分化阶段时则再次降低。可溶性蛋白质作为一种结构物质,对各种物质的合成均起到重要作用,许多研究认为蛋白质代谢紊乱引起营养失调是败育的主要原因[2-4]。与此同时,植物在有氧生理过程中,体内会产生具有消极作用的活性氧对植物产生伤害,从而引起相关组织的生理生化紊乱。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)对于清除氧自由基有增强作用,避免活性氧因聚集在植物体内而造成的脂膜受损。过氧化物酶(POD)可氧化自由的IAA,可催化H2O2作为氧化物,可使IAA和H2O2含量降低[5]。刘丽华等[6]以板栗为材料研究其雄性不育机制,发现活性氧清除系统的破坏可能是导致板栗雄花序败育的生理原因。脯氨酸也是花药和花粉发育过程中不可缺少的一种氨基酸,是花粉粒形成的前提保障。它不仅可转化为谷氨酸等其他氨基酸供给花粉发育的物质代谢,而且还能起到调节细胞渗透以及清除自由基的作用[7]。
紫薇Lagerstroemiaindica原产于亚洲,为千屈菜科紫薇属落叶灌木或小乔木,栽培历史悠久,花色艳丽,观赏价值高,是中国重要的园林景观植物,广泛种植于我国12个省份。紫薇用途广泛,常用于公园公路绿化、防沙、护坡,同时植株还可入药,花朵可提取香精。紫薇属植物约有55种,我国有紫薇属植物约21种,目前中国紫薇栽培品种繁多,现有的品种多是自然变异后选择而得。本研究团队于2006年在野外偶然发现一株不结实紫薇,并选育为新品种“湘韵”[8],与结实紫薇相比,该不结实紫薇花谢后无果实,花期长达115~132 d,观赏价值高。前人对植物的花器官营养元素含量与其育性的相关性做了大量研究[9],但对于紫薇的研究相对较少。为此,本研究通过对紫薇花芽发育过程中的物质代谢和保护酶活性、营养元素等测定,分析紫薇花芽发育过程中的生理生化变化规律,进一步探讨紫薇结实与不结实的生理生化机制,为紫薇不结实机理研究提供理论依据。
1 材料与方法
1.1 试验材料
试材结实与不结实紫薇Lagerstroemiaindica均采自湖南省植物园(113°03′E,28°10′N),常规水肥管理,根据前期研究,大致将花芽发育过程分为花芽分化初期(时期Ⅰ),花芽分化末期(时期Ⅱ),器官形成初期(时期Ⅲ),器官形成中期(时期Ⅳ)和器官形成末期(时期Ⅴ)5个时期,每个时期取花芽鲜样,放入冰盒,带回实验室中待测。
1.2 试验与测定方法
在扫描电子显微镜下观测紫薇花芽形态时各组织结构更具层次感,观测效果远优于体式显微镜。本试验将5个时期新鲜花芽纵向切开,再粘放在样品台上后放置在离子溅射仪(MSP-mini)喷金镀膜,扫描电子显微镜(Hitachi TM4000 Plus)下观察花芽纵切面发育特征并拍照。分别采集5个时期的30个花芽,利用游标卡尺测量其横纵径。可溶性糖含量和可溶性蛋白含量测定参照李慧敏等[10]的方法,分别称取烘干粉碎花芽约0.5 g,新鲜叶片约0.2 g进行测定。游离脯氨酸含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性的测定参照岑晓斐等[11]的方法,根据标准曲线和公式计算含量和活性。过氧化氢酶(CAT)活性和丙二醛(MDA)含量测定参照王凯等[12]的方法。分别称取新鲜叶片约1、0.5 g,均取上清液进行试验测定。营养元素含量的测定参照白永超等[13]的方法,主要测定K、Ca、Mg、Fe、Zn、Cu、Mn、B等元素的含量。
1.3 数据处理与统计分析
每个指标测定3次,取其平均值,利用Excel 2010和SigmaPlot 10.0软件制作图表,试验数据的统计分析和单因素方差分析和邓肯多重比较采用SPSS 17.0软件完成。
2 结果与分析
2.1 结实紫薇与不结实紫薇花芽形态特征
结实紫薇与不结实紫薇花芽形态特征如图1所示,结实紫薇花芽颜色随时期的增大逐渐加深,从时期 Ⅲ开始极为明显,呈紫红色。而不结实紫薇5个时期花芽青色居多,颜色差异不大。从扫描电镜图看,2种紫薇子房均在时期Ⅲ时露出胚珠,长出花柱,随着时期增大,花柱逐渐成形。结实紫薇在时期Ⅲ时已开始长出花瓣和花丝,而不结实紫薇花瓣不明显,说明从时期Ⅲ开始结实紫薇比不结实紫薇发育速度更快,程度更深。结实紫薇与不结实紫薇花芽横纵径参数如表1所示,结实紫薇5个时期花芽大小分别为:3.67 mm×3.93 mm;5.40 mm×5.49 mm;7.08 mm×7.78 mm;7.69 mm×8.18 mm;8.45 mm×10.04 mm。不结实紫薇5个时期花芽大小分别为:3.23 mm×3.73 mm;4.61 mm×4.94 mm;6.73 mm×6.92 mm;7.17 mm×7.55 mm;8.17 mm×8.75 mm。整体来看,结实紫薇各个时期花芽大于不结实紫薇同时期花芽。

图1 结实与不结实紫薇花芽形态Fig.1 Fruiting and unfruiting L.indica flower bud morphology

表1 结实与不结实紫薇花芽形态特征参数Table 1 Fruiting and unfruiting L.indica morphological characteristics of flower buds
2.2 可溶性糖和可溶性蛋白含量的测定
由图2可以看出,结实紫薇与不结实紫薇在花芽发育过程中可溶性糖含量变化趋势相同,两者均呈先上升后下降的趋势。其中,时期Ⅰ到时期Ⅱ可溶性糖含量显著上升,当花芽发育处于时期Ⅲ时,结实和不结实花芽的可溶性糖含量均达到最大值。而从时期Ⅳ开始,花芽的可溶性糖含量缓慢下降。在整个花芽发育过程中,不结实紫薇花芽的可溶性糖含量均低于同时期的结实,说明糖类物质的亏缺可能导致小孢子的育性降低,是引起紫薇花雄性不育的原因之一。可溶性蛋白的缺亏导致花器官中蛋白质合成的异常,是影响植物不育的重要原因之一。紫薇结实和不结实花芽发育不同时期中可溶性蛋白的测定结果如图2所示。随着花芽的发育,结实与不结实的可溶性蛋白含量均呈下降趋势,并在花芽发育后期降到最低值。不结实在不同时期花芽中的可溶性蛋白含量均低于结实,其中时期Ⅲ不结实相比结实降低了22%。
2.3 游离脯氨酸含量的测定
游离脯氨酸可为花粉的萌发和花粉管的伸长提供能源和氨源。由图3可以看出,在花芽发育过程中,结实花器官中游离脯氨酸一直处于持续积累的状态,到时期Ⅴ达到最大值(83.12 μg·g-1),较时期Ⅰ提高了58.9%。而不结实的游离脯氨酸含量仅在时期Ⅰ高于结实,其余4个时期含量均低于同时期的结实,从时期Ⅲ到时期Ⅴ含量增加缓慢,时期Ⅴ较时期Ⅰ仅提高了20%,说明不结实在花芽发育过程中游离脯氨酸积累较少。
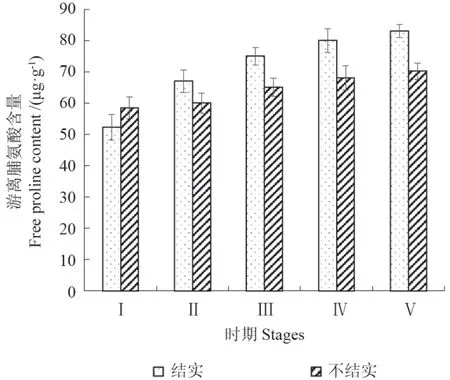
图3 花芽发育过程中游离脯氨酸含量的变化Fig.3 Changes of free proline content during flower bud development
2.4 超氧化物歧化酶活性的测定
SOD是植物体活性氧清除系统的重要保护酶之一,对于自由基的产生和清除系统之间的平衡起积极作用。由图4可以看出,在花芽的发育过程中,不育株紫薇SOD活性呈下降趋势,其中时期Ⅱ显著下降,之后下降幅度较小。可育株紫薇SOD的活性总体呈先下降后上升的趋势,时期Ⅲ是SOD活性的转折点,此时期SOD活性降到最低,仅为142.31 U·g-1·min-1,时期Ⅴ虽然SOD活性上升,但仍然低于时期I,且时期I的SOD活性是时期Ⅴ的1.5倍。对比2个品种,除时期Ⅲ外,其他时期花芽的SOD活性均是结实高于不结实。
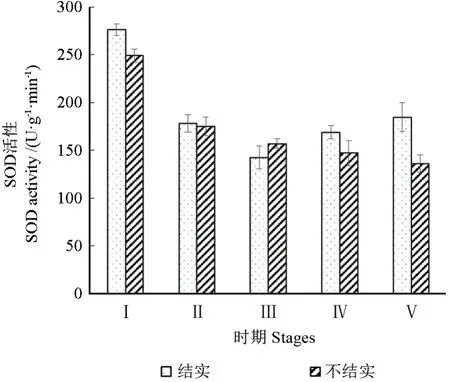
图4 花芽发育过程中超氧化物歧化酶活性的变化Fig.4 Changes of SOD activity during flower bud development
2.5 过氧化氢酶活性的测定
CAT是植物保护自身免受H2O2毒害的关键酶之一,催化H2O2分解为氧分子和水,从而有效清除植物体内的H2O2。由图5可知,不结实紫薇和结实紫薇花芽中CAT活性的变化均呈下降的趋势,其中结实的CAT活性下降幅度要大于不结实。整体而言,不结实的CAT活性在花芽发育各阶段均显著低于同时期可结实的活性,当花芽发育到时期Ⅴ时结实的CAT活性是不结实的1.6倍,说明不结实紫薇的CAT代谢并不旺盛。
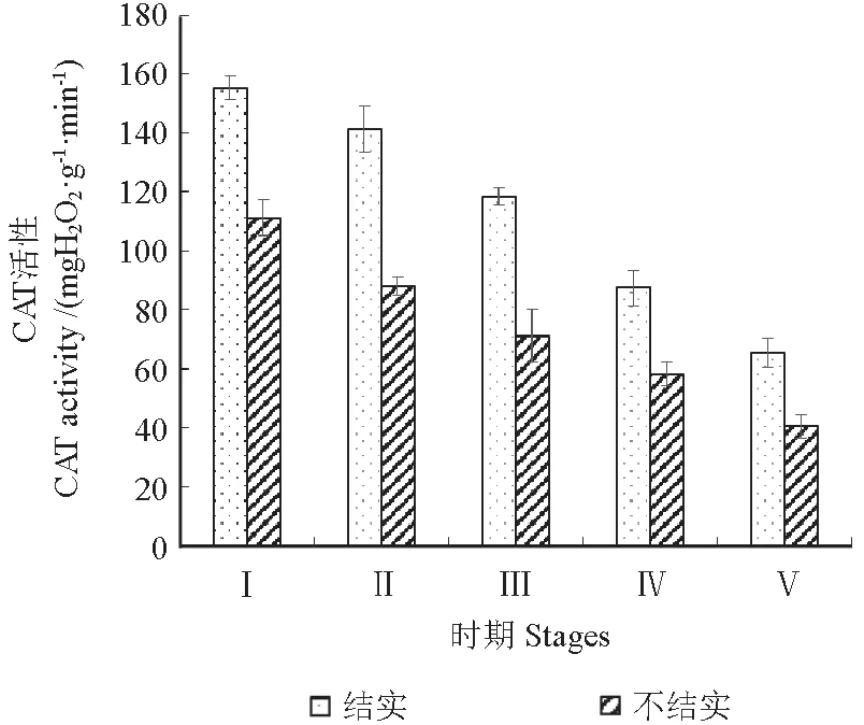
图5 花芽发育过程中过氧化氢酶活性的变化Fig.5 Changes of CAT activity during flower bud development
2.6 过氧化物酶活性的测定
POD是植物体内的一种关键酶,其活性与花药内营养物质的积累密切相关,在植物体内生长素含量方面起着重要作用。不结实紫薇和结实紫薇在花芽发育的不同阶段,花芽中POD活性变化如图6所示。在花芽发育的5个时期中,不结实和结实的POD活性呈相反的变化趋势。结实POD活性缓慢下降,从时期Ⅰ的225.12 U·g-1·min-1下降至时期Ⅴ的171.03 U·g-1·min-1,不结实的POD活性显著上升,由时期Ⅰ的154.61 U·g-1·min-1上升至时期Ⅴ的246.26 U·g-1·min-1。在时期 Ⅲ时,结实与不结实的POD活性无显著差异(P>0.05)。
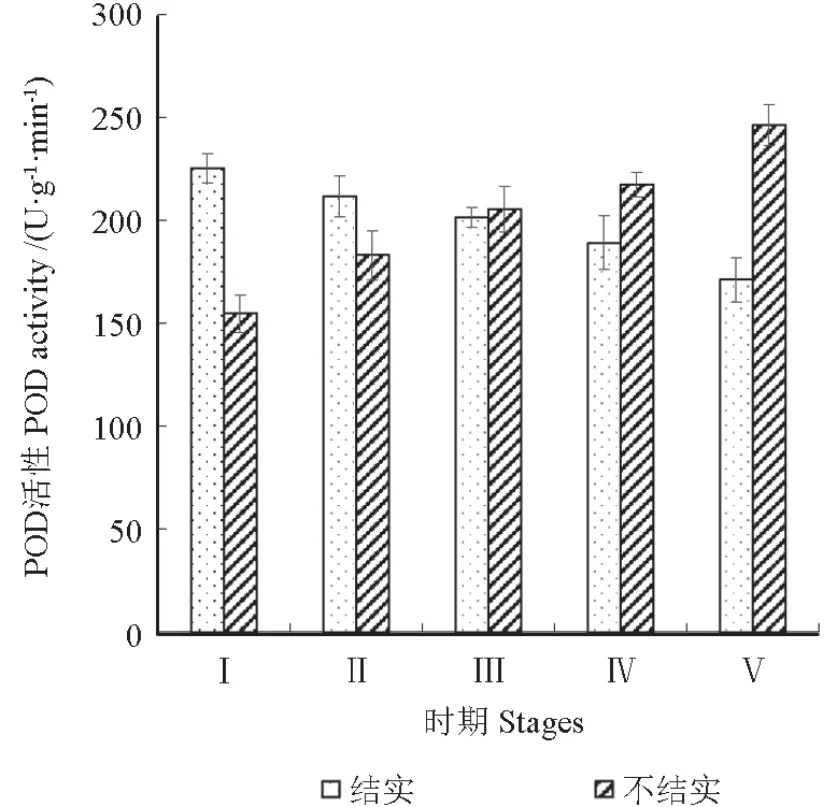
图6 花芽发育过程中POD活性的变化Fig.6 Changes of POD activity during flower bud development
2.7 丙二醛含量的测定
丙二醛是植物脂质过氧化的一个重要生理指标,丙二醛在花芽发育时期的大量积累会使细胞膜结构遭到破坏,从而引起细胞内生理生化代谢的紊乱。由图7可知,在不结实紫薇和结实紫薇花芽发育过程中,不结实和结实花芽的丙二醛含量表现为花芽发育程度越深,丙二醛含量越高,并且不结实的丙二醛含量均高于同时期的结实。结实紫薇的丙二醛含量缓慢上升,尤其是从时期Ⅱ到时期Ⅴ仅上升3.7 μmol·g-1。不结实紫薇的丙二醛含量在时期Ⅳ和时期Ⅴ显著增加,其含量分别是同时期结实的1.4和1.6倍。从花芽分化时期Ⅳ开始,不结实紫薇丙二醛含量显著升高,说明丙二醛的持续积累可能是紫薇不结实的一个原因。

图7 花芽发育过程中MDA活性的变化Fig.7 Changes of MDA activity during flower bud development
2.8 营养元素含量的测定
营养元素作为植物细胞结构的物质组成成分,同时也是植物生命活动的调节者。通过对结实紫薇与不结实紫薇花芽中K、Ca、Mg、Fe、Zn、Cu、Mn、B等元素含量的测定,发现花芽发育过程中,结实与不结实花芽中营养元素的含量有较大差异(图8)。

图8 花芽发育过程中营养元素含量的变化Fig.8 Changes of nutrient elements during flower bud development
结实紫薇的K含量呈显著上升趋势,并且在时期V达到最大值,69.56 mg·g-1,与时期Ⅰ相比,提高了64.4%。不结实紫薇的K含量在时期Ⅰ和时期Ⅱ含量较低且无显著差异,时期Ⅲ时K含量显著增加。总体而言结实紫薇的K含量显著高于不结实。结实紫薇与不结实紫薇在花芽发育过程中Ca含量的变化趋势一致,呈先下降后上升再下降的趋势。从时期Ⅰ到时期Ⅱ,结实紫薇的Ca含量显著下降,时期Ⅱ较时期Ⅰ下降了7.9 mg·g-1,不结实紫薇Ca含量虽然也有下降,但降幅较小,仅下降4.1 mg·g-1,且时期Ⅱ不结实紫薇的Ca含量略高于结实紫薇。当花芽发育到时期Ⅲ时,结实和不结实的Ca含量均达到最大值分别为34.41 mg·g-1和32.53 mg·g-1,随后Ca含量下降,但仍高于时期Ⅰ。
结实紫薇在花芽发育的前三个时期Mg含量显著下降,到时期Ⅲ时Mg含量最低,仅为20.11 mg·g-1,在花芽发育的后期Mg含量显著上升,时期Ⅴ时Mg含量达到30.34 mg·g-1。不结实紫薇的Mg含量变化趋势在花芽发育的前3个时期与结实紫薇变化趋势一致,Mg含量显著低于同时期的结实紫薇。结实紫薇的Fe含量在时期Ⅰ含量为934.43 μg·g-1,时期 Ⅱ到时期Ⅴ,Fe含量呈先下降后上升再下降的变化趋势。不结实紫薇的Fe含量均显著低于同时期的结实紫薇,且变化趋势有较大差异,不结实呈先下降后上升的变化趋势,在花芽发育的时期Ⅱ、Ⅲ和Ⅳ,Fe含量显著降低,在花芽时期Ⅴ才有所上升。结实紫薇的Zn含量在花芽发育的前期显著下降,在时期Ⅲ上升至80.56 μg·g-1,在时期Ⅴ达到最低值70.04 μg·g-1。不结实紫薇的Zn含量变化趋势与结实不同,在花芽发育前期Zn含量显著上升,从时期Ⅲ开始Zn含量显著下降,并在后期含量保持平稳。总体而言结实含量显著高于不结实,结实Zn含量的平均值是不结实的1.58倍。结实紫薇在花芽发育过程中Cu含量的变化呈先升高后下降的变化趋势,在时期Ⅱ达到最大值为66.13 μg·g-1,较时期Ⅰ升高了63.5%,从时期 Ⅲ开始缓慢下降,但时期Ⅴ的Cu含量仍显著高于时期Ⅰ,是时期Ⅰ的1.24倍。不结实紫薇在花芽发育过程中Cu含量变化不大,从相对含量上来看,除时期Ⅰ外,其他时期均显著低于同期结实紫薇。结实紫薇在时期Ⅱ时Mn含量最高,为70.14 μg·g-1,而后随着花芽的发育呈逐渐下降的趋势,时期Ⅴ为最低值43.52 μg·g-1,较时期Ⅱ降低了37.9%。不结实紫薇Mn含量在花芽发育过程中变化较大,前期显著升高在时期Ⅱ达到最大值,随后时期Ⅲ显著下降,在时期Ⅳ再次上升,时期Ⅴ含量显著下降。从相对含量来看,不结实紫薇Mn含量显著高于结实紫薇,尤其是在花芽发育后期,时期Ⅳ和时期Ⅴ不结实紫薇的Mn含量均在结实紫薇的1.6倍以上。结实紫薇在花芽发育的初期(时期 I)含量最高为116.13 μg·g-1,随着花芽的持续发育结实紫薇硼含量出现一定波动,先下降后上升再下降。不结实紫薇硼含量与结实紫薇变化趋势相似。不结实紫薇上升转折出现在时期Ⅳ,而结实紫薇从时期Ⅲ开始。从相对含量来看,不结实紫薇硼含量显著低于结实紫薇。
3 讨论与结论
3.1 讨 论
花芽分化包括生理分化、形态分化和性细胞形成3个阶段,决定着植物开花和结果过程[14-15]。紫薇经营养生长后,当外界环境成熟时,芽分生组织开始发生生理变化和一系列形态变化,逐渐产生各花器官原基最终发育为成熟花器官[16]。本研究发现2种紫薇在时期 Ⅰ和时期 Ⅱ内外部形态发育差异不大,从时期 Ⅲ开始结实紫薇比不结实紫薇发育速度更快,程度更深。从外部形态看,不结实紫薇与结实紫薇柱头和子房发育正常,这与许欢[17]的研究结果相似。物质代谢是植物生命活动的基础,花器官生长发育过程中需要积累大量的蛋白质、氨基酸和糖类物质。研究人员以小麦和玉米[18]为材料的研究发现,不育系花芽的游离脯氨酸含量降低。在本研究中,不结实紫薇花芽中游离脯氨酸含量时期Ⅰ外,随着花芽的发育其余4个时期含量均低于同时期的结实紫薇,说明不结实在花芽发育过程中游离脯氨酸积累较少,其游离脯氨酸的缺乏可能是导致花粉败育的一个重要原因。本研究中不结实紫薇在不同时期花芽中的可溶性蛋白含量明显低于同时期结实紫薇,并且在花芽发育过程中呈下降趋势。说明不结实材料可能由于可溶性蛋白的缺乏,致使一些正常的生理代谢反应不能有效地进行,而产生败育,这与刘金兵[19]对于辣椒的研究结果一致。本研究中,结实紫薇与不结实紫薇在花芽发育过程中虽然可溶性糖含量变化趋势相同,但是不结实可溶性糖含量均低于同时期的结实,说明糖类物质的亏缺可能导致小孢子的育性降低,导致紫薇花的雄性不育。
膜脂稳定是维持细胞正常生命活动的基本条件,丙二醛则是反映植物脂质过氧化的一个重要指标。本研究表明,在花芽发育的所有时期,不结实紫薇的丙二醛含量均明显高于结实紫薇,在不结实花器官中一直存在过量积累的现象。这与彭婧[20]在辣椒上的研究结果一致,由此推测,不育株的形成可能与花芽中MDA的过量积累有关,虽然上部外观还没表现出败育现象,但MDA的积累可能使得内部组织细胞已经受到破坏。植物体内的保护机制主要依靠活性氧酶清除系统来实现。其中SOD、POD和CAT是活性氧清除系统重要的保护酶。前人研究认为植物不育与SOD密切相关[21-23],CAT在消除植物体内自由基方面也起重要作用。本试验结果表明,不结实紫薇的CAT活性从花芽发育初期至发育末期都比相应的可育株紫薇低,SOD活性除时期 Ⅲ外,其他时期与CAT活性一致,均为不结实低于结实,该结果与刘莉等[24]在水稻不育方面的研究结果相似。在植物不育机制中,保护酶的影响通常有两种学说,一种是不育系保护酶活性低于可育系;另一种是不育系保护酶高于可育系导致活性氧升高产生的保护反应[25]。由此可见,紫薇的不结实属于酶活受到抑制,这可能会导致不结实花器官中的活性氧不能及时分解,从而造成对细胞膜的伤害从而影响小孢子正常发育。POD是植物体内的一种关键酶,可有效阻止H2O2的积累[26]。本研究中不结实紫薇的POD活性除花芽发育Ⅰ、Ⅱ时期外,其他3个时期都高于同期的结实紫薇,整体呈缓慢上升趋势。刘金兵等[27]在甜椒不育系抗氧化酶活性研究中也发现,同时期不育系花药内POD活性均显著高于保持系POD活性,推测POD活性偏高将大量分解和氧化IAA,导致IAA浓度偏低,造成花器官发育过程中生长素的亏损、物质代谢紊乱、能量代谢亏损,从而影响小孢子正常发育。
矿质营养作为电子载体的组分、酶的组成部分或激活剂,对花器官发育和保持正常生理生化特征具有重要的作用。Fe和Cu是植物体呼吸作用的电子传递链许多成员的组分,本研究中不结实紫薇在整个花芽发育过程中Fe和Cu的含量均低于结实紫薇,而且在花芽发育过程中的差异达到了显著水平。说明不结实花芽发育过程中,可能由于铁和铜含量的不足,最终使得花药的发育受到明显的影响。Mn作为吲哚乙酸氧化酶的辅因子,其含量将影响IAA氧化酶的活性和植物体内IAA水平。不结实紫薇的Mn含量在花芽发育过程中显著高于结实,说明其可能发生IAA亏损,导致维管束发育不正常,使得水和营养物质进入花药的通道受阻,影响花粉发育。Zn在DNA复制、转录以及基因的表达、细胞分裂、蛋白质合成等方面均具有极为重要的作用[28]。不结实紫薇Zn含量在各时期均显著低于结实,可能会间接地影响花粉的发育。在花芽发育的各阶段,不结实紫薇的K、Mg和Ca含量均低于相应时期的结实,说明花器官的发育需要较多的营养物质提供支撑,而营养物质的不足会直接使得花器官的发育受阻,具体有关机理还需进一步深入研究。
3.2 结 论
结实紫薇各个时期花芽横纵径大于同时期不结实紫薇,结实紫薇在时期Ⅲ时已开始长出花瓣和花丝,而不结实紫薇的花瓣不明显。不结实紫薇花芽的可溶性糖、可溶性蛋白含量均低于同时期的结实紫薇。糖类物质的亏缺可能导致小孢子的育性降低,导致紫薇花的雄性不育。不结实在花芽发育过程中游离脯氨酸积累较少。不结实紫薇的CAT代谢并不旺盛,丙二醛的持续积累可能是不结实败育的一个原因。不结实花芽发育过程中,可能由于各营养元素含量的不足,使与之相关的酶活性受到影响,最终使得花药的发育受到明显的影响。

