特应性皮炎外周血单个核细胞转录组特征及其在度普利尤单抗疗效预测中的应用
王钰,李巍
作者单位:200040 上海,复旦大学附属华山医院皮肤科
1 背景
特应性皮炎是一种高度异质性的炎症性皮肤病[1],其特征为Th2细胞主导的炎症反应[2],其他Th细胞亚群(如Th1、Th17和Th22细胞)也有不同程度的参与[3-6]。除T细胞外,2型先天淋巴样细胞、树突状细胞、嗜酸性粒细胞、肥大细胞和自然杀伤细胞也参与了AD的发病[7-8]。深入探讨AD分子表型可以为阐明发病机制、评估预后和预测治疗反应提供线索。
2 方法
本研究纳入来自复旦大学附属华山医院门诊56例中重度成年AD患者,根据Hanifin &Rajka标准诊断[9]AD。患者均接受度普利尤单抗治疗,具体给药方法为在负荷剂量600 mg后,每隔一周自行皮下给予度普利尤单抗300 mg治疗。采用湿疹面积及严重程度指数(eczema area and severity index,EASI)和特应性皮炎严重程度评分(Scoring Atopic Dermatitis,SCORAD)评价疾病严重程度。在基线和治疗16周后,对患者进行疾病严重度评估并收集血液样本。此外,本研究招募了30名无特应性或其他疾病史的健康志愿者作为健康对照。
对35例来自AD患者基线和16周度普利尤单抗后的PBMCs样本,以及30名健康对照的PBMCs样本进行RNA测序,针对测序结果进行差异基因分析及富集分析。并使用WGCNA分析探寻对度普利尤单抗疗效有预测作用的基因,在另外21例AD患者中进一步验证了这两个基因的预测能力。
3 结果
3.1 AD患者PBMCs转录组特征分析
将进行测序的100例样本分为健康对照组(NC组),AD患者基线组(AD组)及AD患者度普利尤单抗治疗后组(AD-dupi组),使用IPA分析(ingenuity pathway analysis)进行富集分析。结果发现AD的失调通路主要与免疫和炎症通路有关。与NC组相比,AD组表现出增强的2型炎症,具体表现为Th2通路及IL-13信号通路的上调;此外,还发现AD患者IL-8信号通路上调,而NK细胞信号通路下调。度普利尤单抗治疗后,Th2通路和IL-8信号通路在AD-dupivs.NC中不再富集(图1)。
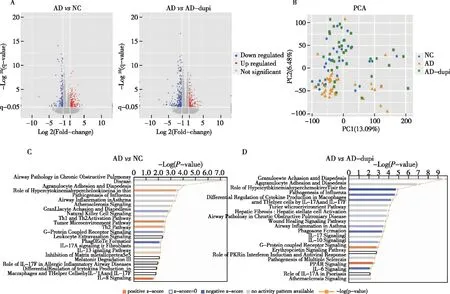
图1 差异基因鉴定及通路富集分析A.NC组与AD组(左)、AD组与AD-dupi组(右)之间的差异基因火山图;B.基于NC、AD和AD-dupi组所有检测基因的主成分分析;C,D.NC组与AD组(C)、AD组与AD-dupi组(D)之间的前20条IPA富集通路NC:正常对照;AD:特应性皮炎组;AD-dupi:度普利尤单抗治疗组
还使用GSVA(gene set variation analysis)方法定量分析三组中各Th信号通路及NK细胞信号通路。发现在AD组中Th2/Th22通路、Th17抗菌肽相关基因以及天然调节性T细胞(nTreg)丰度上调,而TGF-β信号和NK细胞信号下调。度普利尤单抗治疗后,Th2细胞因子受体表达的增加被逆转,而Th2细胞因子表达量并没有显著变化。另外Treg相关IL-10信号通路及Tr1细胞丰度在治疗后存在一定程度回升(图2)。
3.2 AD患者PBMCs转录组WGCNA分析
为了从复杂的转录组数据中探寻与度普利尤单抗疗效相关的基因,使用WGCNA分析将35例AD患者治疗前后的转录组数据分组为基因共表达模块。一共鉴定出10个基因模块,其中2个基因模块在度普利尤单抗治疗后发生显著变化,且与度普利尤单抗疗效相关:黑色模块基因在治疗后表达显著升高,其基线表达量与基线严重程度及度普利尤单抗疗效呈负相关,而绿色模块的结果正好相反。重点分析这两个基因模块,使用这两个模块内的基因构建蛋白互作网络,选择在蛋白互作网络内且与疗效指标具有较强相关性的核心基因进行进一步分析。由此筛选出了黑色模块的核心基因MAP2K3和绿色模块核心基因UBE2L3进行具体分析验证(图3)。

图3 加权基因共表达网络分析A.模块特征基因与外部临床特征的关系;B.黑色模块(上)和绿色模块(下)与EASI75基因显著性的相关性散点图;C.黑色模块(上)和绿色模块(下)内基因的信号通路富集
3.3 MAP2K3和UBE2L3具有一定度普利尤单抗疗效预测价值
在转录组测序数据中,MAP2K3和UBE2L3与疗效指标具有较强相关性:基线MAP2K3表达量与治疗后EASI评分的下降百分比呈显著负相关,而基线UBE2L3表达量与治疗后EASI评分的下降百分比呈显著正相关(MAP2K3:r=-0.44,P=0.009;UBE2L3:r=0.41,P=0.015)。以EASI75为结局变量进行ROC分析,这两个基因均具有较高AUC值(MAP2K3:AUC=0.819;UBE2L3:AUC=0.796)。进一步以EASI评分下降百分比为结局变量进行线性回归也证实,较低水平的MAP2K3基线表达量或较高水平的UBE2L3基线表达量的患者更容易获得度普利尤单抗治疗较好的疗效(MAP2K3:β=-0.41,P=0.021;UBE2L3:β=0.41,P=0.027)(图4)。
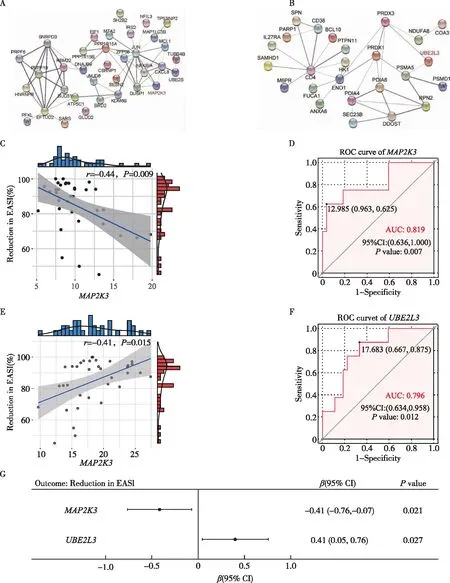
图4 度普利尤单抗疗效相关模块分析A、B.利用STRING数据库构建的黑色模块(A)和绿色模块(B)的核心基因(Hubgene)蛋白互作网络(PPI);C.黑色模块中核心基因MAP2K3基线表达量与EASI减少百分比的散点图;D.MAP2K3预测EASI75的ROC曲线;E.绿色模块中核心基因UBE2L3基线表达量与EASI减少百分比的散点图;F.UBE2L3预测EASI75的ROC曲线;G.以EASI减少百分比为结局变量的MAP2K3及UBE2L3的线性回归分析(经SCORAD调整)ROC:受试者工作特征曲线;AUC:曲线下面积
为了进一步验证上述结果,在其余21例AD患者中使用qPCR的方法检测MAP2K3和UBE2L3的基线表达量,并将其与疗效指标进行分析。同样发现这两个基因基线表达量与疗效显著相关,ROC分析中两基因均具有较高AUC值,线性回归分析也证实了以上两基因具有一定的疗效预测能力。
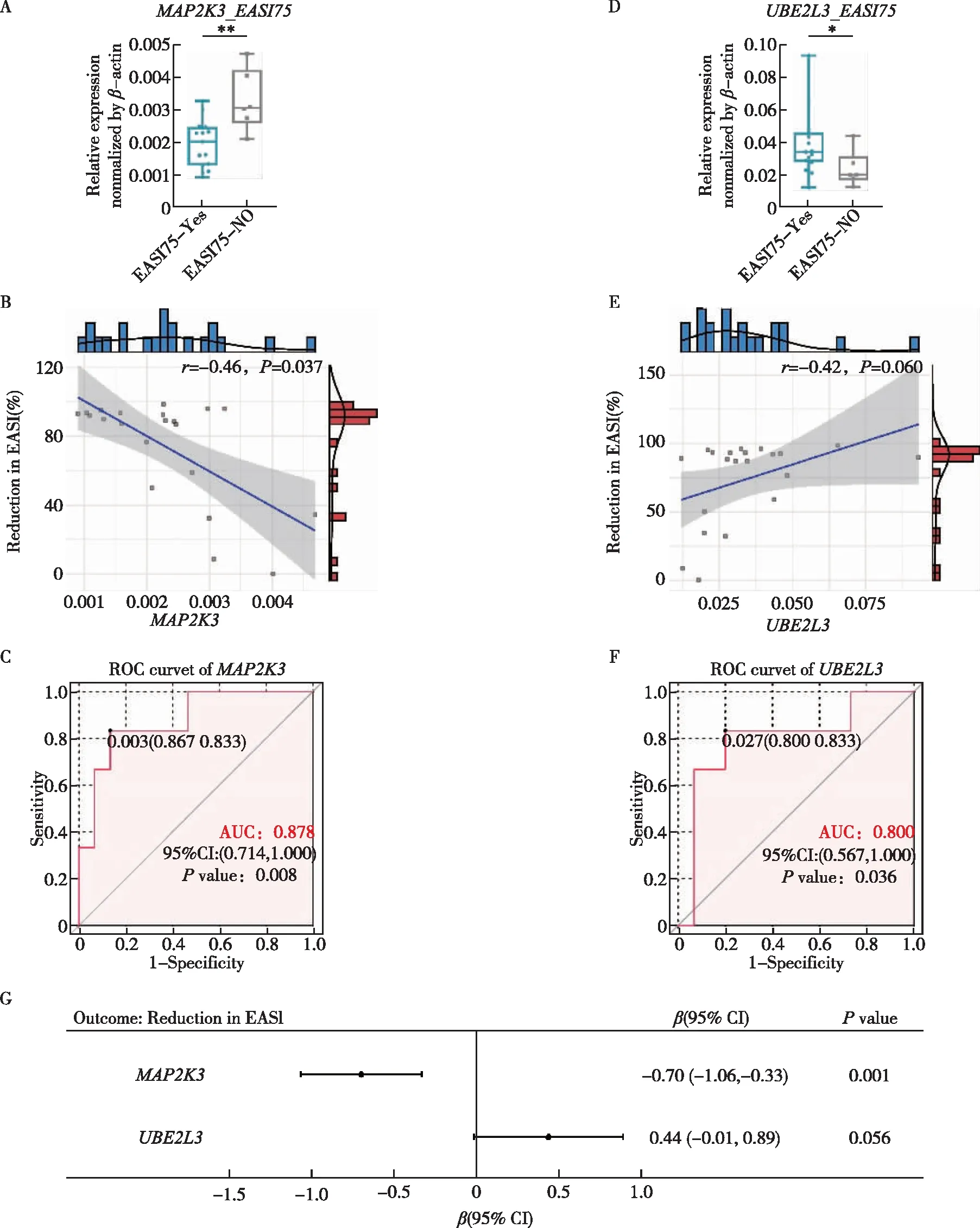
图5 MAP2K3和UBE2L3在另外21例AD患者中作为度普利尤单抗疗效预测因子的qRT-PCR验证A.EASI75和未达到EASI75的患者MAP2K3基线表达量的比较;B.MAP2K3基线表达量与EASI减少百分比的散点图;C.MAP2K3预测EASI75的ROC曲线;D.UBE2L3基线表达量在EASI75和未达到的患者中的比较;E.UBE2L3基线表达量与EASI减少百分比的散点图;F.UBE2L3预测EASI75的ROC曲线;G.以EASI减少百分比为结局变量的MAP2K3及UBE2L3的线性回归分析(经SCORAD调整)
4 讨论
本研究首次报道AD患者PBMCs转录组特征,及其在度普利尤单抗治疗后的变化,为揭示AD发病机制提供线索;同时,本研究也利用WGCNA分析,发掘了两个可能对度普利尤单抗疗效有预测作用的分子。然而,本研究也具有一定的局限性,PBMCs作为血液中单个核细胞的混合物,包括了T细胞、B细胞和单核细胞等多种细胞,通过PBMCs转录组辨别其中细胞亚群的转录组特征较困难;另外,本研究测序队列及验证队列样本量都较小,所挖掘的预测分子需要在更大的队列进一步验证其疗效预测能力。

