科学思维:化学探究实验的灵魂
白建娥 吴琼英

摘要: 科学思维是化学探究实验的灵魂。对铁钉与CuSO4溶液反应pH降低的“异常”现象进行深入探究,设计成时长80分钟的高三复习课。沿着“发现异常→设计方案→分析解释→又见异常→系统梳理→模型内化”六个教学环节层层递进,促进核心知识、认识思路和学科观念结构化,全面提升学生的思维品质。
关键词: 科学思维; 探究实验; 铁与硫酸铜反应; 高三复习
文章编号: 10056629(2023)10005006 中图分类号: G633.8文献标识码: B
科学思维是在化学学习中基于事实与逻辑进行独立思考和判断,对不同信息、观点和结论进行质疑与批判,提出创造性见解的能力;是从化学视角研究物质及其变化规律的思路方法;是从宏观、微观、符号相结合的视角探究物质及其变化规律的认识方式[1]。科学思维是化学探究实验的灵魂。
由铁钉与CuSO4溶液反应后pH降低,推测发生了反应:4Fe2++O2+10H2O4Fe(OH)3↓+8H+,该“异常”现象此前并未引起太多关注,相关文献只搜索到一篇[2],文献作者在九年级“质量守恒定律”一节的演示实验中发现铁钉与CuSO4溶液反应后pH下降的现象,通过对比实验得出异常现象产生的原因是Fe2+被O2氧化,建议演示实验时铁钉与CuSO4溶液的反应装置应该密闭。笔者改进了该实验,发现了更多的探究点,于是设计成一堂高三实验探究课,以进一步发展学生的高阶思维。
1 情境素材的教学价值
基于课标、学情及探究实验过程,笔者梳理了Fe与CuSO4溶液反应蕴含的教学价值,如图1所示。
Fe与CuSO4溶液的反应涵盖了一系列科学探究要素:提出问题(铁钉与硫酸铜溶液反应后为什么pH下降)→作出假设[Fe3+水解生成Fe(OH)3]→设计实验[检验Fe(OH)3]→依据一系列现象论证观点、评估和改进观点等。经历80分钟的探究过程,可使这个真实的情境素材最大限度地发挥其功能价值,促使学生的核心知识、认识思路和核心观念进一步系统化、结构化,促进科学思维的发展。
2 资料卡片的呈现方式
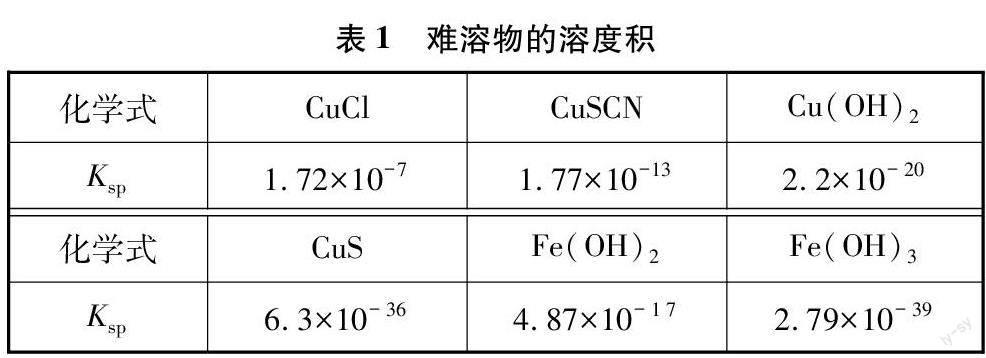
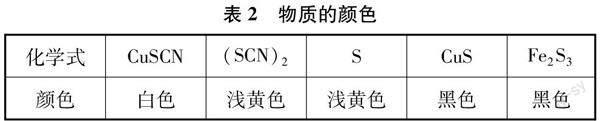
在Fe与CuSO4溶液反应实验现象的分析过程中,要用到相应的支撑数据或事实性知识。高三复习阶段,若还像新授课或一轮复习课那样在需要的环节呈现所用信息,则脚手架太过明显,反而会限制学生的思维。本节课模拟高考探究实验题中“资料”的呈现方式,将可能用到的信息集中给出,让学生根据解决问题的需要,适时选取合适的数据或事实。相当于给学生提供一个“工具箱”,至于要用到什么工具,什么时候使用,均由学生自行决定。这样,既给了学生自由度,同时也带来挑战,有利于分析、综合、评价、创新等高阶思维的发展。表1、2是本节课的“资料卡片”。
K4[Fe(CN)6]与Fe3+产生蓝色沉淀、与Cu2+产生红棕色沉淀。
3 教学目标及流程
教学目标:
(1) 通过实验探究铁钉与硫酸铜溶液反应后pH降低的原因,建立从热力学和动力学两个角度研究化学反应的视角,纠正对盐类水解程度的偏差认识,发展系统思维、批判思维,提升宏微结合、变化平衡等学科核心素养。
(2) 在Fe3+水解产物Fe(OH)3的检验过程中,发展对“分散系”概念的科学认识,强化识别和排除干扰因素的能力,反复将证据与结论进行逻辑关联,提升证据推理学科核心素养。
(3) 结合具体实验和试题对探究过程建立分析解释“异常”现象的思维模型,促使核心知识、认识思路与核心观念进一步结构化,全面提升思维品质。
探究实验教学流程如图2所示。
4 课堂实录
4.1 发现异常
[驱动性任务]预测铁钉与CuSO4溶液反应过程中的实验现象、溶液pH的变化,并说明依据。
课堂上教学活动过程沿着图3所示的顺序展开。
在之前的学习中,学生已经建构了“物质性质类”和“反应规律类”探究试题的问题解决思维模型,因此在教师提供证据(溶液的pH从4.19降到2.83)之前,有个别学生想到Fe2+可能被O2氧化,但随即被同伴否定,认为Fe、 Cu存在的情况下,Fe3+會被还原为Fe2+。教师提供证据后,新的质疑再次产生:盐类水解程度很弱,Fe3+水解产生的H+能够弥补Fe、 O2反应消耗的H+且还能“绰绰有余”吗?
经过多轮次思维碰撞与简单计算,学生形成了科学的观点:Fe、 Cu与Fe3+的反应是自发反应,但是由于反应速率较慢,故可以在相当长的时间内大量共存;水解程度不是一成不变的,溶液越稀,水解程度越大,pH为2.83时,Fe3+基本水解完全。
注:Fe3+在水中以[Fe(H2O)6]3+形式存在,水解可生成[Fe(H2O)5OH]2+、 [Fe(H2O)4(OH)2]+等,水解后还可能发生缔合作用产生双聚体[3]。为适应高中生的认知水平,水解产物一律用Fe(OH)3表示,后文也将水解产物统称为Fe(OH)3。
4.2 设计方案
[驱动性任务]设计实验证实反应体系中存在Fe(OH)3,用流程图呈现实验方案,方框内为实验对象,箭头上标明试剂和操作。
此环节让学生独立设计并将方法、思路以流程图的形式进行显性化表达,促使其对实验过程产生身临其境的“画面感”,尽可能全面地考虑细节问题,避免思维碎片化。教师巡视过程中对学生的方案做出评价,并指定一位中等程度的学生上讲台板书其方案,随后同伴点评,板书的学生认可后作改进,最终形成如图4的方案(两次过滤后的滤液和滤渣用数字1和2区分)。
学生首先想到Fe(OH)3为沉淀,应该与反应生成的Cu一起存在于红色固体1中,加入H2SO4将其溶解,过滤掉Cu(红色固体2)后,向滤液2中加入KSCN{依据资料卡片还可以加入K4[Fe(CN)6]、 Na2S}检验Fe3+;但是开始并未想到沉淀会吸附Fe3+干扰后续检验,经过互动、补充,确定红色固体1要进行“洗涤”。有几位思维灵活的学生立即想到Fe(OH)3具有胶体性质,于是推测滤液1中可能也有Fe(OH)3,便设计了用激光笔照射滤液1以检验是否产生“光亮的通路”。
4.3 分析解释
科学思维是化学探究实验的灵魂和聚焦点。二轮复习的课时有限,图4实验方案并未让学生动手实施,由教师提前在实验室完成并拍成视频和照片,课堂上作为证据呈现,让学生将证据与结论进行逻辑关联。
当然,规范操作是实验成功的保证,基础实验操作亦不可忽视。例如,学生对如何过滤比较熟悉,但对如何洗涤沉淀却颇感陌生。于是,教师播放洗涤红色固体1的实验视频,强调“淋洗、浸没”等关键点,帮助学生内化基本技能,学生表现兴致盎然。
此环节的重点是发展学生的批判性思维。实验现象与结论进行关联的过程中,学生需作深入思考:现有证据是否足够充分支持这个观点?现有证据还有哪些其他解释?课堂上的独立思考、敏锐发现、大胆猜想和周密论证等此起彼伏、精彩不断。
教学片断一:
[师]怎样证明红色固体1已洗涤干净?
[生A]取最后一次洗涤液检验是否含Fe3+。
[生B]我认为不能马上检验Fe3+,因为红色固体中含有Fe(OH)3,洗涤过程中可“溶解”出Fe3+。
[师追问]如何排除干扰?
[生C]可以另取纯净的Fe(OH)3固体于试管中,加水溶解,滴加KSCN溶液看是否变红。
[生D]也可以依据Fe(OH)3的Ksp计算一下溶解出的Fe3+是否可以使KSCN溶液变红。
[师]两位同学从定性、定量两个角度给出了很好的建议。那么,检验其他离子能证明沉淀中吸附的Fe3+已洗净吗?
[生E]加BaCl2检验SO2-4,若没有SO2-4,则原体系中其他离子也都已洗净。
[师追问]为什么?
[生E]因为这是CuSO4溶液,部分变成了FeSO4,溶液中SO2-4浓度应该最大。浓度最大的离子都没了,浓度小的就更甭提了。
学生纷纷点头,教师也为生E的创新思维点赞!
教师继续呈现证据:取三份滤液2,分别加入KSCN、 K4[Fe(CN)6]、 Na2S溶液,依次出现溶液变红、生成蓝色沉淀、有气泡且出现黄色浑浊的现象,均证实了固体中存在Fe(OH)3。学生逐一写出相关反应的化学(离子)方程式。
[生C质疑]加入Na2S产生黄色沉淀不能证明溶液中存在Fe3+,空气中的O2也可能将S2-氧化。
[师追问]那如何排除干扰?
[生F]可以做一个对比实验,向等体积蒸馏水中滴加同样多的Na2S溶液,看是否产生相同的现象。
[师]思维缜密,系统考虑了反应体系中可能存在的微粒,特别棒!
教学片断二:
[师]反应后滤液1产生丁达尔效应(见图5),由此你可以得出什么结论?
[生F]滤液1中有Fe(OH)3胶体。
[师讲解]Fe3+水解生成Fe(OH)3分子,多个Fe(OH)3分子聚集“长大”,当聚集体直径达到1~100nm范围内,形成Fe(OH)3胶体;沉淀则是聚集体进一步“长大”导致的结果。可见,同一种物质在不同的条件下可以分散成溶液、膠体和浊液。
[生G]我认为Cu(OH)2也可能形成胶体,所以有丁达尔效应不一定能证明滤液中有Fe(OH)3。
[生H]那就排除Cu2+的干扰,向滤液1中加入Na2S溶液,Cu2+会生成CuS黑色沉淀。
[生I]CuS沉淀过程中会不会也有长不到沉淀尺度范围的胶体粒子呢?
[生J]而且Fe3+也可与S2-发生氧化还原反应。
全班陷入沉默、思考中……
见无人发言,教师提供加入铁钉前用激光笔照射CuSO4溶液的照片(见图6),没有丁达尔效应。
[生G]真是大道至简呀,我怎么就没有想到呢!
[师]加入铁钉前后对比,可以说明问题了吗?
[生J]可以。加入铁钉之前,Cu2+浓度大,水解产生的Cu(OH)2浓度也大,此时尚且没有丁达尔效应。反应后Cu2+浓度降低,水解产生的Cu(OH)2浓度也降低,更不可能产生丁达尔效应。所以,反应后丁达尔效应一定是Fe(OH)3胶体所致。
[生K]反应后溶液pH=2.83,根据Ksp数据计算,此时Cu2+、 Fe2+还未开始沉淀,Fe3+则已几乎沉淀完全,所以丁达尔效应确实能证明含有Fe(OH)3胶体。
4.4 又见异常
Fe(OH)3由Fe3+水解产生,该反应可逆,故学生推测滤液1中有“游离”的Fe3+存在,加入KSCN溶液理应变红。教师播放滤液1中加入KSCN溶液的视频,溶液立即变红,但红色很快褪去,产生了白色沉淀。请学生利用化学用语解释该“异常”现象。
结合已有知识与资料卡片,生L上台板书写出两个反应的方程式:
(1) Fe3++3SCN-Fe(SCN)3
(2) 2Cu2++4SCN-2CuSCN↓+(SCN)2
两个反应解释了溶液变红和生成白色沉淀。
[生M举手]我发现刚滴入KSCN溶液立即变红,说明反应(1)速率快;随着白色沉淀生成,红色褪去,说明反应(2)限度大。
[师]思维敏捷,考虑全面!不仅解释了实验结果,还解释了实验过程。一般来说,氧化还原反应的活化能较大,反应速率较慢;而复分解反应活化能较小,反应速率较快。
本环节用实验视频代替照片,目的就是让学生不能只关注结果,还要关注反应过程,稳固从热力学和动力学研究反应的两个角度,再次呼应环节1中Fe、 Cu与Fe3+既能相互反应(热力学角度),又可以共存的事实(动力学角度)。
4.5 系统梳理
教师呈现对比实验:将等质量铁粉加入等浓度、等体积的CuSO4溶液,反复振荡使其充分反应,一段时间后溶液pH升高。取等量的三份上层清液于试管中,分别加入K3[Fe(CN)6]、 K4[Fe(CN)6]和KSCN溶液,现象如图7所示。
[师]依据实验现象,可得出什么结论?
[生D]铁钉换为铁粉后,产物中铁元素主要为Fe2+{加入K3[Fe(CN)6]产生深蓝色沉淀,图7左},由于铁粉过量且在振荡之下充分反应,Fe3+浓度已经很小,加入KSCN溶液,溶液只能变黄(图7右);K4[Fe(CN)6]检验Fe3+相对灵敏,出现蓝色沉淀(图7中)。
[师]为什么其他条件相同时,铁钉与铁粉产生不同的现象?
[生N](眉飞色舞地)铁粉与Cu2+在不断振荡下充分接触,反应速率快。生成的Fe2+一旦被O2氧化为Fe3+, Fe3+在铁粉的横冲直撞下又被还原,故Fe3+浓度很小。消耗H+的反应为主要矛盾,Fe3+水解为次要矛盾,反应后pH升高;而铁钉在烧杯底部纹丝不动,任由Fe2+被O2氧化,生成的Fe3+绝大多数接触不到铁钉,不会被还原,体系中Fe3+浓度较大,水解成为主要矛盾,导致溶液pH下降。
全班学生情不自禁、热烈鼓掌!
有了生动的感性体验,接下来让学生对Fe与CuSO4溶液的探究过程进行复盘。此环节是对环节2的呼应。如果说环节2是实验前的“纸上谈兵”,那么环节5则是实验后的总结提炼。复盘的目的是促使学生反思问题解决过程中如何运用知识、如何提取信息分析问题以及如何探索问题的解决方案。教师点请学生当众发言或表达,鼓励学生不受干扰地说出完整的话,使其准确、流畅地把内隐的方法、思维均逐步外显出来。这既是对学生学习效果的诊断,也是对同伴的一种尊重和示范。
4.6 模型内化
[驱动性任务]图8是小艾同学对反应中出现的“异常现象”的分析解释和思路方法的总结,请你结合本节课Fe与CuSO4溶液的反应以及近期完成过的典型探究实验题谈谈对该思路方法的理解。
往常的教学是教师带领学生完成探究之后建立模型,此环节笔者以班级“小艾”同学之名将模型给出,让学生结合本节课的探究进一步理解模型的内涵。因此,设计这个活动是希望学生能将零散知识和解决问题的方法、观念进行系统整理,将其统摄在模型框架之下。语言表达过程中,同伴之间的观点交锋、教师适时的点拨鼓励均能够促进深度思维,从而获得具有概括性和高度迁移性的知识和观念,稳固分析解释“异常”现象的认识角度与思维路径。
5 教学反思
5.1 “整”任务比“碎”任务有利于学生深度思考
Fe与CuSO4溶液反应的再探究中,笔者设计的所有驱动性任务均为“整”任务,需学生独立地进行系统思考、长程推理,并且以流程图、化学方程式或大段的语言表述充分外显其思维过程,而不是“一问一答”、你一言我一语的“碎”任务。“碎”任务容易造成知识和思维的割裂,相当于总是拄着拐杖走路。“整”任务完成后,在学生回答或展示过程中,教师耐心聆听,不仅不“越位”提示,而且还延时评价,给同伴相互补充、多轮次思维碰撞创造机会。学生每提出一个猜想或判断,教师都要进行追问,促使其深度思考,然后将认识角度和思维路径显性化,供同伴评价或借鉴,达到生生之间相互学习的目的。
5.2 探究“课”比探究“题”更能够提升思维品质
探究实验课将纸面探究转化为真实探究[4],为学生外露思维提供了契机。与探究题相比,探究课主题更聚焦、证据更直观(实验视频和照片)。在教师的精心设计下,课堂节奏更适合充分思考、研讨交流与观点表达。Fe与CuSO4溶液反应产生的诸多现象既在“意料之外”,也在“情理之中”,看似寻常却最奇崛。既促进了核心知识、认识思路和学科观念的结构化,又有助于思维敏捷性、深刻性、批判性、创新性的全面提升。课后笔者对部分学生做了访谈,学生普遍反映通过这堂课“刷新了对铁与硫酸铜溶液反应的认知”,感觉“知识更系统、理解更透彻”。
参考文献:
[1]中华人民共和国教育部制定. 义务教育化学课程标准(2022年版)[S]. 北京: 北京師范大学出版社, 2022: 6.
[2]包义才, 龙琪. 铁与硫酸铜溶液反应的异常现象探究[J]. 化学教育(中英文), 2023, 44(1): 120~122.
[3]北京师范大学等. 无机化学(第四版)[M]. 北京: 高等教育出版社, 2018: 773.
[4]曾璐, 钟晓媛. 建立复杂体系综合实验探究的解题策略——以高三实验探究复习课为例[J]. 化学教学, 2022,(9): 89~93.

