基于细胞死亡方式Parthanatos的相关疾病治疗策略的研究进展
路紫瑶 综述,马传福,巴雪青 审校
1.长春职业技术学院食品与生物学院,吉林长春 130000;2.长春市就业训练中心,吉林长春 130000;3.东北师范大学生命科学学院,吉林长春 130000
2008 年,HARRAZ 等[1]发现了由多聚ADP 核糖聚合酶1[poly(ADP-ribose)polymerase 1,PARP1]介导的程序性脑死亡的新形式,根据其发生机制,细胞死亡命名委员会将其命名为Parthanatos[2]。经过10余年的研究发展,Parthanatos 的分子机制逐渐明确,被正式定义为由PARP1 介导的凋亡诱导因子(apoptosis-inducing factor,AIF)和巨噬细胞抑制因子(macrophage migration inhibitory factor,MIF)依赖的程序性细胞死亡[1-4]。虽然其在形态学方面既类似于细胞凋亡又类似于细胞坏死,但其发生机制是一个十分独特的途径。Parthanatos 是多种神经退行性疾病的主要发病原因,如帕金森症(Parkinson's disease,PD)、阿尔莫茨海默症(Alzheimer's disease,AD)、卒中、缺血性再灌注等,除此之外,Parthanatos 也参与到了部分肿瘤如肺癌、乳腺癌的发生过程中[5-7]。因此,深入了解Parthanatos 的分子机制是治疗由Parthanatos 引起的相关疾病的前提,Parthanatos 中的核心蛋白也有望成为相关疾病的治疗靶点,为更多疾病提供有前景的治疗策略和方法。本文基于Parthanatos 的具体分子机制,从抑制和促进Parthanatos 层面对相关疾病治疗策略的研究进展作一综述。
1 Parthanatos概述
Parthanatos 广泛发生于活性氧、炎性损伤、谷氨酸兴奋性中毒诱导的损伤环境中,以及神经退行性疾病和肿瘤的病理过程中。Parthanatos 的发生不依赖于caspase,其过程主要有以下几个阶段:首先,广泛的DNA 损伤导致PARP1 过度活化并介导多聚ADP核糖化[poly(ADP-ribose),PAR]的发生,随后,AIF从线粒体中释放,与MIF 在细胞质中相结合,并共同发生核转移,入核后,MIF发挥核酸酶功能,导致DNA大片段化降解,细胞死亡。见图1[8]。
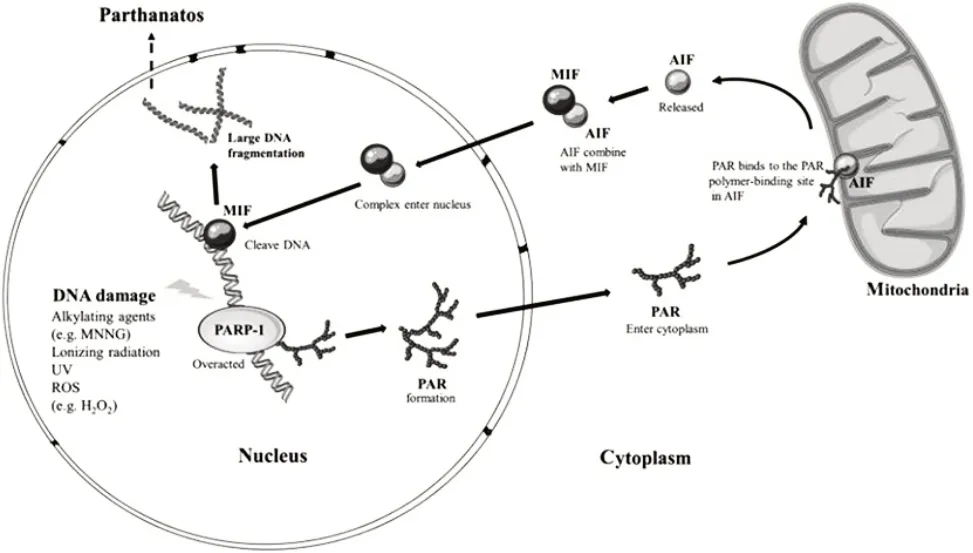
图1 Parthanatos的分子机制Fig.1 Molecular mechanism of Parthanatos
1.1 PARP1的过度活化 PARP1具有多种生物学功能,被称为“DNA 损伤感受器”,DNA 损伤程度较轻时,适当活化的PARP1 会促进DNA 损伤修复,细胞得以存活;DNA损伤程度较为严重时,PARP1会抑制DNA 损伤修复并开启细胞凋亡途径;而DNA 损伤很严重时,过度活化的PARP1 将开启Parthanatos 细胞死亡通路[9]。在Parthanatos 中,过度活化的PARP1会诱导PAR 化的发生,PAR 化是一种蛋白翻译后修饰,PARP1 以烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)为底物,将ADP 核糖连成长链并共价连接到靶蛋白上,形成多聚ADP核糖聚合物(PAR 聚合物),在Parthanatos 中,当细胞内的PAR聚合物不断积累时,PAR 分解酶[poly(ADP-ribose)glycohydrolase,PARG]、ADP 核糖水解酶3(ADP ribohydrolase 3,ARH3)会将PAR 聚合物水解成游离的PAR[9]。PAR 作为PARP1 过度活化的产物从细胞核中释放并转移至线粒体附近,是Parthanatos 级联反应中关键的上游信号,其将进一步诱导细胞死亡。
1.2 AIF与MIF的核转移 AIF主要定位于线粒体内膜及膜间隙中,在细胞死亡信号的刺激下,AIF 将从线粒体转移至细胞核。在Parthanatos 中,PAR 游离至线粒体附近导致线粒体膜的通透性发生改变,并进一步与AIF相结合,促使AIF从线粒体释放,但AIF与PAR 相结合的具体机制仍有待探究[7,10]。而AIF入核后导致DNA 片段化降解的机制一直未被很好的阐明,因为AIF 并不具有核酸内切酶的活性,其无法剪切DNA,直至2016 年WANG 等[4]通过对含有超过16 000 个人重组蛋白的蛋白芯片进行分析,发现了与AIF相结合且具有核酸酶活性的MIF,并将其称为PARP1 依赖的AIF 介导的核酸酶。该研究表明,在Parthanatos中,AIF会与细胞质中的MIF 相结合,二者共同入核后,MIF 发挥其核酸酶功能将DNA 切割成约50 000 bp 大小的片段,最终促使细胞死亡,实验表明,敲除MIF、阻断AIF 与MIF 相互作用或将MIF 的核酸酶活性位点突变,均能抑制由烷基化试剂(MNNG 或NMDA)及氧化应激条件刺激引起的Parthanatos[4,11]。
综上所述,Parthanatos 细胞死亡通路主要涉及PARP1 的过度活化、PAR 的积累、AIF 与MIF 的核转移、MIF介导的DNA 片段化降解等关键过程。目前,Parthanatos 的具体机制已逐渐明确,但仍有部分问题需要探究:①PAR 从细胞核释放的机制;②PAR与AIF 相互作用的机制;③MIF 作为核酸酶更倾向于识别怎样的染色质环境。同时,各种死亡方式在一定程度上并不是完全独立的,在一些情况下,Parthanatos 与其他细胞死亡模式并行运行,因此还需进一步的研究来揭示Parthanatos 与其他细胞死亡方式之间的联系。
2 Parthanatos与疾病
2.1 Parthanatos 与神经退行性疾病 神经退行性疾病主要是由神经元损伤引起的一种慢性疾病,包括AD、PD、亨廷顿舞蹈症(Huntington's disease,HD)、肌萎缩性侧索硬化症(amyotrophic lateralizing sclerosis,ALS)等。AD是一种最为常见的神经退行性疾病,β-淀粉样蛋白(beta amyloid protein,Aβ)的病理性聚集是AD 发病的主要原因之一,研究表明,Aβ 的聚集将引起神经元细胞的氧化应激反应,从而导致PARP1过度激活、PAR 积累,最终细胞发生Parthanatos 而死亡[12-13]。在罹患AD 的转基因小鼠模型的大脑切片中,PAR 的表达量随小鼠年龄的增长和病情的加深而增加,除此之外,Parthanatos 的核心蛋白MIF 也与AD 密切相关,AD 患者脑脊液中的MIF 表达水平为正常人的3 倍左右[11-12],此外,在小鼠模型和人神经元细胞系中,MIF 的小分子抑制剂ISO-1 可显著降低Aβ 诱导的细胞毒性[14]。PD 作为第2 常见的神经退行性疾病,其主要病理特征为α-突触核蛋白(alphasyn-aptonucleoprotein,α-syn)的病理性聚集、多巴胺能神经元的变性坏死等[13-14]。近期有研究发现,Parthanatos的激活是α-syn病变的主要驱动因素,研究者用α-syn 预制纤维(alpha-synuclein preformed fibrils,α-syn PFF)处理小鼠神经元细胞,细胞中PAR 的含量在第3 ~7 天逐渐增加直至最高峰,PARP 抑制剂ABT-888 能够有效抑制α-syn PFF 诱导的细胞死亡,而坏死性凋亡抑制剂以及细胞自噬抑制剂均无法减轻α-syn PFF 诱导的细胞死亡,广谱的caspase 抑制剂也只能部分减轻α-syn PFF 的毒性,表明α-syn PFF主要通过诱导的细胞发生Parthanatos而死亡,除此之外,PD 患者脑脊液中的PAR 水平也明显高于对照组,且PAR 水平与患病时间呈正相关[14]。除了这两种较为常见的疾病,研究者在HD患者大脑的神经元细胞中发现了较强的PARP1免疫反应性及较弱的caspase 免疫反应性,表明caspase 介导的细胞死亡在HD 发展过程中起次要作用,这可能与Parthanatos 的参与有关[5]。在ALS 的疾病模型中也发现了PAR 水平的升高和AIF 核转移的现象[5]。综上,Parthanatos与神经退行性疾病之间密切相关,对其深入研究对相应疾病的治疗至关重要。
2.2 Parthanatos与肿瘤 研究表明,Parthanatos及Parthanatos中的核心蛋白与肿瘤的发生发展密切相关[10,15]。有研究对8 000 余份样本中的PARP1基因进行微阵列分析,结果显示,与同等的正常组织相比,PARP1在多种肿瘤组织中表达更高,尤其在肺癌、乳腺癌、卵巢癌、子宫内膜癌和皮肤癌中,PARP1的表达与正常组织具有显著差异[15]。PARP1还参与了前列腺癌的进展,随着肿瘤侵袭性的增强,PARP1在前列腺癌细胞中的表达水平也随之增加[7]。实验表明,敲除PARP1的小鼠罹患上皮癌的风险大幅降低,这是由于PARP1表达水平下降后抑制了促炎因子NF-κB调控的促癌蛋白的表达,并抑制了Parthanatos的发生[6]。此外,在PARP1敲除小鼠的实验模型中,结直肠癌发生率也明显降低,研究发现,PARP1表达水平降低时,可抑制细胞周期蛋白和转录激活因子的表达,进而抑制结直肠癌的发生[8]。AIF 在抑制肿瘤细胞增殖和转移上也起着重要作用,在荷瘤小鼠的实验模型下,AIF 的下调将促进上皮间充质转化(epithelial mesenchymal transformation,EMT)过程,进而促进肿瘤细胞增殖转移[16-17]。此外,AIF 还可改善肿瘤治疗的耐药性,研究表明,抑制AIF 表达会导致非小细胞肺癌的化疗耐药性增强[10]。而MIF 也通过多种机制参与到了肿瘤的发生过程中,MIF 通过调节促炎分子的表达,如IL-6、IL-8、COX2 和TLR4,从而促进肿瘤增殖,除此之外,MIF 通过抑制钙黏蛋白的表达促进EMT 过程,进而导致肿瘤细胞迁移能力增强[18]。因此,Parthanatos 在肿瘤的发生发展中起多效作用,针对Parthanatos 级联反应中的任何一步均可能成为肿瘤治疗中有前景的治疗策略。
3 基于Parthanatos的相关疾病的治疗策略
Parthanatos 与多种神经退行性疾病相关,包括AD、PD、HD、脑中风等[7,19]。除此之外,Parthanatos 还与多种肿瘤的发展密切相关,如肺癌、乳腺癌等[10]。目前,在神经退行性疾病的治疗方面,通过抑制神经元细胞发生Parthanatos 来治疗相关疾病具有巨大的潜力;在肿瘤治疗方面,通过促进肿瘤细胞发生Parthanatos也成为肿瘤治疗的新策略。
3.1 通过抑制Parthanatos 的发生治疗神经退行性疾病
神经退行性疾病的典型病理表征为神经元的损伤病变以及病理蛋白的聚集,目前有研究表明,在缺血性损伤与氧化损伤的应激压力下,致使神经元细胞以Parthanantos 的形式而死亡是神经退行性疾病发病的主要原因[5]。因此,抑制神经元细胞发生Parthanatos是治疗相关疾病的关键。目前在此方面PARP1 抑制剂的研究较为广泛,除此之外也有学者在抑制AIF 的核转移、阻断AIF 与MIF 相互作用以及抑制MIF的核酸酶活性方面进行研究与探讨,见图2。

图2 抑制Parthanatos发生的途径Fig.2 Pathway to inhibit Parthanatos
3.1.1 PARP1 抑制剂 在Parthanantos 中,PARP1 的激活开启了整个细胞死亡通路,因此,有效抑制PARP1 活性是治疗由Parthanatos 引起的相关疾病的重要靶点。PARP1 作为Parthanantos 级联反应中重要的上游信号,PARP1 抑制剂在神经系统疾病的治疗中也具有巨大的潜力。
在对PD 的研究中,研究者对注射α-syn PFF 的小鼠进行分析,6 个月后,野生型小鼠的神经元减少约50%,而使用PARP1 抑制剂ABT-888 处理的小鼠神经元则无明显减少,除此之外,PARP1抑制剂维利帕尼(veliparib)、卢卡帕尼(rucaparib)、泰拉帕尼(talazoparib)在PD 小鼠模型中均可有效抑制病理性αsyn 介导的PARP1 激活,进而阻断神经细胞发生Parthanato[20]。在对AD的研究中,将PARP1抑制剂PJ34与罹患AD的转基因小鼠的脑皮层细胞进行共培养,结果表明,PJ34 显著降低了PAR 的积累,研究表明,PARP1 抑制剂PJ34 可通过抑制Aβ 诱导的PARP1 激活,从而抑制神经元细胞的死亡[21]。在对HD的研究中,研究者用PARP1 抑制剂INO-1001 治疗R6/2 转基因小鼠,组织学和免疫组化检测结果表明,与对照组相比,INO 1001 处理的R6/2 小鼠存活时间更长,神经功能障碍症状更轻[22]。运动神经元病是一种致命的神经退行性疾病,在罹患该疾病的小鼠模型中,PARP1 抑制剂奥拉帕尼(olaparib)和维利帕尼(veliparib)能够有效降低患病小鼠的神经毒性及神经元细胞的死亡[11]。在继发性脊髓损伤中,PARP1 抑制剂PHE、3AB 可有效抑制脊髓神经元中PARP1 的激活和AIF 的核转移,进而抑制Parthanatos 的发生[7]。因此,使用PARP1 抑制剂可能是未来治疗神经系统疾病的一种有前途的策略。
3.1.2 抑制AIF 的核转移 AIF 从线粒体到细胞核的易位对Parthanatos至关重要,阻断AIF的核转移是抑制Parthanatos发生的进一步机会。研究表明,PAR与AIF 相结合是AIF 易位的关键[7,11]。因此,开发能够抑制AIF 与PAR 相互作用的小分子药物也是有效阻断由Parthanatos引起的相关疾病的新策略。
有研究通过体外实验发现,热休克蛋白70(heat shock protein 70,HSP70)和硫氧还蛋白1(thioredoxin 1,Trx1)能与AIF 相互作用,并有效抑制AIF 诱导的Parthanatos[23]。另有研究表明,在缺氧缺血性脑组织模型中,亲环素A(cyclophile A,CypA)参与了AIF的核转移过程,特异性阻断AIF 与CypA 的相互作用可有效抑制细胞死亡,近期有学者设计出能够靶向人CypA 的特异性AIF 阻断肽,作为CypA 的配体,通过阻断AIF 与CypA 的结合,减少神经细胞的死亡,尽管该研究在动物模型中尚需进一步验证,但这些数据均表明阻断AIF 核易位的药物可能成为治疗神经系统疾病的潜在药物[24]。有研究发现,在AIF 的C-端催化结构域处含有1 个PBM(567-592)区域,其中的精氨酸588,赖氨酸589 和赖氨酸592 位点对AIF与PAR的绑定至关重要,是AIF诱导细胞发生Parthanatos 的关键位点,将这3 个位点突变会导致AIF无法与PAR相互作用,其释放和易位也无法完成,但却不会影响AIF 的氧化酶活性以及与DNA 结合能力,表明AIF 的细胞保护功能和细胞死亡功能是相互独立的[7]。因此,有可能开发出一种能特异性阻断AIF与PAR相互作用的小分子药物,进而抑制Parthanatos的发生,为相关疾病的治疗提供新思路。
3.1.3 抑制MIF 的核酸酶活性 与PARP1 和AIF 在Parthanatos 中的广泛研究相比,MIF 的报道相对较少,这是由于其在Parthanato 中的作用发现的较晚。MIF 是一种PARP1 依赖的AIF 介导的核酸酶,会将DNA切割成50 000 bp左右大小的片段,在Parthanatos中,MIF入核后发挥其核酸酶活性,最终促使DNA 大片段降解,这是Parthanatos 级联反应的最后一步,严重的DNA 损伤导致细胞不可逆转的死亡[4]。因此,抑制MIF 在细胞核中发挥核酸酶活性也是一个关键的治疗靶点。
MIF 具有多种酶活性,包括互变异构酶活性、巯基蛋白氧化还原酶活性,这使MIF 具有多种生物学功能[25]。而MIF 的核酸酶活性是WANG 等[4]于2016年在对Parthanatos 的研究中发现的,证实了MIF 作为下游效应物参与了Parthanatos 的级联反应,MIF第1 个α 螺旋中的谷氨酸残基22 位点(E22)对其核酸酶活性至关重要,但MIF 的核酸酶活性不依赖于其氧化还原酶和互变异构酶活性,因此,有可能开发出只抑制MIF 的核酸酶活性的药剂。2022 年,研究者发现,MIF 作为核酸酶在PD 中发挥着重要作用,是PD 的直接致病因素,研究者将α-syn PFF 分别注射至野生型小鼠和缺乏核酸酶活性(MIF E22Q)及互变异构酶活性(MIF P2G)的MIF 突变体小鼠中,发现MIF E22Q 突变体小鼠中多巴胺神经元的死亡明显减少,表明MIF 的核酸酶活性参与了α-syn 诱导的神经退行性病变,研究者进一步通过大规模复合筛选鉴定出MIF 核酸酶特异性的抑制剂PAANIB-1,研究表明,该抑制剂对于MIF 核酸酶体外抑制率高达60%、细胞死亡抑制率高达70%,可有效预防体内由α-syn PFF 过表达或MPTP 中毒引起的神经退行性病变,并在罹患PD 的动物模型中获得了良好的疗效,该分子有望成为治疗PD 的关键药物,也有望进一步为神经退行性疾病的治疗提供机会[26]。
3.2 通过促使癌细胞发生Parthanatos治疗癌症
在癌症治疗方面,诱导Parthanatos 正成为一种杀伤癌细胞的新策略,并在肺癌和乳腺癌中得到了相应的证实[10,27-28]。由于肿瘤细胞具有非常复杂的微环境,在特定情况下,细胞死亡不止是一种细胞死亡形式的表现,实际上代表了Parthanatos 与其他细胞死亡形式之间的相互作用,因此,将其他死亡途径与Parthanatos 作为共同靶点,对癌细胞将更具杀伤力,能够为肿瘤的治疗提供新方向。
3.2.1 PARP1激动剂 PARP1既能促进DNA 损伤修复,又能诱导细胞死亡,因其具有多种生物学功能,其在肿瘤中的作用一直以来均为研究热点。由于PARP1可修复肿瘤细胞在放化疗过程中产生的DNA损伤,进而导致肿瘤细胞存活,而PARP1抑制剂可通过抑制肿瘤细胞的损伤修复,致使肿瘤细胞死亡,因此,PARP1 抑制剂一直以来均是备受研究者关注的抗肿瘤药物,但PARP1 抑制剂在肿瘤治疗时的耐药性也不可避免,如何有针对性地克服耐药性也是人们持续关注的重点。近年来有多项研究显示,PARP1的表达水平在多种肿瘤组织中明显增加,而PARP1激动剂可使PARP1 过度活化,从而诱导肿瘤细胞发生Parthanatos 而死亡[7,27-29]。这提示我们通过使用PARP1激动剂来诱导肿瘤细胞发生Parthanatos,可为肿瘤的治疗提供新策略。但在目前的研究中,只有少数化合物可间接活化PARP1,从而实现肿瘤细胞Parthanatos 的发生。胶质瘤细胞中PARP1 的表达水平明显高于正常细胞,且其表达水平与胶质瘤恶性程度呈正相关,研究表明,H2O2引起的胶质瘤细胞死亡表现出Parthanatos 的典型特征,包括PARP1 过度激活,PAR 聚合物形成和AIF 核异位,这为以Parthanatos 为途径杀死癌细胞提供了理论上的可行性[29]。目前已有研究表明,一种传统植物的活性成分脱氧鬼臼毒在体内外均可通过诱导过量活性氧的产生导致PARP1 过度活化,进而促使神经胶质瘤细胞发生Parthanatos 而死亡[7]。与上述机制相同,β-拉帕醌为一种天然的奈醌类化合物,其可通过提高活性氧水平来诱导肝癌细胞的PARP1 过度活化,进而诱导肝癌细胞发生Parthanatos[30]。目前发现的这俩种化合物均是通过提高活性氧水平进而间接导致肿瘤细胞PARP1过度活化,从而促使肿瘤细胞发生Parthanatos而死亡。还有许多临床实验证据表明,肿瘤细胞的凋亡缺陷是癌症耐药性最常见的原因,对于这些患者,Parthanatos 途径可以绕过细胞凋亡障碍进而作为肿瘤细胞的另一种死亡途径,除此之外,Parthanatos 与其他细胞死亡途径之间存在的密切联系尚有待进一步探究,共同靶向这些不同的死亡途径,对肿瘤细胞将更具杀伤力,是未来肿瘤治疗的潜在策略[5]。
3.2.2 促进AIF 核转移 AIF 的核转移是Parthanatos发生的关键步骤。目前有研究证实,通过促进AIF发生核转移能够促进细胞发生Parthanatos,这也是一种通过诱导肿瘤细胞发生Parthanatos 的新的治疗手段。BZL101 是植物黄芩的提取物,可促进AIF 的易位,特异性诱导肿瘤细胞死亡,在晚期乳腺癌患者中进行的Ⅰ期临床试验结果表明,BZL101 通过促进AIF 核转移进而促进肿瘤细胞死亡是治疗肿瘤的一种安全可行策略[31-32]。阿替普利莫德(atiprimod)是一种阳离子两亲性化合物,能够有效促进AIF 的核转移,在该项研究中,atiprimod 被证明能显著抑制小鼠体内继发性骨髓瘤的生长,延长荷瘤小鼠的生存期,通过促进线粒体中AIF 的释放和核易位,最终加剧肿瘤细胞的死亡[33]。因此,通过使用BZL101、atiprimod 及其他激动剂,有望从多个层面上实现肿瘤细胞Parthanatos 的加重,可能是肿瘤治疗的一个创新目标。
4 小结及展望
Parthanato 参与了多种疾病的病理过程,包括PD、AD、运动神经元病等神经退行性疾病,同时也参与了一些肿瘤的病理过程。Parthanatos 由PARP1 过度激活所引起,并依赖于AIF 和MIF 介导的大规模DNA 片段化降解。通过抑制PARP1 活性、AIF 的核易位以及MIF 的核酸酶活性,可有效抑制神经细胞发生Parthanatos,进而延缓或阻止相关神经退行性疾病的发展;而通过使用相关化合物促使PARP1 过度激活、AIF 核易位来诱导肿瘤细胞以Parthanatos 的形式而死亡也成为肿瘤治疗的新策略。但关于Parthanatos 的分子机制仍需进一步探究,如PAR 从细胞核释放的机制、AIF 如何与PAR 相结合、MIF 识别的染色质环境等。除此之外,Parthanatos 与其他细胞死亡模式相关联的机制也需进一步探索,从多个层面上实现对细胞死亡的加重,开发多靶点治疗也是未来肿瘤治疗的重点研究方向。综上所述,深入了解Parthanatos 的分子机制是治疗由Parthanatos 引起的相关疾病的关键,对Parthanatos 分子机制及其核心蛋白的深入研究具有重要意义,能够为更多疾病提供有前景的治疗策略和方法。

