鼠源性病毒实时荧光定量PCR检测方法的建立及验证
王吉,王莎莎,李威,付瑞,谭淑萍,范婷婷,郑立群,刘志坚,汤华东,万滔,岳秉飞
1.中国食品药品检定研究院国家实验动物微生物遗传检测中心,北京 102629;2.舒泰神(北京)生物制药股份有限公司,北京 100176;3.未名生物医药有限公司,福建厦门 361009;4.武汉海特生物制药股份有限公司,湖北武汉 430056
动物源性制品存在携带人兽共患病毒的可能,为确保人用动物源性生物制品的使用安全性,避免如汉坦、呼肠孤病毒Ⅲ型等人兽共患病毒的扩散[1-2],人用药品注册技术国际协调会议(International Conference on Harmonization,ICH)及《欧洲药典》EP10.2021对人用动物源性原材料及制品均有病毒安全性评价及检测的相关要求[3-4]。《中国药典》三部(2020 版)对人用动物源性生物制品及原材料的使用安全性也有相应要求,包括人用鼠源表皮生长因子、鼠源神经生长因子、单克隆抗体等相关制品均需进行8 种鼠源人兽共患外源病毒的检测[5]。
《中国药典》三部(2015版)收录的鼠源人兽共患外源病毒检测方法包括细胞试验、动物抗体产生试验、鸡胚感染试验等方法,耗时较长、操作繁琐、使用动物数量较多,还会产生动物干扰检验结果等问题[5]。为避免上述不足,中国食品药品检定研究院(以下简称中检院)和舒泰神(北京)生物制药股份有限公司(以下简称舒泰神)建立了对8种鼠源性病毒的荧光定量PCR(real-time fluorescent quantitative PCR,Q-PCR)检测方法,在此基础上,由中检院联合舒泰神、厦门未名生物医药有限公司和武汉海特生物制药股份有限公司3 家单位,对该方法进行验证,以期用于鼠源性制品8种外源病毒的检测。
1 材料与方法
1.1 病毒 淋巴细胞脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)、汉坦病毒(Hantavirus,HV)、鼠痘病毒(又名脱脚病病毒)(ectromelia virus,EctV/Mouse Pox,MPV)、仙台病毒(Sendai virus,SV)、小鼠肺炎病毒(pneumonia virus of mice,PVM)、呼肠孤病毒Ⅲ型(reovirus type 3,Reo3)、鼠腺病毒(mouse adenovirus,MAdV)、小鼠白血病病毒(mouse leukemia virus,MuLv)、小鼠脑脊髓炎病毒(Theiler’s murine encephalomyelitis virus,TMEV)、脑心肌炎病毒(encephalomyocarditis virus,EMCV)、牛痘病毒(cowpox virus,CPV)、流感病毒H3N2(简称H3N2)、流感病毒B(influenza B virus,Flu B)、猴腺病毒(simian adenovirus,SAdV)、禽腺病毒Ⅰ型(fowl adenovirus groupⅠ,FAdV-Ⅰ)及禽白血病病毒(avian leukosis virus,ALV)均由中检院实验动物质量检测室保存并提供。
1.2 样品 26 批SARS-CoV-2 疫苗生产用单抗细胞株由国内15 个厂家提供;15 批其他鼠源性制品(重组带状疱疹疫苗3 批、抗人CD3 抗体3 批、鼠神经生长因子6 批、鼠表皮生长因子3 批)由国内6 个厂家提供;阴性单抗细胞株(经Q-PCR 法检测确认8 种病毒均为阴性)为国内某厂家送检的重组带状疱疹疫苗生产用单抗细胞株。
1.3 主要试剂 8种病毒质粒标准品及EASY Dilution(for Real Time PCR)均购自宝生物工程(大连)有限公司;Taqman DNA Expression Master Mix购自美国ABI公司;RNA 快速提取试剂盒购自德国QIAGEN 公司;逆转录试剂盒购自美国Thermo公司。
1.4 标准曲线的建立 委托Thermo 公司设计并合成针对8 种鼠源性病毒的引物和探针,见表1。按照《中国药典》三部(2020 版)通则3303 鼠源性病毒检查法,分别由中检院、舒泰神、厦门未名生物医药有限公司、武汉海特生物制药股份有限公司实验室(编码1~4)进行检测。将质粒标准品用EASY Dilution 进行10 倍系列稀释(2 × 108~2 × 100copies/µL),取2×107~2×102copies/µL的质粒标准品进行Q-PCR检测,每个稀释度设3个重复。PCR反应体系为:RNase FreedH2O3.75µL,引物F/R(10µmol/L)各0.5µL,探针(10µmol/L)0.25µL,模板5µL,TaqmanDNAExpression Master Mix 10µL,共20µL。PCR反应条件为:50 ℃保持2 min;95 ℃预变性10 min;95 ℃15 s,60 ℃1 min,共40 个循环,在每个循环延伸结束时进行荧光信号检测[1-7]。探针的荧光标记选择FAM(5'端)作为报告发光基团,TAMRA(3'端)为淬灭基团。以Ct为纵坐标,病毒标准品浓度为横坐标,绘制标准曲线(取5~7 个稀释度)[1,7],标准曲线的Slope 应在-3~-3.5之间,R2应>1±0.05,Eff应在80%~120%之间。

表1 8种病毒引物及探针序列Tab.1 Sequences of primers and probes of 8 viruses
1.5 检测方法 用RNA 快速提取试剂盒提取待检病毒总RNA,逆转录合成cDNA,以其为模板进行PCR扩增,扩增体系及条件同1.4 项。Ct≤35 且拷贝数≥10 copies/µL时,判为阳性;Ct≤35且拷贝数<10或Ct>35且拷贝数≥10或Ct>35且拷贝数<10 copies/µL时,判为阴性。
1.6 方法的验证
1.6.1 特异性 选择LCMV、HV、EctV、SV、PVM、Reo3、MAdV、MuLv 8 种鼠源性病毒及相应的小鼠其他易感病毒、同科同属病毒及感染引起同类疾病的相关病毒[8-9],每种鼠源性病毒对应的其他病毒见表2。按1.5 项方法于4 个实验室分别进行检测,以RNase Free dH2O作为阴性对照,每个样品设3个重复[1,7]。8种鼠源性病毒应有特异性病毒扩增曲线产生,其他病毒应无扩增曲线。
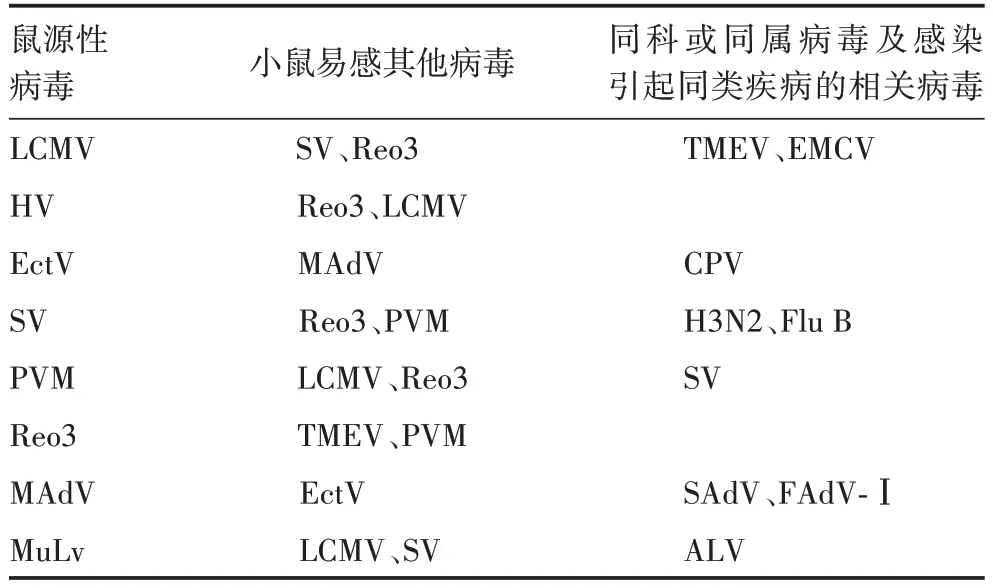
表2 8种病毒特异性验证用相关病毒Tab.2 Related viruses used for detection of specificity of Q-PCR method for 8 viruses
1.6.2 灵敏度 将质粒标准品用EASY Dilution 稀释为2×107~2×100copies/µL,按1.5 项方法,于4 个实验室分别进行检测,每个稀释度设3 个重复[1,4]。灵敏度应不低于2×102copies/µL。
1.6.3 精密性 将质粒标准品用EASY Dilution 稀释为2×103~2×107copies/µL,随机选择3 个连续浓度梯度,按1.5 项方法检测3 次,每个浓度各设3 个重复,计算3个重复的Ct和拷贝数变异系数(CV),即试验内精密性;计算每个浓度梯度3 次检测间Ct和拷贝数的CV,即试验间精密性。Ct和拷贝数的CV均应<25%。4个实验室分别进行检测,每次检测至少应有3个实验室满足上述结果要求[1,4]。
1.7 病毒污染模拟试验 将LCMV、HV、EctV、SV、PVM、Reo3、MAdV、MuLv 8 种鼠源性病毒用无菌PBS 稀释为10-1~10-8,将不同浓度梯度病毒按10%的体积分数加入阴性单抗细胞株样品中,取0.2 mL,采用1.5项方法进行检测。4个实验室分别进行检测,实验室间拷贝数检测限相差应≤1个数量级[1,7]。
1.8 盲样检测 给每个厂家随机分发32份阴性单抗细胞株样品,每种病毒4份,其中2份加入不同量(1%~50%)的相应病毒,混匀,即阳性样品。2 份阴性及2份阳性样品随机编号1 ~4。采用1.5项方法进行检测,以RNase Free dH2O为阴性对照。检出的阳性样品,需用相同方法进行复检。4家单位检出结果符合率应为100%[1,7]。
1.9 方法的应用 用建立的方法检测26批国内15个厂家的SARS-CoV-2 疫苗生产用单抗细胞株及15 批国内6个厂家其他鼠源性制品的8种外源病毒。
1.10 数据采集及分析 应用7500fast 软件进行数据采集、分析及作图。
2 结果
2.1 标准曲线的建立 实验室1检测LCMV的标准曲线图见图1,获得曲线方程为:y= -3.284x+ 35.917,R2=0.999,实验室1 对其他病毒及其他实验室检测的标准曲线均略。8 种病毒的Q-PCR 标准曲线参数均符合要求,见表3。
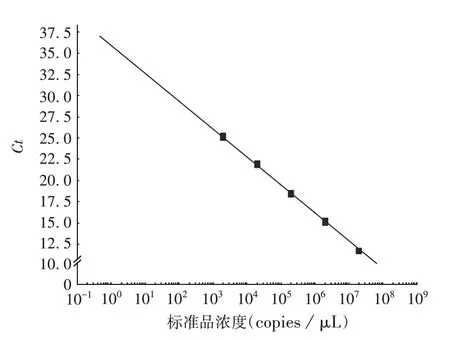
图1 实验室1检测LCMV的标准曲线Fig.1 Standard curve of LCMV detection in laboratory 1
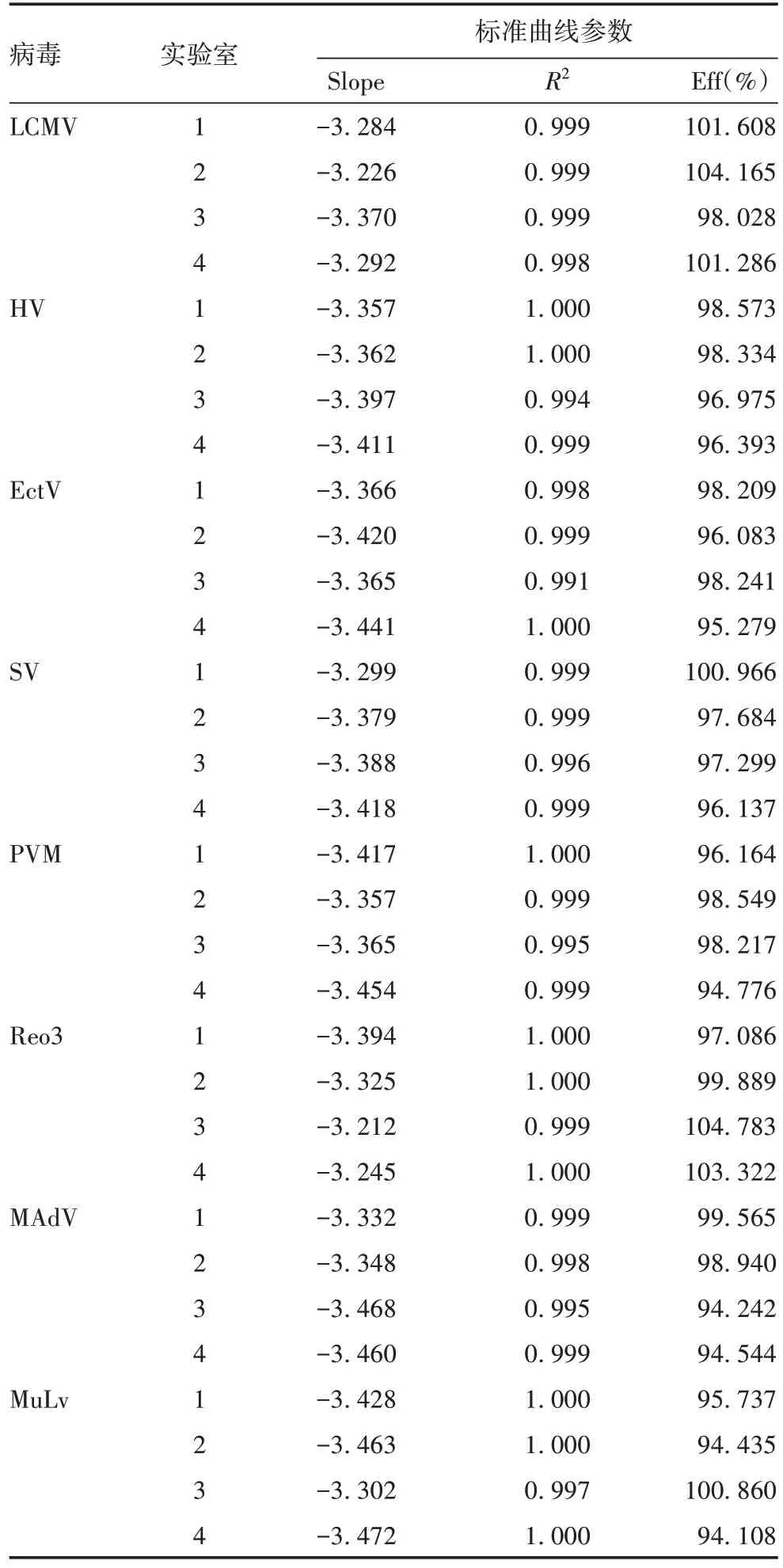
表3 4个实验室建立8种病毒Q-PCR标准曲线参数汇总表Tab.3 Summary table of Q-PCR standard curve parameters of 8 viruses in 4 laboratories
2.2 方法的验证
2.2.1 特异性 Q-PCR 法检测8 种病毒均可见明显的扩增曲线,阴性对照和其他病毒均无扩增曲线产生。以实验室1对LCMV特异性扩增曲线图为例,见图2,其他均略,相应Ct和拷贝数见表4。表明该方法具有良好的特异性。
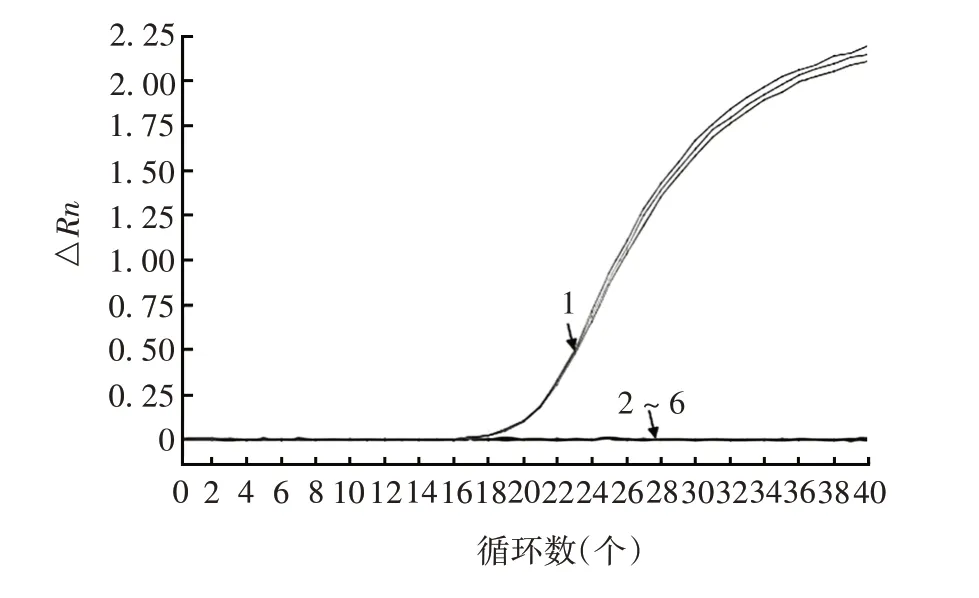
图2 特异性验证的扩增曲线(以实验室1 检测LCMV为例)Fig.2 Amplification curve of specificity verification(taking LCMV detection in laboratory 1 as example)
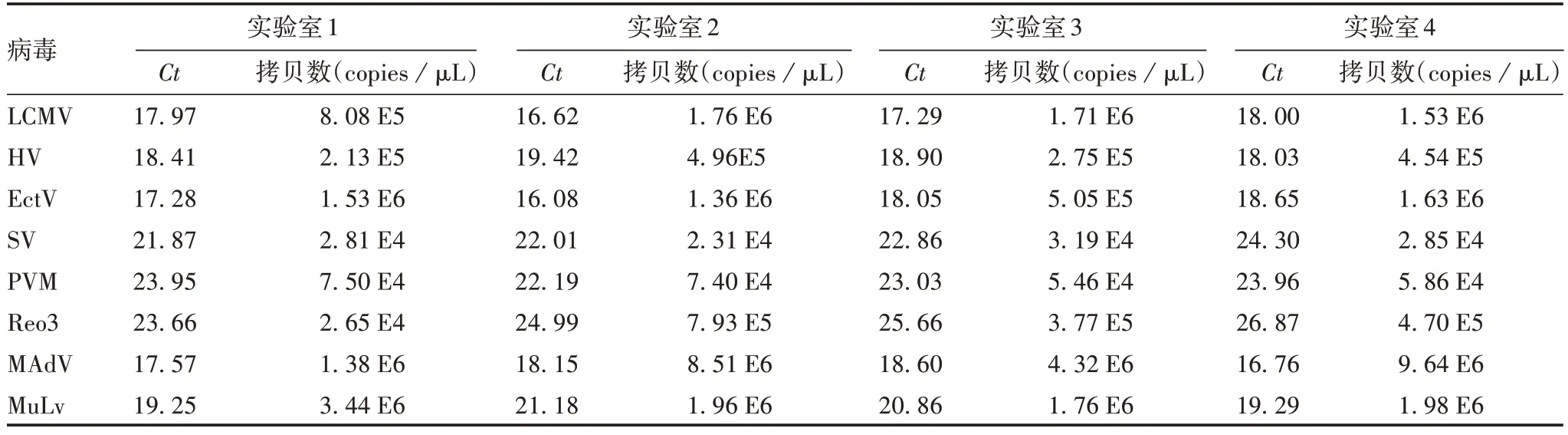
表4 特异性验证结果Tab.4 Specificity verification results
2.2.2 灵敏度 实验室2 对EctV 检测的灵敏度为2 × 102copies/µL,实验室2 对其他7 种病毒及其他3 个实验室对8 种鼠源性病毒的检测灵敏度均为2×101copies/µL,以实验室1 对LCMV 的特异性扩增曲线为例,见图3,其他均略。
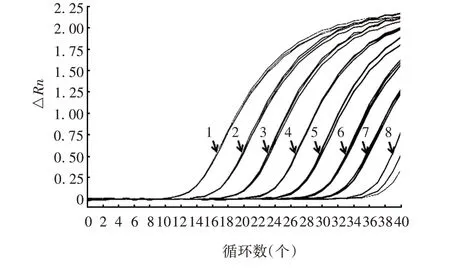
图3 灵敏度验证的扩增曲线(以实验室1检测LCMV为例)Fig.3 Amplification curve of sensitivity verification(taking LCMV detection in laboratory 1 as example)
2.2.3 精密性 除实验室3 对MAdV 检测拷贝数试验间CV为37.58%外,实验室3对其他7种病毒和其他3个实验对8种病毒检测的试验内、试验间Ct和拷贝数CV均<25%,。以实验室1对LCMV特异性扩增曲线为例,见图4。表明该方法具有良好的精密性。
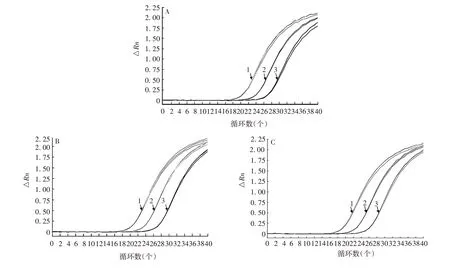
图4 精密性验证的扩增曲线(以实验室1检测LCMV为例)Fig.4 Amplification curve of precision verification(taking LCMV detection in laboratory 1 as example)
2.3 病毒模拟污染试验 4 个实验室对模拟污染病毒的检测灵敏度相差均控制在1 个数量级之内,见图5(以实验室1对LCMV特异性扩增曲线为例)及表5。
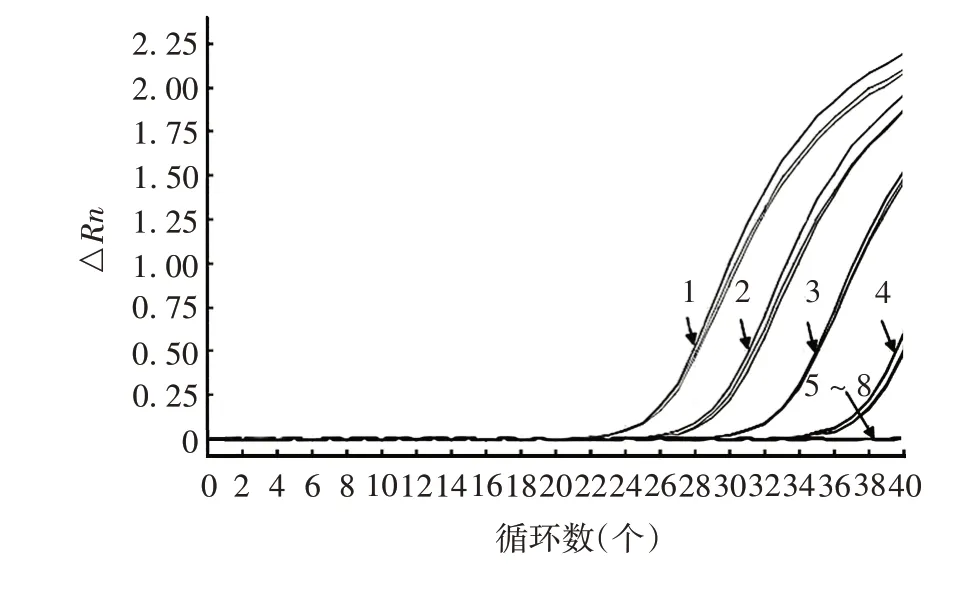
图5 病毒模拟污染的扩增曲线(以实验室1检测LCMV为例)Fig.5 Amplification curve of virus simulated contamination test(taking LCMV detection in laboratory 1 as example)
表5 8种病毒模拟污染试验结果Tab.5 Simulated contamination test results of 8 viruses
2.4 盲样检测 4 个实验室的检测盲样样本阴性结果和阳性结果符合率为100%,见图6、图7(以验室1对LCMV特异性扩增曲线为例)及表6。
图6 盲样检测结果(以实验室1检测LCMV为例)Fig.6 Blind sample detection results of LCMV in laboratory 1(taking LCMV detection in laboratory 1 as example)
图7 盲样阳性样本复检结果(以实验室1 检测LCMV为例)Fig.7 Retest results of LCMV blind positive samples by laboratory 1(taking LCMV detection in laboratory 1 as example)
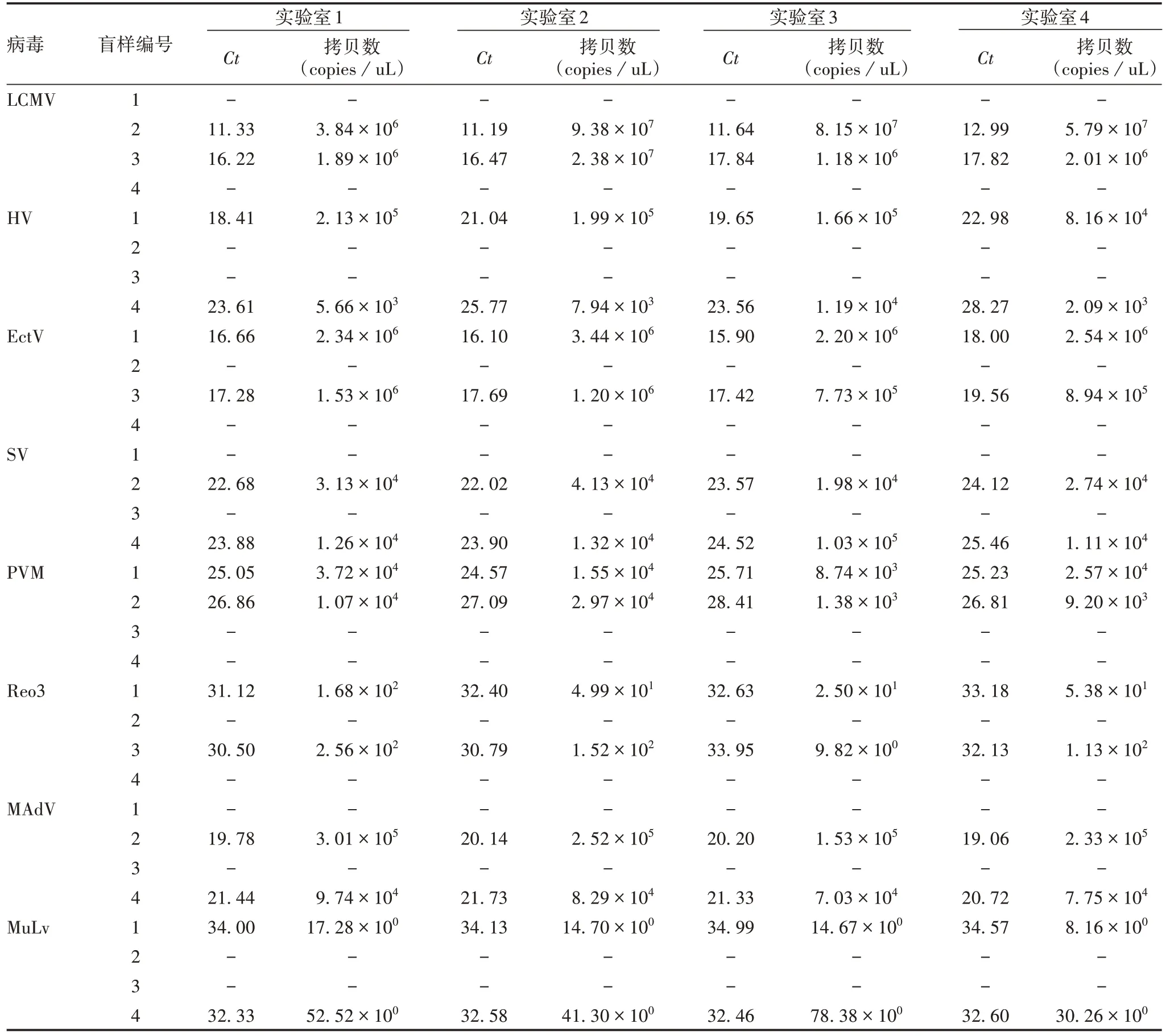
表6 8种病毒荧光定量PCR法盲样检测结果汇总表Tab.6 Summary results of blind sample detection by Q-PCR for 8 viruses
2.3 方法的应用 26 批SARS-CoV-2 疫苗生产用单抗细胞株及15 批其他鼠源性制品的检测结果均为阴性,图略。
3 讨论
随着医学、生物学检验检测技术的不断更新和发展,对人用生物制品的检测提出了新的要求,尤其是人用动物源性生物制品的使用安全性方面。Q-PCR法操作简便、反应快速、重复性好、灵敏度高、特异性强、结果清晰可靠,已广泛应用于临床检测与诊断、质量与安全检测等多个领域[10-16]。《美国药典》USP43.2020和《欧洲药典》EP10.2021 已将Q-PCR 法纳入用于动物源性产品及细胞基质外源病毒的检测[3-4]。本研究对8 种鼠源病毒Q-PCR 法进行了验证,该方法既能提高检测的敏感性和特异性,又能与国际接轨[6]。
本研究结果显示,4 个实验室建立的8 种病毒Q-PCR 法标准曲线参数均符合要求。验证结果显示,Q-PCR法检测8种目的病毒均可见特异性扩增曲线,检测同科同属或小鼠易感其他病毒均未见相应特异性扩增曲线;除实验室2 对EctV 的灵敏度为2×101copies/µL外,实验室2对其他7种病毒和其他实验室对8 种病毒的灵敏度均为2 × 101copies/µL;4 个实验室对LCMV、HV、PVM、MuLv 4 种病毒模拟污染试验的检测灵敏度一致;除实验室3对MAdV检测拷贝数试验间CV为37.58%外,实验室3 对其他7种病毒和其他3个实验对8种病毒检测的试验内、试验间Ct和拷贝数CV均<25%,符合重复性稳定性要求。盲样检测结果显示,4个实验室检测结果符合率为100%,表明8 种鼠源病毒Q-PCR 法特异性、灵敏度、精密性良好。
实验室2检测EctV的灵敏度为2×102copies/µL,与预期结果(2×101copies/µL)相差1 个数量级;实验室3 对MAdV 检测拷贝数试验间CV为37.58%,不符合<25%的要求;模拟病毒污染试验结果显示,4个实验室对EctV、SV、Reo3 和MAdV 4 种病毒检测灵敏度不完全一致,相差1 个数量级。出现上述结果的原因可能是受不同人员操作熟练程度、不同仪器升温和降温的精确性差异及每个孔间温度的均一性差异等因素影响而导致的[7]。因此,在设计试验方案及判定标准时考虑上述因素的影响,在Q-PCR检测限之内,规定方法灵敏度验证应不低于2×102copies/µL,模拟污染实验检测灵敏度差异在1 个数量级范围内,精密性验证CV应<25%。
Q-PCR 法与鼠源性病毒检测传统方法比较,不仅可定性,还可定量,且操作简便快速,节省动物的使用量,符合减少(reduction)、替代(repIacement)和优化(refinement),即3R 原则;避免了动物本身可能携带病毒的干扰,使结果判定更加准确可靠;易于推广,有助于企业自检;应用范围广,可用于鼠源性生物制品、半成品及原材料的检测。本实验室采用Q-PCR 法对26 批SARS-CoV-2 疫苗生产用单抗细胞株及15 批鼠源神经生长因子和其他制品进行了检测,结果均为阴性,节省了大量动物,缩短了检验周期,加快了产品的研发速度和上市时间,尤其是为SARS-CoV-2疫苗等相关产品的上市争取了时间。

