工程化细胞因子的研究进展
侯宗文,黄钰综述,史新昌,周勇,张怡轩 审校
1.沈阳药科大学,辽宁沈阳 117004;2.武昌首义学院,湖北武汉 430064;3.中国食品药品检定研究院卫生部生物技术产品检定方法及其标准化重点实验室,北京 100050
细胞因子是由各种细胞(免疫及非免疫细胞)分泌产生的在细胞间发挥相互作用的一类可溶性多肽/蛋白,可通过与自身受体相互作用调节细胞增殖、分化及凋亡,诱导免疫应答[1]。细胞因子可通过旁分泌、自分泌及内分泌机制发挥信号传递的作用。目前普遍认为细胞因子可分为6类:白细胞介素(interleukin,IL)、集落刺激因子、干扰素(interferon,IFN)、生长因子、趋化因子、肿瘤坏死因子(tumor necrosis factor,TNF)。
细胞因子与其靶细胞上的受体结合后可触发细胞内特定的级联反应,进而产生相应的生物学效应,如增强细胞代谢、触发细胞增殖或凋亡等。细胞因子的受体通常为多个跨膜蛋白组成的多聚体,且细胞因子与不同受体多聚体结合后可产生不同的效应[1]。多种胞因子具有同样或类似的生物学作用,如白细胞介素-2(IL-2)和IL-15 均能刺激T 细胞增殖[2]。一种细胞因子也可抑制或激活另一种细胞因子的功能。
细胞因子最初从人血清及动物组织中提取,但获取量十分有限,随着基因工程技术的兴起,人们逐渐利用基因工程改造的大肠埃希菌表达提取,但表达的包涵体复性存在诸多技术瓶颈,继而应用哺乳动物细胞表达系统提供具有功能的细胞因子,自此,多种形式的工程化细胞因子技术得到长足的发展。
细胞因子工程化是以结构生物学和细胞工程为基础,利用现代生物工程技术对天然或重组细胞因子进行结构修饰及改造,以提高细胞因子的治疗效力或增加细胞因子类药物的产量。工程化的细胞因子广泛应用于多种疾病的治疗。如通过抑制IL-17治疗银屑病[3],通过IL-6 和IL-1 拮抗剂治疗COVID-19[4],通过阻断肿瘤坏死因子治疗克罗恩病[5]等。
鉴于细胞因子对不同受体亲和力的差异,细胞因子工程化的研究集中在改变受体结合亲和力上,如对IL-2“超级因子”[6]和IL-15“超级激动剂”[7]的尝试;提高受体结合选择性,如IL-12 部分激动剂的研发[8];通过干扰相互作用,如IL-15 拮抗剂和IL-13超因子的使用[9]。本文主要对细胞因子的工程化设计、靶向、递送以及mRNA 表达、细胞技术的创新作一综述,并进行展望。
1 重组细胞因子的设计
随着现代生物分析技术的进步,最新的蛋白质工程已经开发出用于增加细胞因子的功能、降低毒性、提高信号转导效率、优化分布的技术。以下着重探讨如何使用不同的蛋白质工程模式设计细胞因子。
1.1 聚乙二醇(polyethylene glycol,PEG)化和肽基化细胞因子的体内半衰期一直是影响细胞因子类药物治疗效果的关键因素。用PEG共价偶联细胞因子是延长其半衰期的有效方法。PEG 可增加细胞因子的相对分子质量及体积,降低肾脏清除率,减少与血浆成分的相互作用,从而降低其免疫原性。Besremi是单糖基修饰的脯氨酸IFNα-2b,并具有甲氧基PEG部分,通过重组DNA 技术在大肠埃希菌细胞中产生。临床试验表明,PEG 后可将给药间隔延长至2 ~4 周,能更持久地控制血细胞数量,以用于治疗真性红细胞增多症[10]。HOGGATT 等[11]在大肠埃希菌中表达的重组人粒细胞集落刺激因子的基础上,使用新的糖PEG 化技术,通过在非格司汀的苏氨酸134开放位点添加O-聚糖,然后用唾液酸转移酶将20 kD的PEG-唾液酸衍生物转移至O-聚糖上制备了重组人粒细胞刺激因子类药物——Lonquex,作为非格司亭的长效生物仿制药,与培非格司亭相比,Lonquex的终末半衰期延长了7 ~10 h,可显著增加血液中中性粒细胞数量。
IL-2 是临床应用最广泛的细胞因子之一,其受体由3 条链组成,根据对IL-2 亲和力的不同可分为低亲和力IL-2Rα、中亲和力IL-2Rβγ 和高亲和力IL-2Rαβγ。研究表明,IL-2 的毒性通常与高亲和力三聚体IL-2Rαβγ 复合物的激活有关,这种高亲和力的三聚体在调节性T 细胞上大量表达,进而促进肿瘤生长[12]。可以将IL-2 进行PEG 化缀合,使其PEG 部分特异性阻断与IL-2α亚单位的结合位点,但维持与其他受体亚单位的相互作用,从而选择性地促进T细胞和NK 细胞的扩增[13-14]。虽然PEG 的细胞因子疗法取得一定进展,但PEG 化的细胞因子也并非完全安全,其原因是患者在长期使用过程中可能产生抗PEG化的抗体[15]。由于PEG可作为mRNA疫苗的赋形剂,用于稳定脂质纳米颗粒,所有mRNA 疫苗均可能含有PEG。mRNA COVID-19 疫苗在极少数情况下所产生的过敏反应可能由PEG引起[16]。为解决上述问题,出现了可降解和非免疫原性的PEG 替代品,即合成多肽。用合成多肽与细胞因子化学偶联,即肽基化。动物试验表明,肽基化后的细胞因子显示出极强的蛋白酶抗性和低免疫原性[17]。
1.2 定点进化技术 定点进化技术可用于直接设计细胞因子,并改变受体结合位点的亲和力。定点进化是基于对蛋白质界面内氨基酸突变时自由能变化的预测。由于在细胞因子与受体相互作用的情况下,潜在的能量极难预测,因此,该方法主要用于削弱受体-细胞因子相互作用。在过去的几十年中,野生型IL-2已在临床上用于治疗多种癌症,但会引起严重毒副作用。为了在癌症治疗中激活细胞毒性T 细胞,许多工程改造均集中在改变IL-2对不同受体亚基的亲和力上,在设计突变体时,可用易错PCR 创建IL-2变异体的诱变文库,并根据对IL-2Rβ 的亲和力进行筛选,最终产生对IL-2Rβ亲和力增强的IL-2“超级因子”,IL-2“超级因子”在小鼠模型中显示出更强的抗肿瘤反应,更低的毒副作用,进一步将IL-2超因子与白蛋白融合,可改善其药代动力学特性[18]。
除了IL-2,最近还对其他细胞因子进行了定点突变。IL-18 可增强抗肿瘤免疫,但其临床治疗效果不理想,主要是由IL-18结合蛋白(IL-18 binding protein,IL-18BP)的诱饵受体负调节导致。临床研究表明,在接受重组IL-18 治疗的患者中,IL-18BP 的血清浓度增加了10 ~100 倍[19]。ZHOU 等[20]使用酵母表面展示的定向进化筛选了超过2.5 亿个mIL-18 变异体,这些变异体随机分布在13 个受体接触位置,经过5 轮IL-18Rα 的选择和针对IL-18BP 的反向选择,获得1 个完全结合IL-18Rα 的群体。该群体的测序揭示了11 个独特的序列,从中创建了2 个“共有序列”CS1 和CS2,通过重组表达该变异体,并通过表面等离子体共振检测其对IL-18Rα 和IL-18BP 的亲和力。结果表明,所有选择的变异体均保留与IL-18Rα的结合位点,与IL-18BP的结合可忽略不计。GORBY等[21]首先将IL-10 中螺旋D 和E 之间的连接接头延伸6 个肽以产生单体IL-10,然后用单体IL-10 构建体转染酵母,结果显示,单体IL-10 构建体保留了与IL-10Rα 结合位点,但与IL-10Rβ 结合力较弱。继续利用易错PCR产生对IL-10Rβ具有增强亲和力的IL-10 突变体,并将突变产物电穿孔至酿酒酵母菌株EBY100中,进行了8轮选择,随着IL-10Rβ 浓度逐渐降低,分离出与IL-10Rβ 结合并具有增强亲和力的IL-10 变体,从而解决了使用高剂量IL-10 引发的毒性问题。
1.3 结构解析指导设计技术 利用结构解析指导设计技术来制备工程化细胞因子需要依赖于细胞因子详细的结构知识和先进的蛋白模型。IL-22 是机体内一种重要的抗炎细胞因子,但也会引发炎性反应,可通过降低与受体IL-10Rβ 的亲和力来提高受体结合特异性,从而减少不必要的促炎反应的发生。SAXTON等[22]通过突变IL-22的4个氨基酸残基(Q1-16A、K124A、Q128A 和S45E)提高了受体结合选择性,选择性地激活了STAT3信号通路,增强了细胞因子的功能特异性。MENDOZA 等[23]解析了IFNγ 晶体结构,并确定了完整六聚体IFNγ-IFNγR1-IFNγR2(2∶2∶2)信号复合物的晶体结构,该结构揭示了6个相互作用位点:IFNγ 与IFNγR1 共享的2 个位点1界面,IFNγ与IFNγR2共享的2个位点2界面,IFNγR1与IFNγR2共享的2个位点3界面。进一步研究表明,IFNγ先与IFNγR1结合为二聚体后,才能与IFNγR2相互作用;同时,作者进一步合理地设计了与IFNγR1结合但取消与IFNγR2 结合的IFNγ 三重(K74A/E75Y/N83R)突变体,减少了IFNγ作用的多效性。
2 靶向和递送
利用蛋白质工程设计出的细胞因子可在多种疾病中发挥良好的治疗效果,但较高的给药剂量限制了其广泛的临床应用。可采取以下策略减少细胞因子的多效性,提高其靶向性。
2.1 抗体与细胞因子融合设计 使用抗体修饰细胞因子是目前改善细胞因子定位的一种流行策略。抗体与细胞因子的融合体称为免疫细胞因子,抗体片段的大小和空间排列极大地影响了细胞因子的靶向性能[24]。WEISS 等[25]将单链可变片段(single-chain variable fragment,scFV)或其二聚体形式的L19 片段分别与TNFα 和IL-12 融合制备了L19-mTNF 和L19-mIL12,结果证明,2 种免疫细胞因子均能促进肿瘤浸润淋巴细胞的增殖,并增加肿瘤微环境(tumor microenvironment,TME)中促炎细胞因子的数量,可实现有效的抗胶质母细胞瘤活性。QIAO 等[26]将西妥昔单抗的可结晶片段(fragment crystallizable,Fc)分别与本身抗原结合片段(fragment antigen binding,Fab)和IL-10二聚体融合构建出CmAb-(IL-10)2,静脉注射CmAb-(IL-10)2至小鼠模型后,与rIL-10相比,其半衰期从2.7 ~4.5 h延长至40 h;进一步用高(2 mg/kg)或低(0.8 mg/kg)剂量的CmAb-IL-2 注射至小鼠体内,可显著诱导炎性细胞因子分泌,并伴有体重减轻,最终所有用高剂量治疗的小鼠均死亡。相比之下,即使CmAb-(IL-10)2剂量(4 mg/kg)远高于CmAb-IL-2,CmAb-(IL-10)2治疗的小鼠中也未观察到以上效应。因此,CmAb-(IL-10)2可能是全身治疗癌症的良好候选物,具有延长半衰期和降低毒性的作用。L19-mTNF、L19-mIL12和CmAb-(IL10)2的结构见图1[25-26]。
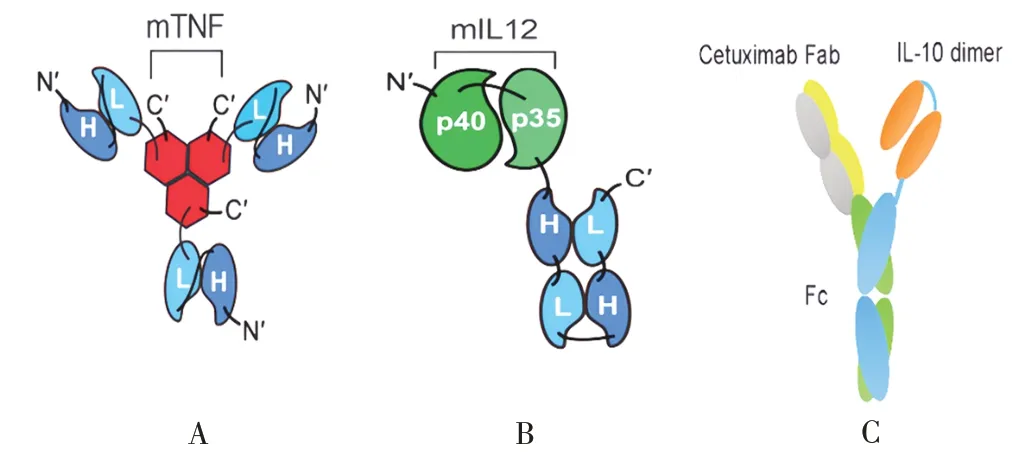
图1 L19-mTNF(A)、L19-mIL12(B)和CmAb-(IL10)2(C)的结构图Fig.1 Structure diagram of L19-mTNF(A),L19-mIL12(B)and CmAb-(IL10)2(C)
细胞因子也可作为抗体的接合物,即用2 个特异性抗体分别靶向肿瘤抗原及免疫细胞,用细胞因子将2 个特异性抗体连接。VALLERA 等[27]首先合成了由抗CD16的scFv、抗CD33的scFv和作为接头的IL-15组成的三特异性杀伤细胞接合物。这种设计的优点是同时结合肿瘤抗原和自然杀伤(NK)细胞受体,并用修饰的IL-15 将NK 细胞和肿瘤细胞结合在一起形成免疫突触,可刺激NK细胞存活和增殖,促进肿瘤细胞死亡。抗体细胞因子融合策略可显著提高细胞因子的疗效,增加细胞因子的循环半衰期,但也存在脱靶效应及免疫原性等问题[28]。
2.2 细胞因子与毒素融合 胶质母细胞瘤中过表达IL-4 的高亲和力受体可通过IL-4 偶联毒素的方式达到治疗的目的。MOHAN 等[29]开发了一种靶向基因融合蛋白,并命名为MDNA55,其包含2个分子:高度特异性的环状IL-4 超因子和假单胞菌外毒素a 的催化结构域。二者融合的作用机制见图2[29]。MDNA55与肿瘤细胞表面IL-4R结合,整个复合物被内吞为内体,弗林蛋白酶发现并切割内体中的假单胞菌外毒素a,并将其释放至胞质溶胶中,游离的假单胞菌外毒素a 导致ADP 糖基化,延伸因子失活,蛋白质合成抑制,最终导致肿瘤细胞死亡。
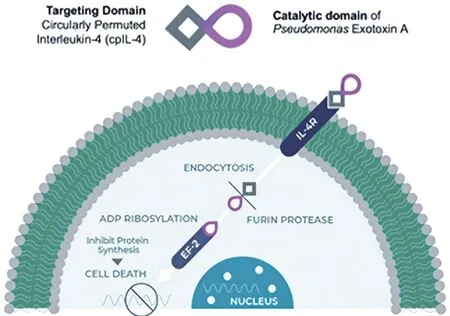
图2 环状IL-4 超因子和假单胞菌外毒素a 融合的作用机制Fig.2 Mechanism of fusion of cyclo-IL-4 hyperfactor and Pseudomonas exotoxin a
2.3 前药设计 将细胞因子与蛋白质或肽连接形成前药融合体,其在体外无活性,进入体内后被疾病部位过表达的特异性蛋白酶切割后,重新激活细胞因子。前药策略不仅可延长细胞因子的血液半衰期,还能实现细胞因子的靶向定位。HSU 等[30]设计了受体掩蔽的IL-2 的前药ProIL2,其包含4 个结构域:野生型hIgG1 Fc、IL-2 变体、IL2Rβ 和柔性基质金属蛋白酶(matrix metalloproteinases,MMPs)-可切割接头,并通过GGGGS将IL-2突变体融合至野生型hIgG1 Fc的N-末端,柔性MMP-可切割接头将IL2Rβ的完整胞外结构域融合至Fc 的N-末端。这种设计方式可产生肿瘤治疗的双重作用,既可利用IL-2 的突变体实现CD8+T细胞的有效激活,还能利用肿瘤相关MMPs的特异性切割作用释放阻断的IL-2 受体,并实现靶向激活作用,将副作用降到最低。ProIL2 在肿瘤中的作用机制见图3[30]。
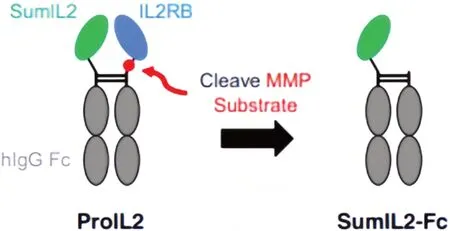
图3 ProIL2在肿瘤中的作用机制Fig.3 Mechanism of ProIL2 in tumors
IL-12能强效激活淋巴细胞发挥免疫作用,但IL-12早期临床试验因患者严重的全身性炎症的毒副作用被叫停。MANSUROV 等[31]用肿瘤相关蛋白酶可切割的含有35 个氨基酸的接头将IL-12Rβ1 受体的Q20-A261 位结构域与IL-12 的p35 亚单位的N-末端连接,并将其与p40 亚单位结合,达到掩盖IL-12 受体二聚体的作用,掩盖的IL-12 在肿瘤相关蛋白酶作用下,才能将接头酶解。动物试验证明,完整的掩蔽IL-12 变体的活性比未修饰的IL-12 低约80 倍,可消除全身性免疫相关不良反应事件,而不影响其免疫疗效。
2.4 肿瘤定位设计 TME 与正常组织相比有更多胶原。可利用胶原结合蛋白对TME 中的胶原进行定位,从而发挥肿瘤靶向作用。IL-2 的剂量限制性毒性抑制了其疗效和临床转化,MOMIN 等[32]将IL-2与小鼠血清白蛋白(mouse serum albumin,MSA)结合后再与胶原结合蛋白Lumican融合,构建了Lumican-(GGG)2-MSA-(GGGS)1-IL-2-(H)6。加入MSA的作用是确保Lumican与胶原蛋白结合时,与IL-2的空间接触,同时也增加了IL-2的相对分子质量,减少了远离肿瘤的扩散通量。将此构建体注射至患黑色素瘤的小鼠内,延长了细胞因子的局部滞留时间,增强了抗肿瘤免疫。MANSUROV 等[33]利用IL-12 的异二聚体结构,将胶原结合结构域(collagen binding domain,CBD)通过GGGSGGGS与IL-12每个亚单位融合,与未修饰的IL-12 相比,CBD-IL-12 在肿瘤中的累积增加,导致肿瘤内IFNγ 持续增加,体循环减少,降低全身毒性。CBD-IL-12异二聚体结构见图4[33]。
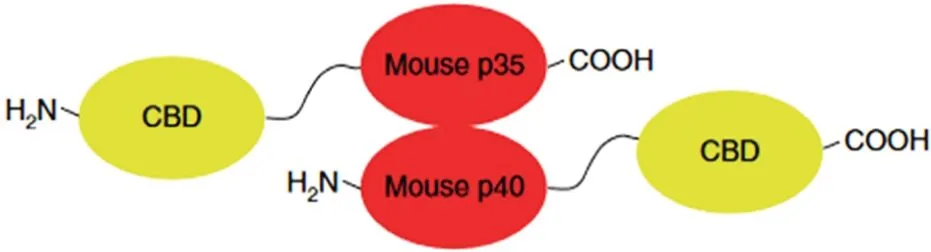
图4 CBD-IL-12结合示意图Fig.4 Schematic diagram of binding CBD-IL-12
2.5 纳米颗粒定位 细胞因子纳米医学技术可将细胞因子递送至特定的细胞或器官以提高细胞因子的局部浓度。一种方法是将细胞因子包被在纳米颗粒的表面,使细胞因子在特定部位富集。通过制备含有表面结合的IL-2和抗CD137的PEG 化脂质体的组合纳米颗粒使免疫刺激剂在肿瘤中快速积累,引发相当于高剂量游离IL-2/抗CD137的T细胞和NK细胞反应的有效激活,但也加速了从血流中的清除[34]。另一种方法是利用纳米颗粒将细胞因子递送至非肿瘤靶标,并释放细胞因子。KAMALY 等[35]用微流控芯片技术构建了靶向动脉粥样硬化斑块的Ⅳ型胶原结合聚合物纳米粒,并用此纳米粒包裹IL-10,当胶原蛋白结合这些颗粒时,聚合物缓慢释放IL-10,促进了动脉粥样硬化炎症的消退。
2.6 溶瘤病毒载体递送 细胞因子溶瘤病毒是天然存在或重组的病毒,其可在TME中选择性复制,破坏肿瘤细胞并将肿瘤抗原呈递给免疫细胞。通过对溶瘤病毒进行基因改造,使其递送编码细胞因子的基因,将其注射至肿瘤动物模型中,可使肿瘤显著消退,延长动物存活时间[36-37]。Adstiladrin 是以非复制型腺病毒为载体,将编码人IFNα-2b 的基因整合至非复制性腺病毒载体的基因组而研发用于治疗膀胱癌的基因治疗药物,可将编码人IFNα-2b 的基因转移至膀胱壁细胞,利用膀胱壁细胞自身的翻译机制表达出大量的人IFNα-2b 蛋白,从而发挥治疗作用[38]。
3 基于核酸和免疫细胞的工程化细胞因子设计
3.1 基于mRNA的设计 COVID-19疫情的暴发加速了mRNA 疫苗及mRNA 递送载体研发。将编码细胞因子的mRNA 递送至机体中,利用机体自身翻译机制表达大量细胞因子进而发挥治疗作用。但直接向体内递送裸mRNA 易被体内RNA 酶降解,且难以穿过细胞膜并导致先天性免疫激活,因此需将mRNA进行体外包装,从而实现mRNA有效递送。
利用脂质纳米粒(lipid nanoparticle,LNP)技术可实现mRNA的有效递送。LIU等[39]合成了含有二氨基的可电离脂质材料(diamino lipid derivatives,DALs),并用该脂质体包裹编码细胞因子的mRNA 注射至肿瘤细胞内。结果显示,与单一细胞因子疗法相比,肿瘤内注射负载IL-12 mRNA的DAL4-LNP在抑制黑色素瘤生长方面更有效。此外,肿瘤内注射双DAL4-LNP-IL-12 mRNA 和IL-27 mRNA 可协同抑制肿瘤生长,并产生强大的免疫细胞浸润现象,重塑TME,而不会引起系统毒性。
将编码细胞因子混合物的mRNA 用LNP 进行局部递送后增强T 细胞对癌细胞的反应,重塑TME[40]。虽然进行了LNP 的局部递送,但少量的LNP 也会从肿瘤部位泄露至循环系统,进入肝脏导致脱靶效应。研究发现,肝脏中富含microRNA-122,可在mRNA上设计microRNA-122 的结合位点序列,当LNP-mRNA进入肝脏后,含microRNA-122 互补序列的mRNA 链会被切割,蛋白翻译终止[41]。
3.2 基于T细胞的设计 嵌合抗原受体(chimeric antigen receptor,CAR)T 细胞疗法是体外收集并分离患者T 细胞后,在T 细胞上转入特定的CAR 基因,并重新回输至患者体内。该方法使用了自体细胞,进而减少了免疫介导的宿主排斥的反应,但也增加了制造过程的复杂性,同时明显增加了成本[42]。由于T 细胞持久性和适应性差、实体瘤穿透性差以及TME 的免疫抑制,迄今为止在实体瘤中几乎未取得成功。
CAR-T 细胞也可作为递送细胞因子的载体,通过这种细胞载体可在体内激发、维持和增强免疫反应。研究表明,CCL19和IL-7在淋巴器官中T细胞区的形成及维持中发挥重要作用[43]。但直接将这些细胞因子与CAR-T 细胞结合可诱导细胞因子介导的毒性反应[44]。ADACHI等[45]用2A肽将编码CAR、IL-7 和CCL19 的基因串联,形成表达IL-7 和CCL19 的CAR-T细胞,小鼠体内注射后实现了实体瘤的完全消退和小鼠生存期延长。LIU 等[46]利用一种非天然糖纳米颗粒标记T 细胞,用于锚定抗肿瘤细胞因子,一方面可增强T 细胞功能,另一方面使得毒性细胞因子具有局部、集中的活性而不产生不必要的全身副作用。该方法增加了T 细胞对实体瘤的浸润,刺激了宿主的免疫系统对抗肿瘤细胞,从而抑制肿瘤生长。
3.3 基于NK细胞的设计 与基于T细胞的免疫疗法诱导的副作用相比,NK 细胞的过继转移可引起轻微的“细胞因子风暴”和其他副作用。但NK 细胞的弱生存能力是一个缺点[47]。通过对NK 细胞进行直接的基因修饰可延长其在体内的存在时间并发挥其生物学功能。LIU 等[48]用逆转病毒载体将编码IL-15、抗CD19 CAR、半胱天冬酶9 的基因修饰NK 细胞,从而构建了CAR-NK 细胞以治疗CD19 阳性癌症,在Ⅰ和Ⅱ期临床试验(NCT03056339)中的大多数患者对治疗均存在抗肿瘤反应。
3.4 基于其他免疫细胞的设计 YAO 等[49]从小鼠的单核细胞中分离并诱导出成熟的树突状细胞后,用构建的过表达IL-12 的慢病毒转染树突状细胞以进行基因修饰,将该树突状细胞注射至模型小鼠的黑色素瘤中,可产生强烈的抗肿瘤作用。由于嵌合抗原受体免疫细胞疗法存在脱靶毒性、潜在免疫原性以及复杂和昂贵的体外制备等问题,KANG 等[50]设计了一种CAR-巨噬细胞疗法,将巨噬细胞靶向纳米载体与CAR-IFNγ 编码的质粒组成纳米复合物后并在体内注射,结果显示,该纳米复合物可诱导巨噬细胞向M1 型分化,并具有CAR 介导的肿瘤吞噬、抗肿瘤免疫调节和抑制实体肿瘤生长的能力,对实体肿瘤非常有效,降低了制备成本,减少了制备过程的复杂性。
3.5 细胞因子与免疫检查点阻断剂的联合设计 提供单一的免疫刺激信号并不足以产生持久的免疫反应,因此,结合多种免疫刺激信号的联合免疫疗法越来越受到重视。以下重点介绍细胞因子与免疫检查点阻断剂的联合设计。
在TME 中,肿瘤细胞上的免疫检查点配体会与T 细胞上的相应受体结合,从而产生免疫逃逸效应。目前,广泛应用免疫检查点阻断剂来恢复TME 中T细胞的免疫反应性,但在所谓的“冷”肿瘤中效果有限。JEFFREY 等[51]用IL-12 与CBD 融合成CBD-IL-12,能局部激活抗肿瘤免疫,从而减少免疫相关副作用。进一步将CBD-IL-12和抗程序性死亡受体1(programmed cell death protein 1,PD-1)抗体联合应用,结果显示免疫“冷”肿瘤有显著的消退。
SHEN 等[52]设计将PD-1 靶向抗体与IL-21 突变体融合,这种双功能融合蛋白可阻断PD-1/PD-L1相互作用,同时将IL-21细胞因子递送至表达PD-1的T细胞,可改善IL-21血清半衰期,进而减少给药频率,并可改善和扩展目前临床上抗PD-1疗法的效用。
4 总结、挑战及展望
本文综述了细胞因子工程化研究的最新进展,通过蛋白质工程技术对细胞因子进行设计修饰或定点诱变,以提高细胞因子的治疗效力;通过抗体结合、纳米工程、病毒递送及前药等设计实现细胞因子的靶向递送;通过将编码几种细胞因子的mRNA 用LNP 包装后注射至肿瘤细胞内,增加细胞因子的治疗效果;搭载细胞因子的免疫细胞疗法和细胞因子偶联毒素治疗也取得了重大成功,各种工程化方法各有利弊,目前大部分产品均处于研发阶段。
细胞因子类药物的显著毒性和微弱疗效为临床转化带来了重大挑战,截至目前,唯一被临床批准改善细胞因子类药物性质的方法是与PEG 聚合物偶联。细胞因子的多效性仍然是细胞因子衍生毒性的主要原因,并且是临床转化的一个大的障碍,因此,在激活所需免疫细胞与脱靶效应之间找到最佳平衡仍然是一个关键挑战。虽然细胞因子的工程开发及联用策略解决了细胞因子半衰期短及高剂量给药全身反应严重等问题,但由于细胞因子的体外修饰会存在免疫原性风险,尽管在动物模型中取得了良好疗效,但考虑跨物种的反应性,其具体应用仍需较长时间,且细胞因子最佳给药剂量和给药途径以及不同肿瘤类型对细胞因子或细胞因子组合敏感度的研究等问题尚未解决。
未来将会出现更多研究,以提高用于治疗目的细胞因子的活性、寿命、药代动力学和递送。细胞因子疗法有望从4 个方向发展:①利用生物学知识及现代生物学技术对细胞因子进行重新设计,以改进细胞因子产品药代动力学性质,增加其半衰期;②局部给药。将细胞因子的重组蛋白或编码细胞因子的基因治疗载体直接注射至TME 中,以实现细胞因子的靶向治疗;③通过细胞因子的精准试验设计、复杂的患者分层实现细胞因子的精准治疗;④协同组合。如多种细胞因子的联合治疗,细胞因子与其他免疫疗法联合应用。
综上所述,各种细胞因子工程化策略之间的组合和调整可提高细胞因子临床应用的疗效并降低不良副作用,这也将进一步激发基于细胞因子的免疫疗法的发展,从而为难治性疾病的治疗开发新方法和新途径。

