Lowry2法检测组分百日咳疫苗中间产品蛋白含量的适用性验证
赵芳圆,杜瑞晓,李世慧
北京生物制品研究所有限责任公司细菌类疫苗研究室,北京 100176
百日咳是由百日咳博德特菌引起的一种具有高度传染性的呼吸道疾病[1],未研发出相关疫苗前,婴幼儿百日咳的发病率和死亡率高于脊髓灰质炎和麻疹的总和[2]。百日咳是全球最常见的疫苗可预防疾病之一[3],对适龄儿童接种无细胞百白破疫苗可预防百日咳等相关疾病。
无细胞百日咳疫苗按照百日咳原液生产纯化工艺不同分为高速蔗糖离心共纯化疫苗和柱层析组分疫苗[4],组分百日咳疫苗由百日咳的相关抗原组成,包括丝状血凝素(filamentous hemagglutinin,FHA)、百日咳毒素(pertussis toxin,PT)、百日咳黏着素(pertactin,PRN)等,其成分配比更加明确,不良反应率更低。由于组分百日咳疫苗采用柱层析纯化,工艺较为复杂,其中引入甘油、尿素、Triton-X100,后续脱毒工艺引入甘油、戊二醛、甲醛等诸多物质,对Lowry1法测定蛋白含量存在较大干扰,国内外也有相关研究报道[5-6]。因此,急需一种可以准确测定组分百日咳疫苗各步骤中间品蛋白含量的方法,在不同干扰物质存在及样品颜色影响的情况下,蛋白定量均不受干扰。Lowry2 法[《中国药典》三部(2020 版)福林酚法-第二法]是在Lowry1 法的基础上通过脱氧胆酸盐-三氯乙酸沉淀进行预处理,可在最大程度上消除干扰物质的影响[4,7]。为评价Lowry2 法检测组分百日咳疫苗中间产品蛋白含量的准确性,本研究以各步骤中间产品背景缓冲液作为其指示样品,验证Lowry2法检测组分百日咳疫苗中间产品蛋白含量的准确性,并采用该方法检测3 批组分百日咳疫苗中间产品的蛋白含量。
1 材料与方法
1.1 样品 纯化后FHA、PRN、PT 抗原及其所用背景缓冲液和脱毒后FHA、PRN、PT抗原及其背景缓冲液由北京生物制品研究所有限责任公司菌苗室及细菌类疫苗研究室提供。
1.2 主要试剂及仪器 蛋白含量测定国家标准品由中国食品药品检定研究院提供(270009-201107);氢氧化钠购自北京化工厂;碳酸钠、三氯乙酸、硫酸铜购自国药集团化学试剂有限公司;二水合酒石酸二钠、去氧胆酸钠、福林酚试剂和离习机(SG3K30)购自美国Sigma公司;紫外分光光度计购自日本岛津公司(UV-1800)。
1.3 检测方法 按《中国药典》三部(2020 版)蛋白含量测定方法(Lowry2 法)的要求配制试剂。A 液:氢氧化钠-碳酸钠;B 液:酒石酸二钠-硫酸铜、去氧胆酸钠试液、72%三氯醋酸;C 液:A 液与B 液按照50∶1混合。将标准品逐级稀释至蛋白浓度为0、10、20、30、40、50 µg/mL,精密量取各标准品与样品溶液1.0 mL,分别置于15 mL离心管中,加入去氧胆酸钠溶液0.1 mL,涡旋混匀,室温放置10 min;加入72%三氯醋酸溶液0.1 mL,涡旋混匀,3 000×g离心30 min,弃上清,沉淀用1 mL C 液复溶后,再加入C 液5 mL,混匀,室温放置10 min;加入2 倍稀释的福林酚试剂0.5 mL,立即混匀,室温放置30 min,750 nm 波长处测定吸光度值。以标准品浓度-吸光度绘制标准曲线,并计算样品浓度。标准曲线线性回归方程的相关系数(R2)应≥0.98。测定结果需乘以相应的稀释倍数。
1.4 Lowry1与Lowry2法检测的比较 分别使用脱毒及纯化样品背景缓冲液稀释标准蛋白至50µg/mL,并同时测定两种背景缓冲液(不含蛋白),采用Lowry1 和Lowry2 法检测后,在扣除背景缓冲液的测定值后,得到两种方法蛋白测定的实际数值,并计算回收率。
1.5 Lowry2法的验证
由于组分百日咳疫苗中的PT、FHA、PRN抗原所使用的纯化、脱毒背景缓冲液均不相同,Lowry2法检测蛋白含量的验证需单独进行。
1.5.1 专属性 采用Lowry2 法检测脱毒及纯化样品背景缓冲液和超纯水,设2个平行,分别测定3次,与超纯水检测结果进行比较。
1.5.2 线性范围 精密量取超纯水稀释的0、10、20、30、40、50 µg/mL 的蛋白标准品溶液,采用Lowry2法测定3次,计算3次测定结果的R2,应≥0.98。
1.5.3 准确性 用脱毒及纯化样品背景缓冲液稀释标准品蛋白至40、50、60 µg/mL 作为供试品,设2个平行,分别测定3 次,并按下式计算回收率,应在(100±10)%。
回收率(%)=测定浓度/理论浓度×100%
1.5.4 精密性
1.5.4.1 重复性 将脱毒及纯化FHA、PRN、PT 作为供试品,取同一浓度的供试品,由同一名实验员重复测定6次,计算RSD,应≤3%。
1.5.4.2 中间精密性 将脱毒样品及纯化FHA、PRN、PT 作为供试品,取同一浓度的供试品,由2名不同实验员分别测定6次,并计算RSD,应≤3%。
1.6 方法的应用 取3 批组分百日咳疫苗中间产品(S01、S02、S03),每批包括纯化和脱毒后PT、FHA、PRN抗原,采用Lowry2法测定蛋白含量。
1.7 统计学分析 应用GraphPad Prism 7.04 软件进行统计学分析,两组间比较采用独立样本t检验,若两组数据不满足方差齐性,采用Welch校正。以P<0.05为差异有统计学意义。
2 结果
2.1 Lowry1 与Lowry2 法检测结果的比较 单独测定背景空白时,Lowry1 法测定的数值已严重偏离理论值,Lowry2法未受影响;扣除背景缓冲液的测定值后,两种方法的蛋白测定结果均接近理论值,具有一致性。见表1。表明两种背景缓冲液中添加的甘油、尿素等物质会对Lowry1 法测定造成干扰,Lowry2 法未受影响,并能反应出蛋白的真实测定值。
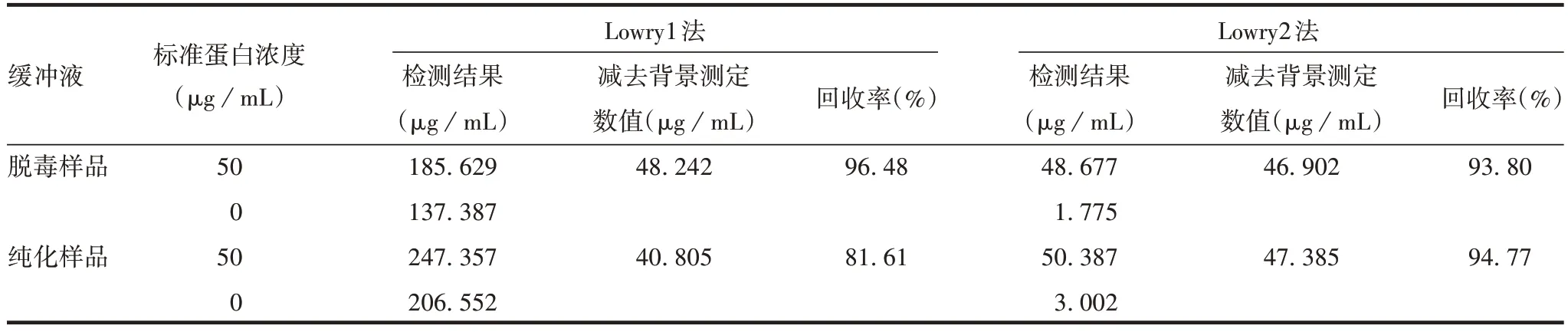
表1 Lowry1与Lowry2法检测脱毒和纯化样品背景缓冲液的结果Tab.1 Detection of background buffers of detoxified and purified samples by Lowry1 and Lowry2 methods
2.2 Lowry2法的验证
2.2.1 专属性Lowry2 法测定脱毒及纯化样品背景缓冲液蛋白含量与超纯水比较,差异均无统计学意义(P均>0.05),见表2。说明组分百日咳疫苗各步骤中间产品背景液对Lowry2法检测无干扰。
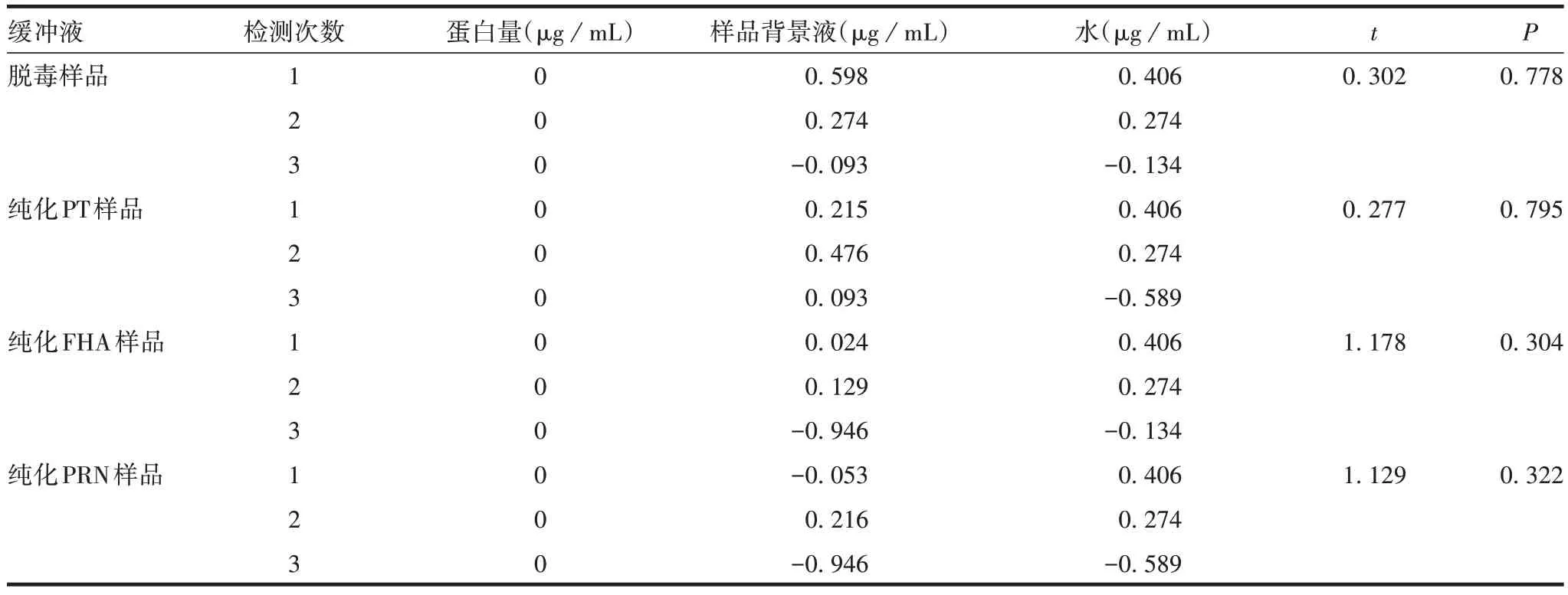
表2 Lowry2法测定各背景缓冲液与超纯水蛋白含量的比较Tab.2 Comparison of protein content in background buffer and ultrapure water detected by Lowry2 method
2.2.2 线性范围 3 次标准曲线的测定结果R2均大于0.98,见表3。表明蛋白浓度在0 ~50µg/mL 之间标准曲线线性关系良好。

表3 Lowry2法线性范围的重复性验证Tab.3 Repeatability verification of linear range of Lowry2 method
2.2.3 准确性 脱毒及纯化样品背景缓冲液的加标回收率均在90% ~110%之间,见表4。表明Lowry2法测定组分百日咳疫苗中间产品蛋白含量准确性良好。
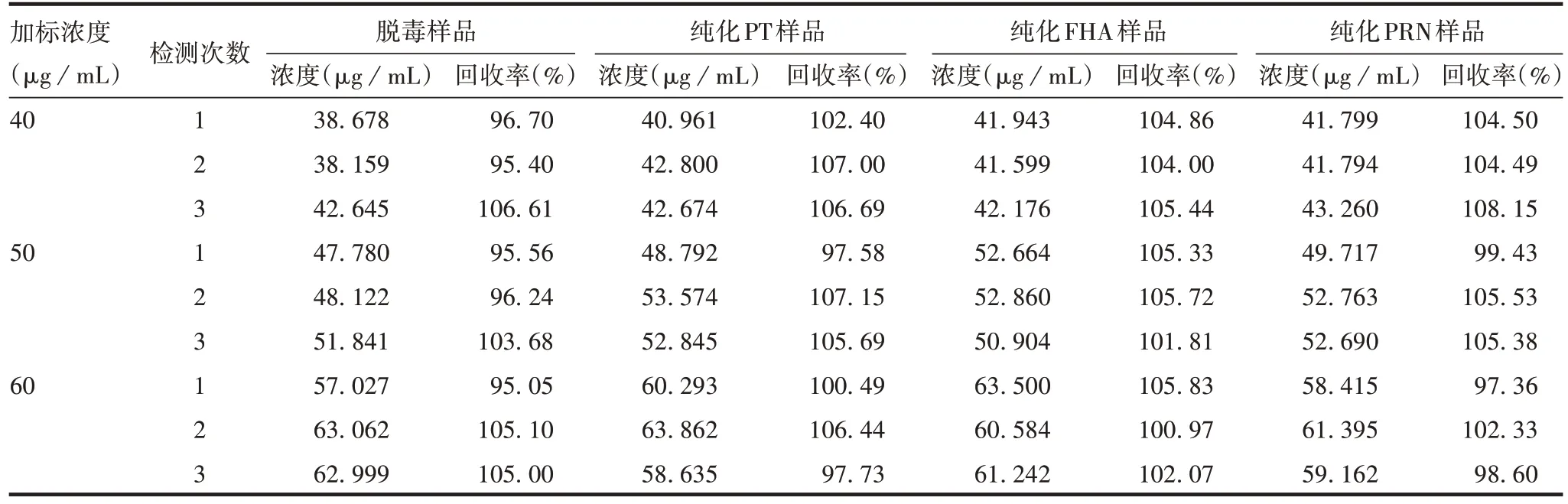
表4 Lowry2法测定各背景缓冲液的准确性验证Tab.4 Accuracy verification of Lowry 2 method in detection of background buffers
2.2.4 精密性
2.2.4.1 重复性 同一名实验员连续测定6 次同一批脱毒及纯化后PT、FHA、PRN 样品的RSD均<3%,见表5。表明Lowry2 法检测组分百日咳疫苗中间产品蛋白含量的重复性良好。
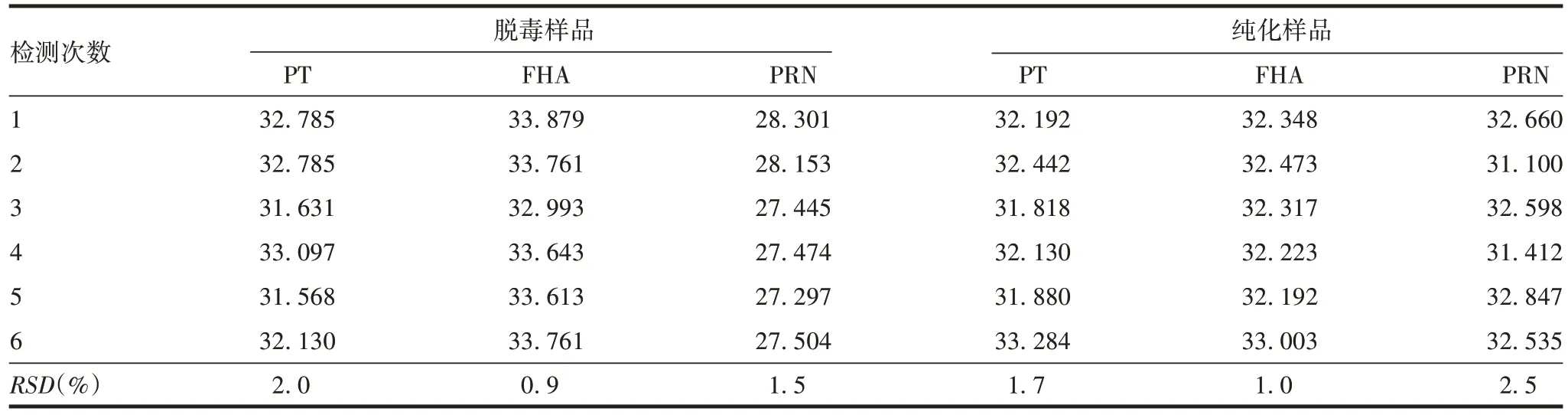
表5 Lowry2法测定组分百日咳疫苗中间产品的重复性验证(µg/mL)Tab.5 Repeatability verification of Lowry 2 method for detection of component pertussis vaccine intermediate products(µg/mL)
2.2.4.2 中间精密性 2名实验员连续测定6次同一脱毒及纯化PT、FHA、PRN 样品的RSD均<3%,见表6。表明Lowry2 法检测组分百日咳疫苗中间产品蛋白含量的中间精密性良好。
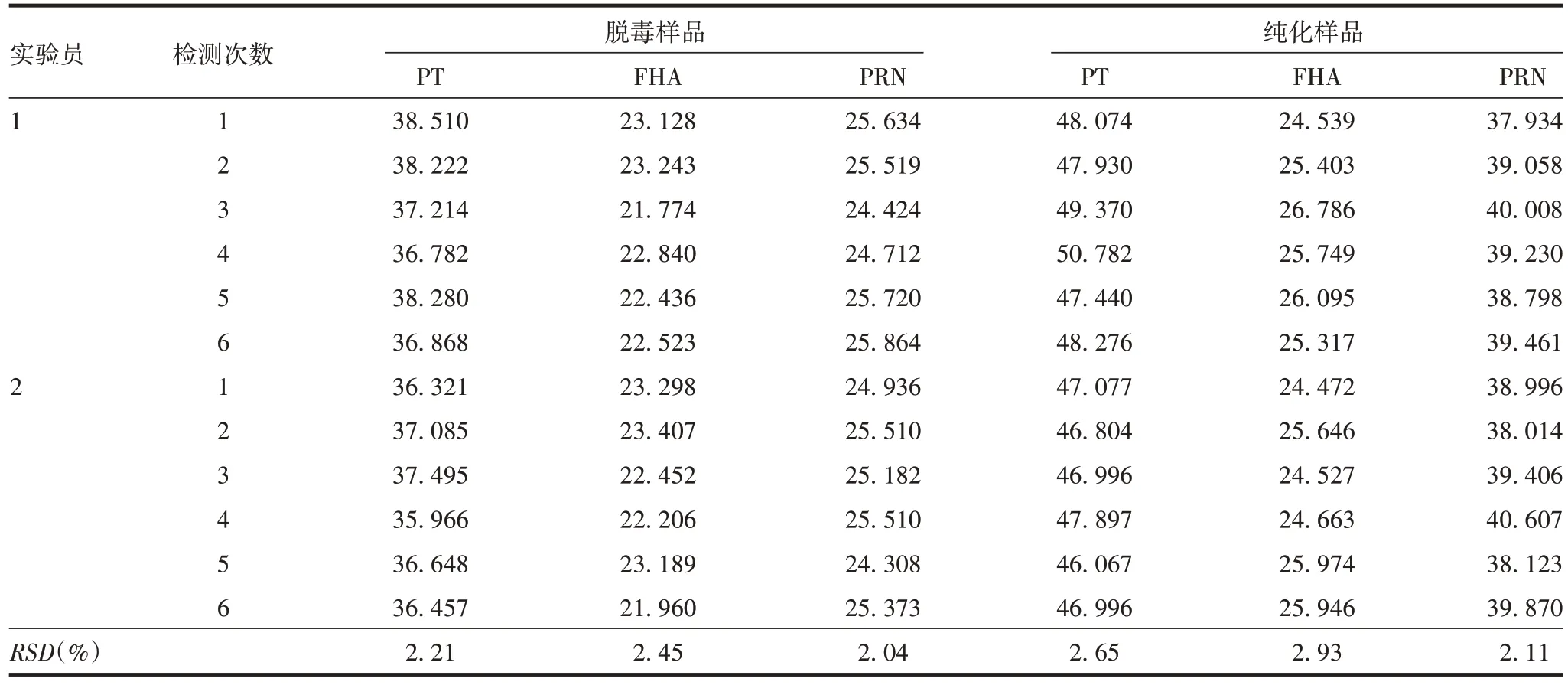
表6 Lowry2法测定组分百日咳疫苗中间产品的中间精密性验证(µg/mL)Tab.6 Intermediate precision verification of Lowry2 method for detection of component pertussis vaccine intermediate products(µg/mL)
2.3 方法的应用 检测结果显示,3批组分百日咳疫苗纯化及脱毒后PT、FHA、PRN样品的蛋白测定结果均符合企业内部《制造与检定规程》要求,见表7。
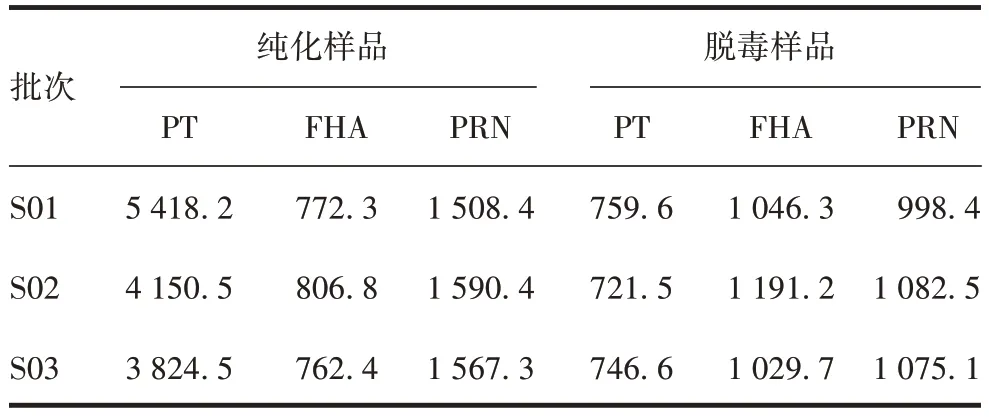
表7 3批组分百日咳疫苗中间产品蛋白测定结果(µg/mL)Tab.7 Protein detection results of intermediate products of three batches of component pertussis vaccine(µg/mL)
3 讨 论
蛋白质样品的浓度测定通常通过测定280 nm波长处的紫外吸收率或蛋白质与染料/金属离子间的定量反应(Bradford、Lowry 或BCA 分析)来完成。紫外吸收检测快速方便,但只适合纯度高、成分单一且无颜色干扰的样品。Bradford 分析法灵敏度相对较高,方法简单,试剂稳定,但由于染料结合程度的不同,单个蛋白质的测定结果可能会存在较大差异[6]。BCA 法测定快速简便,干扰物质少,不受大部分样品中的去垢剂等化学物质影响,但易受蔗糖、尿素、NH4+和EDTA 等物质的影响[8],王丽等[9]发现,组分百日咳疫苗中硫酸铵的存在会对BCA法测定蛋白含量产生严重干扰。Lowry 法是《中国药典》中规定的百日咳疫苗蛋白定量方法[10],但Lowry1 法常受样品颜色、甘油以及尿素、Triton 等物质的影响[4-7,11-13],测定结果往往偏离真实值。组分百日咳疫苗因其生产工艺的特殊性,在纯化、脱毒过程中加入了尿素、戊二醛、甘油等物质,易对检测结果造成干扰。蛋白定量的准确与否直接决定了脱毒剂的添加量、毒性的残留以及成品免疫原性的强弱,对疫苗质量有较大影响。Lowry2法通过酸沉淀处理可排除干扰成分的影响[4],因此更适合组分百日咳疫苗中间产品的蛋白质定量。
本实验采用《中国药典》三部(2020版)通则0731中的Lowry2 法进行组分百日咳疫苗中间产品的蛋白测定,并对Lowry2 法的专属性、线性、准确性及精密性进行验证,结果显示,该方法灵敏、稳定且易操作,可排除样品中其他物质的干扰,线性范围在0 ~50 µg/mL,R2>0.98,准确性和精密性良好。采用Lowry2 法检测3 批组分百日咳疫苗纯化及脱毒后样品的蛋白含量,结果均符合企业内部《制造与检定规程》要求。因此,Lowry2 法可用于组分百日咳疫苗多步骤中间产品的蛋白含量测定,并使各步骤之间的蛋白含量具有可比性和可分析性。

