非小细胞肺癌A549细胞培养上清液中外泌体的分离提取及鉴定
郑巧鑫,苏欣,魏淑贞,刘诗怡,罗晶,黄颖,苏会岚,李娜
成都医学院公共卫生学院,四川成都 610500
细胞外小囊泡(extracellular vesicles,EVs)包括外泌体、微囊泡和其他囊泡。外泌体直径为30~150 nm,含有核酸和蛋白质[1-3]。有研究发现,大多数细胞均能产生外泌体[4-6],其广泛存在于各种体液和细胞培养液中[7]。外泌体的功能取决于其来源细胞的类型,因此可用于追溯其母体来源[8]。多项研究表明,肿瘤来源的外泌体参与肿瘤细胞和基底细胞之间的遗传信息传递,促进大量新血管生成,影响肿瘤的生长、侵袭、扩散、耐药性和免疫监视[9-14];外泌体还可作为诊断生物标志物及药物的输送载体[15-16]。因此,检测血液中不同肿瘤细胞外泌体对肿瘤诊断具有重要意义[17]。
肺癌是全球发病率及死亡率最高的恶性肿瘤之一,目前,临床现有筛检手段(胸部X 片、螺旋CT、支气管内镜、痰细胞学等)的敏感性、特异性和适用性有限,难以实现早期诊断。外泌体来自于多泡体释放的循环囊泡,参与肿瘤细胞多种生物学功能[18],是细胞间信息传递的重要媒介,有望成为新一代的新兴生物标志物[19],探讨其在肿瘤发生和发展中的内在机制,可为肺癌的早期有效诊断和治疗提供新思路[20],而外泌体的分离提取技术成为其相关研究的关键步骤[21]。目前,有多种方法分离EVs,获得不同浓度和纯度的外泌体[22],如超速离心法(ultracentrifugation,Ult)、密度梯度离心法和免疫磁珠法[23-25]。但这些方法耗时耗力,分离效率较低[26],对外泌体损伤较大[27],纯度低且易存在蛋白质污染[28],不能满足相关研究和应用的需要。Exo QuickTM是快速分离提取外泌体的试剂盒,该方法简便、快速、可靠,但其成本较高,外泌体获得率有限[29]。因此,本研究将Exo QuickTM与Ult结合,建立改良法(Ult-Exo QuickTM,U-EQ),用该方法分离非小细胞肺癌A549 细胞外泌体,并进行纯化及生物学鉴定,以期提高外泌体获得率,为实现以外泌体为标志物进行肿瘤早期诊断奠定基础。
1 材料与方法
1.1 细胞 非小细胞肺癌A549细胞购自ATCC。
1.2 主要试剂及仪器 胎牛血清、RPMI1640培养基及青-链霉素均购自美国Gibco公司;Exo QuickTM试剂盒购自上海Umibio 公司;DiI染色工作液购自上海Yeasen Biotech 公司;增强BCA 蛋白检测试剂盒、兔抗CD63单克隆抗体、兔抗HSP70 多克隆抗体及HRP 酶标记的羊抗兔IgG 均购自上海Beyotime Biotechnology公司;纳米粒子追踪分析(nanoparticle tracking analysis,NTA)系统购自成都测试狗科研服务有限公司公司。
1.3 细胞培养 将A549 细胞用RPMI1640 完全培养基(含10%胎牛血清及1%青-链霉素)于37 ℃培养48 h,细胞覆盖率达50%~60%,弃培养基,PBS 洗涤2 次,更换为无血清RPMI1640 培养基,继续培养48 h,收集细胞上清液。
1.4 外泌体的分离提取 将A549 细胞培养上清于4 ℃,300×g离心10 min;取上清液,于4 ℃,2 000×g离心10 min;取上清,于4 ℃,12 000×g离心10 min;取上清,按1∶4 的体积分数加入Exo QuickTM试剂盒中的外泌体浓缩液(exosome concentration solution,ECS),4 ℃放置3 h;于4 ℃,10 000×g离心60 min;取沉淀,用PBS重悬,于4 ℃,12 000×g离心2 min;取上清,加至Exo QuickTM试剂盒中的外泌体纯化柱(exosome purification filter,EPF)的上腔,于4 ℃,3 000×g离心10 min,收集EPF 柱底部的液体,即纯化外泌体。将纯化外泌体于4 ℃,12 000 ×g离心至液体体积为初始体积的1/5,收集外泌体溶液,按50µL/瓶分装,-80 ℃保存。同时采用传统方法,即Ult 法提取A549 细胞外泌体[30]。
1.5 外泌体的鉴定
1.5.1 蛋白浓度 采用增强BCA 蛋白检测试剂盒检测外泌体的蛋白浓度。
1.5.2 粒径分布 用1 × PBS 将100 µL 外泌体重悬至1 mL,NTA 分析外泌体的布朗运动轨迹并测定外泌体的浓度和粒径大小。
1.5.3 形态观察
1.5.3.1 荧光染色 取10µL外泌体,加入1mL5µmol/L的DiI染色工作液,37 ℃孵育30 min;1 340×g离心5 min,弃上清液,用37 ℃预热的培养基重悬沉淀,重复离心3 次,取沉淀,PBS 重悬,置倒置荧光显微镜下观察,并拍照。
1.5.3.2 透射电镜(transmission electron microscope,TEM) 将外泌体用1×PBS稀释100倍后,按2 mL分装至EP 管中,送成都测试狗科研服务有限公司进行TEM拍摄。
1.5.4 CD63和HSP70蛋白表达的检测 采用Western blot 法。BCA 法检测外泌体浓度,经7%~15% SDSPAGE 分离后,转移至PVDF 膜,用5%脱脂奶粉于室温封闭1 h;分别加入兔抗CD63 单克隆抗体及兔抗HSP70 多克隆抗体(均1∶1 500 稀释),于4 ℃孵育24 h;用TBST 洗涤3 次,加入HRP 标记的羊抗兔IgG(1∶2 000 稀释),于室温作用1 h;ECL法显色。
1.6 数据采集及分析 应用Excel 2016 软件进行数据采集分析及作图。
2 结果
2.1 外泌体的蛋白浓度 U-EQ 和Ult 法分离提取外泌体的蛋白浓度分别为1.355和0.909 mg/mL,U-EQ分离提取外泌体的蛋白浓度大幅提高。
2.2 外泌体的粒径分布 U-EQ 和Ult 法提取外泌体的颗粒总数分别为4.65×109和4.06×109粒/mL,峰值尺寸分布范围分别为81.5~165.5 和59.5~176.5 nm,平均尺寸分别为(152.3±8.8)和(94.3±9.8)nm。见图1 和图2。表明U-EQ 法提取的外泌体大小分布更均匀,颗粒浓度更高。
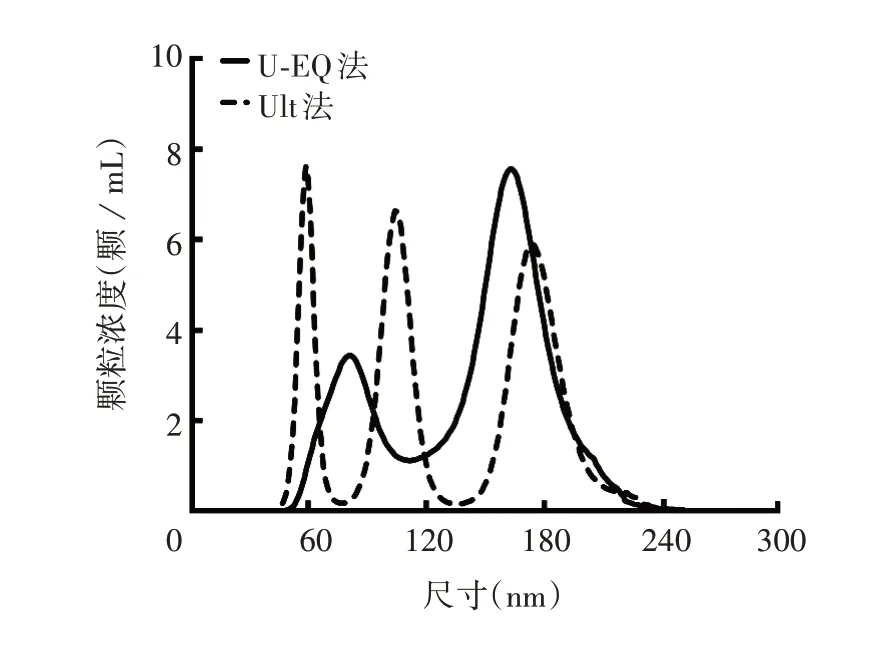
图1 A549细胞外泌体的粒径分布图Fig.1 Particle size distribution of A549 cell exosomes
图2 A549细胞外泌体的布朗运动视频截图(×20)Fig.2 Screenshot of Brownian motion video of A549 cell exosomes(×20)
2.3 外泌体的形态
2.3.1 荧光染色 镜下观察可见,两种方法分离提取A549 细胞培养上清中外泌体的形态均为微小囊泡,直径为30~150 nm,但U-EQ 法分离提取的外泌体形态均一,Ult 法分离提取的外泌体粒径差异较大。见图3。
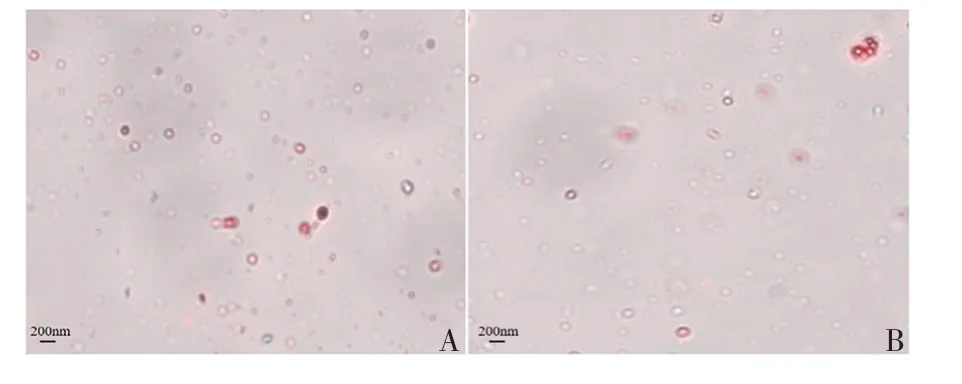
图3 A549细胞外泌体的荧光显微镜下观察(×50)Fig.3 FluorescencemicroscopyofA549cellexosomes(×50)
2.3.2 透射电镜 两种方法分离提取的外泌体均为微囊泡,直径范围为30~150 nm,但U-EQ 法分离提取的外泌体粒径较均一,Ult 法分离提取的外泌体大小相差较大。见图4。
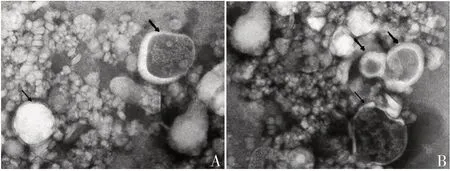
图4 A549细胞外泌体的TEM照片(×200)Fig.4 TEM photography of A549 cell exosomes(×200)
2.4 外泌体表面CD63和HSP70蛋白的表达情况 两种方法分离提取的外泌体中均可见CD63 和HSP70蛋白表达,相对分子质量分别为56 000 和70 000,U-EQ法分离提取的外泌体蛋白表达量更高,见图5。
3 讨论
目前,由于缺乏外泌体标准化的分离和纯化方法,使实验室间相关性较差,难以进行深入研究。传统技术,如Ult法、密度梯度离心法和免疫磁珠法,存在纯度低、操作困难或外泌体团聚的问题,限制了外泌体相关研究的进展。因此,从各种不同肿瘤中简单快速分离提取外泌体成为亟需解决的问题。
采用Exo QuickTM试剂盒分离提取外泌体应用广泛[31],但试剂盒成本较高,本研究在此基础上结合外泌体分离的黄金标准Ult法建立改良法(U-EQ法),从A549 细胞培养上清液中分离纯化外泌体,该方法分离提取外泌体的产量高,耗时较短,浓度可达1.355 mg/mL,颗粒浓度达4.65 × 109粒/mL,而Ult法分离提取的外泌体浓度为0.909 mg/mL,颗粒浓度为4.06×109粒/mL。经TEM、NTA、荧光染色分析,改良法分离提取的外泌体纯度及浓度均高于传统方法。
外泌体鉴定是分离提取的关键步骤。外泌体中含有多种生物分子,如各种蛋白质、DNA、mRNA、非编码RNA 和脂质。外泌体蛋白参与外泌体抗原递呈及内吞转运等相关生命活动,维持外泌体骨架结构。外泌体中普遍存在的蛋白,如4次跨膜蛋白(CD9、CD63、CD81 及CD82)、热休克蛋白(HSP60、HSP70 及HSP90)等是外泌体提取鉴定中的重要指标,是外泌体的特异性标志性蛋白[32]。HSP70 是肿瘤细胞膜锚定蛋白,在肿瘤细胞中异常高表达,而正常细胞表达水平较低,受细胞周期的严格调控[33]。采用Western blot法对外泌体表面标志性蛋白CD63及HSP70表达水平进行检测,从蛋白层面对外泌体进行鉴定,结果表明,U-EQ法分离提取的外泌体表面CD63及HSP70蛋白表达量更高。
综述所述,U-EQ 法可获得足够数量的A549 细胞外泌体,且浓度更高、粒径更均一,为以外泌体为标志物进行肿瘤早期诊断奠定了基础。

