阿尔茨海默病患者血液中外泌体miR-223及NLRP3表达水平及临床意义
师俊亮 郝豫萍 夏源 戴恩云
[摘要] 目的 探討血清中外泌体miR-223及核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)表达水平与阿尔茨海默病(Alzheimers disease,AD)发生及进展的关系。方法 选取2018年3月—2019年12月于我院老年医学科就诊的老年AD患者65例作为研究组,分为轻度认知功能障碍(MCI)亚组(41例)和痴呆(DAT)亚组(24例);另外纳入同时期神经功能正常的老年人60例作为对照组。采用实时荧光定量聚合酶链式反应和酶联免疫吸附测定法检测受检者血清中外泌体miR-223及NLRP3表达水平。采用Pearson及Spearman检验分析受检者血清中外泌体miR-223及NLRP3与简易精神状态检查量表(MMSE)评分的关系。绘制受试者工作特征(ROC)曲线,计算血清中外泌体miR-223及NLRP3用于AD患者MCI诊断或者DAT鉴别诊断的曲线下面积(AUC)。结果 与对照组相比较,研究组受试者血清中外泌体miR-223的表达水平显著降低,NLRP3表达水平显著升高(t=6.623,Z=-9.451,P<0.05);与MCI亚组相比,DAT亚组受试者血清中外泌体miR-223表达水平显著降低,NLRP3表达水平显著升高(t=3.190,Z=-5.288,P<0.05)。研究组受试者血清中外泌体miR-223表达水平与NLRP3表达水平呈负相关(r=-0.859,P<0.001),与MMSE评分呈正相关(r=0.790,P<0.001),研究组受试者血清中NLRP3表达水平与MMSE评分则呈负相关(r=-0.776,P<0.001)。血清中外泌体miR-223联合NLRP3诊断AD患者MCI的AUC为0.91(95%CI=0.86~0.97),灵敏度为89.0%,特异度为76.5%;其鉴别诊断DAT的AUC为0.81(95%CI=0.75~0.88),灵敏度为70.0%,特异度为85.0%。结论 miR-223/NLRP3信号通路可能参与AD的发生和发展,血清中外泌体miR-223和NLRP3的检测对AD患者MCI和DAT的诊断或鉴别诊断具有一定价值,值得进一步深入研究。
[关键词] 阿尔茨海默病;认知功能障碍;微RNAs;NLR家族,热蛋白结构域包含蛋白3;外泌体;曲线下面积;诊断;老年人
[中图分类号] R749.16
[文献标志码] A
EXPRESSION OF BLOOD EXOSOMAL miR-223 AND NUCLEOTIDE-BINDING OLIGOMERIZATION DOMAIN-LIKE RECEPTOR PROTEIN 3 IN PATIENTS WITH ALZHEIMERS DISEASE AND THEIR CLINICAL SIGNIFICANCE\ SHI Junliang, HAO Yuping, XIA Yuan, DAI Enyun (Department of Geriatrics, Henan Workers Hospital, Zhengzhou 450003, China)
[ABSTRACT] Objective To investigate the expression levels of serum exosomal miR-223 and nucleotide-binding oligome-rization domain-like receptor protein 3 (NLRP3) in patients with Alzheimers disease (AD) and their association with the development and progression of AD. Methods A total of 65 elderly patients with AD who attended Department of Geriatrics in our hospital from March 2018 to December 2019 were enrolled as study group and were divided into mild cognitive impairment (MCI) subgroup with 41 patients and dementia of Alzheimer type (DAT) subgroup with 24 patients, and 60 elderly individuals with normal neurological function were enrolled as control group. Quantitative real-time PCR and ELISA were used to measure the expression levels of serum exosomal miR-223 and NLRP3. The Pearson and Spearman tests were used to analyze the correlation of serum exosomal miR-223 and NLRP3 with Mini-Mental State Examination (MMSE) score. The receiver operating characteristic (ROC) curve was plotted to calculate the area under the ROC curve (AUC) of serum exosomal miR-223 and NLRP3 in the diagnosis of MCI in AD patients or the differential diagnosis of DAT. Results Compared with the control group, the study group had a significantly lower expression level of serum exosomal miR-223 and a significantly higher expression level of NLRP3 (t=6.623,Z=-9.451,P<0.05), and compared with the MCI subgroup, the DAT subgroup had a significantly lower expression level of serum exosomal miR-223 and a significantly higher expression level of NLRP3 (t=3.190,Z=-5.288,P<0.05). In the study group, the expression level of serum exosomal miR-223 was negatively correlated with that of NLRP3 (r=-0.859,P<0.001) and was positively correlated with MMSE score (r=0.790,P<0.001), while the expression level of serum NLRP3 was negatively correlated with MMSE score (r=-0.776,P<0.001). Serum exosomal miR-223 combined with NLRP3 had an AUC of 0.91 (95%CI=0.86-0.97), a sensitivity of 89.0%, and a specificity of 76.5% in the diagnosis of MCI in AD patients, while it had an AUC of 0.81 (95%CI=0.75-0.88), a sensitivity of 70.0%, and a specifi-city of 85.0% in the differential diagnosis of DAT. ConclusionThe miR-223/NLRP3 signaling pathway might be involved in the development and progression of AD, and measurement of serum exosomal miR-223 and NLRP3 has a certain value in the diagnosis of MCI or the differential diagnosis of DAT in AD patients, which requires further studies in the future.
[KEY WORDS] Alzheimer disease; Cognitive dysfunction; MicroRNAs; NLR family, pyrin domain-containing 3 protein; Exosomes; Area under curve; Diagnosis; Aged
阿尔茨海默病(Alzheimers disease,AD)属于一种不可逆的神经退行性疾病,以认知功能障碍和进行性痴呆为主要特征[1]。美国国立老化研究所和阿尔茨海默病协会(NIA-AA)提出的最新AD研究框架指出,AD是包括轻度认知功能障碍(MCI)和痴呆(DAT)在内的连续病程,在AD核心临床诊断标准的基础上,应综合考虑AD病理生理变化证据,并强调生物学标志物可以用于AD的早期诊断[2]。NOD样受体蛋白(NLRs)属于细胞质模式识别受体,可以被部分病原微生物或者受损细胞释放的非微生物危险信号激活,进而启动炎症小体依赖性天然免疫反应[3]。目前动物实验证实,降低AD小鼠大脑皮质区小胶质细胞核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)的表达,可以明显改善AD小鼠的学习和记忆的能力[4],由此可以推测miR-223/NLRP3信号通路可能参与AD的发生机制。本研究以我院老年医学科就诊的65例老年AD患者作为研究的对象,旨在探讨miR-223/NLRP3信号通路在AD的发生及发展中的作用,为血清中外泌体miR-223及NLRP3作为AD诊断和进展判断的血清学指标提供理论依据。
1 资料与方法
1.1 一般资料
选择2018年3月—2019年12月于我院老年医学科就诊的老年AD患者作为研究组。纳入标准:①初诊者;②症状、实验室检查、简易精神状态检查量表(MMSE)评分[2]、脑部CT及MRI等检查结果符合NIA-AA提出的AD核心临床诊断标准[5];③MMSE评分≤26分,日常生活能力保留者。排除标准:①合并其他疾病者,包括患有心肌梗死、恶性肿瘤、帕金森病、颅脑外伤、多发性硬化症等可能引起miR-223表达异常者;②存在其他类型痴呆(如血管性痴呆、额颞叶痴呆)者。依据MMSE量表,按认知功能障碍进展程度将研究组受试者分为MCI亚组和DAT亚组。另外选择60例神经功能正常的老年人作为对照组,纳入标准:①同时期自愿接受血样采集和MMSE问卷调查的同一社区人群;②年龄、性别、体质量指数(BMI)、基础疾病、受教育程度等基本资料与研究组受试者匹配者;③一般认知功能及记忆正常,无痴呆临床症状及其他精神系统疾病者。排除标准同研究组。
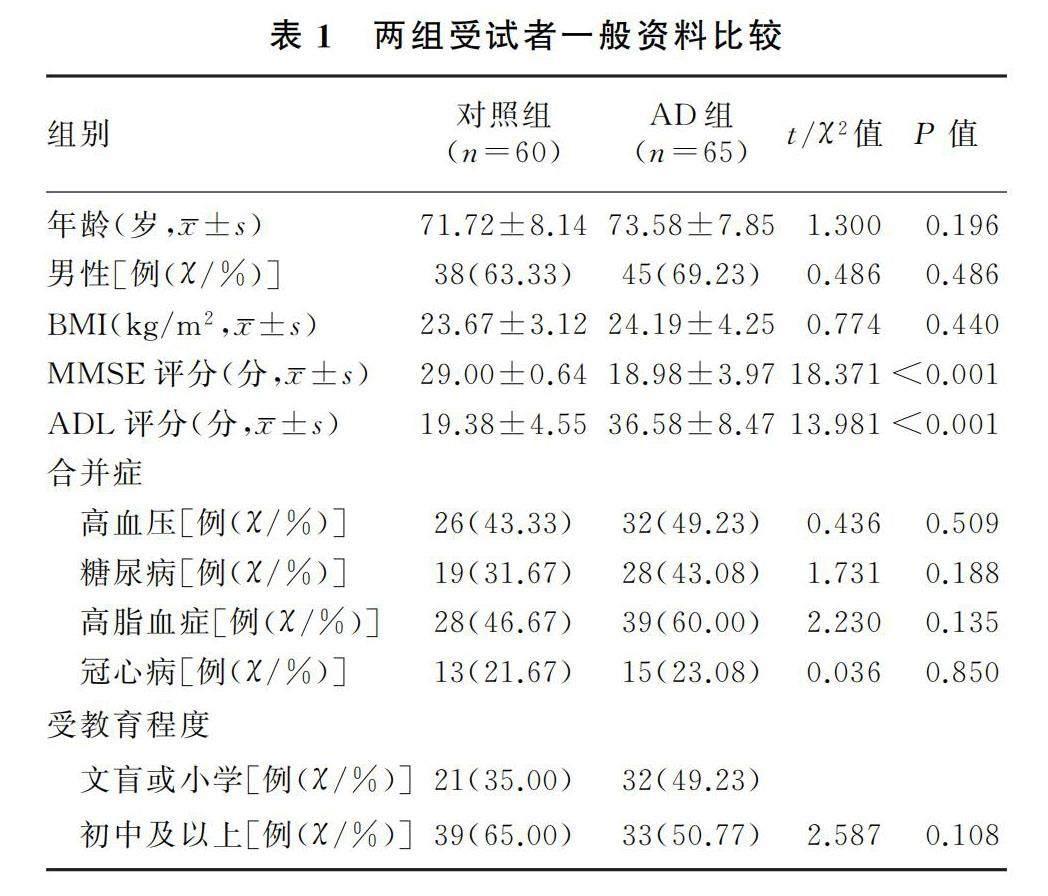
研究组受试者共65例,其中MCI亚组41例,DAT亚组24例。研究组与对照组受试者的年龄、性别、BMI、基础疾病、受教育程度等基本资料比较无显著差异(P>0.05),两组受试者具有可比性。研究组受试者的MMSE评分和日常生活能力量表(ADL)评分显著低于对照组(t=13.981~18.371,P<0.001)。见表1。
1.2 研究方法
1.2.1 样本采集 每位受试者禁食12 h后采集外周静脉血,室温下3 000 r/min离心10 min,后4 ℃下12 000 r/min离心5 min。将采集的血清样本保存在-80 ℃冰箱备用。
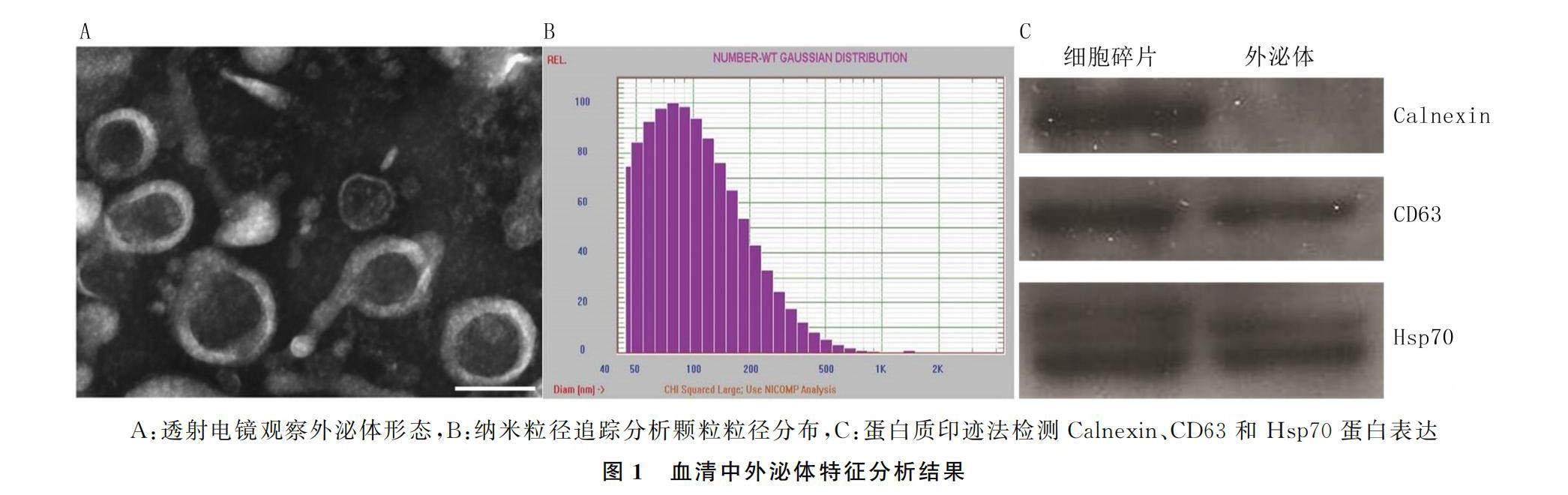
1.2.2 血清中外泌体提取及鉴定 取出冻存备用样本,于(25±3)℃室温下放置20 min复溶,使用外泌体分离试剂盒(美国Invitrogen公司)按照说明书步骤分离血清中外泌体。用HT7700透射电子显微镜(日本日立公司)观察外泌体形态及颗粒大小,用纳米粒径追踪技术分析粒径分布。采用蛋白质印迹法测定外泌体特征蛋白热休克蛋白70(Hsp70)、溶酶体相关膜蛋白-3(CD63)以及内质网特征蛋白Calnexin的表达水平。
1.2.3 血清中外泌体miR-223表达水平测定 利用miRNA分离试剂盒提取上述外泌体中总RNA,选取microRNA First Strand cDNA合成试剂盒(大连宝生生物公司)在20 μL反应体系中进行逆转录反应,获得cDNA。以cDNA为模板,U6 mRNA为内源对照,采用MicroRNAs Quantization PCR Kit(上海Sangon公司)和LightCycler 480实时PCR系统(德国Roche applied science公司)进行实时荧光定量聚合酶链式反应。反应进行条件为:95 ℃ 10 min,1个循环;95 ℃ 15 s,59.5 ℃ 30 s,36个循环。miR-223正向引物为5′-CCACGCTCCGTGT-ATTTGAC-3′,反向引物为5′-CCGCACTTGGGGTATTTGAC-3′,使用公式2-ΔΔCT计算miR-223相对表达量,进行3次独立重复试验,结果选取3次试验的平均值。
1.2.4 血清中NLRP3表达水平测定 取出冻存备用样本,于(25±3)℃室温下放置20 min复溶,利用酶联免疫吸附测定试剂盒(加拿大MyBioSource公司),按照试剂盒说明检测血清中NLRP3水平。
1.3 统计方法
利用SPSS 17.0和Graphpad prism 6.0软件进行数据分析。计量资料采用x?±s或M(P25,P75)表示,组间相关指标的比较采用t检验或非参数检验;分类变量以例(率)表示,组间比较采用卡方检验;相关分析采用Pearson检验或Spearman检验。绘制受试者工作特征(ROC)曲線,计算曲线下面积(AUC)、诊断灵敏度和特异度。以P<0.05为差异有统计学意义。
2 结果
2.1 血清中外泌体提取及鉴定结果
透射电子显微镜观察显示,分离出形状、大小不一的囊泡,具有典型的胞外体形态和双层膜结构(图1A);粒径平均分布范围为50.00~200.00 nm,平均粒径为(158.52±18.71)nm,稀释后调整粒子浓度为2.86×109个/L(图1B)。蛋白质印迹结果显示,内质网特征蛋白Calnexin蛋白表达阴性,而外泌体特征蛋白Hsp70以及溶酶体相关膜蛋白CD63则呈特异性高表达(图1C)。
2.2 两组受试者血清中外泌体miR-223及NLRP3表达水平比较
研究组和对照组受试者血清中外泌体miR-223表达水平分别为0.67±0.34、1.00±0.19,NLRP3水平分别为12.31(7.82,19.44)、4.45(2.45,9.58),两组间上述两指标比较差异具有显著意义(t=6.623,Z=-9.451,P<0.05)。在研究组中,DAT亚组和MCI亚组受试者血清中外泌体miR-223表达水平分别为0.52±0.26、0.76±0.31,NLRP3水平分别为20.78(14.45,28.52)、8.87(6.11,12.63),两亚组当中上述两指标相比较差异具有显著意义(t=3.190,Z=-5.288,P<0.05)。
2.3 研究组受试者血清中外泌体miR-223、NLRP3表达水平及MMSE评分间的相关性
Pearson及Spearman检验示,研究组受试者血清中外泌体miR-223与NLRP3表达水平呈负相关(r=-0.859,P<0.001),与MMSE评分呈正相关(r=0.790,P<0.001);血清中NLRP3表达水平与MMSE评分呈负相关(r=-0.776,P<0.001)。
2.4 血清中外泌体miR-223、NLRP3的测定对AD患者MCI的诊断价值
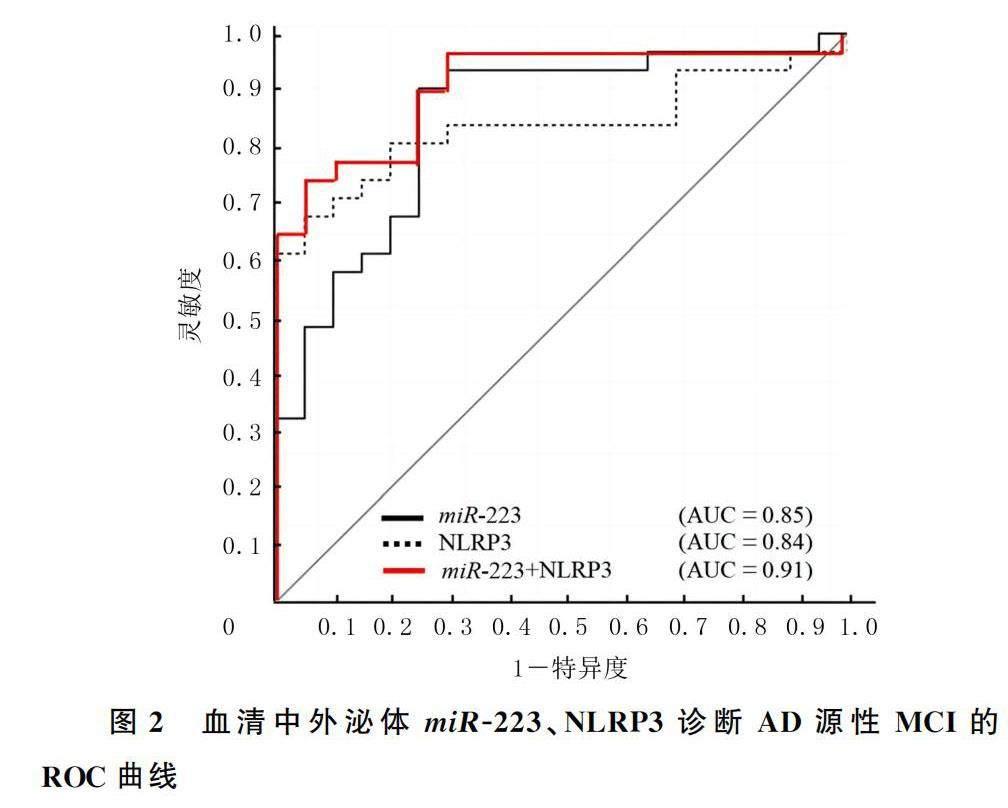
将对照组受试者作为对照,绘制ROC曲线。血清中外泌体miR-223以及NLRP3诊断AD患者MCI的AUC分别为0.85(95%CI=0.76~0.91)和0.84(95%CI=0.75~0.89),最佳截断值为0.74和8.15。该最佳截断值下,血清中外泌体miR-223和NLRP3诊断AD患者MCI的灵敏度分别为89.4%和81.7%,特异度分别为76.1%以及70.9%。另外,血清中外泌体miR-223联合NLRP3诊断AD患者MCI的AUC为0.91(95%CI=0.86~0.97),灵敏度和特异度分别为89.0%和76.5%。见图2。
2.5 血清中外泌体miR-223、NLRP3水平测定对DAT的鉴别诊断价值
将MCI亚组受试者作为对照,绘制ROC曲线。血清中外泌体miR-223和NLRP3鉴别诊断DAT的AUC分别为0.70(95%CI=50.64~0.78)和0.79(95%CI=0.71~0.85),最佳截断值分别为0.61和15.42。该最佳截断值下,血清中外泌体miR-223和NLRP3鉴别诊断DAT的灵敏度分别为85.0%和72.8%,特异度分别为76.1%和57.5%。血清中外泌体miR-223联合NLRP3鉴别诊断DAT的AUC为0.81(95%CI=0.75~0.88),灵敏度和特异度分别为70.0%和85.0%。见图3。
3 讨论
AD属于一种不可逆转的认知功能进行性障碍综合征,受人口老龄化影响,近年来我国AD发病率明显上升[6]。大量研究表明,异常miRNAs在多种人类疾病的发生发展中起着重要作用。本研究结果显示,与对照组相比较,研究组受试者的血清中外泌体miR-223表达水平普遍降低,同时伴有血清中NLRP3水平升高;且与MCI亚组相比,DAT亚组受试者也存在上述变化。上述结果说明miR-223/NLRP3信号通路可能参与了AD的发生以及进展过程。
miRNAs是神经系统当中大量存在的一种非编码小分子RNA,是神经元细胞的重要功能调节因子[7-8]。众多研究在AD大脑组织和脑脊液中观察到了异常miRNAs表达,这表明不同miRNAs参与调节神经退行性变相关基因表达,可能是AD的发病机制之一[9]。miRNAs不仅调节细胞内生物学过程,也存在于外周血外泌体中,在内分泌模式下调节其他细胞中的靶mRNA[10]。例如WEI等[11]研究证实间充质干细胞衍生的外泌体miR-223通过磷酸酶张力蛋白同源物-磷脂酰肌醇-3激酶/蛋白激酶B信号通路保护神经元免于凋亡,并为AD治疗提供了一种潜在的靶点。在本研究中,研究组受试者血清中外泌体中miR-223表达水平较对照组下调,且DAT亚组受试者血清中外泌体miR-223表达水平低于MCI亚组,这可能是因为miR-223下调可能会干扰与神经元细胞周期相关的信号通路,从而导致与AD进展相关的神经元凋亡。另外,本研究的ROC曲线提示血清中外泌体miR-223用于AD患者MCI的早期诊断以及DAT的鉴别诊断,其灵敏度和特异度均较高。这些结果均证实了血清中外泌体miR-223作为AD诊断生物标志物的有效性。此外,血清样本相较于脑脊液样本较为简单易得,随着二代基因测序技术的发展,血清miRNAs检测也愈发方便准确。
神经退行性疾病与遗传易感性、蛋白质结构异常、线粒体功能障碍以及氧化应激失衡等密切相关,β-淀粉样蛋白(Aβ)沉积并激活小胶质细胞驱动脑神经炎症是AD主要的病理基础[12]。本研究結果显示,研究组血清中NLRP3表达水平普遍升高,且DAT亚组血清中NLRP3水平高于MCI亚组,这说明NLRP3是参与AD发生和进展的重要分子,对AD的识别和治疗具有一定指导意义。神经炎症是AD进行性神经病变的重要基础,脑组织中NLRP3在认知功能障碍早期即被激活,现有研究成果推测NLRP3炎症小体可能在AD的发生发展中起作用,这可能与其在小胶质细胞中被Aβ激活会引发神经炎症有关[13-15]。Aβ聚集蛋白的积累以及小胶质细胞和星形胶质细胞的激活是AD的典型病理特征,后者可促进炎症分子的释放,上述过程都会损害神经元的结构和功能,导致偶发性记忆缺陷和认知功能障碍[16]。NLRP3炎症小体被认为是AD关键及常见的先天免疫应答物,NLRP3炎症小体的激活是在小胶质细胞吞噬原纤维Aβ后开始的,该过程导致溶酶体损伤,组织蛋白酶B释放、半胱氨酸天冬氨酸特异性蛋白水解酶1激活和一氧化氮的释放,进而促进AD病理的发展[17]。HENEKA等[18]发现,小胶质细胞中NLRP3炎症小体被Aβ激活是白细胞介素-1β成熟及随后炎性事件的基础,并且推测抑制NLRP3炎症小体有望成为AD治疗的新型手段之一。
既往研究表明,NLRP3为miR-223的重要靶点,但miR-223并不会立即触发负反馈机制,而是通过调节炎症因子,到达启动机体炎症反应所需的“炎症水平”,从而导致NLRP3炎症小体的激活[19]。本研究中,研究组受试者的血清中外泌体miR-223与NLRP3表达水平呈负相关,这也进一步提示了miR-223/NLRP3信号通路在AD中的作用机制。此外,ROC曲线评估外泌体miR-233联合NLRP3诊断AD源性MCI的AUC为0.91,灵敏度及特异度分别为89.0%和76.5%,二者联合鉴别诊断AD患者DAT的AUC为0.81,灵敏度以及特异度分别为70.0%和85.0%,上述结果均表明miR-233联合NLRP3对AD具有良好的诊断效能,且对评估该病进展具有一定意义。
综上所述,miR-223/NLRP3信号通路可能参与AD的发生和发展,检测血清中外泌体miR-223和NLRP3表达水平对于AD患者的早期MCI以及DAT进展具有一定的判断价值,值得进一步深入研究。同时本文仍存在一定的局限性,如miR-223与NLRP3之间的靶向调控关系,以及两者在AD发生发展中的作用机制,仍需要在细胞实验、动物实验乃至大样本临床研究中进一步验证。
伦理批准和知情同意:本研究涉及的所有试验均已通过河南省职工医院伦理委员会的审核批准(文件号L2019015)。所有试验過程均遵照《涉及人的生命科学和医学研究伦理审查办法》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:师俊亮、郝豫萍参与了研究设计;夏源、师俊亮、戴恩云参与了论文的写作和修改。所有作者均阅读并同意发表该论文,且均声明不存在利益冲突。
[参考文献]
[1]汪惠琳,徐清清,郑国庆. 精神疾病治疗进展(四):阿尔茨海默病[J]. 医药导报, 2017,36(10):1148-1152.
[2]JACK C R Jr, BENNETT D A, BLENNOW K, et al. NIA-AA research framework: Toward a biological definition of Alzheimers disease[J]. Alzheimers Dement, 2018,14(4):535-562.
[3]彭阳,史伟峰. NLRs信号转导通路在真菌感染中的作用机制[J]. 临床检验杂志, 2017,35(7):528-530.
[4]李洋,费洪新,张晓杰. 芪苓益脑汤对阿尔茨海默病小鼠炎症小体NOD样受体蛋白3表达的影响[J]. 中国医药导报, 2019,16(32):14-17,26,181.
[5]GALVIN J E, SADOWSKY C H, NINCDS-ADRDA. Practical guidelines for the recognition and diagnosis of dementia[J]. J Am Board Fam Med, 2012,25(3):367-382.
[6]朱琼,陈星星. 阿尔茨海默病的流行病学调查及国内康复治疗现状分析[J]. 中华物理医学与康复杂志, 2017,39(11):866-869.
[7]KORITZINSKY E H, STREET J M, STAR R A, et al. Quantification of exosomes[J]. J Cell Physiol, 2017,232(7):1587-1590.
[8]CHANG W S, WANG Y H, ZHU X T, et al. Genome-wide profiling of miRNA and mRNA expression in Alzheimers di-sease[J]. Med Sci Monit, 2017,23:2721-2731.
[9]SWARBRICK S, WRAGG N, GHOSH S, et al. Systematic review of miRNA as biomarkers in Alzheimers disease[J]. Mol Neurobiol, 2019,56(9):6156-6167.
[10]张萍,杨波,蔡小玲,等. 外泌体微小RNA研究进展及诊断价值[J]. 检验医学, 2019,34(12):1139-1144.
[11]WEI H, XU Y, CHEN Q, et al. Mesenchymal stem cell-derived exosomal miR-223 regulates neuronal cell apoptosis[J]. Cell Death Dis, 2020,11(4):290-300.
[12]TIWARI S, ATLURI V, KAUSHIK A, et al. Alzheimers disease: Pathogenesis, diagnostics, and therapeutics[J]. Int J Nanomedicine, 2019,14:5541-5554.
[13]ISING C, VENEGAS C, ZHANG S S, et al. NLRP3 inflammasome activation drives tau pathology[J]. Nature, 2019,575(7784):669-673.
[14]VAN-ZELLER M, DIAS D, SEBASTIO A M, et al. NLRP3 Inflammasome: A starring role in amyloid-β- and tau-driven pathological events in Alzheimers disease[J]. J Alzheimers Dis, 2021,83(3):939-961.
[15]KELLEY N, JELTEMA D, DUAN Y, et al. The NLRP3 inflammasome: An overview of mechanisms of activation and regulation[J]. Int J Mol Sci, 2019,20(13):3328-3351.
[16]JANELIDZE S, MATTSSON N, STOMRUD E, et al. CSF biomarkers of neuroinflammation and cerebrovascular dysfunction in early Alzheimer disease[J]. Neurology, 2018,91(9):e867-e877.
[17]FRIKER L L, SCHEIBLICH H, HOCHHEISER I V, et al. β-Amyloid clustering around ASC fibrils boosts its toxicity in microglia[J]. Cell Rep, 2020,30(11):3743-3754.
[18]HENEKA M T, KUMMER M P, STUTZ A, et al. NLRP3 is activated in Alzheimers disease and contributes to pathology in APP/PS1 mice[J]. Nature, 2013,493(7434):674-678.
[19]LA-ROSA F, MANCUSO R, AGOSTINI S, et al. Pharmacological and epigenetic regulators of NLRP3 inflammasome activation in Alzheimers disease[J]. Pharmaceuticals (Basel), 2021,14(11):1187-1197.
(本文编辑 范睿心 厉建强)

