错配修复蛋白和人表皮生长因子受体2 表达与结直肠癌患者淋巴结转移的相关性
贾红梅
结直肠癌是消化道最常见的恶性肿瘤之一,也是全世界癌症患者死亡的第二大原因,在2020 年有超过180 万例新病例和90 万例患者死亡[1]。结直肠癌的早期诊断率普遍较低,大多数患者在中晚期才被确诊,结直肠癌术后复发和转移受淋巴结转移的影响,也是预后的关键因素[2]。因此,对结直肠癌淋巴转移的深入研究十分必要。结直肠癌主要由环境因素、遗传因素及其相互作用引起,与至少三种不同的遗传途径相关,包括微卫星不稳定性、染色体不稳定性和CpG 二核苷酸(CpG 岛)甲基化表型[3]。其中,微卫星不稳定性的特征是DNA 甲基化或基因突变引起,导致短重复序列长度的广泛改变。错配修复蛋白是结直肠癌的特异性分子标志物,错配修复蛋白的种系突变可引起错配修复基因失活,进而造成无法修复的错误DNA 复制,导致正常细胞的基因组发生改变,转化为肿瘤细胞。
有研究表明,错配修复蛋白是影响结直肠癌发生的风险因素。MSH2、MSH6、MLH1、PMS2 均为常见错配修复蛋白,但其与结直肠癌患者淋巴转移的相关性尚不明确[4]。人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)是一种与恶性肿瘤密切相关的大分子,与癌细胞增殖和细胞外基质重构有关,可能会影响结直肠癌患者的淋巴结转移[5]。基于此,本研究分析错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达与结直肠癌患者淋巴结转移的相关性,现报告如下。
1 资料与方法
1.1 研究对象及一般资料 选择2020 年12 月—2023 年1 月东营市河口区中医院收治的116 例结直肠癌患者作为研究对象。其中男性64 例,女性52 例,年龄32~78 岁,平均(52.11±6.62)岁;体质量指数(body mass index,BMI)18.9~26.7 kg/m2,平均(22.17±0.86)kg/m2;肿瘤直径0.9~67.7 mm,平均(34.1±5.6)mm;TNM分期:Ⅰ期13例,Ⅱ期46例,Ⅲ期34 例,Ⅳ期23 例;病理组织学诊断:黏液腺癌50 例,非黏液腺癌66 例;肿瘤部位:左半结肠39 例,右半结肠33 例,直肠44 例;侵袭程度:黏膜及下层2 例,肌层19 例,浆膜及其外部95 例;淋巴结转移59 例,无淋巴结转移57 例。
1.1.1 纳入标准 ① 符合《中国结直肠癌诊疗规范(2020 年版)》[6]诊断标准;② 经组织病理学诊断确诊为结肠癌或直肠癌;③ 切除前未进行化疗或放疗;④ 资料完整;⑤ 意识与认知功能无异常,可正常交流;⑥ 愿意接受随访。
1.1.2 排除标准 ① 肿瘤复发;② 合并其他恶性肿瘤;③ 患有精神疾病;④ 患有严重呼吸系统、肝脏、肾脏或心血管疾病。
1.1.3 伦理学 本研究符合医学伦理学标准,并经东营市河口区中医院医学伦理委员会审核通过(审批号:20230809),患者与家属均知情同意。
1.2 仪器与试剂 MSH2、MSH6、MLH1、PMS2 抗体试剂盒均由福州迈新生物技术开发有限公司提供,Her-2 表达检测试剂盒由圣克鲁斯生物技术(上海)有限公司公司提供。
1.3 研究方法 研究对象均通过两名病理医师诊断为结肠癌或直肠癌,收集术后肿瘤组织和邻近组织,使用4%中性甲醛液固定,进行石蜡包埋(石蜡切片厚度为3~4 μm)及苏木素-伊红(hematoxylineosin,HE)染色。采用Max Vision 二步法进行免疫组化试验,于65 ℃烤片2 h,石蜡切片,脱蜡、水化,使用磷酸缓冲盐溶液进行3 次冲洗(每次30 min),使用过氧化物酶阻断剂对内源性过氧化酶活性进行封闭10 min,加入一抗至组织完全覆盖。在室温下孵育至恢复室温,加入生物素标记的二抗至组织被完全覆盖,向其中滴加DAB 显色试剂,放置5 min,使用苏木素复染1 min,流水冲洗,常规脱水、透明和封片。
1.3.1 错配修复蛋白表达检测 使用免疫组化法抗体试剂盒检测MSH2、MSH6、MLH1、PMS2 蛋白的阳性表达率。判断标准:错配修复蛋白MSH2、MSH6、MLH1、PMS2 均定位于细胞核,细胞核(间质细胞、上皮细胞、浸润淋巴细胞)呈黄色或棕黄色颗粒为阳性细胞,细胞核不着色为缺失。在400 倍显微镜下随机选择每张切片10 个视野,记录阳性细胞占比。染色强度为深棕色、深黄色、浅黄色、不着色分别记为3 分、2 分、1 分、0 分,阳性细胞占比>80%、51%~80%、11%~50%、≤10%分别计为4分、3分、2 分、1 分,染色强度评分与阳性细胞占比评分的乘积≥2 分表示错配修复蛋白MSH2、MSH6、MLH1、PMS2 为阳性表达,任意一项缺失均可判定为微卫星不稳定性。
1.3.2 Her-2 表达检测 使用免疫组化法试剂盒测定Her-2 表达阳性率。判断标准:标本显色度为棕黑色、棕黄色、淡黄色、无色分别记为3 分、2 分、1 分、0 分,阳性细胞占比>75%、51%~75%、11%~50%、≤10%分别记为4 分、3 分、2 分、1 分,标本显色度评分与阳性细胞占比评分之和为Her-2 表达评判标准,评分≥4 分、2~3 分、<2 分可分别判定为强阳性、阳性、阴性。
1.3.2 患者分组 参考《肿瘤病理诊断规范(结直肠癌)》[7]以及结合病理形态学诊断结果,确定结直肠癌患者的淋巴结转移发生情况,根据是否发生淋巴结转移分为淋巴结转移组(59 例)和无淋巴结转移组(57 例)。
1.4 统计学方法 采用SPSS 25.0 软件进行数据处理。计数资料以百分比表示,采用χ2检验;计量资料符合正态分布以均数±标准差(±s)表示,组间比较采用独立样本t检验。P<0.05 为差异具有统计学意义。采用Logistic 回归分析检验MSH2、MSH6、MLH1、PMS2、Her-2 表达与结直肠癌患者淋巴结转移的关系。绘制受试者工作特征曲线(receiver operator characteristic curve,ROC 曲线),并计算ROC曲线下面积(area under ROC curve,AUC),检验MSH2、MSH6、MLH1、PMS2、Her-2 表达对结直肠癌患者淋巴结转移的评估价值,AUC>0.90 表示评估性能较高,0.71≤AUC≤0.90 表示有一定评估性能,0.50≤AUC<0.71 表示评估性能较低,<0.50 表示无评估性能。
2 结果
2.2 Logistic 回归分析错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达与结直肠癌患者淋巴结转移的相关性 将结直肠癌患者淋巴转移情况作为状态变量(1=有淋巴结转移,0=无淋巴结转移),将MSH2(1=缺失,0=阳性)、MSH6(1=缺失,0=阳性)、MLH1(1=缺失,0=阳性)、PMS2(1=
2.1 是否淋巴结转移结直肠癌患者错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达阳性比较 病理形态学诊断结果显示,本研究116 例结直肠癌患者中,有淋巴结转移59 例,无淋巴结转移57 例。两组MSH6 表达差异无统计学意义(P>0.05);淋巴结转移组的MSH2、MLH1、PMS2 缺失率及Her-2 阳性率均明显高于无淋巴结转移组,差异均有统计学意义(均P<0.05)。见表1。缺失,0=阳性)、Her-2(1=阳性,0=阴性)表达作为自变量,经Logistic 回归分析结果显示,错配修复蛋白MSH6 表达与结直肠癌患者淋巴转移无相关性(P>0.05),错配修复蛋白MSH2、MLH1、PMS2 表达及Her-2 表达均与结直肠癌患者淋巴结转移呈正相关(均P<0.05)。见表2。
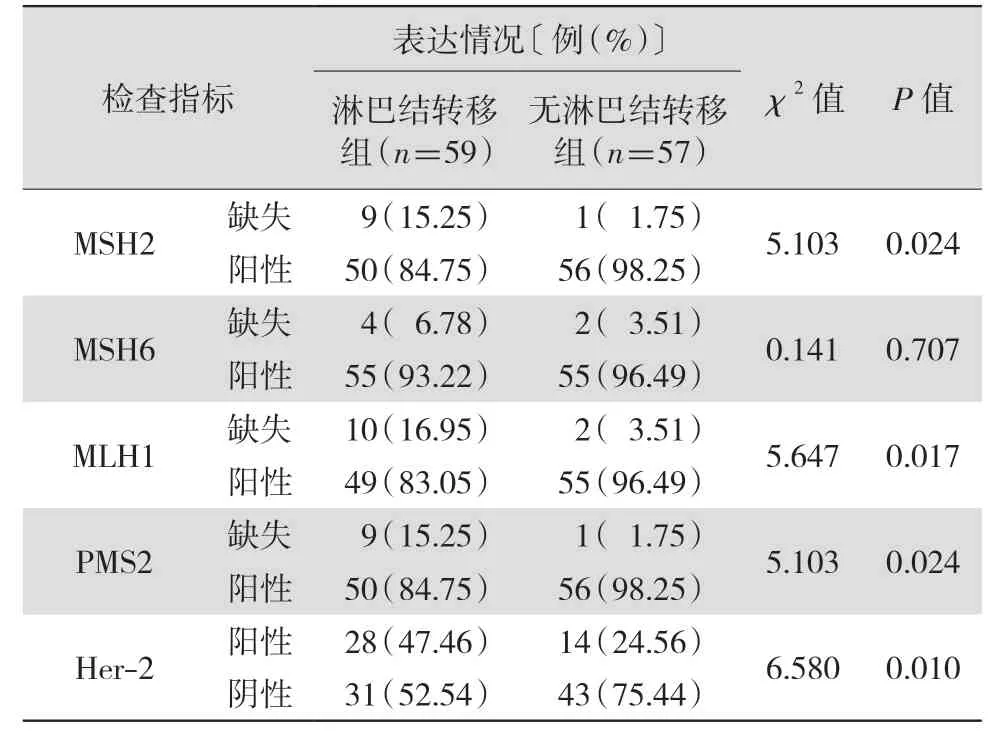
表1 不同淋巴结转移情况结直肠癌患者错配修复蛋白MSH2、MSH6、MLH1、PMS2 及Her-2 表达比较

表2 Logistic 回归分析错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达与结直肠癌患者淋巴结转移的相关性
2.3 错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达对结直肠癌患者淋巴结转移的评估价值 将结直肠癌患者淋巴转移情况作为状态变量(1=有淋巴结转移,0=无淋巴结转移),将MSH2(1=缺失,0=阳性)、MSH6(1=缺失,0=阳性)、MLH1(1=缺失,0=阳性)、PMS2(1=缺失,0=阳性)、Her-2(1=阳性,0=阴性)表达作为检验变量,绘制ROC 曲线图。结果显示,错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达评估结直肠癌患者淋巴转移的AUC 分别为0.567、0.516、0.567、0.567、0.614,均有一定评估价值,但评估性能不高。见图1,表3。

图1 错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达对结直肠癌患者淋巴结转移评估价值的ROC 曲线
3 讨论
结肠直肠癌是一种常见的消化道恶性肿瘤,全世界每年约有120 万例新发病例和60 万例死亡病例[8]。结直肠癌具有复杂的生物学行为,并且容易对化疗药物产生耐药性,淋巴结转移是恶性肿瘤的主要生物学特征,结直肠癌疗效差往往与肿瘤的转移有关[9]。因此,迫切需要了解如何预测和控制淋巴转移,并在临床上对肿瘤进行早期综合治疗。
结直肠癌的发生发展是多种基因和因素共同作用的结果,其发病机制复杂[10]。错配修复系统可以及时修复受损的DNA,保证遗传信息的稳定性,错配修复缺陷被定义为在肿瘤和微卫星不稳定性中缺乏免疫组织化学可检测的错配修复蛋白表达,当错配修复系统存在缺陷时,由于校对和修复功能减弱或缺失,受损的DNA 不能被及时修复,导致DNA 错配的积累,造成微卫星不稳定性,最终导致细胞癌变[11-13]。Her-2 是Her 家族的成员,也是一种原癌基因,Her-2 基因扩增和蛋白过表达参与了几种人类癌症的发病和进展,包括肺癌、前列腺癌、膀胱癌、结直肠癌、胰腺癌等,因此常被认为是一种不良预后因素[14]。本研究结果显示,淋巴结转移组患者体内MSH6 表达与无淋巴结转移组患者比较差异无统计学意义,淋巴结转移组的MSH2、MLH1、PMS2缺失率及Her-2 阳性表达率均明显高于无淋巴结转移组。Logistic 回归分析结果显示,错配修复蛋白MSH6 表达与结直肠癌患者淋巴转移无相关性,错配修复蛋白MSH2、MLH1、PMS2 表达及Her-2表达与结直肠癌患者淋巴结转移有关。分析原因为:MSH2 与大肠埃希菌MutS 基因同源,参与DNA错配修复,可以处理DNA 损伤的修复,促进细胞凋亡[15]。MLH1 编码的蛋白质是DNA 损伤信号的一部分,MLH1 可参与DNA 错配的修复系统,并参与减数分裂[16]。错配修复蛋白在维持DNA 的结构和功能中具有重要的作用,随着这种修复机制的丧失,复制期间的错误率增加了100~1 000 倍,可能表现为微卫星不稳定性引起的癌基因激活或抑癌基因失活,也可能表现为直接引起癌基因或抑癌基因突变,从而诱发癌变[17-18]。错配修复蛋白缺失患者的微卫星不稳定性显著增加,从而导致淋巴结转移的概率相应增加。Her-2 是一种由细胞癌基因编码的具有酪氨酸激酶活性的蛋白质,是细胞基因组的正常组成部分,参与对细胞生长、分化和分裂的调节[19]。Her-2 激活引起异常基因扩增、异常转录调节和mRNA 过度表达,其蛋白产物过度表达并产生肿瘤转化活性,造成表皮生长因子受体(epidermal growth factor receptor,EGFR)蛋白激酶的持续激活,使细胞生长失控,导致肿瘤的发生发展,加快肿瘤的生长,诱发淋巴结转移[20]。另外,本研究绘制ROC 曲线图,结果显示,错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达及Her-2 表达评估结直肠癌患者淋巴转移的AUC 分别为0.567、0.516、0.567、0.567、0.614,均有一定评估价值,但评估性能不高。
综上所述,错配修复蛋白MSH2、MSH6、MLH1、PMS2 表达缺失及Her-2 阳性表达与结直肠癌患者淋巴结转移有关。
利益冲突作者声明不存在利益冲突

