胃间质瘤的MSCT 定位及定性价值分析
陆峰,胡道付,丁忠华,赵海光,陈伏庆
间质瘤是起源于胃肠道壁的间叶性肿瘤,又名胃肠道间质瘤(GIST),可发生于胃肠道任何部位且具有多向分化潜能,临床上以胃部发病较多,占比高达50%~70%,称为胃间质瘤(GST),该病以中老年群体发病较多,无明显性别倾向性。临床研究发现,GST 临床恶性率高达20%~30%,早期症状无特异性,且中老年群体存在就医延迟、综合体质差及治疗耐受性不佳等特点,如不能给予及时准确的诊断很可能导致病情延误,增加不良预后风险[1]。目前,临床上GST 以病理活检为诊断“金标准”,但组织活检不适用于早期病情筛查[2]。MSCT 是临床上应用较为广泛的影像检查,可清晰显示肿瘤部位、大小、密度及边界等,通过增强扫描及平面重建技术还可确定肿瘤生长方向、与周围组织的关系及肿瘤血管特征等,诊断准确性较高[3-4]。本研究探讨MSCT 对GST 定位及定性的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料 回顾性收集2016年4月至2022年8月平湖市第一人民医院收治的87 例疑似GST 患者。诊断标准:(1)符合中国胃肠间质瘤诊断治疗共识(2017年版)[5]中GST 的临床诊断标准,均行术后病理活检;(2)术前行MSCT 扫描且病历资料完整;(3)入组前未进行手术及放化疗等治疗。排除标准:(1)MSCT检查禁忌;(2)合并恶性肿瘤、感染或其他胃肠道疾病;(3)严重肝肾等脏器功能障碍;(4)既往有胃部手术史。其中男46 例,女41 例;年龄29 ~83 岁,平均(56.2±13.5)岁;体质量指数(BMI)20 ~26 kg/m2,平均(23.21±1.44)kg/m2;病程2 ~13年,平均(7.13±2.44)年。87 例患者中经病理诊断确诊GST 73 例,非GST 病变14 例;GST 患者中病变位于胃底34 例,胃体21 例,胃窦18 例;18 例为体检偶然发现,55 例临床表现为消化道出血、便血、腹痛及贫血等。本研究经平湖市第一人民医院医学伦理委员会审批通过。
1.2 方法 所有患者均于检查前8 h禁食、水,并于扫描前喝800 ~1 000 ml 水充盈胃部,患者取仰卧位,在腹部中心定位,采用64 排128 层螺旋CT 机(Canon,日本,型号:Aquilion PRIME)、32 排64 层螺旋CT 机(SIEMENS,德国,型号:SOMATOM Perspective)先进行平扫,扫描参数:管电压120 kV,管电流250mA,矩阵512×512,螺距1.2,层厚4~5mm,重建间隔0.8 mm,重建层厚1 mm,扫描范围为整个腹部。而后采用双管高压注射器以3 ~4 ml/s 的速度静脉注射对比剂(碘海醇,300 mg/ml),注射剂量为1.5 ml/kg,以腹腔水平主动脉为监测点,当CT 值达到100 HU 时开始扫描,并于25、60、180 s 后进行动脉期、静脉期、延迟期扫描。扫描结束后将数据上传至工作站。
图像处理及评估指标:由本院2 名副主任及以上医师共同阅片,并进行容积重建(VR)、最大密度投影(MIP)、曲面重建(CPR)及病情评估,意见相左时,由两人共同商议决定。评估指标包括肿瘤部位、形态、大小、与周围组织的关系、是否存在钙化/溃疡、生长方式、转移情况、强化程度(轻度:CT 值上升<20 HU;中度:CT值上升20 ~40 HU;显著:CT值上升>40 HU)。
病理活检:所有患者均进行免疫组织化学处理,行光学显微镜检测,GST 判定标准参照文献[5],即:CD117 阳性、CD34 阳性、S-100 阴性或弱阳性。
GST 危险度分级[6]:参照美国国立卫生研究院(NIH)分级,根据肿瘤大小及核分裂象计数将危险度分为极低危、低危、中危、高危4 个等级,其中将极低危、低危划分为低风险,将中危及高危划分为中高风险。
1.3 观察指标 分析MSCT 对GST 的临床诊断价值、定位情况及危险度分级,并比较不同病理危险度患者的MSCT 影像特征。
1.4 统计方法 采用SPSS 23.0 统计软件进行分析,计数资料采用2检验;计量资料以均数±标准差表示,采用t 检验。P <0.05 表示差异有统计学意义。
2 结果
2.1 MSCT 诊断GST 的临床价值分析 MSCT 诊断GST 71 例阳性,16 例阴性,其中漏诊3 例,误诊1例,诊断敏感度为95.89%(70/73),特异度为92.86%(13/14),准确度为95.40%(83/87),阳性预测值为0.986(70/71),阴性预测值为0.813(13/16),Kappa值为0.839,与病理检测具有较高的一致性(Kappa >0.75),见表1。
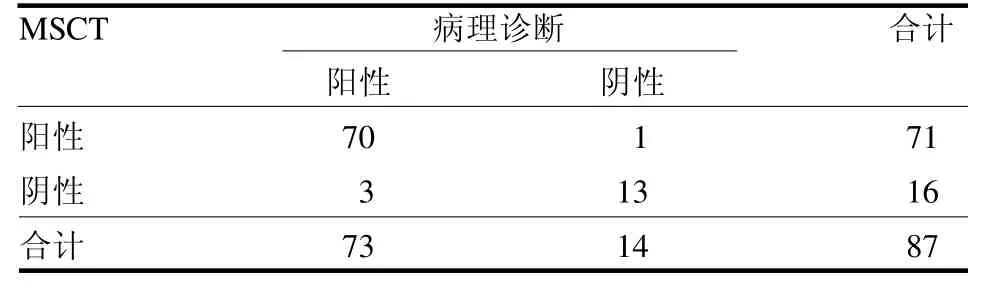
表1 MSCT 诊断GST 的临床价值分析例
2.2 MSCT 定位GST 情况 73 例GST患者中浆膜下31 例,肌壁间24 例,黏膜下18 例;MSCT诊断浆膜下29 例,肌壁间24 例,黏膜下18 例,其中浆膜下漏诊3 例,误诊1 例,两种检查方式差异无统计学意义(2=0.039,P >0.05),见表2。
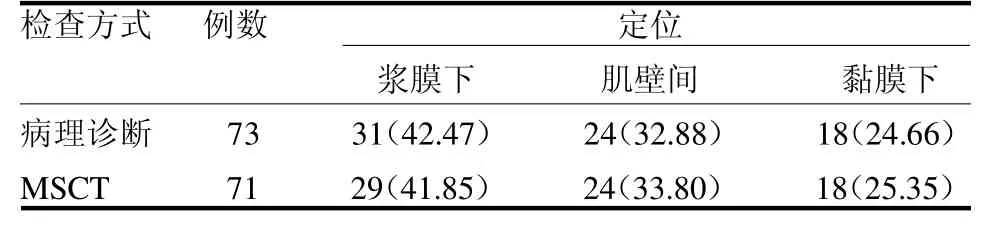
表2 MSCT 定位GST 情况例(%)
2.3 MSCT 诊断GST 危险度分级情况 87 例患者中共有14 例非GST,GST极低危18 例,低危26 例,中危24 例,高危5 例,MSCT 诊断准确率分别为92.86%(13/14)、88.89%(16/18)、88.46%(23/26)、87.50%(21/24)及80.00%(4/5),总准确率为88.51%(77/87),其中误诊1 例,极低危2 例分级不足;低危2 例分级不足,1 例过度分级;中危2 例分级不足,1例过度分级;高危1 例分级不足,见表3。
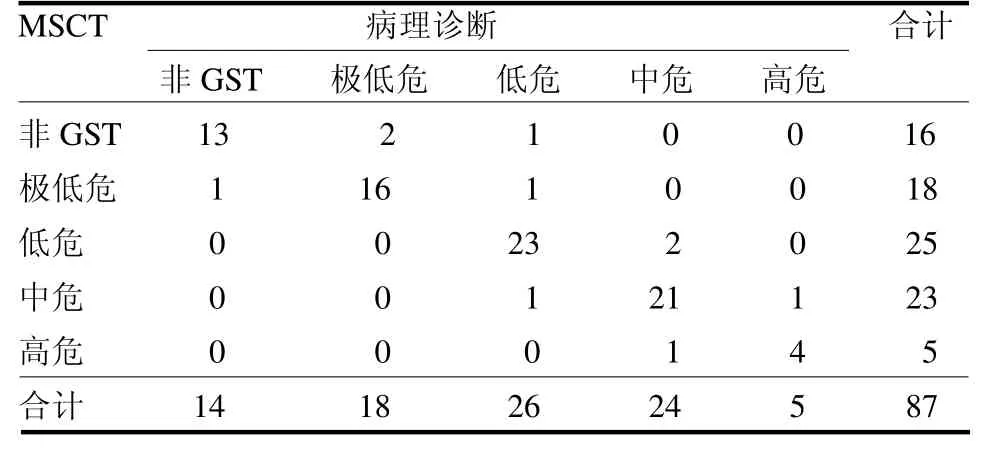
表3 MSCT 诊断GST 分级情况例
2.4 不同病理危险度患者的MSCT 影像特征比较MSCT 诊断极低危、低危43 例,为低危组;中危、高危28 例,为高危组。高危组肿瘤最长径>5 cm、不规则形态、不完整边界、不均匀密度及消化道出血占比均高于低危组(均P <0.05),见表4。
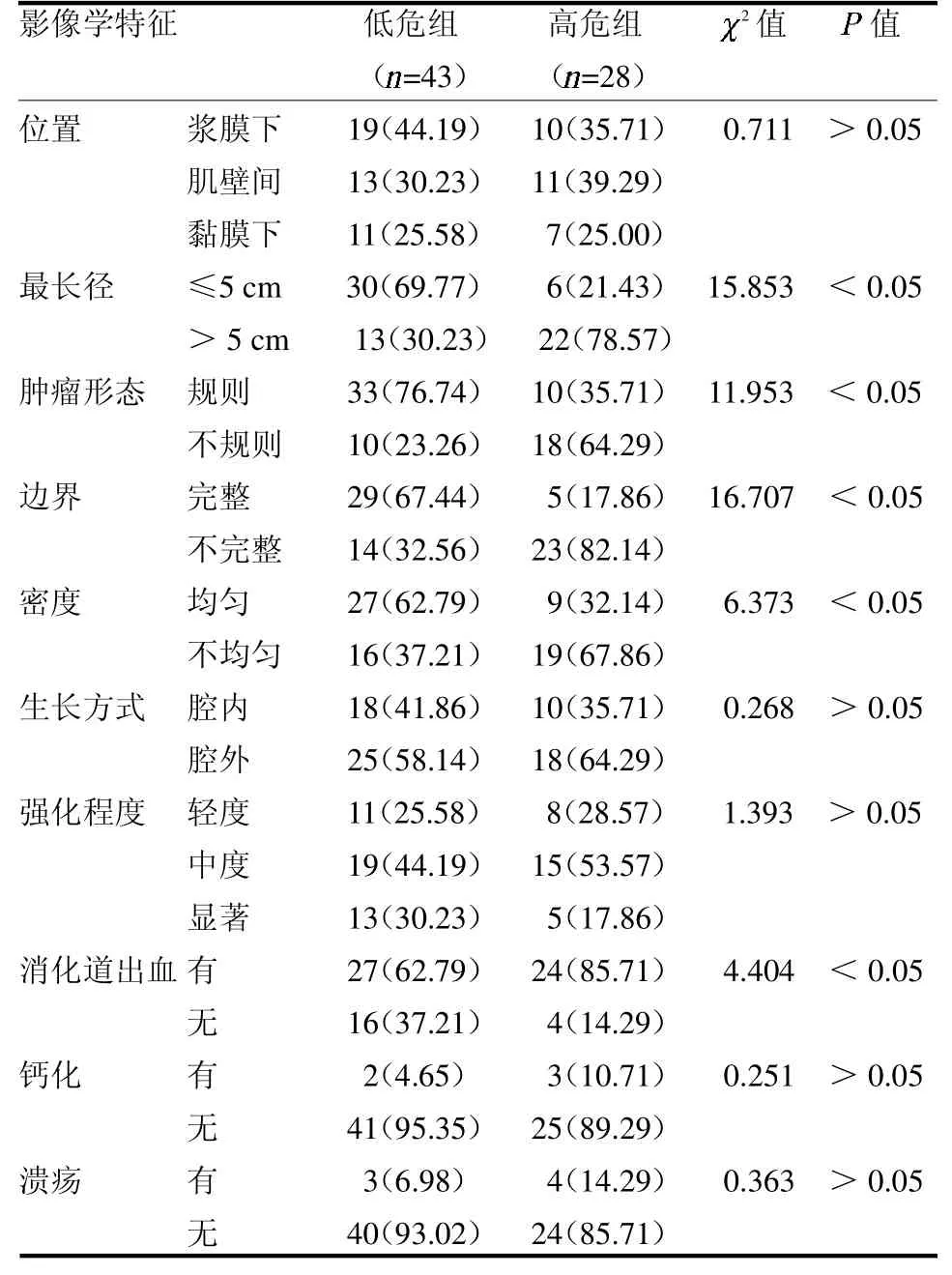
表4 不同病理危险度患者的MSCT 影像特征比较例(%)
3 讨论
GST起源于黏膜下层,早期病变较小,黏膜较为完整,晚期黏膜可发生溃疡、钙化,临床症状表现多样,早期患者临床表现并不明显,而当表现出腹痛、包块、消化道出血时往往已进入中晚期,部分患者出现转移现象,因而治疗难度加大。临床上手术治疗方案的确定与肿瘤位置、恶性程度、受累面积等有关,因而需加强早期筛选,以改善预后[7-8]。
以往胃癌检查多采用内镜和病理检查的方式确诊,虽然准确性较高,但作为侵入性操作易引起受检者胃肠道不适,GST多为中老年患者,自身免疫功能较差,胃肠道反应更明显,很难用于早期癌症筛查。另一方面,进展期GST 病灶多呈现出向腔内外膨胀性生长的趋势,形状多为不规则分叶状,表面布满结节,凹凸不平,而侵入性检查难度较大,GST 晚期病灶中溃疡、钙化性病变面积较小,仅通过胃镜或病理检查不仅存误诊、漏诊风险,还可能造成正常黏膜组织损伤,因而需借助影像学检查辅助诊断[9-10]。MSCT扫描获得的容积数据经三维重建可清晰还原肿瘤大小、位置、形状、密度等影像特征,通过注射对比剂进行增强扫描还可进一步观察肿瘤病灶与周围组织的关系、侵袭及转移情况,这些特征对肿瘤定位、定性及治疗方案的拟定起着重要作用[11-12]。在肿瘤的良恶性判断方面,MSCT 可通过扫描强化特征进行判断,良性肿瘤组织密度均匀,强化程度较为均匀,而恶性组织多呈侵袭性增长,质地较为粗糙,因而强化程度不均匀。
本研究纳入87 例患者,71 例诊断为GST阳性,16 例诊断为阴性,其中漏诊3 例,误诊1 例,诊断敏感度为 95.89%,特异度为 92.86%,准确度为95.40%,Kappa 值为0.839,与病理检测具有较高的一致性,这提示GST 采用MSCT 诊断的准确性较高,对疾病治疗具有较高的参考价值。病理检查与MSCT 诊断对病灶的定位差异无统计学意义(P >0.05),这说明通过MSCT 增强扫描对GST 肿瘤病灶定位的准确性较高,漏诊、误诊均为浆膜下病灶,这与病灶位置较为隐匿及病灶直径较小有关,GST早期病变较小,因而不易被发现。危险度是评估GST恶性程度、复发的重要指标,主要根据肿瘤部位、大小、病理性核分裂象及是否发生破裂确定[13]。多项研究表明,中、高危险度GST 存在复发转移风险较高,其中以瘤体最长径>5 cm 为主,这主要与肿瘤生长过程中相关基因突变有关。中、高危GST 多呈现多形性、密度不均特点,而低危GST 形态较为规则,密度较为均衡,这主要是中、高危肿瘤增长速度较快,瘤体在各个方向的增长不均匀导致的,MSCT扫描时高危组更易出现强化不均匀现象[14]。本研究结果显示MSCT 诊断NIH 分级整体准确率为88.51%,其中极低危易出现漏诊,低危和中危以诊断不足居多,分析可能与病灶侵袭范围难以判断有关,GST 进展期病灶多呈膨出、不规则状,表面凹凸不平,因而其病灶大小难以精确估算,部分患者合并胃溃疡也可能对病灶检测造成干扰。高危组肿瘤最长径>5 cm占比高于低危组,形态分布以不规则及边界不完整为主,密度不均匀、消化道出血占比较高,这主要是由于高危组病灶多为恶性增长,因而膨出现象明显;这与王思凯等[15]的研究结果基本一致。这提示MSCT 诊断GST 图像参数具有一定的特征性,对肿瘤定位、定性及临床治疗具有较高的参考价值。
利益冲突 所有作者声明无利益冲突

