肺超声在心脏急重症疾病合并肺水肿中应用的研究进展
赵浩天,李 丽
(河北省人民医院 超声科,河北 石家庄 050000)
肺超声技术不同于传统超声。传统超声更强调于对直观超声征象的解读,肺超声需基于肺部病理生理学、血流动力学及心功能-肺循环-容量负荷间的适配关系,从而精确把握肺部病变、肺通气功能和肺内渗漏的潜在风险等[1]。目前,国内肺超声的应用有两种模式,一种是以急危重症病房为主的临床医师学习超声技术并开展肺超声,该模式的优势在于临床医师通过超声“视窗”能更好地把握即时肺部病变状态[2],劣势是学习超声技术的难度、时间花费和操作水平不均一;另一种是以超声科医师开展床旁超声业务,该模式操作技术准确、稳定,但对肺部疾病的深层理论欠理解。目前,国内肺超声技术尚未完全普及,根据不同医院情况,以上两种模式相互补充,对肺超声技术的发展和临床诊疗将会颇有益处。河北省人民医院开展肺超声及联合心肺技术近5年,以病理生理学基础和肺超声检查相结合的方式,开展床旁肺超声检查3000余例次,出具正式肺超声报告1000余份,结合经验,对肺超声在急重症心脏疾病合并肺水肿中的应用进行综述。
1 肺超声与心功能Frank-Starling曲线的相关性
Frank-Starling曲线可反映机体容量负荷与心功能间相互作用关系。不同机体对应不同曲线,左心泵功能衰竭患者的Frank-Starling曲线较健康人低平,提示其对前负荷增加的耐受程度低。Frank-Starling曲线的“上升支”与“平台支”的拐点对应着前负荷与心泵功能的临界点,即静水压驱动肺水肿产生的临界点[3]。
肺超声可敏感地捕捉到肺间质/小叶间隔内血管外肺水含量超过5%的水平,当肺毛细血管静水压升高达到25 mmHg时,液体转移至肺间质,此时肺超声B线取代A线,呈离散型分布;达35 mmHg时(1 mmHg=0.133 kPa),液体量增加并进入肺泡腔,此时B线数量增多,呈密集融合分布[1]。肺超声在Frank-Starling曲线的“上升支”呈A线,在“平台支”呈B线,在拐点位置即A线与B线动态变化的临界点,且随着B线数量和密集程度的增加,反映机体在“平台支”的位置更远离拐点(图1)。因此,肺超声和Frank-Starling曲线密不可分,可将该曲线由抽象思维达到可视化水平的一个重要载体。血管外肺水曲线是在Frank-Starling曲线基础上对评估患者液体反应性而设计的[4],其本质反映了在拐点位置随着心功能对前负荷增加的耐受度达到极限后,血管外肺水随之增加,可被肺超声发现与监测。
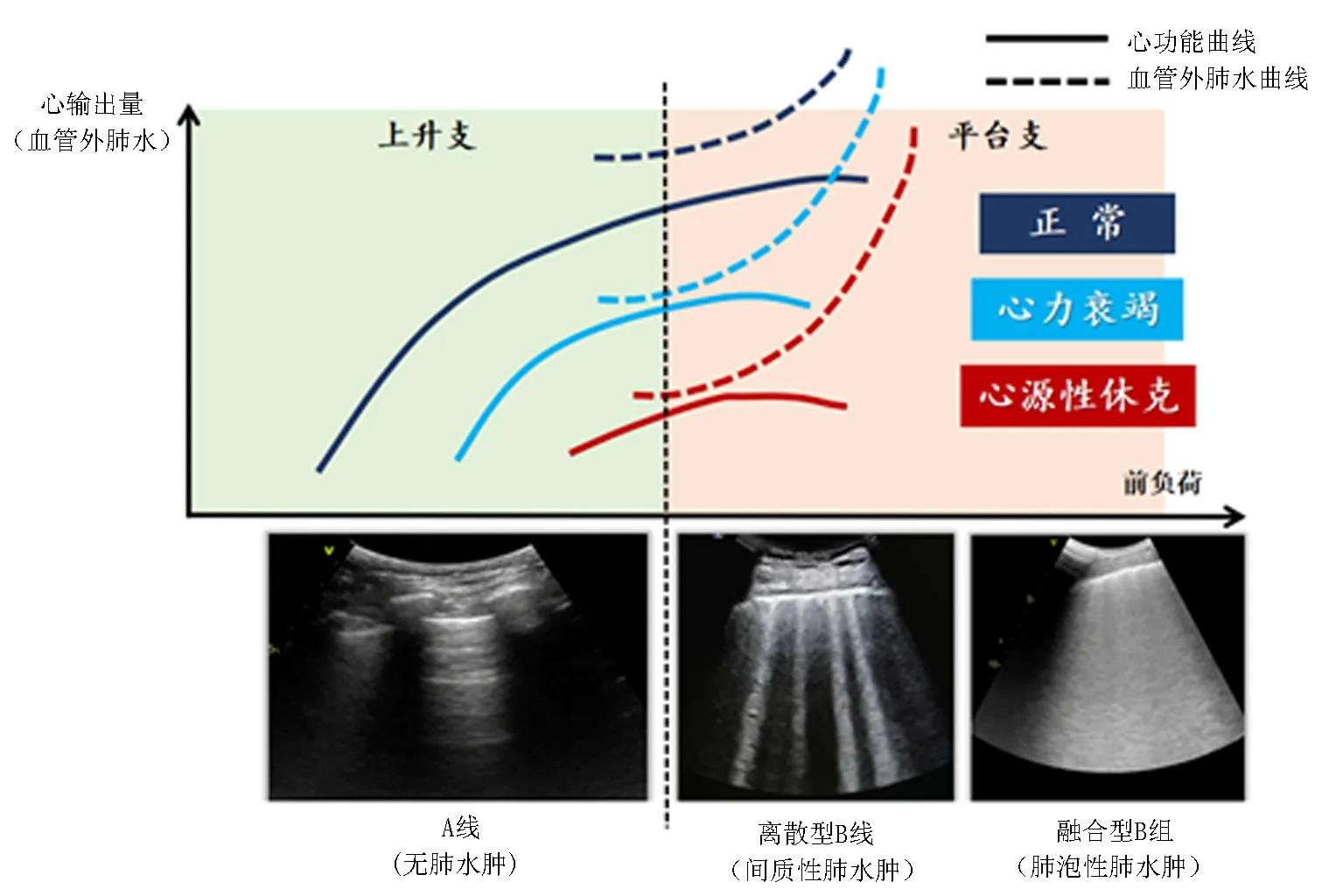
图1 肺超声征象与心功能Frank-Starling曲线及血管外肺水曲线的关系
2 肺超声技术原理与意义
2.1肺超声征象背后的原理 初学者对于肺超声征象局限于简单的记忆,如A线代表肺通气,B线代表肺泡/间质渗出等,但难以鉴别呼吸困难的原因,如肺超声局部肺通气完全丧失导致肺实变,其可能是肺泡腔内炎症渗出,导致肺泡塌陷引起;也可能是急性心力衰竭导致双肺漏出液增多,压迫肺组织不张。再如,肺超声检测出同样是以肺部B线为主的呼吸困难,进一步观察胸膜形态、胸膜滑动性等因素,可作为鉴别B线原因以及评估肺通气功能的依据[5]。
A线和B线均为超声伪像,系因气体存在,气体与胸膜、肺间质等存在较大的声阻抗差异,因此声波无法完全透声而产生伪像。A线代表胸膜后方气体而非正常肺,气胸、慢性阻塞性肺疾病、肺大疱等疾病亦可表现为A线,需进一步通过肺超声其他特征予以鉴别。B线产生是因为肺间质增厚,当肺间质厚度达到超声仪器分辨率(通常为1 mm)时,B线产生取代A线。B线的数量、分布和密集程度反映了整体或局部肺组织病变的特征,离散型B线提示肺间质水平的渗出或病变,融合型B线提示肺泡水平的渗出或病变,B线数量越多、分布越密集,提示肺组织内充气减少程度越重[1]。
肺实变亦称为“肝样变”“肺组织样征象”,系因局部肺组织内气体几乎完全吸收,无气体干扰的超声波可顺畅穿透,因此显示出如同肝脏组织一样的肺脏。肺实变可发生于大叶性肺炎、大量胸腔积液压缩、肿瘤压迫或痰痂阻塞导致阻塞性肺不张等。
2.2心源性肺水肿的肺超声特征及意义 肺超声直观征象与其背后所反映的病理生理学结合越密切,则这项技术为临床诊疗提供的信息就越广泛和深入。肺超声由A线-B线-实变-胸腔积液的演变过程,反映的是局部肺组织范围内肺泡腔的集体“失充气化”的过程,即通气范围减少、液体渗出增多。然而B线仅反映肺间质增厚,从多种肺间质病变中区分出心源性肺水肿需要结合B线的分布特点、胸膜特点、下腔静脉和心脏超声的静态与动态特点等进行综合分析,见表1。

表1 心源性肺水肿的心肺超声特征
对于突发急性心肌梗死、急性左心衰竭等患者,因喘憋、端坐呼吸、接受辅助通气等因素,计算机断层扫描技术(computer tomography,CT)不便于床旁,因此需借助超声和胸片完成影像学检查。研究[11]显示,肺超声较胸片有更高的敏感性(91.05% vs 60.16%)、特异性(91.18% vs 66.67%)、阳性预测值(92.56% vs 68.52%)和阴性预测值(89.42% vs 58.12%)。荟萃分析[12]显示,急诊入院患者急性心力衰竭的诊断中,肺超声较其他影像学工具和实验室指标有更高的敏感性(85.3%)和特异性(92.7%),其次为超声心动图,高于B型钠尿肽(B-type natriuretic peptide,BNP),N-末端B型钠钠尿肽前体(N-terminal pro BNP,NT-proBNP)、胸片、生物电阻抗技术等。而肺超声和超声心动图同属一种技术,且左室扩张、左室舒张功能减低等参数可强化肺超声的鉴别诊断,因此,床旁心肺超声一体化检查对价值意义重大。2021年,“ESC急性和慢性心力衰竭诊断和治疗指南”首次将肺超声纳入新发急性心力衰竭诊断流程[13],见图2。
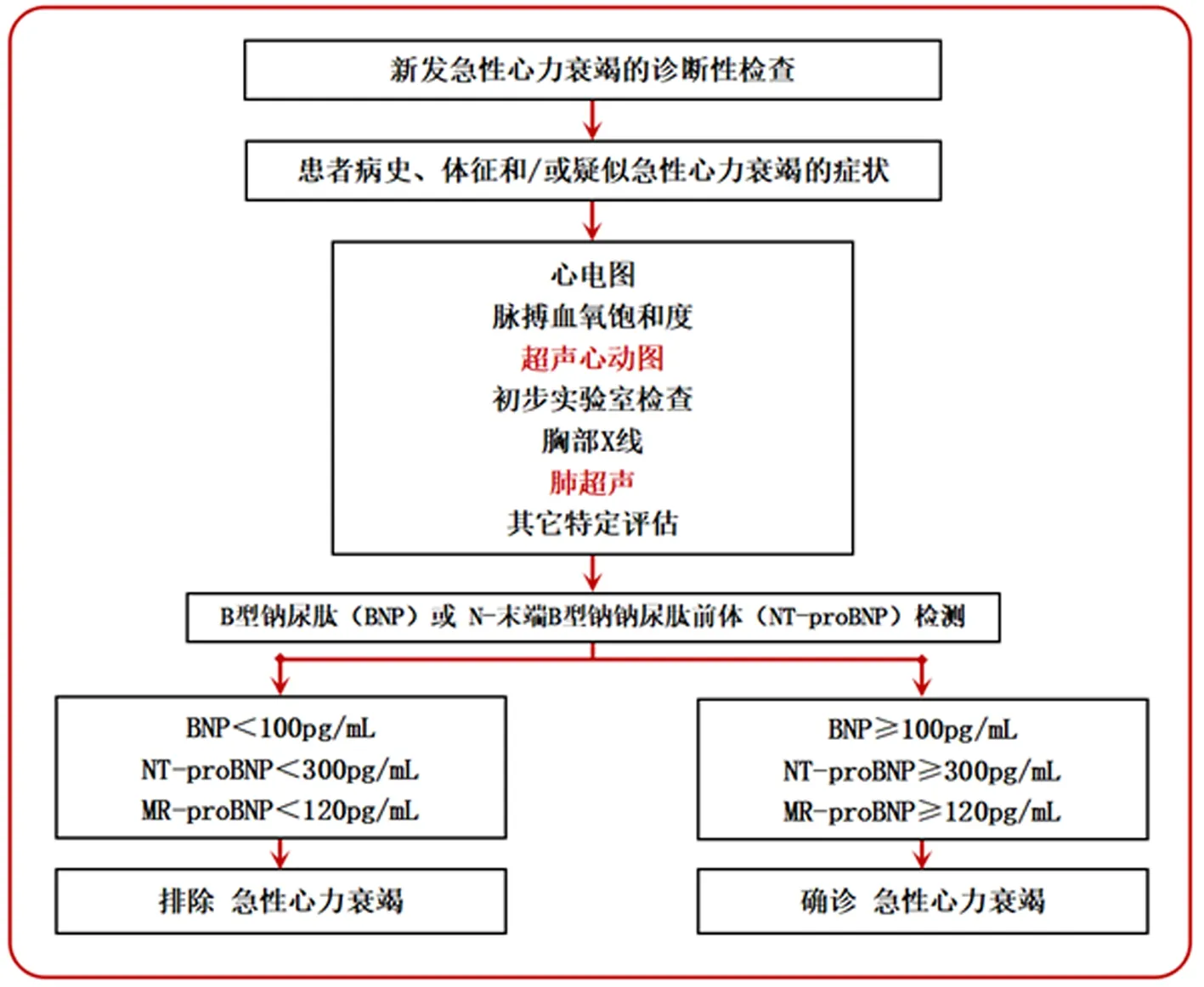
图2 2021版“ESC急性和慢性心力衰竭诊断和治疗指南”对新发急性心力衰竭诊断检查的建议[13]
3 肺超声在心脏急重症疾病合并肺水肿中的应用
肺超声在心脏急重症疾病合并肺水肿中的应用价值逐渐被越来越多的临床医师所认可。然而,仅会用肺超声看B线还远远不够,鉴别肺水肿的类型和来源,对诊疗决策制定有更大的意义。突发急性心肌梗死或急性左心衰竭导致的心源性肺水肿、全身炎症反应继发脓毒症休克、进而破坏肺组织结构造成急性肺损伤(肺源性肺水肿),或合并脓毒症心肌病后心源性和肺源性肺水肿同时存在,肺超声应如何从血流动力学入手进行评估,需将技术和理念进行深度融合[1-2]。
3.1肺超声在心源性肺水肿中的应用 目前,相关心力衰竭指南逐渐将肺超声纳入诊断和评估范畴[13-14],然而对肺超声的应用方法描述较少。单纯在心力衰竭患者的肺超声中对B线计数作为肺水肿严重程度评估是不严谨的,这是因为,一些危重的慢性心力衰竭患者合并肺炎较常见,其肺内B线可能是炎症渗出导致,而非静水压增高。因此,明确肺水肿的特征尤为重要。赵浩天等[9]使用联合心肺超声对肺水肿和肺炎构建鉴别诊断模型显示,双肺连续性 B模式、双肺对称性 B模式、≥1个胸腔积液区、左室射血分数(left ventricular ejection fraction,LVEF)<50%、左室充盈压>14是心源性肺水肿的危险因素(OR>1),而≥1个肺实变区、≥1个胸膜滑动消失区是肺炎的危险因素(OR>1),并根据β积分法构建了简易评分方案[6](图3)。根据该简易评分,对床旁鉴别急性呼吸困难类型有着准确、快速等优点。

图3 基于心肺超声鉴别诊断模型评分法对急性呼吸困难的鉴别诊断流程[6]
3.2肺超声在脓毒症/脓毒症休克合并肺水肿中的应用 脓毒症/脓毒症休克基于全身炎症反应可造成多器官损伤,对肺脏的损伤包括破坏肺泡和肺毛细血管结构,从而增加肺渗透性导致肺水肿(肺源性)[15-16];对心脏的损伤常为脓毒症诱导的心功能障碍(sepsis induced myocardial dysfunction,SIMD),其中最常见的类型是心尖球形综合征,还有左心弥漫抑制、全心弥漫抑制及心肌节段性抑制等类型。对脓毒症/脓毒症休克患者应重视使用超声心动图日常检测心肌运动状态,可及时、高效地发现是否合并SIMD,从而第一时间给予针对性治疗[17]。
脓毒症休克患者病情复杂,其肺部渗出可能兼有炎症、静水压性肺水肿和渗透性肺水肿多种因素相混合,因此,当脓毒症休克患者早期肺部仅局灶性渗出病灶,短时间内快速进展为双肺弥漫渗出时,应警惕合并急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的可能,需立即通过超声对心脏和下腔静脉进行检测,明确是否合并心源性因素加剧肺组织渗漏。肺超声B线及评分对脓毒症休克患者肺内渗出诊断准确性较高,且和有创血流动力学监测指标血管外肺水指数、氧合指数等重要指标相关性良好。研究[18]显示,肺超声评分与氧合指数呈负相关性(r=-0.794),与血管外肺水指数呈正相关(r=0.845)。
3.3肺超声在鉴别心源性和肺源性肺水肿中的应用 不同类型的肺水肿其病理生理学原因差异较大,心源性肺水肿和以ARDS为首的肺源性肺水肿是临床常见的导致急性呼吸衰竭,甚至休克的肺水肿类型。心源性肺水肿基于左心功能不全和容量过负荷失衡,淤积在肺循环内的液体在静水压的驱动下进入肺组织;而ARDS是基于各种肺内或肺外因素导致肺泡上皮细胞和肺毛细血管内皮细胞破坏,即“门户开放”,血管内液体渗漏至血管外肺组织[9]。心源性肺水肿的发生使小叶间隔增厚,而对胸膜及胸膜下间质并无实质性破坏,因此,双肺弥漫对称的B线、胸膜光滑且滑动良好是其典型肺部超声表现[3-6, 11-13];ARDS其肺部渗出的不对称性、多发局灶性和重力依赖性等特征与肺组织损伤的不均一性相符合,且下肺或背部的实变/B线明显多于上肺等无规律性特征,是其肺超声特点[3-19]。进一步联合超声心动图可强化鉴别诊断效能。超声发现,左心室扩张、左心室舒张功能减低伴或不伴收缩功能减低、左室充盈压增高、左房压增高及下腔静脉扩张固定等证据[8-9],是进一步佐证心源性肺水肿的有力证据[6]。而排除以上左心源性因素,如左心功能良好、下腔静脉纤细等,可佐证该病例的肺部渗出是基于肺内渗透性增加、而非静水压增高引起。
3.4联合心肺超声在撤机相关性肺水肿(weaning-induced pulmonary oedema,WIPO)中的应用 机械通气患者撤机失败发生频繁,其常见原因可简述为,A(airway):气道原因;B(brain):脑功能原因;C(cardic):心功能原因,左心功能不全患者撤机后诱发肺水肿;D(diaphragm)膈肌原因,系长时间、高参数机械通气导致的膈肌废用性萎缩;E(endocrine):内分泌激素原因[20-21]。其中,心功能原因导致的心源性撤机失败,其原理是机械通气撤离后,胸腔内正压变为生理性负压,从而降低右心室的后负荷,促使静脉回流增加。当合并左心功能不全时,撤机引起的静脉回流增加可看作是“自体补液”,因此,引起肺水肿导致呼吸困难和再次机械通气。
不同研究[22-23]显示,心源性撤机失败在重症监护病房内撤机失败患者中占21%~87%。因此,尝试撤机拔管前,联合心肺超声和心肌酶学指标检查尤为重要[24]。超声发现,撤机前双肺以A线为主(提示肺通气尚可)、心脏结构和功能无明显异常(心功能储备良好)是撤机安全性的基础。当超声发现左心功能不全,且自主呼吸试验(检验患者对撤机的耐受性)期间,前胸壁出现B线取代A线的动态演变,则高度提示WIPO发生,应立即停止撤机决策,以改善心功能为治疗方向,以备下一次安全撤机。Ferre等[25]研究显示,在机械通气转向自主呼吸后,前胸壁4区域内B线数量增幅≥6条对预测WIPO的曲线下面积(ROC)为0.91(敏感性88%,特异性88%)。国内学者[26]使用超声观察撤机患者双侧前胸壁区域,在自主呼吸试验第15 min和第0 min对比,肺超声评分的增幅>1.5分对预测撤机失败的ROC为0.793(敏感性77.08%,特异性67.19%),将心、肺、膈肌超声参数联合评估其ROC为0.914。以上两项研究的亮点均是评估肺超声动态变化,即撤机前、后胸前区B线数量对比,从而预测WIPO发生的可能。
与左心室射血分数(left ventricular ejection fraction,LVEF)比较,代表舒张功能及左室充盈压力的E/e’参数对心源性撤机失败更敏感。有研究[25]显示,发生WIPO的患者在撤机前后E/e’较前明显增加[(10.6±3.7) vs (9.2±3.2)],而非WIPO组间变化不明显[(9.2±4.3) vs (9.1±4.4)]。另一项前瞻性观察性研究[27]发现,撤机失败组较成功组有更高的E/e’[10.9(8.7~18.0) vs 7.7(6.4~10.6)]。另两项研究[28-29]均显示,撤机失败组具有较高的E/e’,而两组间LVEF与撤机成败无关。
3.5联合心肺超声对肺水肿相关血流动力学的评估 左心功能被认为是肺水肿产生的前提,正常的肺循环是一个低压环境,当容量负荷超出左心耐受力后,肺循环淤血可导致压力增高,进而肺水肿产生。因此,双肺显示为A线(无B线)与肺循环内低嵌顿压环境有关[7]。右心功能在肺水肿形成中同样意义重大[10]。当左心室收缩功能减退、右心室收缩功能正常时,右心室每搏输出量高于左心室每搏输出量,进而在每次心动周期内,右心室推送的血液无法被左心室完全接纳,导致肺循环内液体积聚。在这个过程中,存在右心功能和左心功能失耦联的状态,是肺水肿形成的重要因素。此外,一些特殊情况导致右心室发生应激而收缩性能增强,也可能会导致肺水肿的发生[10]。
联合心肺超声并不仅是简单的将心脏超声和肺超声的指标罗列在一起,而是应探究其内在联系,如心脏问题是否影响到肺,肺的问题是否影响到心脏等。左心和右心不协调,也是导致夹在二者中间的肺脏发生病理变化的重要原因之一。右心和肺水肿互为影响关系,肺水肿的本质是肺循环容量过负荷,会引起肺动脉压力,即右心室后负荷的升高,从而导致右心室结构和功能的改变。右心室是心脏四个腔室里面唯一可发生急性扩张的心腔,右心室的斜形肌纤维结构对前负荷(容量负荷)或后负荷(肺动脉压力)的突然改变表现出较差的耐受能力,可发生收缩和舒张功能减低、腔室扩张等变化,进而造成中心静脉压增高和体循环淤血,导致血流动力学进一步恶化。
3.6肺超声对指导肺水肿治疗措施制定中的应用 肺超声可用于每日定性和定量评估肺水肿,并指导清除治疗。床旁肺超声可每日多次对肺水肿患者的肺部进行动态可视化监测,在初期门诊或急诊科就诊的急性呼吸困难患者中,第一时间使用联合心肺超声对心功能、肺部渗出和血流动力学状态予以评估[2]。当确诊为心源性肺水肿后,立即予以针对性利尿脱水治疗。在此期间,心肺超声应用于每日1次或多次评估。心肺超声征象与肺水肿疗效有较高的相关性[30],双肺B线数量减少甚至转为A线、下腔静脉内径减小及变异率增大、左心内径减小等超声征象变化高度提示脱水治疗有效。当双肺呈A线、下腔静脉塌陷时,应立即停止脱水,以防低血容量发生。
4 小结
心脏和肺脏均为全身血流动力学的氧输送器官,二者发挥协同作用为全身氧耗器官供血供氧。心肺超声是临床医师的“眼睛”,临床思维理念和逻辑是“大脑”。融入心肺血流动力学和病理生理学理念的心肺联合超声技术对急性呼吸-循环功能障碍患者的诊疗意义重大,可第一时间发现问题并探寻病因、协助制定治疗决策方向、治疗节点内重复观察对比疗效并调整策略,最终达到对心肺疾病患者的“滴定式”血流动力学优化,提供更加实时、合理和准确诊疗方案。

