非诺贝特对酒精性肝病患者肝脏巨噬细胞极化及肝纤维化指标的影响
任玲玲 陈芳玲 陈 益 王立明 陈光兰
酒精性肝病是由长期大量饮酒引起的、以肝细胞炎症或坏死为主要病理变化的肝病类型,病情迁延可进展至酒精性肝纤维化、肝硬化甚至肝衰竭,严重影响患者的生活质量[1]。目前临床治疗酒精性肝病尚无特效药,主要通过戒酒、锻炼和对症支持等方法缓解病情,但疗效不够理想[2]。近年来研究发现,除肝星状细胞外,肝脏巨噬细胞也是肝脏炎症反应的效应细胞,且在肝纤维化的发生和进展过程中发挥着重要作用[3]。研究表明,激活过氧化物酶体增殖物激活受体α(PPARα)可干扰激活蛋白-1(AP-1)/NF-κB 信号通路,从而抑制组织因子及促炎因子产生,增强肝脏巨噬细胞的抗纤维化作用,进而拮抗肝纤维化进程[4]。非诺贝特是临床上常用的调脂类药物,其亦是PPARα 激动剂。既往的研究报道多集中于非诺贝特治疗非酒精性脂肪性肝病方面[5],而关于非诺贝特治疗酒精性肝病的报道较少。基于此,本研究探讨了非诺贝特对酒精性肝病患者肝脏巨噬细胞极化及肝纤维化指标的影响,旨在为临床治疗提供更多参考。
1 研究对象与方法
1.1 研究对象
选择2018 年1 月至2022 年9 月丽水市第二人民医院住院治疗的100 例酒精性肝病患者作为研究对象,采用奇偶数字法将患者分为研究组和对照组,每组各50 例。纳入标准:(1)18~80 岁;(2)符合《酒精性肝病诊疗指南 (2010 年1 月修订)》[6]中的诊断标准;(3)B 超下经皮穿刺肝脏活体组织检查结果示存在肝纤维化病变,肝纤维化分期为S1~S2 期[7]。排除标准:(1)入组前1 个月内接受酒精性肝病相关治疗;(2)合并病毒性肝炎、肝硬化等其他类型肝病,或为非酒精性脂肪性肝病;(3)合并严重的心脑血管疾病、自身免疫病或恶性肿瘤;(4)近1 个月内使用过其他影响本研究结果的药物;(5)妊娠期或哺乳期妇女;(6)患有精神、认知等障碍;(7)过敏体质或对非诺贝特过敏;(8)依从性差。剔除标准:(1)治疗期间失访;(2)无法坚持戒酒、饮食控制及锻炼;(3)因病情反复等原因中断治疗。
研究组50 例中男性36 例,女性14 例;年龄23~72 岁,平均年龄为(51.45±8.79)岁;平均BMI 为(27.35±3.12)kg/m2;持续饮酒年限5 ~31年,平均持续饮酒年限为(18.58±9.37)年;每日乙醇摄入量80~160 g,平均每日乙醇摄入量为(115.23±23.98)g;病程3~8 年,平均病程为(6.49±1.24)年;肝纤维化分期S1 期19 例,S2 期31 例;有吸烟史24 例。对照组50 例中男性38 例,女性12例;年龄25~78岁,平均年龄为 (52.31±8.83)岁;平均BMI 为(27.21±3.14)kg/m2;续饮酒年限5~32 年,平均持续饮酒年限为(18.62±9.33)年;每日乙醇摄入量84~158 g,平均每日乙醇摄入量为(114.98±23.85)g;病程3~9 年,平均病程为(6.57±1.26)年;肝纤维化分期S1 期18 例,S2 期32 例;有吸烟史22 例。2 组在性别、年龄、BMI、持续饮酒年限、每日乙醇摄入量、病程、肝纤维化分期和吸烟史方面的差异均无统计学意义(P均>0.05)。所有入组患者均知情并签署同意书,本研究经医院医学伦理委员会审批通过(批件号:20230068)。
1.2 治疗方法
对照组入组后进行常规干预治疗,即戒烟、戒酒、低脂饮食及适量运动,补充维生素和微量元素,进行保肝、降酶治疗;对于Maddrey 判别函数评分(MDF)>32 分或终末期肝病模型(MELD)评分>20 分的患者,给予糖皮质激素治疗[8-9]。研究组在对照组的基础上口服非诺贝特片(由江苏恩华药业股份有限公司生产,国药准字H32022964,规格0.1 g/片),饭后服用,每次1 片,每日3 次,连续治疗2 个月。
1.3 观察指标
1.3.1 临床疗效判定 显效指治疗结束后患者恶心呕吐、食欲减退、乏力、腹痛、体重减轻等临床症状均完全消失,肝功能指标水平降至正常范围,肝纤维化症状消退;有效指治疗结束后患者临床症状显著改善,肝功能指标水平显著下降,肝纤维化症状减轻;无效指治疗结束后患者的临床症状、肝功能指标、肝纤维化症状均无显著改善[6,8]。
1.3.2 肝脏巨噬细胞的分离与培养 参考文献10进行肝脏巨噬细胞的分离与培养[10]。B 超引导下行肝穿刺活体组织检查,获取肝组织,用含10%肝素的生理盐水洗涤;用镊子划碎组织并装入试管,以0.05%胶原酶Ⅱ消化,37 ℃孵育40 min,用200目细胞筛过滤;PBS 溶液稀释,4 ℃下2 000 r/min离心10 min,弃上清;取沉淀,PBS 溶液冲洗2 ~3 次,每次5 min;将Percoll 细胞分离液(购自北京百奥莱博科技有限公司,货号:SY0531)与PBS 溶液以9 ∶1 比例混合,4 ℃下3 000 r/min 离心30 min;吸出白膜层后,PBS 溶液冲洗,得到单个核细胞;以含GM-CSF 因子的10%胎牛血清1640 培养基重悬细胞,置于6 孔板内,于37 ℃、5% CO2培养箱内培养7 d。
1.3.3 肝脏巨噬细胞表型检测 采用流式细胞术检测肝脏巨噬细胞的表型。收集培养7 d 后的肝脏巨噬细胞,以F4/80-PE 和CD11B-FITC 标记M1 型巨噬细胞,以F4/80-PE 和CD206-FITC 标记M2 型巨噬细胞,流式抗体购自美国Sigma 公司,4 ℃下孵育3 min;PBS 溶液冲洗3 次,每次5 min;用PBS溶液重悬后,使用流式细胞仪(购自美国BD 公司,型号:FACSCalibur)检测,应用CellQues Pro 软件进行分析。
1.3.4 肝组织中M1 型和M2 型巨噬细胞标志物水平检测 采用蛋白质印迹法测定肝组织中M1 型和M2 型巨噬细胞标志物水平。取肝组织,采用RIPA法充分裂解;4 ℃下4 000 g 离心15 min,收集上清液,采用BCA 法进行蛋白质定量;行常规电泳,湿法转至PVDF 膜,5% BSA 封闭;滴加一抗,分别为抗诱导型一氧化氮合酶(iNOS)抗体(1 ∶1 000)、抗IL-1β 抗体(1 ∶3 000)、 抗IL-10 抗体(1 ∶3 000)、抗精氨酸酶-1(Arg-1)抗体(1 ∶1 000),以抗β-肌动蛋白(β-actin)抗体(1 ∶5 000)作为内参,以上抗体均购自美国Abcam 公司;4 ℃孵育过夜,TBST 洗膜3 次,每次5 min;滴加与一抗同种属二抗(1 ∶5 000),室温孵育2 h;TBST 洗膜3 次,每次5 min;使用ECL 发光液(购自北京凯诗源生物科技有限公司,货号:My35737)进行化学发光,使用凝胶成像仪(购自美国GE 公司,型号:ImageQuant100)显像,应用Image ProPlus 6.0 软件对条带灰度值进行分析。iNOS 和IL-1β 为M1 型巨噬细胞标志物,IL-10 和Arg-1 为M2 型巨噬细胞标志物。
1.3.5 实验室指标测定 分别于治疗前及治疗后抽取入组患者清晨空腹静脉血5 mL,3 000 r/min 离心10 min(离心半径10 cm),分离血清和血浆,在-20 ℃下保存待测;使用全自动生物化学分析仪(购自深圳迈瑞生物医疗电子股份有限公司,型号:BS-350S)测定血清ALT、AST、总胆红素(TBil)、γ-谷氨酰转移酶(GGT)、总胆固醇(TC)和三酰甘油(TG)水平。采用放射免疫法测定血清透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)和Ⅳ型胶原(Ⅳ-C)水平,试剂盒均购自上海钰博生物科技有限公司。
1.4 统计学方法
应用 SPSS 19.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验,组内比较采用配对样本t检验。计数资料以例(%)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 2 组临床疗效比较
经治疗后,研究组中显效21 例,有效23 例,无效6 例,总有效率为88.00% (44/50);对照组中显效13例,有效23例,无效14例,总有效率为72.00%(36/50)。与对照组相比,研究组治疗后的总有效率显著升高,差异有统计学意义(χ2=4.000,P=0.046)。
2.2 2 组肝脏巨噬细胞表型比较
流式细胞术分析结果发现,经治疗后,研究组肝脏巨噬细胞中M1 促炎型巨噬细胞(CD45+F4/80+CD11B-CD86+)的占比显著低于对照组,M2 抑炎型巨噬细胞(CD45+F4/80+CD11BCD206+)的占比显著高于对照组,差异均有统计学意义(P均<0.05)。见图1。
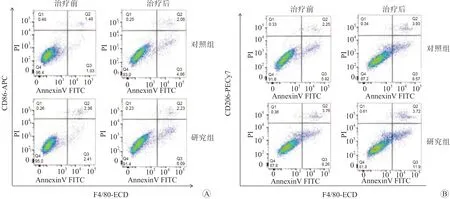
图1 2 组肝脏巨噬细胞表型比较 A M1 促炎型巨噬细胞 B M2 抑炎型巨噬细胞
2.3 2 组肝组织中iNOS、IL-1β 水平比较
治疗前,2 组肝组织中M1 型巨噬细胞标志物(iNOS 和IL-1β)水平的差异均无统计学意义(P均>0.05)。治疗后,研究组肝组织中iNOS、IL-1β 水平均显著低于对照组,差异均有统计学意义(P均<0.05)。见表1、图2。
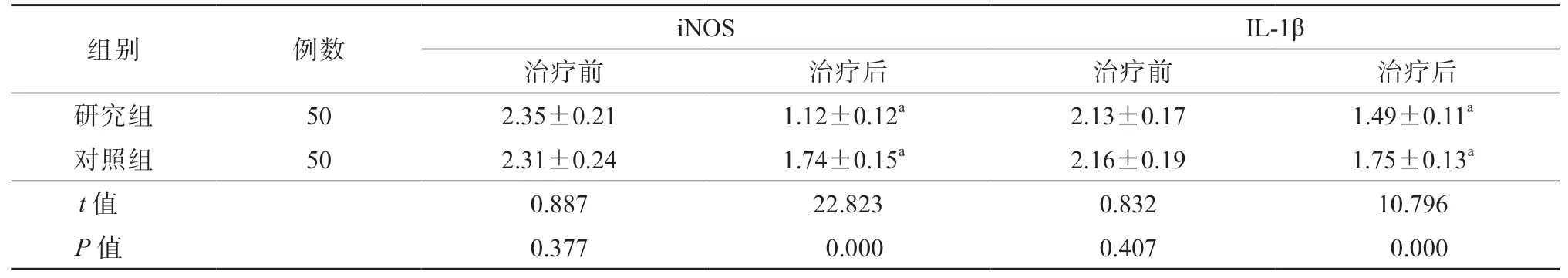
表1 2 组肝组织中iNOS、IL-1β 水平比较
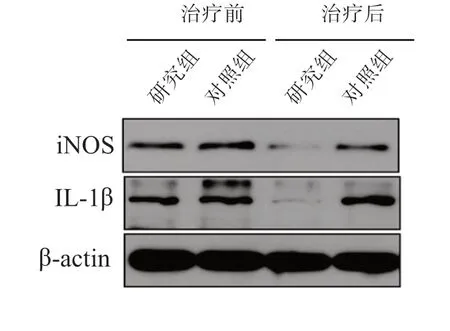
图2 2 组肝组织中iNOS、IL-1β 水平比较
2.4 2 组肝组织中IL-10、Arg-1 水平比较
治疗前,2 组肝组织中M1 型巨噬细胞标志物(IL-10 和Arg-1)水平的差异均无统计学意义(P均>0.05)。治疗后,研究组肝组织中IL-10、Arg-1 水平均显著高于对照组,差异均有统计学意义(P均<0.05)。见表2、图3。
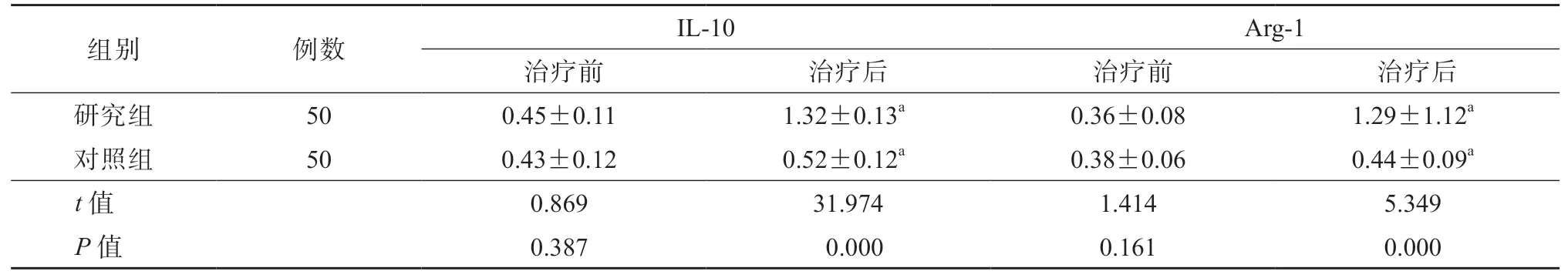
表2 2 组肝组织中IL-10、Arg-1 水平比较

图3 2 组肝组织中IL-10、Arg-1 水平比较
2.5 2 组肝功能指标水平比较
治疗前,2 组肝功能指标(包括ALT、AST、TBil 和GGT)水平的差异均无统计学意义(P均>0.05)。治疗后,研究组血清ALT、AST、TBil 和GGT 水平均显著低于对照组,差异均有统计学意义(P均<0.05)。见表3。
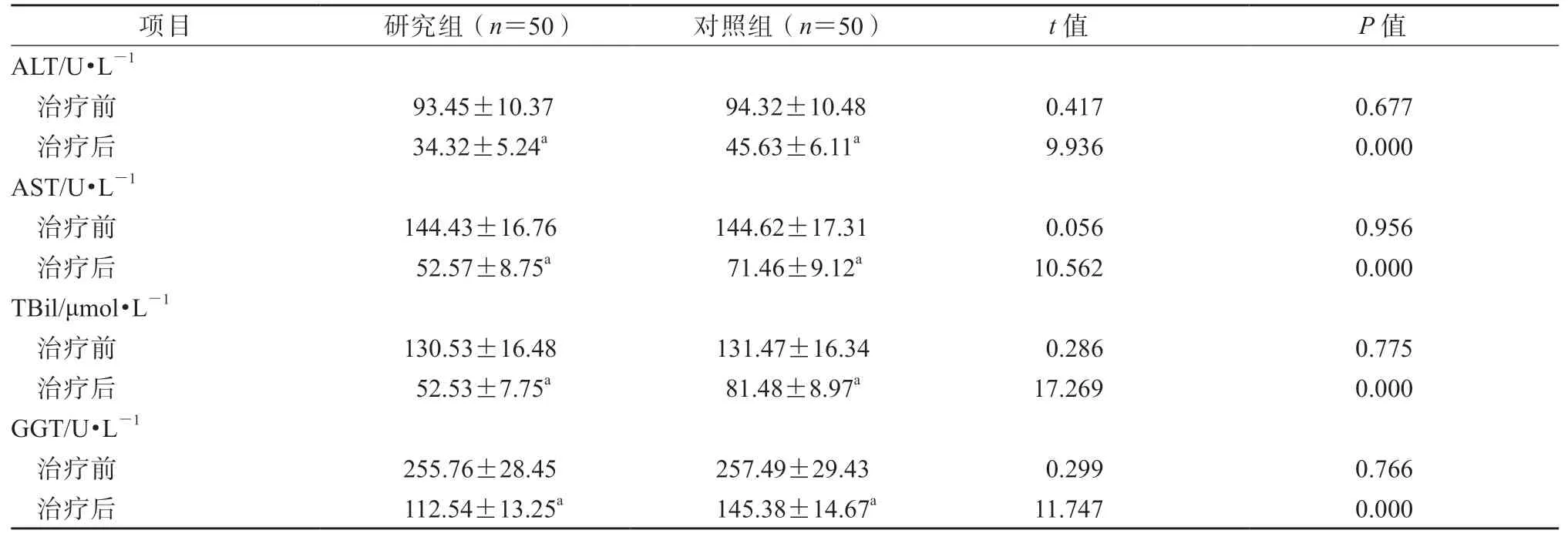
表3 2 组肝功能指标水平比较
2.6 2 组肝纤维化指标水平比较
治疗前,2 组肝纤维化指标( 包括HA、LN、PCⅢ和Ⅳ-C)水平的差异均无统计学意义(P均>0.05)。 治疗后, 研究组血清HA、LN、PCⅢ和Ⅳ-C 水平均显著低于对照组,差异均有统计学意义(P均<0.05)。见表4。
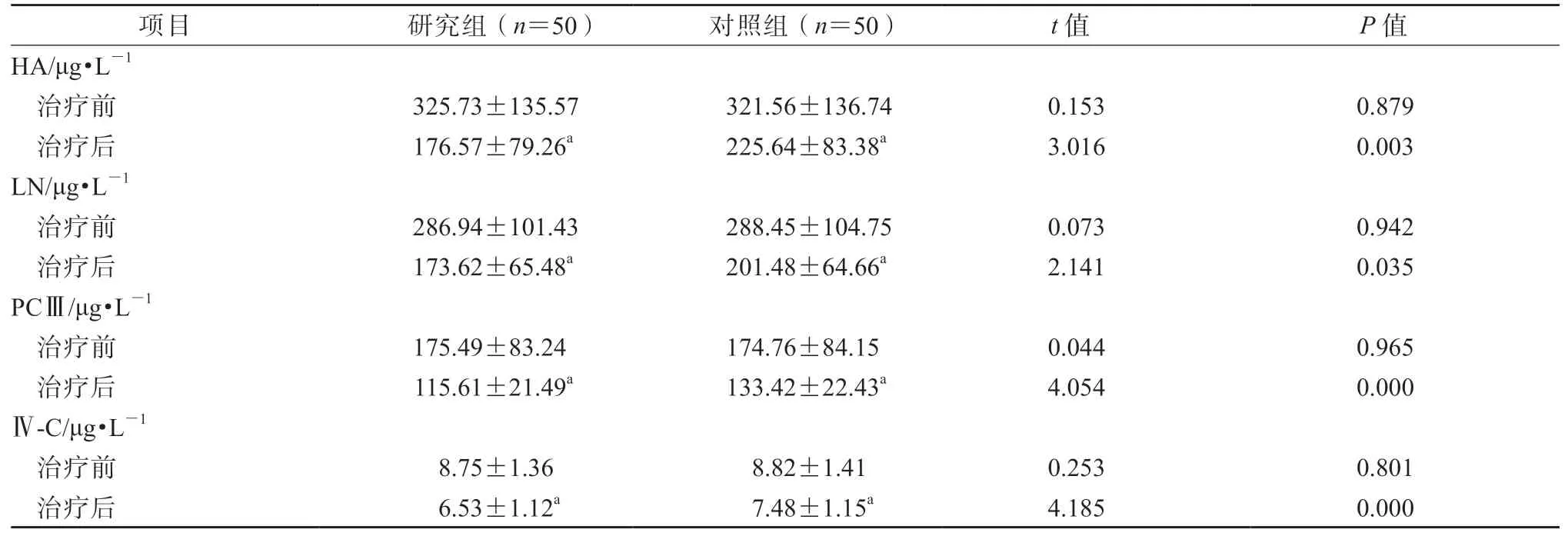
表4 2 组肝纤维化指标水平比较
2.7 2 组血脂指标水平比较
治疗前,2 组血脂指标(TC 和TG)水平的差异均无统计学意义(P均>0.05)。治疗后,研究组血清TC、TG 水平均显著低于对照组,差异均有统计学意义(P均<0.05)。见表5。
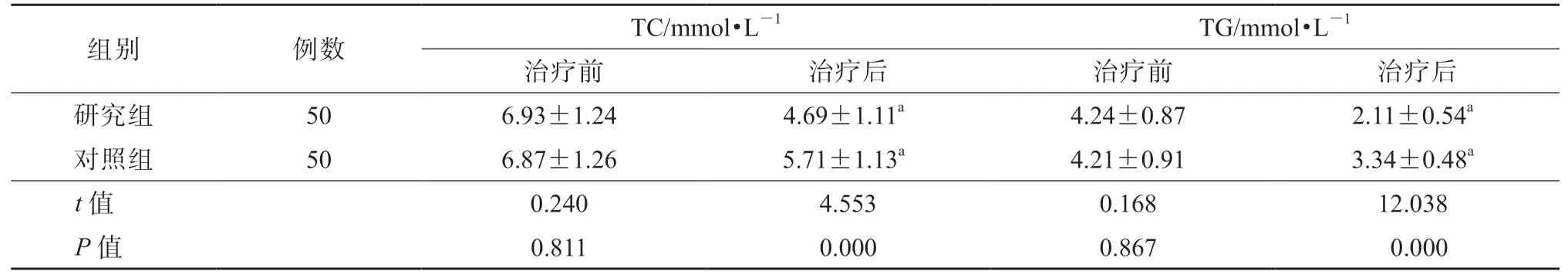
表5 2 组血脂指标水平比较
3 讨论
一项荟萃分析结果显示,全球50%以上肝脏疾病与过度饮酒有关,其中亚洲地区酒精性肝病的患病率为4.81%,且患病率随时间推移呈上升趋势,其可能成为未来亚洲地区慢性肝病的主要原因[11]。研究表明,药物治疗对于酒精性肝病的防治具有一定效果,但其仅能抑制肝纤维化的进展,而无法逆转早期肝纤维化[12]。肝脏巨噬细胞位于肝血窦内,具有显著的异质性和极化性,可发挥调节机体免疫应答、清除体内细菌毒素等作用。近年来研究发现,肝脏巨噬细胞极化在肝脏疾病的发生和进展过程中起着重要作用[13]。有报道称,通过靶向调节肝脏巨噬细胞极化/分化,可减轻由非酒精性脂肪性肝病或酒精性肝病引起的肝脏脂肪变性、炎症反应、肝纤维化和肝硬化[14]。
PPAR 是糖脂质代谢、炎症反应等过程的重要调节因子,研究表明PPAR 激动剂在肝病治疗中具有重要意义[15]。研究发现,通过激活PPARα 可抑制巨噬细胞向M1 型分化,进而减轻炎症反应[16]。非诺贝特是一种选择性PPARα 激动剂。毛重山等[17]研究表明,非诺贝特可有效降低非酒精性脂肪性肝病合并2 型糖尿病患者的血脂水平,并减轻肝纤维化程度。本研究将非诺贝特应用于酒精性肝病患者的治疗,结果发现经治疗后患者血清TC、TG 水平均显著降低,与以往的报道相符[17],这提示非诺贝特可有效改善酒精性肝病患者的血脂水平,其机制可能为非诺贝特通过PPARα 途径促使胆固醇转化为胆汁酸流出,并抑制胆固醇从头合成,从而加速脂肪酸氧化[18]。本研究入组患者的肝纤维化分期为S1~S2 期,属于早期肝纤维化。研究结果显示,经非诺贝特治疗后患者血清肝功能及肝纤维化指标水平均显著改善,且与经常规干预治疗的对照组相比,上述指标显著降低,这提示非诺贝特可能具有逆转早期肝纤维化的作用,并能促进肝功能恢复,这与以往报道结果相符[19]。本研究发现,研究组治疗后肝内固有巨噬细胞中CD45+F4/80+CD11B-CD86+细胞的占比显著低于对照组,CD45+F4/80+CD11B-CD206+细胞的占比显著高于对照组,这提示非诺贝特可能通过抑制肝脏巨噬细胞向M1 型分化,并促进M1 型向M2 型极化,进而改善肝脏纤维化程度。iNOS 和IL-1β 主要由M1 型巨噬细胞分泌,IL-10 和Arg-1 主要由M2 型巨噬细胞分泌。本研究结果显示,治疗后,研究组肝组织中iNOS、IL-1β 水平均显著低于对照组,而IL-10、Arg-1 水平均显著高于对照组,这表明非诺贝特治疗酒精性肝病的作用机制可能与促进肝脏巨噬细胞向M2 抑炎型巨噬细胞分化有关。
综上所述,非诺贝特能够有效降低酒精性肝病患者的血脂水平,抑制肝纤维化进展,改善肝功能,其作用机制可能与调节肝脏巨噬细胞极化有关。本研究仅纳入酒精性肝病伴早期肝纤维化患者,且未对患者的不良反应进行观察和统计,结果存在一定局限性,拟在今后扩大样本量进一步探究非诺贝特的应用价值。

