肝细胞癌切除术后早期复发和转移的危险因素分析及Nomogram 模型构建
高小青 姜胜攀 李 军 胡友涛 孙建斌
肝细胞癌(HCC)是原发性肝癌的常见类型[1]。手术切除是目前治疗HCC 的有效手段,在中国HCC 患者术后3 年、5 年累计生存率分别为41.5%、30.9%[2-3]。HCC 复发和转移是导致患者预后不良的主要原因[4]。探究HCC 切除术后早期复发和转移的影响因素并采取相应措施,对于实现个体化干预和治疗,进而改善患者预后尤为重要。近年来,Nomogram 模型常被用于临床研究。研究表明,Nomogram 模型在预测HCC 患者术后生存率方面的效能较高,但目前的研究主要基于人口统计学和临床病理特征,而临床病理特征相关数据往往只能在手术后获得,仅能代表群体特征,无法体现个体的异质性[5-7]。除临床病理特征外,实验室检查亦在HCC 的诊断和预后评估中具有重要价值[8]。筛选出更有价值的预测因素,并调整各项预测因素所占权重,建立能更好地应用于临床预测HCC 切除术后早期复发和转移的Nomogram 模型已成为临床研究热点。本研究对248 例HCC 患者的人口学、临床病理特征及手术相关资料进行分析,同时结合血常规、血液生物化学和肿瘤标志物检测结果,探讨HCC 切除术后早期复发和转移的危险因素,并构建Nomogram 模型,旨在为临床提供更多参考依据。
1 研究对象与方法
1.1 研究对象
回顾性分析2014 年12 月至2019 年12 月于武汉市第三医院肝胆外科行手术切除治疗的248 例HCC患者的病历资料。纳入标准:(1)18~80 岁;(2)行肝脏肿物完整切除术,术后经组织病理学诊断为HCC[9],且均为初诊、初治;(3)术前未接受放射治疗、化学治疗和射频消融术等;(4)术前无肝内转移或远处转移;(5)术前肝功能Child-Pugh 分级为A 级或B 级[10];(6)临床病理特征资料和实验室检查数据完整。排除标准:(1)术前影像学结果示有肝外器官转移者;(2)严重感染、肾功能不全、免疫系统疾病或血液系统疾病者;(3)合并混合型胆管癌或其他恶性肿瘤者;(4)失访或术后30 d 内死亡者。本研究经医院医学伦理委员会批准(批件号:武三医伦KY2023-028),入组患者的临床病理特征资料和实验室检查数据在分析前均经匿名化处理。
1.2 临床资料收集
基于本院的电子病历数据库,收集入组患者的人口学、临床病理特征及手术相关资料,包括年龄、性别、饮酒史、吸烟史、HBV 感染史、丙型肝炎病毒(HCV)感染史、肝硬化情况、术前肝功能Child-Pugh 分级、手术切除方式、肿瘤数目、组织学类型、肿瘤大小、微血管侵犯情况、TNM 分期、巴塞罗那临床肝癌(BCLC)分期及辅助化学治疗情况等。所有手术切除样本的组织学评估由2 位高年资病理学专家独立完成。
1.3 实验室检查数据收集
所有入组患者均于入院48 h 内采集外周静脉血样本,4 000 r/min 离心10 min,收集上层血清进行血常规、血液生物化学和肿瘤标志物检测。血常规检测项目包括中性粒细胞计数(NEUT)、淋巴细胞计数(LYMPH)和血小板计数(PLT),血液生物化学检测项目包括白蛋白(ALB)、AST、ALT、γ-谷氨酰转肽酶(GGT)、总胆红素(TBil)和C 反应蛋白(CRP),肿瘤标志物检测项目为甲胎蛋白(AFP)。中性粒细胞计数与淋巴细胞计数比值(NLR)= NEUT(×109/L)/LYMPH(×109/L),血小板计数与淋巴细胞计数比值(PLR)= PLT(×109/L)/LYMPH(×109/L),系统免疫炎症指数(SII)= PLT(×109/L)×NEUT(×109/L)/LYMPH(×109/L),C 反应蛋白与白蛋白比值(CAR)=CRP(mg/L)/ALB(g/L), 白蛋白与胆红素比值(ALBI)=-0.085×ALB(g/L)+0.66×lg[TBil(μmol/L)],预后营养指数(PNI)=ALB(g/L)+5×LYMPH(×109/L)。格拉斯哥预后评分(GPS)标准:CRP≤10 mg/L 且ALB≥35 g/L 计0 分;CRP≤10 mg/L 且ALB<35 g/L,或者CRP>10 mg/L 且ALB≥35 g/L 计1 分;CRP>10 mg/L 且ALB<35 g/L 计2 分。
1.4 随访
所有入组患者按照标准方案于术后开始随访。随访频率为术后第1~2 年每3 个月随访1 次,第3~4年每6 个月随访1 次,之后每年随访1 次,随访截至2023 年1 月31 日。随访方式包括门诊复查肝胆脾超声、胸-腹-盆腔CT 扫描和实验室检查 (血常规、肝肾功能及血清AFP 检测等)。上述检查结果显示异常者,进一步行CT 增强扫描、磁共振成像(MRI)检查或正电子发射断层显像-计算机断层摄影(PETCT) 检查,以明确是否存在肝内复发或远隔脏器转移,诊断有困难时考虑行穿刺活体组织检查。
以无复发生存率(RFS)为主要研究结局,即患者自接受手术治疗之日起至术后出现肝内复发或远处转移(包括淋巴结、肺和骨转移等)的时间[11]。
1.5 统计学分析
应用SPSS 23.0 软件对数据进行统计学分析。计数资料以例(%)表示,组间比较采用χ2检验。采用Cox 比例风险回归模型分析HCC 切除术后早期复发和转移的危险因素。基于多因素Cox 比例风险回归模型分析结果,应用R 4.0.3 软件构建Nomogram 模型,计算一致性指数(C-index)。采用ROC 曲线评估Nomogram 模型预测HCC 切除术后早期复发和转移的效能。绘制校准曲线评估Nomogram 模型预测RFS与实际值的一致性。P<0.05 为差异有统计学意义。
2 结果
2.1 HCC 切除术后早期复发和转移情况
随访结果显示,248 例HCC 患者的中位随访时间为37.5 个月(四分位距:23.0~55.0),其中106 例(42.74%)出现肝内复发或转移(设为复发组),将其余142 例患者设为未复发组。入组患者的1 年、3 年和5 年RFS 分别为92.34%(229/248)、66.13%(164/248)和57.26%(142/248)。
2.2 2 组的临床病理特征比较
与未复发组相比,复发组中Child-Pugh 分级为B 级、肿瘤大小≥5 cm、有微血管侵犯、BCLC 分期为B~C 期的患者占比显著升高,差异均有统计学意义(P均<0.05)。见表1。
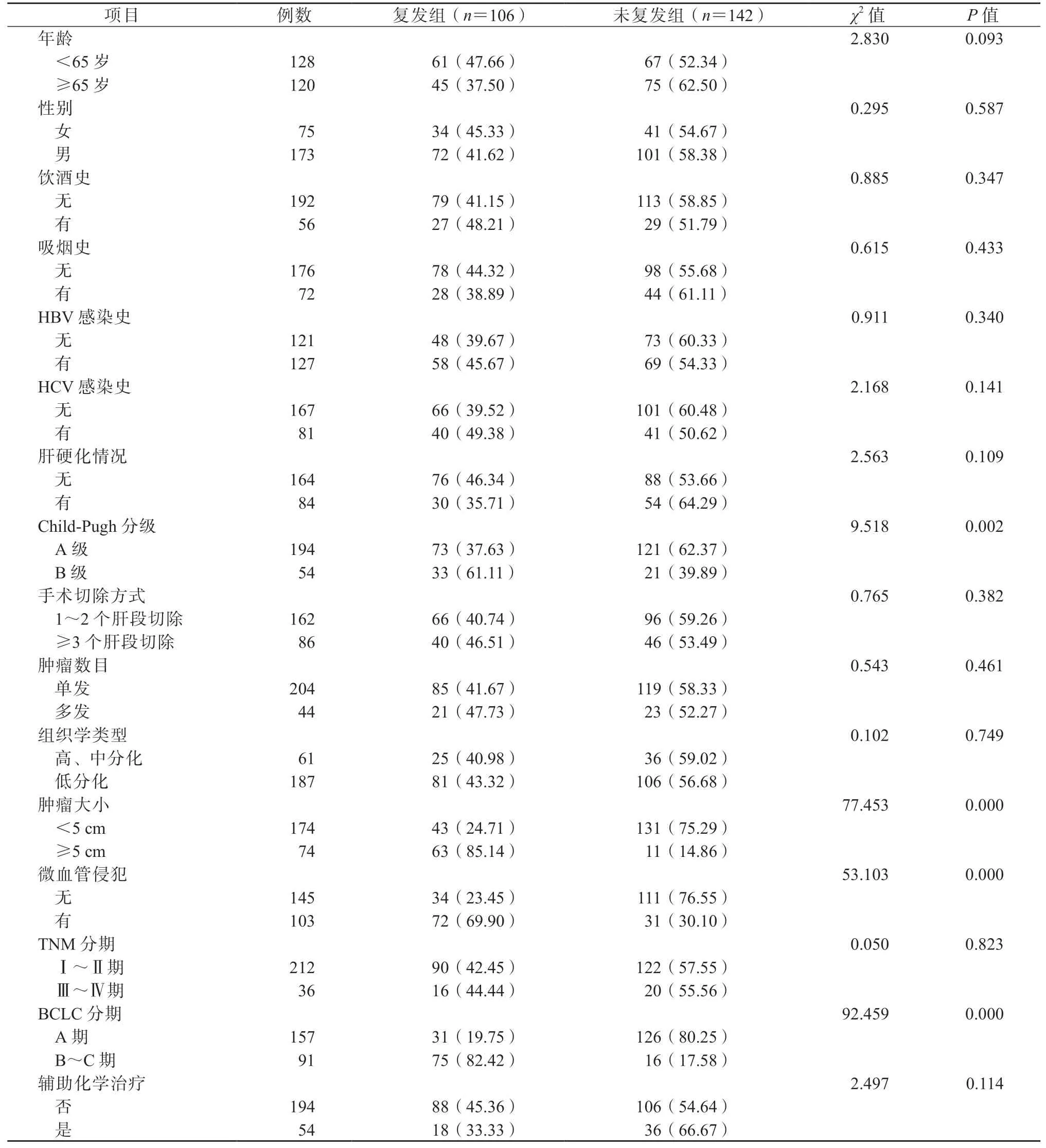
表1 2 组的临床病理特征比较/例(%)
2.3 2 组的实验室检查数据比较
与未复发组相比,复发组中血清AFP≥400 ng/mL、SII≥375.3、AST/ALT≥1.03、ALBI≥-2.24、GGT/PLT≥0.36、PNI≤47.2、PLR≥113.4、NLR≥2.14、CAR≥0.15、GPS 为1~2 分的患者占比显著升高,差异均有统计学意义(P均<0.05)。见表2。
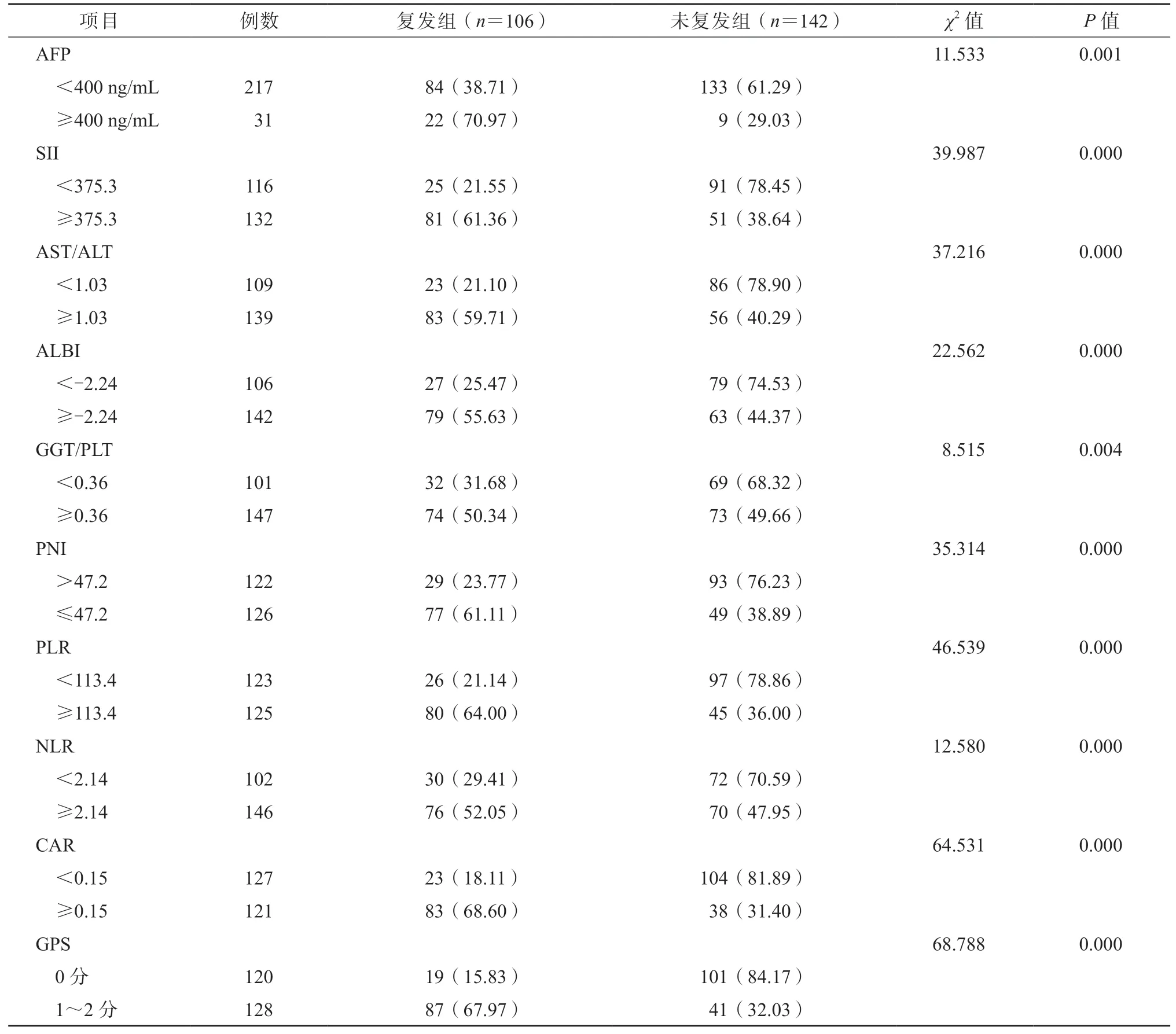
表2 2 组的实验室检查数据比较/例(%)
2.4 影响HCC 术后早期复发和转移的相关因素
将248 例HCC 患者术后早期复发和转移情况作为因变量,将患者的年龄、性别、饮酒史、吸烟史、HBV/HCV 感染、肝硬化情况、Child-Pugh 分级、手术切除方式、肿瘤数目、组织学类型、肿瘤大小、微血管侵犯、TNM 分期、BCLC 分期、辅助化学治疗情况、AFP、SII、AST/ALT、ALBI、GGT/PLT、PNI、PLR、NLR、CAR 和GPS 作为自变量,纳入单因素Cox 比例风险回归模型分析,结果显示Child-Pugh 分级、肿瘤大小、微血管侵犯、BCLC 分 期、AFP、SII、AST/ALT、ALBI、GGT/PLT、PNI、PLR、NLR、CAR 和GPS 均与HCC 切除术后早期复发和转移有关(P均<0.05)。将上述单因素分析中P<0.05 的项目纳入多因素Cox 比例风险回归模型分析,结果显示肿瘤大小、AFP、SII和CAR 均是影响HCC 切除术后早期复发和转移的独立危险因素(P均<0.05)。见表3。
2.5 Nomogram 模型构建
基于多因素Cox 比例风险回归模型分析结果,构建Nomogram 模型(纳入肿瘤大小、AFP、SII 和CAR),测算模型中每个独立危险因素的得分,其中肿瘤大小≥5 cm 项目计98 分,AFP≥400 ng/mL项目计48 分,SII≥375.3 项目计85 分,CAR≥0.15项目计100 分,4 项总和为331 分,故Nomogram模型以331 分为分界点以判断HCC 切除术后是否发生早期复发和转移。总分对应的预测值即为Nomogram 模型对HCC 切除术后早期复发和转移的预测概率。见图1。
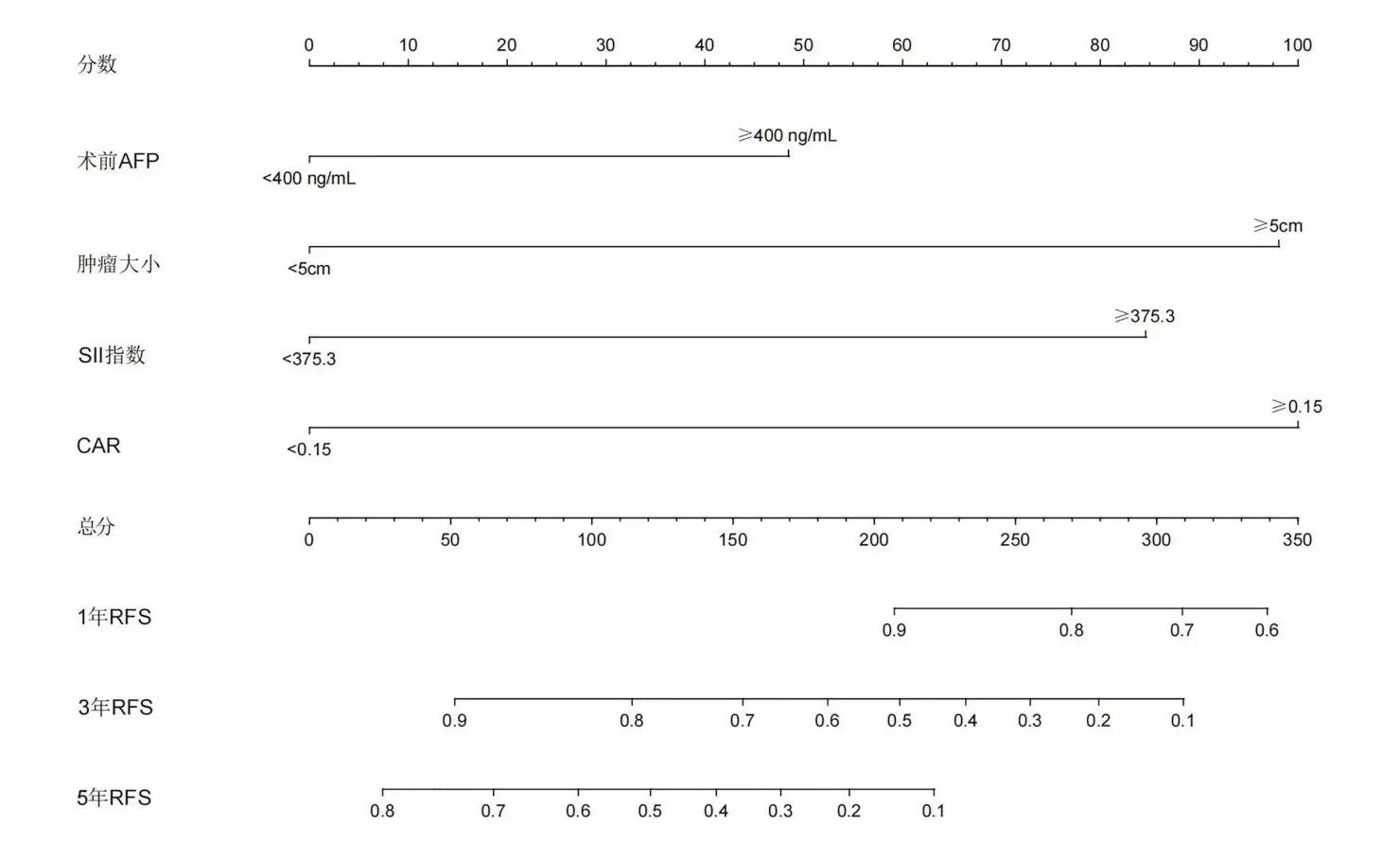
图1 HCC 切除术后早期复发和转移的Nomogram 模型图
2.6 Nomogram 模型评价
Nomogram 模型预测HCC 切除术后早期复发和转移的C-index 为0.787(95%CI:0.693~0.881)。ROC 曲线分析结果显示,Nomogram 模型预测HCC患者术后1 年、3 年和5 年RFS 的曲线下面积(AUC)分别为0.849、0.857 和0.885,敏感度分别为81.48%、84.75%和86.36%,特异度分别为78.46%、80.11%和83.45%,见图2。校准曲线结果显示,Nomogram 模型预测HCC 切除术后患者的1 年、3 年和5 年RFS与实际值的一致性均较好,见图3。
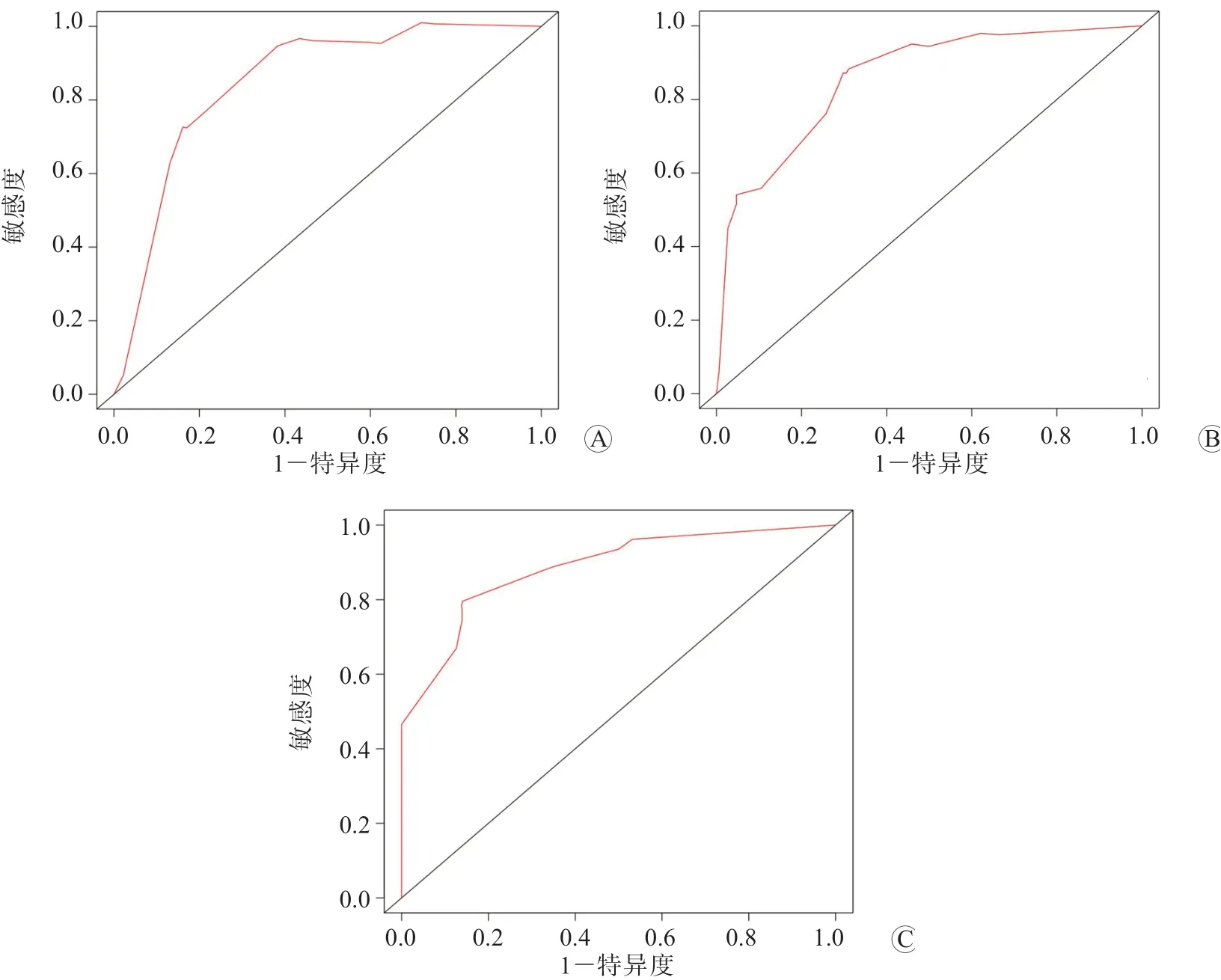
图2 Nomogram 模型预测HCC 切除术后早期复发和转移的ROC 曲线 A 1 年RFS B 3 年RFS C 5 年RFS
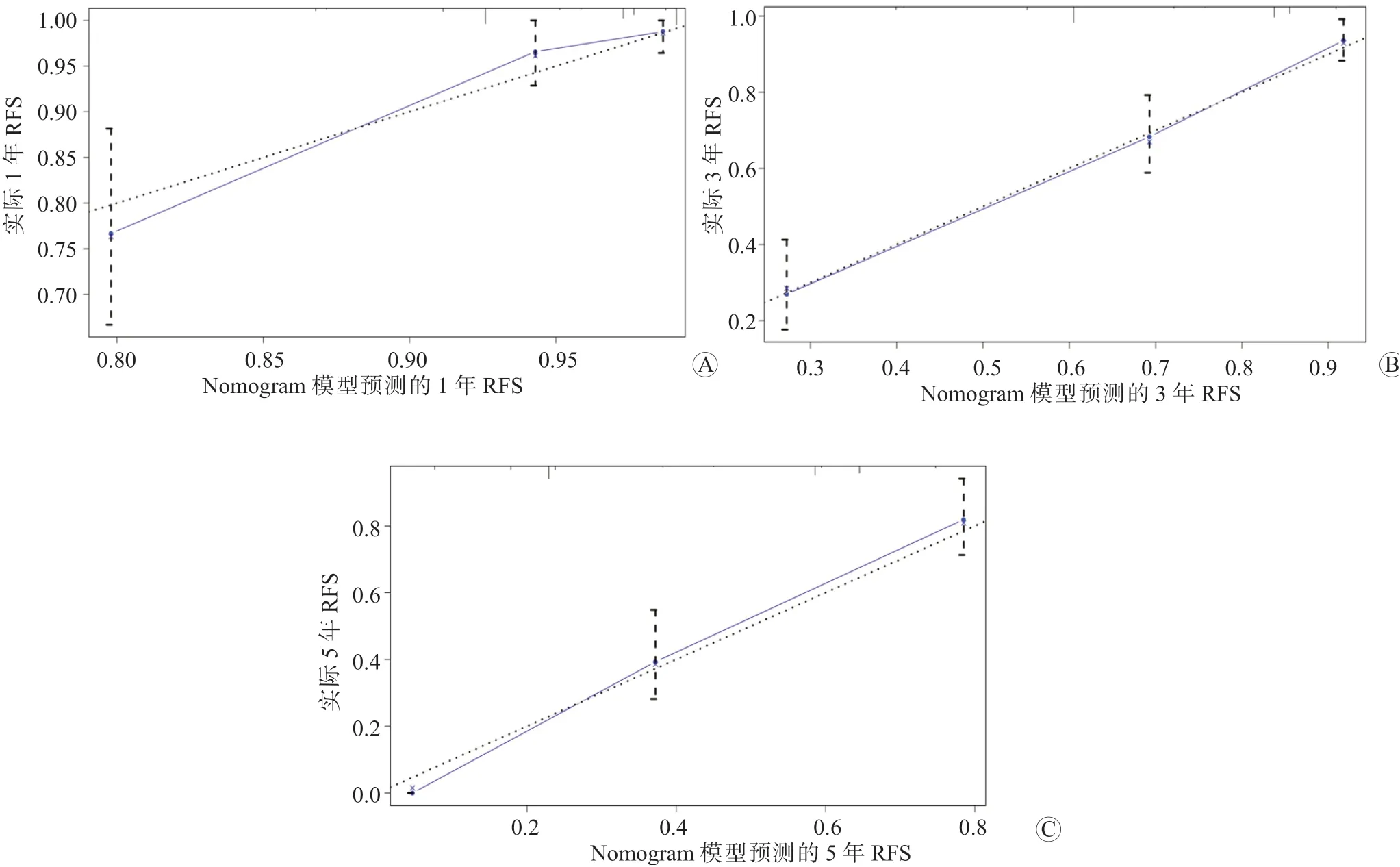
图3 Nomogram 模型预测HCC 切除术后早期复发和转移的校准曲线 A 1 年RFS B 3 年RFS C 5 年RFS
3 讨论
一项单中心观察性、真实世界队列研究结果显示,HCC 患者1 年、3 年和5 年累积生存率分别为64.3%、40.6%和30.7%,1 年、3 年和5 年累积复发率分别为2.7%、47.5%和59.5%,这提示HCC 存在早期诊断率低、根治率低及复发率高等问题[12]。研究表明,HCC 切除术后复发与肿瘤数目、肿瘤直径、血管侵犯、肿瘤分期、分化程度等临床病理特征密切相关[13-14]。临床病理特征主要由手术切除或术前穿刺等方式获取,而实验室检查具有无创性、可重复分析、实时监测等优势。研究发现,临床病理特征联合血清学指标检测对于预测HCC 切除术后复发具有重要意义[15]。
本研究的随访结果显示,248 例HCC 患者的中位随访时间为37.5 个月,患者1 年、3 年和5 年RFS 分别为92.34%、66.13%和57.26%,这与以往的研究报道相符[16]。本研究发现,与未复发组相比,复发组中Child-Pugh 分级为B 级、肿瘤大小≥5 cm、有微血管侵犯、BCLC 分期为B~C 期的患者占比显著升高,这提示Child-Pugh分级、肿瘤大小、微血管侵犯、BCLC 分期与HCC 切除术后早期复发和转移有关。进一步的多因素Cox 比例风险回归模型分析结果显示,肿瘤大小≥5 cm 者术后复发和转移风险是<5 cm 者的3.192 倍,这提示肿瘤大小是影响HCC 切除术后早期复发和转移的独立危险因素。既往研究表明,SII、PLR、NLR 和PNI等可作为反映炎症-免疫-营养过程的血清学指标,可用于评估HCC 患者的预后情况[17]。近年来亦有文献报道,ALBI、AST/ALT、GGT 和PLT 等血液生物化学指标在HCC 的诊断和预后评估中具有重要的临床价值[18]。本研究结果显示,与未复发组相比,复发组中血清AFP≥400 ng/mL、SII≥375.3、AST/ALT≥1.03、ALBI≥-2.24、GGT/PLT≥0.36、PNI≤47.2、PLR≥113.4、NLR≥2.14、CAR≥0.15和GPS 为1~2 分的患者占比显著升高,这提示血清AFP、SII、AST/ALT、ALBI、GGT/PLT、PNI、PLR、NLR、CAR 和GPS 均与HCC 患者术后早期复发和转移有关。进一步的多因素Cox 比例风险回归模型分析结果显示,血清AFP≥400 ng/mL 者术后复发和转移风险是<400 ng/mL 者的1.761 倍,SII≥375.3 者术后复发和转移风险是<375.3 者的2.718 倍,CAR≥0.15 者术后复发和转移的风险是<0.15 者的3.277 倍,这提示血清AFP、SII 和CAR均是影响HCC 切除术后早期复发和转移的独立危险因素。基于以上多因素Cox 比例风险回归模型分析结果,本研究构建了Nomogram 模型,结果显示Nomogram 模型预测HCC 切除术后早期复发和转移的C-index 为0.787。ROC 曲线分析结果显示,Nomogram 模型预测HCC 患者术后1 年、3 年和5 年RFS 的曲线下面积(AUC)分别为0.849、0.857 和0.885,均大于0.8,且校准曲线结果显示Nomogram 模型预测HCC 切除术后患者的1 年、3年和5 年RFS 与实际值的一致性均较好,这提示Nomogram 模型对于HCC 切除术后早期复发和转移具有较高的预测价值,可为临床上选择HCC 患者的治疗方案提供指导。
综上所述,肿瘤大小、血清AFP、SII 和CAR均是影响HCC 切除术后早期复发和转移的独立危险因素,基于这4 项影响因素构建的Nomogram 模型对于患者早期复发和转移的预测效能较高,具有一定的临床应用价值。本研究尚存在一定不足之处,如本研究的病历资料均来源于本院电子病历数据库,未对模型进行外部验证,拟在今后开展多中心临床研究,并进行危险因素分层分析,进一步探讨Nomogram 模型的应用价值。

