利那洛肽联合普芦卡必利对IBS-C 小鼠氧化应激状态及SCF/c-kit 信号通路的影响
刘 畅 王 影
便秘型肠易激综合征(IBS-C)是一种反复发作的肠道功能紊乱,以腹胀、排便频率降低及排便困难为主要临床特征[1]。研究表明,IBS-C 的发生、进展与结肠传输功能障碍密切相关,而机体氧化应激状态在IBS-C 的进展中发挥着重要作用[2]。干细胞因子(SCF)来源于胃肠平滑肌细胞,其可作为c-kit 的配体与c-kit 结合,形成SCF/c-kit 信号通路参与调节肠道Cajal 间质细胞(ICC)的增殖和分化,抑制SCF/c-kit 信号通路可导致ICC 凋亡并使IBS-C 患者机体处于氧化应激状态[3]。在IBS-C的临床治疗中,常使用导泻药物以促进机体肠道蠕动,但其远期疗效往往较差,不适合应用于长期维持治疗[4]。普芦卡必利是治疗慢性便秘的新型药物,可激活肠壁5-羟色胺4(5-HT4)受体,促进肠道收缩,加速胃肠道排空[5]。利那洛肽是一种具有镇痛和通便效果的口服型鸟苷酸环化酶C(GC-C)激动剂,对IBS-C 患者的腹痛和便秘症状具有显著改善作用[6]。本研究分别探索普芦卡必利和利那洛肽单独及联合应用于IBS-C 小鼠后,对小鼠氧化应激损伤的修复作用,并探讨其作用机制。
1 材料与方法
1.1 实验动物
50 只SPF 级、C57BL/6 野生型雄性小鼠,6 周龄,体重为18 ~22 g,均购自河北省实验动物中心[许可证号:SCXK(冀)2022-001]。所有小鼠均饲养于SPF 级实验动物房,室内保持12 h 光照与黑暗交替,自由饮水、进食,定期更换垫料。
1.2 实验药物及试剂
利那洛肽胶囊(290 μg/粒)购自瑞典Almac Pharma Services Limited 公司,琥珀酸普芦卡必利片(2 mg/片)购自江苏豪森药业集团有限公司;印度墨汁购自北京索莱宝科技有限公司;胃动素(MOT)、生长抑素(SS)一抗、生物素羊抗兔IgG、DAB 显色试剂盒均购自武汉博士德生物工程有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、活性氧(ROS)、总抗氧化能力(TAOC)检测试剂盒及ELISA 试剂盒均购自南京森贝伽生物科技有限公司;抗SCF、c-kit、GAPDH 小鼠单克隆抗体均购自英国Abcam 公司;基因上、下游引物由上海捷瑞生物工程有限公司提供,RNA 提取试剂盒、反转录试剂盒均购自日本TaKaRa 公司。
1.3 造模、分组及给药干预
选取10 只小鼠作为对照组,其余40 只小鼠采用冰水灌胃法构建IBS-C 模型。使用4 ℃生理盐水灌胃,0.3 mL/只,1 次/d,连续灌胃14 d,造模期间正常饮食、饮水,如观察发现造模小鼠的粪便颗粒数明显减少,粪便含水量明显降低,则提示造模成功。将造模成功的小鼠随机分为模型组、利那洛肽组、普芦卡必利组和联合给药组,每组10 只。利那洛肽组给予利那洛肽(100 μg/kg)灌胃,普芦卡必利组给予普芦卡必利(0.2 mg/kg)灌胃,联合给药组同时给予利那洛肽和普芦卡必利 (剂量同上)进行干预,每日灌胃1 次,连续灌胃14 d。
1.4 小鼠粪便颗粒数及粪便含水量测定
用粪便采集盒连续收集各组小鼠12 h内的粪便,观察粪便性状并记录粪便颗粒数,用电子天平称量粪便湿重,随后将粪便置于65 ℃恒温箱烘干后称量干重,计算粪便含水量,公式:粪便含水量(%)=(粪便湿重-粪便干重)/粪便干重×100%。
1.5 胃残留率测定
各组取5 只小鼠,禁食、不禁水24 h 后给予印度墨汁混悬液(阿拉伯胶制,0.8 mL/只)灌胃,同时腹腔注射阿托品(0.5 mg/kg),于20 min 后处死小鼠并解剖。称量胃组织质量,去除胃内容物后再次称量净重,两者之差即为小鼠胃内容物质量,计算胃残留率,公式:胃残留率(%)=胃内容物(g)/墨汁混悬液(g)×100%。
1.6 小肠推进率测定
取上述小鼠完整的肠组织,将肠组织平铺于洁净桌面,测量墨汁推进长度,计算小肠推进率,公式:小肠推进率(%)=墨汁前端至幽门口的长度/直肠末端至幽门口的长度×100%。
1.7 结肠组织MOT、SS 水平测定
各组另取5 只小鼠,经眼球采血后处死,取近直肠末端的结肠组织于10%福尔马林溶液中固定48 h,取出后用流水冲洗,浸蜡、包埋后切片(厚度为5 μm),切片经脱蜡、透明和脱水后,滴加0.3%的H2O2后置于室温下20 min,经抗原热修复后滴加5%牛血清白蛋白(BSA)封闭20 min,分别加入MOT、SS 一抗于4 ℃孵育过夜,加入二抗后在37 ℃下作用20 min,滴加SABC 试剂后在37 ℃下作用20 min,DAB 避光显色后封片,光学显微镜下观察MOT、SS 的阳性表达情况。阳性细胞判定标准:细胞呈棕黄色至棕褐色颗粒,分布于结肠黏膜层。以阳性细胞的平均光密度(OD)值作为MOT、SS 水平的半定量评价标准。应用ImageJ 软件计算3 个视野的MOT、SS 阳性细胞的平均OD 值,以评价MOT、SS 水平。
1.8 血清氧化应激指标检测
采用ELISA 法检测小鼠血清MDA、ROS、SOD 和TAOC 水平。1.7 小节中的小鼠经眼球采血后,取0.5 mL 血液样品,3 000 r/min 离心15 min,取上清液。分别作空白对照孔、标准孔和样品孔,空白对照孔不加酶标试剂和样品,标准孔分别加入100 μL 酶标试剂和不同浓度梯度的标准品,各样品孔中分别加入100 μL 酶标试剂、10 μL 血清样品和40 μL 稀释剂,置于37 ℃孵育1 h 后洗涤,加底物液显色,经37 ℃避光孵育15 min 后终止反应。使用酶标仪于450 nm 下检测各孔的OD 值,根据标准孔OD 值绘制标准曲线,代入样品孔OD 值后计算得到MDA、ROS、SOD 和TAOC 的浓度。
1.9 结肠组织中SCF、c-kit 蛋白的表达水平检测
采用蛋白质印迹法检测小鼠结肠组织中SCF、c-kit 蛋白的表达水平。取1.7 小节中的小鼠近直肠末端的结肠组织,使用RIPA 裂解液对组织样品进行裂解,获得5 组小鼠的结肠组织蛋白样品,使用BCA 试剂盒测定每个蛋白样品的浓度。取10 μL 蛋白样品上样于SDS-PAGE 胶加样孔内,经电泳分离、PVDF 转膜后,加入5%脱脂牛奶封闭2 h,滴加一抗(1 ∶1 000)并置于4 ℃孵育过夜,洗膜后加入二抗(1 ∶5 000)并置于室温下反应2 h,再次洗膜后加入发光液显色。曝光拍照后,应用ImageJ软件测定条带灰度值,以GAPDH 作为内参,计算SCF、c-kit 蛋白的表达水平。
1.10 结肠组织中SCF 和c-kit mRNA 的表达水平检测
采用实时荧光定量PCR 法检测结肠组织中SCFmRNA 和c-kitmRNA 的相对表达量。取1.7 小节中的小鼠近直肠末端的结肠组织,采用TRIzol 法提取组织总RNA。采用紫外线分光光度法测定RNA 浓度后,取2 μg 总RNA 反转录为cDNA,再以cDNA 为模板,使用RT-PCR试剂盒检测SCFmRNA、c-kitmRNA 的相对表达量。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,共计40 个循环。以GAPDH 作为内参,采用2-△△Ct法检测SCFmRNA、c-kitmRNA 的相对表达量。引物序列见表1。

表1 引物序列
1.11 统计学方法
应用SPSS 20.0 软件进行统计学分析。计量资料以均数±标准差(±s)表示,组内比较采用配对样本t检验,组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 各组的粪便颗粒数和粪便含水量比较
与对照组相比,模型组的粪便颗粒数和粪便含水量均显著减少(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组的粪便颗粒数和粪便含水量均显著增多(P均<0.05);与利那洛肽组、普芦卡必利组相比,联合给药组的粪便颗粒数和粪便含水量均显著增多 (P均<0.05)。见表2。
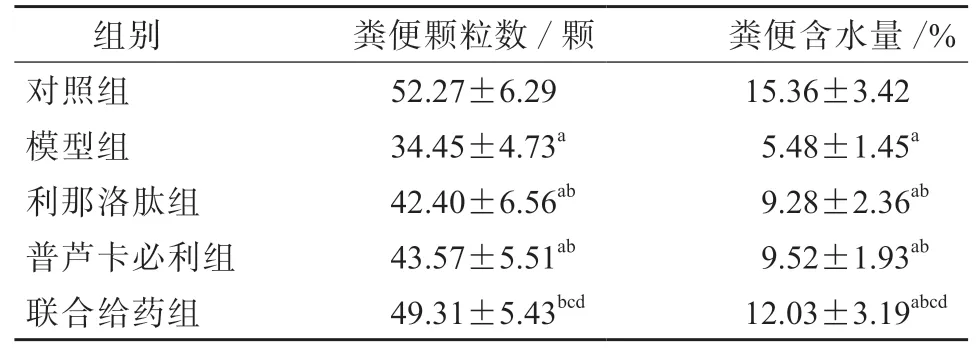
表2 各组的粪便颗粒数和粪便含水量比较
2.2 各组的胃残留率和小肠推进率比较
与对照组相比,模型组的胃残留率显著升高,小肠推进率显著降低(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组的胃残留率均显著降低,小肠推进率均显著升高(P均<0.05)。与利那洛肽组、普芦卡必利组相比,联合给药组的胃残留率均显著降低,小肠推进率均显著升高(P均<0.05)。见表3。
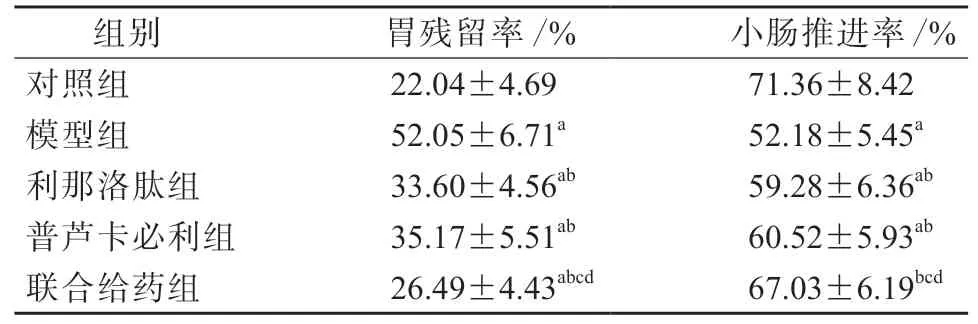
表3 各组的胃残留率和小肠推进率比较
2.3 各组结肠组织中MOT、SS 水平比较
免疫组织化学染色结果显示,MOT、SS 阳性细胞呈棕褐色颗粒。与对照组相比,模型组结肠组织中MOT 阳性细胞的平均OD 值显著降低,SS阳性细胞的平均OD 值显著升高(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组结肠组织中MOT 阳性细胞的平均OD 值均显著升高,SS 阳性细胞的平均OD 值均显著降低(P均<0.05);与利那洛肽组、普芦卡必利组相比,联合给药组结肠组织中MOT 阳性细胞的平均OD值均显著升高,SS 阳性细胞的平均OD 值均显著降低(P均<0.05)。见图1。
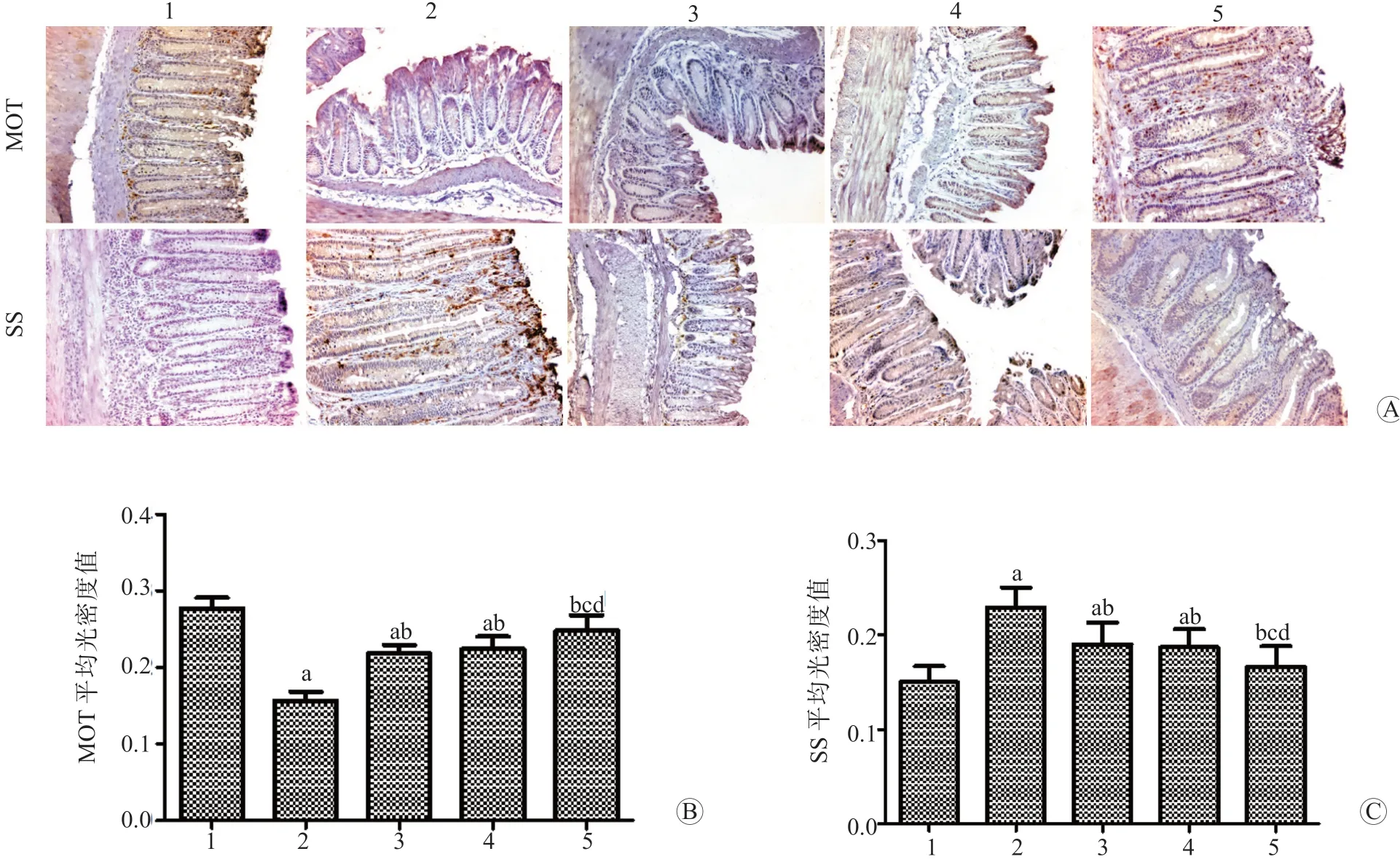
图1 各组结肠组织中MOT、SS 的表达情况 A MOT、SS 阳性细胞的病理图 免疫组织化学色 ×200 B MOT 阳性细胞的平均OD 值C SS 阳性细胞的平均OD 值
2.4 各组血清MDA、ROS、SOD 和TAOC 水平比较
与对照组相比,模型组血清MDA、ROS 水平均显著升高,SOD、TAOC 水平均显著降低(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组血清MDA、ROS 水平均显著降低,SOD、TAOC 水平均显著升高(P均<0.05);与利那洛肽组、普芦卡必利组相比,联合给药组血清MDA、ROS 水平均显著降低,SOD、TAOC水平均显著升高(P均<0.05)。见表4。
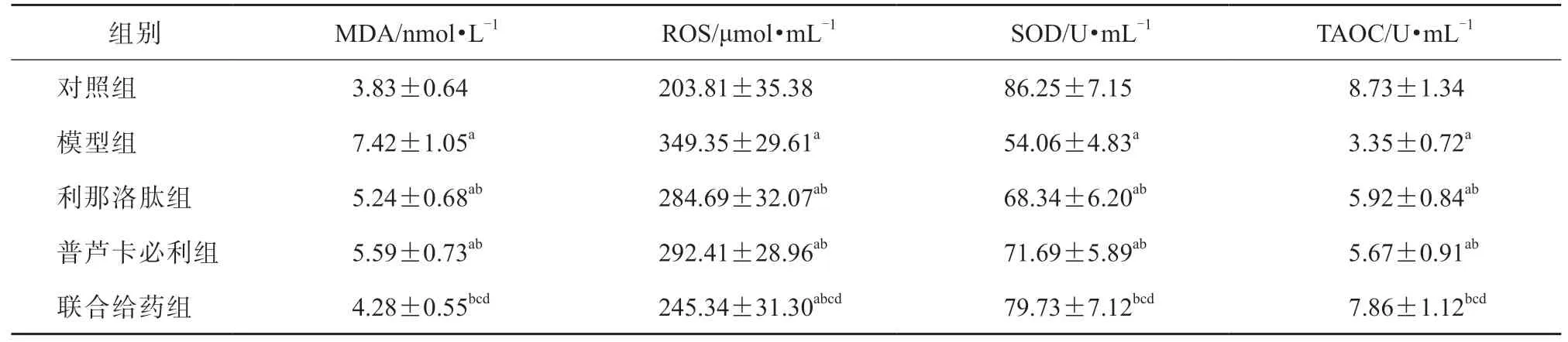
表4 各组血清MDA、ROS、SOD 和TAOC 水平比较
2.5 各组结肠组织中SCF、c-kit 蛋白表达水平比较
与对照组相比,模型组结肠组织中SCF、c-kit蛋白的表达水平均显著降低(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组结肠组织中SCF、c-kit 蛋白的表达水平均显著升高(P均<0.05);与利那洛肽组、普芦卡必利组相比,联合给药组结肠组织中SCF、c-kit 蛋白的表达水平均显著升高(P均<0.05)。见图2。
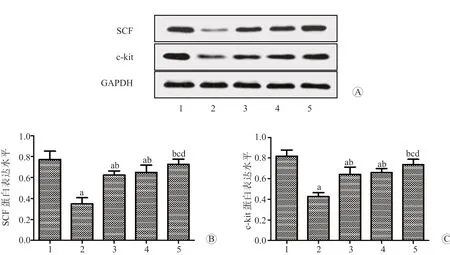
图2 各组结肠组织中SCF、c-kit 蛋白的表达水平 A SCF、c-kit 的蛋白电泳图 B SCF 蛋白表达水平 C c-kit 蛋白表达水平
2.6 各组结肠组织中SCF mRNA、c-kit mRNA 的相对表达量比较
与对照组相比,模型组结肠组织中SCFmRNA、c-kitmRNA 的相对表达量均显著降低(P均<0.05);与模型组相比,利那洛肽组、普芦卡必利组和联合给药组结肠组织中SCFmRNA、c-kitmRNA 的相对表达量均显著升高(P均<0.05);与利那洛肽组、普芦卡必利组相比,联合给药组结肠组织中SCFmRNA、c-kitmRNA 的相对表达量均显著升高(P均<0.05)。见表5。
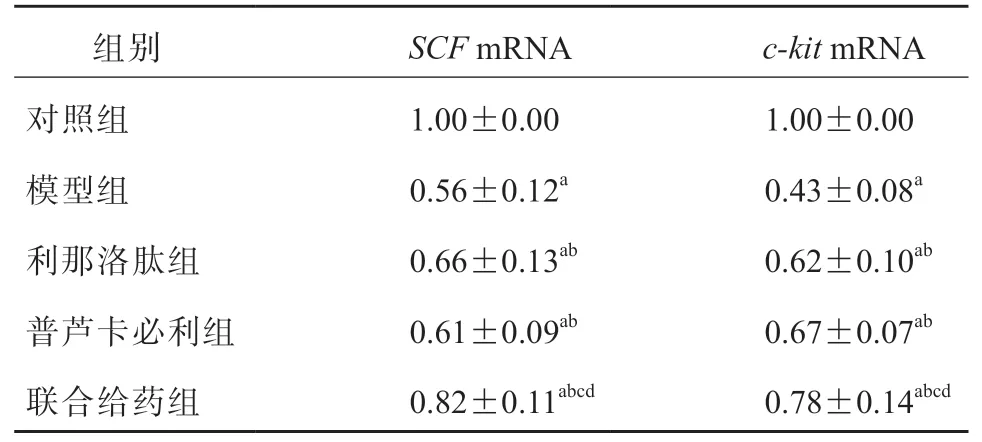
表5 各组结肠组织中SCF mRNA、c-kit mRNA 的相对表达量比较
3 讨论
在中国肠易激综合征(IBS)的患病率约为6.5%,其中IBS-C 的临床发病率约占IBS 总发病率的35.0%,同时IBS 存在就诊率低的现象,仅25%的患者得到及时诊断,较多患者因诊断不及时而延误了治疗时机[7]。目前IBS-C 的治疗方案主要以改善便秘症状、调节饮食和改变生活方式为主,但目前常用药物的不良反应较多且功能单一,无法同时改善腹痛和排便困难,甚至会加重腹痛症状,导致疗效不佳[8]。
普芦卡必利是一种新型5-HT4受体激动剂,可选择性激活5-HT4受体,促使肠道平滑肌收缩,其起效迅速且作用持久,治疗慢性便秘的效果较好[9]。利那洛肽是一种新型口服药物,可通过结合肠上皮细胞GC-C 受体升高胞内、胞外环磷酸鸟苷(cGMP)含量,同时发挥通便和镇痛的疗效;此外,由于其降解产物主要分布于胃肠道,对肝脏和肾脏的损伤均较小,因此安全性较高,可用于IBS-C患者的长期治疗[10]。多项研究表明,利那洛肽可通过激活小肠和结肠的GC-C 以提高小鼠痛阈,进而缓解IBS-C 患者的腹痛症状[11-12]。临床研究表明,利那洛肽可有效缓解IBS-C 患者的排便不适症状,提高肠道痛阈,改善患者的生活质量[13]。由于利那洛肽的上市时间较短,目前关于其作用机制的研究报道较少,因此需进一步探究利那洛肽的药理学机制。
冷刺激是导致IBS-C 反复发作的危险因素,冰水灌胃是目前较为理想的IBS-C 动物模型的造模方法,该法可引起机体肠道运动异常,机体受到刺激后可导致粪便颗粒数和粪便含水量减少,且该症状可持续存在14 d 以上[14]。本研究采用冰水灌胃法构建IBS-C 小鼠模型,观察利那洛肽和普芦卡必利联合应用于IBS-C 小鼠的效果。本研究结果显示,利那洛肽和普芦卡必利单独或联合应用均可增加IBS-C 模型小鼠的粪便颗粒数和粪便含水量,升高小肠推进率,降低胃残留率,这提示利那洛肽联合普芦卡必利治疗可显著改善IBS-C 模型小鼠症状,并可促进肠功能恢复。MOT 具有刺激机体分泌胃蛋白酶、促进消化道机械运动的生理功能,还可抑制SS 释放[15]。SS 可抑制肠道平滑肌收缩,减少肠液分泌及肠道血流量[16]。免疫组织化学染色结果显示,利那洛肽和普芦卡必利单独或联合应用后,结肠组织中MOT 水平升高,SS 水平降低,并且利那洛肽联合普芦卡必利的干预效果更加显著,这提示两者联合使用可调节胃肠激素表达,促进肠道蠕动,进而改善IBS-C 症状。
机体氧化应激状态所造成的ROS 累积可诱导结肠ICC 凋亡,导致肠动力障碍[17]。SOD、TAOC水平可反映机体自由基清除能力,而MDA 水平可反映组织细胞受自由基损伤程度[18]。ELISA 法结果显示,IBS-C 模型小鼠经利那洛肽联合普芦卡必利治疗后,其血清SOD、TAOC 水平均升高,MDA、ROS 水平均降低,这提示两者联合应用可显著增强机体的抗氧化能力,改善IBS-C 小鼠的氧化应激状态。研究表明,氧化应激水平升高可抑制SCF/c-kit 信号通路的活性,促进ICC 凋亡,而通过外源性给予SCF,可通过促进SCF/c-kit 信号通路活化而改善胃肠道动力异常[19]。本研究结果发现,IBS-C 模型小鼠结肠组织中SCF、c-kit 的蛋白和mRNA 的相对表达量均显著降低,经治疗后其表达水平均显著升高,这提示利那洛肽联合普芦卡必利可减轻IBS-C 模型小鼠氧化应激损伤,这可能与SCF/c-kit 信号通路的激活有关。
综上所述,利那洛肽联合普芦卡必利治疗可通过促进IBS-C 模型小鼠SCF/c-kit 信号通路的活化,提高机体抗氧化能力,进而促进小鼠肠道功能恢复,缓解其症状,并且联合用药的疗效优于单药治疗。本课题组今后将进一步探究利那洛肽联合普芦卡必利治疗减轻氧化应激反应、激活SCF/c-kit 信号通路的具体作用机制。

