应用蛋白组学技术研究壳寡糖对水稻幼苗抗寒性能的诱导机理
于宇璇,李倞霆,张晴晴,孙 珍,唐文竹
(大连工业大学生物学院,辽宁 大连 116034)
水稻作为一种单子叶植物,是热带和亚热带地区重要的粮食作物,对低温有较高的敏感性。低温是影响水稻生长发育的重要环境因素之一,会引发众多生理反应,如膜僵化、营养吸收抑制、光合速率降低、生长抑制[1]、同时还会致使脱落酸(ABA)和茉莉酸(JA)等激素水平的短暂增加[2]、膜脂组成的变化[3]、可溶性糖和脯氨酸等渗透压物质的积累[4-6]、抗氧化剂的生成[7]和叶绿素降解[8],严重时甚至会导致秧苗腐烂[9]。随着全球异常气候的增加,低温胁迫频繁发生,其影响范围正在逐渐扩大[10]。
壳寡糖作为一种重要的生物活性分子,具有抗菌、抗氧化、降低胆固醇和免疫调节等作用[11]。蛋白质的结构和功能相互关联,将壳寡糖与蛋白质组学技术相结合,可以更全面地了解蛋白质的结构和功能,揭示其在生物体内的作用机制。
有研究表明[12-13],壳寡糖不仅可以在植物中诱导其对细菌病原体的抗性,还可以促进植物生长,诱导植物对非生物胁迫的各种生理反应。因此,近年来壳寡糖在农业上的应用受到更多关注[14-16]。蛋白质组学借助二维电泳、质谱、色谱等多种技术,探索并发现生物体内产生不同生理特征的原因。如,孙玉明等[19]采用高效液相色谱-高分辨质谱法鉴定拉萨大黄化学成分,不仅提高了拉萨大黄复杂基质中微量化合物的鉴定效率,同时实现了对拉萨大黄提取物中不同类型化合物的分析鉴别;马悦等[20]利用高效液相色谱-四极杆-静电场轨道阱高分辨质谱法分析桑葚提取物中黄酮类和多酚类成分,鉴定出芦丁、异槲皮素等多种化合物,为桑葚的药用、食用和合理开发提供了化学基础。蛋白质组学的意义在于分析生命体中所有表达蛋白质的组成及动态变化,包括蛋白质的定性和定量表达,蛋白与蛋白之间或蛋白与其他物质之间的反应,蛋白质在细胞各处的作用等。
本实验选取明恢63水稻作为研究对象,通过模拟水稻幼苗从正常生长到遭遇低温再到复性的全过程,测定水稻幼苗对应时期的生理生化指标,并采用非标记定量技术对水稻幼苗的差异蛋白进行鉴定分析,通过基因本体(GO, gene ontology)和京都基因与基因组百科全书(KEGG)数据库的富集分析,研究光合作用及淀粉和蔗糖的代谢通路,从蛋白的角度讨论壳寡糖与水稻抗寒性之间的关联,并寻找与抗寒有关联的通路,旨为研发新型生物农药提供思路和实验方法。
1 实验部分
1.1 主要仪器与装置
Q ExactiveTM组合型四极杆Orbitrap质谱仪:美国赛默飞世尔科技公司产品;Ultimate 3000 RSLC nano System液相系统:美国戴安公司产品;GZP-450s程控光照培养箱:上海精宏实验设备有限公司产品。
1.2 主要材料与试剂
明恢63水稻(籼型常规水稻)、醋酸壳寡糖(COS):由大连工业大学微生物资源与生物催化实验室提供;霍格兰通用营养液、次氯酸钠溶液、醋酸壳寡糖、丙酮、碳酸钙、石英砂、蔗糖、蒽酮、乙酸乙酯、浓硫酸、三氯乙酸(TCA)、硫代巴比妥酸(TBA)、连二亚硫酸钠、红四氮唑、磷酸氢二钠、磷酸二氢钠、茚三酮、乙醇、氰化钠、醋酸钠、冰醋酸、亮氨酸、甲硫氨酸溶液、氮蓝四唑溶液、核黄素、EDTA-Na2、H2O2、愈创木酚(除霍格兰通用营养液外,其余均为化学纯,由大连工业大学微生物资源与生物催化实验室提供)。
三羟甲基氨基甲烷(Tris):中国生物工程有限公司产品;盐酸、三氯乙酸(TCA)、丙酮:均为分析纯,天津市凯信化学工业有限公司产品;二硫苏糖醇(DTT)、碘乙酰胺(IAA)、胰蛋白酶(trypsin):美国Sigma-Aldrich公司产品;SteadyPure植物RNA提取试剂盒:艾科瑞生物公司产品;PrimeScriptRT reagent Kit with gDNAEraser(Perfect Real Time)反转录试剂盒:宝日医生物技术有限公司产品;ChamQ Universal SYBR qPCR Master Mix荧光染料:诺唯赞公司产品。
1.3 水稻生长条件和表型分析
取适量种子,用3%次氯酸钠溶液消毒,再用去离子水清洗,然后分别用去离子水和0.5%壳寡糖浸泡24 h。将种子(约140 粒)平铺在网格盘上,向育苗盘内加入水,温度28 ℃,湿度75%,覆盖育苗纸,避光发芽。3天后发芽,去掉育苗纸,将盘内去离子水换成霍格兰通用营养液。培养条件为:温度28 ℃,12 h光照,12 h黑暗,湿度75%。水稻生长到一叶期时开始喷洒0.5%壳寡糖,喷洒频率为每周2次。空白组喷洒等体积的去离子水,成长到三叶期时取样,该组为冷处理前组。同时,在相同的光暗周期和相对湿度下,以15 ℃低温处理模拟5天,恢复至28 ℃培养7 天,壳寡糖喷洒频率为每周2次,若以低温处理时刻为0时,即取样时间为0时,低温处理7天,复性7天,同时,在相同的光暗周期和相对湿度下,其余水稻幼苗继续在植物恒温光照培养箱中培养,将培养温度降低至15 ℃,持续5天,模拟冷应激处理,然后收集部分样品,该组为冷处理组。将其余幼苗的生长温度恢复到28 ℃培养7天,即进行复性,并继续收集部分样品,该组为复性组。取样后立即液氮速冻,放入-80 ℃冰箱,以备后续试验。随机测定30株水稻幼苗在取样时间点产生明显的表型,参数包括空白和实验组水稻幼苗的根长(每株)、叶长(每株)、株高(每株)、鲜重(10株为1个单位)、干重(10株为1个单位),以此评估低温对水稻生长的影响。
1.4 水稻的生化特性
取水稻幼苗在每个取样时间点的0.2 g水稻叶片(每组实验重复3次),用80%丙酮提取叶绿素,测定645、663 nm波长下的吸光值,并计算叶绿素含量,使用蒽酮比色法测量可溶性糖含量[21],参考文献[21]方法测量丙二醛(MDA)含量。用红四氮唑(TTC)测定水稻幼苗根系活力,测定485 nm波长下的吸光值,并计算根系活力,使用水和茚三酮方法提取水稻叶片总氨基酸含量[23],NBT方法测量超氧化物歧化酶(SOD)[24],参考文献[25]方法测量过氧化物酶(POD)和过氧化氢酶(CAT)。
1.5 蛋白质的提取
称取1 g水稻叶片,剪碎放入预冷的研钵中,加入10%聚乙烯吡咯烷酮(PVPP),在液氮中充分研磨至粉末状。加入8 mol/L尿素、10 mmol/L三羟甲基氨基甲烷-盐酸 (Tris-HCl)、1 mmol/L苯甲基磺酰氟(PMSF)溶解缓冲液,在冰上超声处理30 min,以10 000 r/min离心20 min,弃去废液,将上清液转移至新试管中,再加入20 mL含有10%TCA、冷丙酮、10 mmol/L DTT的混合液,-20 ℃过夜沉淀,在4 ℃下以10 000 r/min离心20 min,并丢弃上清液;向试管中加入5 mL冷丙酮、10 mmol/L DTT,-20 ℃下静置4 h,在4 ℃下以10 000 r/min离心15 min,并丢弃上清液;重复此步骤直至上清液无色,然后在室内风干,得到水稻样品总蛋白。
1.6 蛋白质的消化
取1 mg蛋白水溶液,加入100 mmol/L DTT,使DTT终浓度为20 mmol/L;在37 ℃下温育2 h,加入100 mmol/L IAA封闭巯基,使IAA终浓度为20 mmol/L,避光反应40 min;用10 mmol/L Tris将溶液稀释至1 mol/L,按照质量比1∶30加入1 g/L胰蛋白酶,37 ℃水浴下过夜酶解。样品酶解后,通过C18固相微萃取柱脱盐并蒸干,将蒸干的肽段复溶于50 μL 0.1%甲酸水溶液中,待质谱分析。
1.7 实验条件
1.7.1色谱条件 预柱:C18PepMap100(5 μm,100 Å);分析柱:Acclaim PepMapTMRSLC(75 μm×15 cm×3 μm);流动相:A相为0.1%甲酸水溶液,B相为0.1%甲酸水溶液和80%乙腈;流速0.3 μL/min;柱温45 ℃;进样量1 μL;线性洗脱程序:0~10 min(4%B),10~13 min(4%~10%B),13~90 min(10%~35%B),90~114 min(35%~55%B),114~115 min(55%~95%B),115~122 min(95%B),122~123.5 min(95%~4%B),123.5~140 min(4%B)。
1.7.2质谱条件 使用纳升电喷雾(Nano ESI)进行离子化,Q ExactiveTM组合型四极杆Orbitrap质谱仪分析。正离子模式,Full MS/dd-MS2扫描方式。一级质谱条件:Orbitrap分辨率70 000,自动增益控制(AGC)3×106,最大注入时间100 ms,质量扫描范围m/z350~1 800。二级质谱条件:Orbitrap分辨率17 500,AGC 1×105,最大注入时间110 ms,母离子个数15,碰撞能量27%。
1.7.3数据检索条件 质谱输出的原始RAW文件数据采用Proteome Discoverer(2.2.0.388)软件进行搜库。使用的数据库为水稻总数据库(Oryza sativa,1 303 332个序列),来源于Uniprot。胰蛋白酶为唯一裂解酶,最多有2个漏切位点。前体离子的质量偏差为1×10-5,碎片离子的质量偏差允许±0.02 u。使用非标记定量蛋白组学(label-free quantitative, LFQ)对得到的数据结果进行分析。
1.8 非标记定量蛋白组学分析
为了使结果更具统计学意义,用标准差与均值的比值(CV)<20%对LFQ结果进行筛选,得到稳定表达的蛋白质。本实验选择低温胁迫/正常生长、复性/正常生长、复性/低温胁迫3种方式研究存在的差异表达蛋白,其中,相对变化倍数≥1.2(CV<20%)为上调蛋白,相对变化倍数≤0.8(CV<20%)为下调蛋白。
1.9 GO富集分析、功能注释及通路分析
GO富集分析(http:∥geneontology.org)将得到的差异表达蛋白按照生物过程(BP)、细胞成分(CC)和分子功能(MF)3种类别进行分析注释。利用在线分析平台KAAS(https:∥www.genome.jp/tools/kaas/)进行差异蛋白代谢通路分析。
1.10 实时荧光定量(RT-qPCR)分析
使用SteadyPure植物RNA提取试剂盒提取明恢63水稻幼苗的总RNA,PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒对明恢63水稻幼苗总RNA进行反转录,合成cDNA。
用于RT-qPCR的水稻基因核苷酸序列下载于国家水稻数据中心(https:∥www.ricedata.cn/),使用在线分析平台Integrated DNA Technologies(https:∥sg.idtdna.com/pages)进行qPCR引物设计,引物列表详见附表1(请登录《质谱学报》官网http:∥www.jcmss.com.cn下载,以下同)。使用Light Cycler/Light Cycler480 Real Time PCR仪对基因进行RT-qPCR,以GAPDH基因作为内源性qPCR参考,反应体系列于附表2,计算各基因的相对表达量。
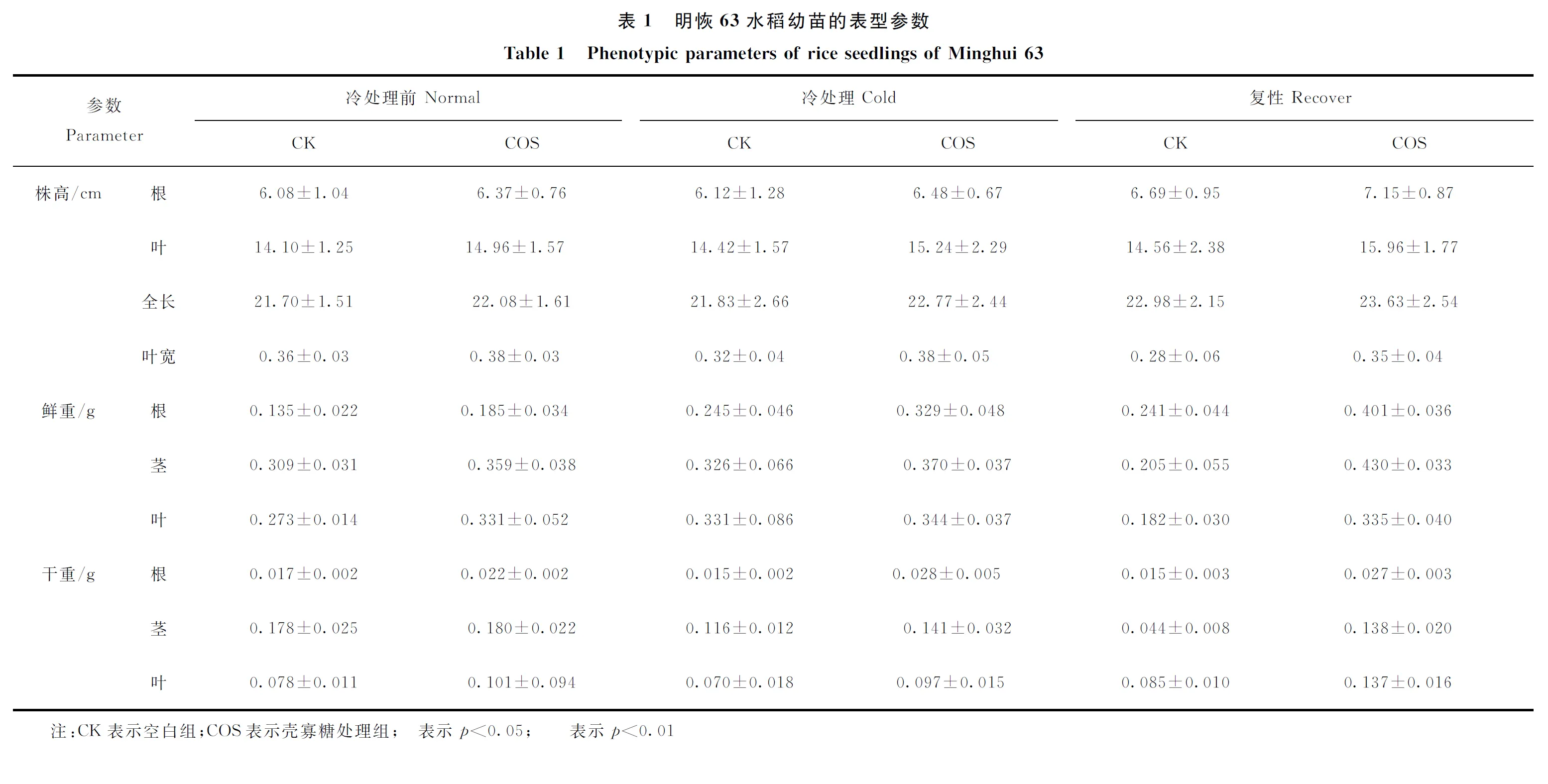

表2 明恢63水稻幼苗蛋白质鉴定数目Table 2 Numbers of proteins in rice seedlings of Minghui 63
1.11 统计分析
使用统计软件SPSS(版本25.0)和Microsoft Excel(版本2007)分析所有数据(空白组与实验组在p<0.05和p<0.01水平上的差异)。
2 结果与讨论
2.1 壳寡糖对水稻幼苗抗寒的影响
2.1.1壳寡糖对水稻幼苗生理指标的影响
明恢63水稻幼苗植株整体较矮、茎粗、叶宽,示于图1。低温处理5天后,空白组水稻幼苗叶片边缘发生蜷曲,这是植物遇冷的表现,复性7天后,空白组水稻茎变细,第3片叶变黄,发生蜷曲的叶片没有得到舒展。而实验组幼苗在遇到低温后,仍挺拔生长且茎粗、叶宽,水稻幼苗抵御低温胁迫的能力较强。明恢63水稻幼苗的表型参数列于表1。与空白组相比,实验组水稻复性时根长增加了6.88%,叶长增加了9.62%,叶宽显著增加;此外,水稻幼苗叶片鲜重、叶片干重、茎鲜重、茎干重、根鲜重、根干重分别增加了66.39%、80%、109.76%、213.64%、84.07%、61.18%。

注:a.d.正常生长;b.e.低温胁迫;c.f.复性图1 明恢63水稻幼苗生长情况Fig.1 Growth of rice seedlings of Minghui 63
2.1.2壳寡糖对水稻幼苗生化指标的影响
为了阐明壳寡糖处理后导致冷胁迫耐受性的可能机制,分析了与冷胁迫相关的生理变化,如叶绿素含量,可溶性糖含量,丙二醛含量,根系活力,总氨基酸含量以及SOD、POD、CAT 3种主要抗氧化酶的活性变化,示于图2。结果表明,实验组幼苗在遭遇低温后,抵御低温胁迫的能力较强;与空白组相比,实验组幼苗的叶绿素含量提高了近1倍、可溶性糖含量增加64.79%、总氨基酸含量增加90.13%,可溶性糖和氨基酸的积累可以抵消产生的渗透胁迫;丙二醛含量下降0.2 mg,根系活力提高1倍多,SOD、POD、CAT活性分别提高13.9%、57.5%、48.66%。壳寡糖处理后的水稻幼苗抵御寒冷相关的酶活性增强,可以显著提高抵御冷胁迫的能力。
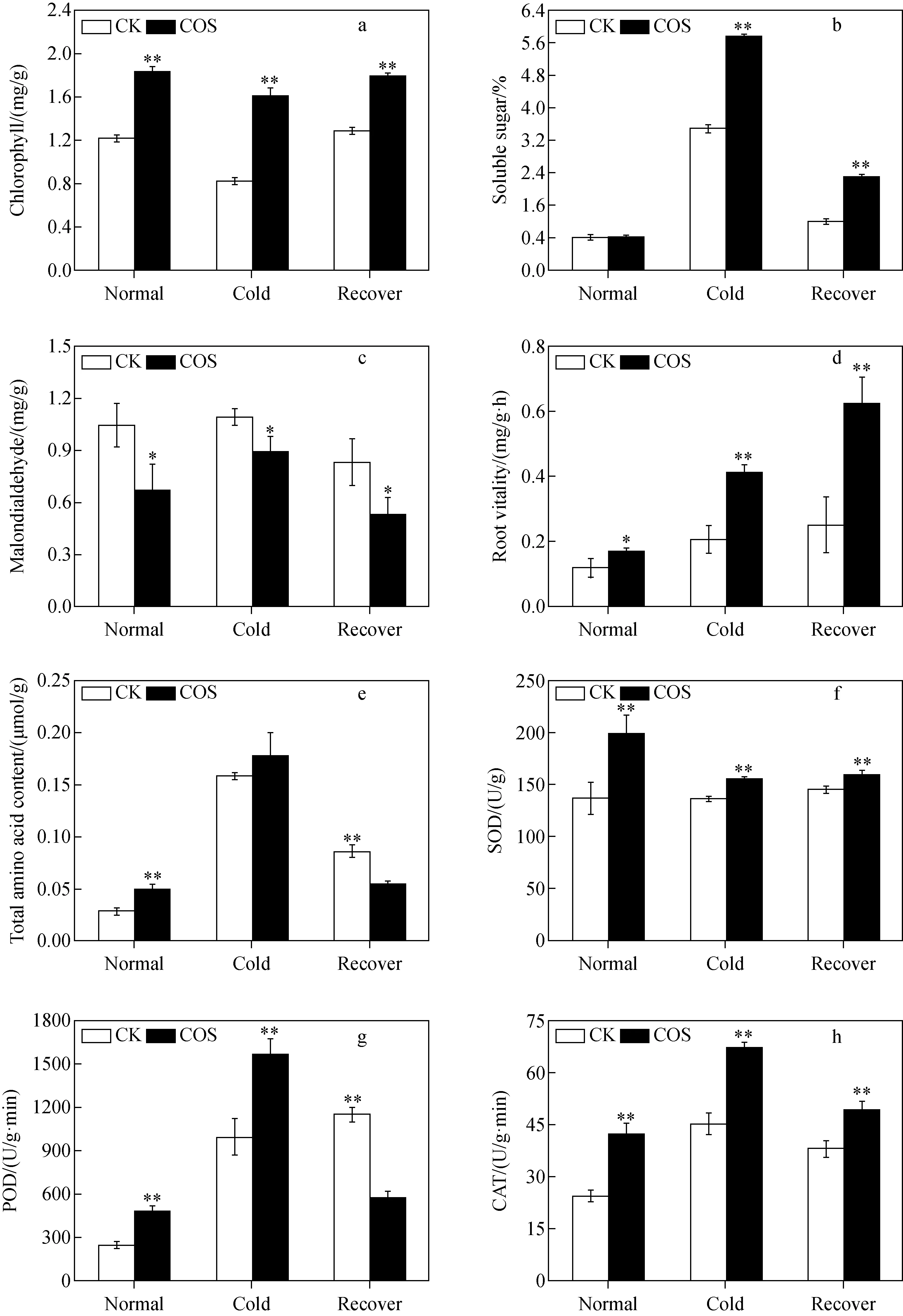
注:a.叶绿素含量;b.可溶性糖含量;c.丙二醛含量;d.根系活力;e.总氨基酸含量;f.SOD活性;g.POD活性;h.CAT活性;所有数据均为平均值±标准误差(SE);*表示与空白组有统计学显著差异(n=3,*p<0.05,**p<0.01)图2 明恢63水稻幼苗生化指标Fig.2 Biochemical indicators of rice seedlings of Minghui 63
2.2 非标记定量蛋白组学结果分析
本实验检测了明恢63水稻幼苗、空白与实验组、3个时间节点(正常情况下生长、低温胁迫、复性),共计6组不同样品,每组样品检测3次,详细信息列于表2。可以发现,加入壳寡糖的实验组蛋白鉴定数大于空白组,可能是壳寡糖增加了蛋白表达量,使一些低表达蛋白容易鉴定到,使用LFQ方法对得到的样品数据结果进行定量蛋白组学分析。
对得到的数据进行初步筛选,重复测定结果中同一蛋白定量结果的CV值<20%,即得到稳定存在蛋白(SPs);在稳定存在蛋白中寻找差异表达蛋白(DEPs),相对变化倍数≥1.2(CV<20%)为上调蛋白(UP),相对变化倍数≤0.8(CV<20%)为下调蛋白(DOWN),详细信息列于表3。其中,实验组明恢63水稻低温胁迫/正常生长(C/N)有1 120个DEPs,其中UP为881,DOWN为239;复性/正常生长(R/N)有1 148个DEPs,其中UP为293,DOWN为855;复性/低温胁迫(R/C)有892个DEPs,其中UP为481,DOWN为441。可以发现,在C/N中UP居多,而在R/N中DOWN居多,表明低温胁迫引起了水稻内部蛋白表达量的大幅变化。
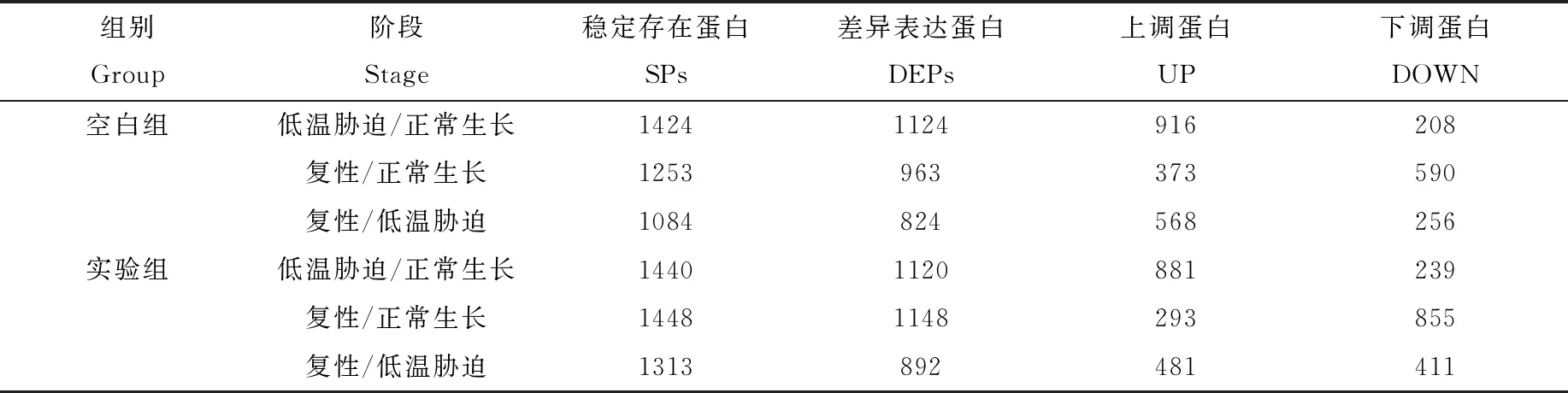
表3 明恢63水稻幼苗稳定蛋白、差异表达蛋白、上调蛋白、下调蛋白数目Table 3 Numbers of stable proteins, differentially expressed proteins, up-regulated proteins, and down-regulated proteins in rice seedlings of Minghui 63
明恢63水稻幼苗差异表达蛋白韦恩图示于图3。其中,空白组水稻幼苗3组方式中均有差异的蛋白为412个,C/N与R/N之间有差异的蛋白为561个,C/N与R/C之间有差异的蛋白为563个,R/C与R/N之间有差异的蛋白为537个;实验组水稻幼苗3组方式中均有差异的蛋白为471个,C/N与R/N之间有差异的蛋白为595个,C/N与R/C之间有差异的蛋白为706个,R/C与R/N之间有差异的蛋白为603个。与空白组相比,实验组在R/C与R/N阶段的蛋白数目高于空白组,表明加入壳寡糖后水稻差异表达蛋白的数目更多,实验组水稻幼苗中有更多的蛋白来抵御胁迫,这对水稻生长是非常重要的。
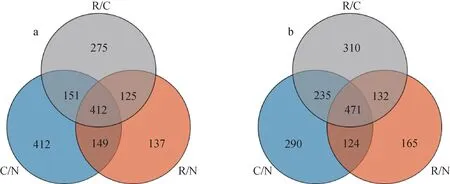
注:a.空白组;b.实验组图3 明恢63水稻幼苗差异表达蛋白韦恩图Fig.3 Venn diagrams of differentially expressed proteins in rice seedlings of Minghui 63
2.3 壳寡糖对低温胁迫下水稻幼苗差异蛋白GO注释分析
为了进一步确定DEPs的功能,本实验进行了GO注释分析,如生物过程(BP)、细胞组分(CC)和分子功能(MF),详见附录2。生物过程注释中前15个条目包括:细胞生物合成过程、细胞芳香族化合物代谢过程、细胞成分组织、细胞氮化合物代谢过程、杂环代谢过程、大分子代谢过程、多细胞生物发育、有机酸代谢过程、有机环状化合物代谢过程、有机物生物合成过程、有机氮化合物代谢过程、有机物分解代谢过程、细胞过程的调节、对无机物的反应、对有机物的反应。其中,富集到差异蛋白数目最多的条目是有机氮化合物代谢过程。C/N有14条目,R/N有13条目,R/C有15条目对应的实验组富集到的生物过程大于空白组。细胞组分注释中前15个条目包括:锚定连接、质外体、细胞壁、叶绿体基质、膜的组成部分、细胞内细胞器、膜界细胞器、非膜界细胞器、细胞器包膜、细胞器腔、细胞器膜、光合作用薄膜、等离子膜、核糖体亚基、类囊体。其中,富集到差异蛋白数目最多的条目是细胞内细胞器和膜界细胞器。C/N有7条目,R/N有13条目,R/C有13条目实验组富集到的细胞组分大于空白组。分子功能注释中前15个条目包括:阴离子结合、阳离子结合、酶结合、糖基转移酶活性、水解酶活性(作用于酸酐)、水解酶活性(作用于酯键)、水解酶活性(作用于糖基键)、相同蛋白结合、无机分子实体跨膜转运蛋白活性、离子跨膜转运蛋白活性、核酸结合、磷酸核苷结合、氧化还原酶活性(作用于供体的 CH—OH 基团)、氧化还原酶活性(作用于 NAD(P)H、肽酶活性)、蛋白质二聚化活性。其中,富集到差异蛋白最多的条目是阴离子结合、阳离子结合、核酸结合。C/N有10条目,R/N有8条目,R/C有15条目实验组富集到的分子功能大于空白组。
从总体上看,水稻幼苗在BP、CC和MF富集到的前15条目中,加入壳寡糖会富集到更多水稻生长必需的条目,差异蛋白既能结合阴离子也能结合阳离子,推测其功能与白蛋白类似,既可以输送不同的物质,也可以将有毒物质输送到解毒器官,有利于水稻缓解低温胁迫造成的伤害,证明了壳寡糖会影响水稻的生命活动,特别是R/C表达的差异蛋白,从低温胁迫再到复性这一极度需要强大的恢复能力过程,加入壳寡糖可以调动更多的蛋白完成恢复过程。
2.4 壳寡糖对低温胁迫下水稻幼苗差异蛋白的KEGG代谢通路研究
为了研究水稻幼苗受壳寡糖影响的途径,本实验用KEGG进行通路富集分析,讨论光合作用途径中蛋白的变化情况。明恢63水稻幼苗DEPs富集的前10条关键性通路示于图4。可以发现,壳寡糖处理过的水稻在富集到的前10条关键通路里大多数差异表达蛋白数目大于空白组,表明壳寡糖在较大程度上影响富集到的关键通路里的蛋白,产生了大量的差异蛋白。
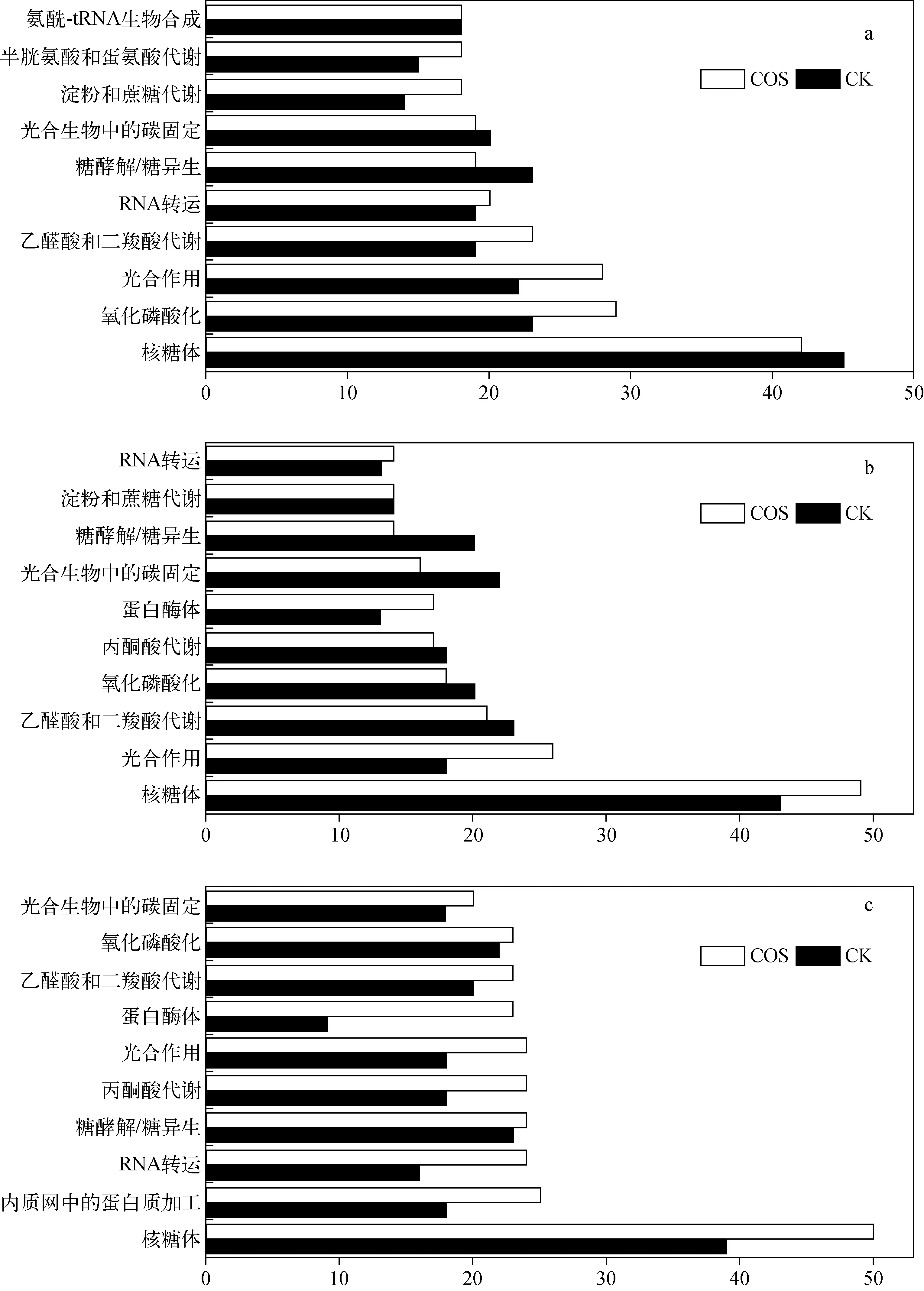
注:a.低温胁迫/正常生长;b.复性/正常生长;c.复性/低温胁迫图4 明恢63水稻幼苗DEPs富集的前10条关键性通路Fig.4 Top 10 key pathways of DEPs enrichment in rice seedlings of Minghui 63
2.4.1壳寡糖对低温胁迫下水稻幼苗光合作用的影响 由于水稻对低温有较高的敏感性,受寒会造成巨大的农业损失,因此,从蛋白质角度分析加入壳寡糖对水稻光合作用的影响。从图4可以看出,在空白组和实验组中,水稻幼苗DEPs对低温胁迫和复性的响应表现出不同的调控模式。实验组光合作用鉴定的蛋白数目大于空白组,加入壳寡糖后会有更多的蛋白服务于光合作用,从而产生有机物。明恢63水稻幼苗在光合作用途径中产生的共同蛋白列于附表3。明恢63水稻幼苗的空白组和实验组共产生27个共同蛋白,正常生长时有27个蛋白表达,有16个蛋白丰度高于空白组;低温胁迫时仅有26个共同蛋白表达,有9个蛋白丰度高于空白组;复性时仅有16个共同蛋白表达,有11个蛋白丰度高于空白组。结果表明,复性阶段前,很多共同蛋白均不表达,在复性时期才开始显现低温胁迫带给水稻的影响,相关蛋白显著下调。研究发现,正常生长和复性阶段的共同蛋白丰度大于空白组,说明水稻经壳寡糖处理后,一方面增强了光合作用,另一方面遏制了低温胁迫。
水稻光合作用途径中的差异蛋白结果列于附表4。明恢63实验组差异蛋白共有25个,其中C/N为10个,R/N为15个。明恢63水稻幼苗实验组C/N:光系统Ⅱ差异表达psbD、psbC、psbB,光系统I差异表达psaK,细胞色素b6f差异表达PetA;R/N:光系统Ⅱ差异表达psbC、psbB、psdD、psbE、psbF、psbS,光系统I差异表达psbC、psbE、psbH,细胞色素b6f差异表达PetA、PetC。可以看出,明恢63水稻幼苗中参与光合作用的差异表达蛋白大多来自更为重要的光系统Ⅱ,且R/N中差异表达的蛋白数量更多,在经历了低温胁迫后,水稻恢复能力较强,仍有大量蛋白参与水稻的光合作用,而空白组光合作用的相关蛋白活性被遏制。
本实验研究了光合作用的第二部分反应电子转移和光合磷酸化,从KEGG富集结果上看,壳寡糖处理过的水稻可以产生更多光合作用相关的蛋白;壳寡糖可以在正常生长环境下调控水稻共同蛋白的丰度,促进光合作用;低温胁迫会使相关蛋白不表达或者低表达,加入壳寡糖后会抵抗低温胁迫的影响,提高表达的蛋白丰度;加入壳寡糖后的水稻更倾向于产生一些独特的蛋白,特别是对于光系统中PSII这一关键复合体。
2.4.2壳寡糖对低温胁迫下水稻幼苗淀粉和蔗糖代谢的影响 水稻籽粒中糙米90%的物质来源于淀粉,而淀粉是籽粒代谢过程中主要的积累产物,其合成过程主要包括蔗糖分解、淀粉积累。蔗糖是糖分运输和贮存的主要形式,可降解为葡萄糖,转化为葡萄糖供体用于生长代谢。
从图4可以看出,水稻幼苗在加入壳寡糖后会产生更多的蛋白,用于淀粉和蔗糖的代谢作用,从而产生有机物。明恢63水稻幼苗在淀粉和蔗糖代谢途径中产生的共同蛋白列于附表5,空白组和实验组的蛋白相互作用通路示于图5,可见实验组的特异酶更多。水稻幼苗空白组与实验组共产生14个共同蛋白,正常生长、低温胁迫和复性时分别有3、9、3个蛋白丰度高于空白组。水稻幼苗蛋白情况的结果显示,复性阶段很多共同蛋白均不表达,水稻在复性时才开始显现低温胁迫带给水稻的影响,相关蛋白显著下调。复性阶段共同蛋白的丰度大于空白组,表明壳寡糖处理后,当水稻幼苗遇到寒冷胁迫时会增强淀粉和蔗糖的代谢作用,促进水稻生长发育,抵挡冷胁迫带来的伤害。
2.5 壳寡糖对低温胁迫下水稻幼苗RT-qPCR分析
为了阐明mRNA在转录水平上与蛋白表达水平之间的关系,同时证明蛋白结论的可靠性,本实验选取明恢63水稻幼苗10条关键性通路中富集的12种关键蛋白,利用RT-qPCR技术对实验组水稻幼苗进行转录相对表达水平上的验证。
以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,得到正常生长、低温胁迫、复性时每个基因的相对表达量,并以正常生长时基因的表达量为基准,对所有基因的表达量进行归一化处理,结果示于图6。其中,有6组DEPs表达水平与mRNA水平完全一致,分别是Q0JGK4(a)、A0A0P0XNM8(b)、Q6KA00(e)、Q5JK35(g)、A0A0E0K211(j)、A0A0E0AYY8(k);有3组DEPs表达水平与mRNA水平有部分一致,分别是Q6Z8K7(c)、Q7Y1F0(i)、A2WZT1(l);有3组DEPs表达水平与mRNA水平完全相反,分别是Q7F190(d)、Q0E2K1(f)、Q75GN6(h)。真核基因表达的转录和翻译发生的时间和位点存在时空间隔,在转录后,会有转录后翻译、翻译后加工及修饰等,因此,基因的转录水平并不总是与其相应的蛋白质水平一致。本研究结果证明了整个实验培养条件过程中水稻基因存在一部分翻译后修饰加工,但是大部分mRNA在转录水平上与蛋白表达水平一致,表明这些蛋白与mRNA转录水平有关。
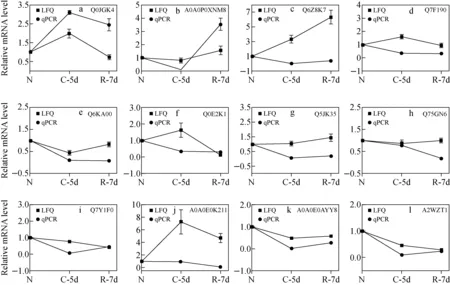
注:N为正常生长;C-5d为低温胁迫5天;R-7d为复性7天图6 12个代表性明恢63水稻幼苗DEPs的LFQ和qPCR比较分析Fig.6 Comparative analysis of LFQ and qPCR of 12 representative DEPs in rice seedlings of Minghui 63
导致RNA转录与蛋白不一致的因素较多。通常情况下,若RNA与蛋白表达趋于一致,那么可推测蛋白没有进行修饰,不存在这种变化;但对于真核生物而言,蛋白质可能发生翻译后修饰,也可能发生降解,或者进一步加工剪切形成复合体等多种变化,导致RNA和蛋白的变化趋势不一致,出现关联性较弱,甚至是相反的情况。
3 结论
本实验以明恢63水稻为研究对象,探究在低温胁迫下壳寡糖对其耐寒机理的诱导。通过生理生化指标得出:壳寡糖处理后的水稻幼苗长势优越,并能抑制低温胁迫导致的水稻幼苗叶片蜷曲、变黄等现象。壳寡糖对水稻幼苗叶绿素、可溶性糖、总氨基酸合成均有促进作用,有效地抑制了丙二醛含量的增加,提高了水稻幼苗根系活力及SOD、POD、CAT 3种抗氧化酶的活性。
基于无标记定量蛋白质组学技术分析得到,实验组蛋白鉴定数大于空白组。差异蛋白韦恩图表明,实验组有更多的相同蛋白抵御胁迫。GO分析结果表明,2种水稻富集到的前15条目基本一致,这些条目与水稻的生命活动密不可分,加入壳寡糖会富集到更多水稻生长必需的条目。从KEGG富集结果看,壳寡糖影响关键通路中的蛋白。通过观察光合作用中电子转移和光合磷酸化过程,推测壳寡糖可以在正常生长环境下调控水稻共同蛋白的丰度,促进光合作用;通过提升淀粉和蔗糖代谢途径中相关蛋白的活性,使表达的蛋白丰度提高,从而帮助水稻幼苗抵抗低温胁迫的影响。RT-qPCR结果表明,蛋白与mRNA转录水平有关,同时也验证了蛋白数据的可靠性以及必要性。

