复合菌群强化修复石油-氯酚污染土壤
李 婧,于钧泷,赵晓东,左 帅,刘其友,张秀霞,2
(1.中国石油大学(华东) 化学化工学院,山东 青岛 266580;2.石油石化污染物控制与处理国家重点实验室,北京 102206)
作业年限较长的油田井场或石化污染场地不仅石油烃污染严重,有机氯化合物也大量存在[1],原油中天然存在的有机氯化物含量一般较少[2],但在采油、炼油过程中因含氯化学助剂的使用,使得原油有机氯含量变高[3]。裴芳等[4]对某炼油厂退役场地监测结果表明,该场地石油和氯苯酚类物质污染严重,主要分布在储油罐所在地;葛锋等[5]调查分析了东北4个石化工业基地,主要污染物有总石油烃(TPHs)、多环芳烃(PAHs)、氯代烃等。由于石油烃和有机氯化合物的复杂性、持久性和致癌、致畸、致突变的“三致”效应,若不及时加以处理,环境问题便随之而来,甚至会造成胎儿致畸、人类致癌、生物中毒等危害[6]。因此,需要采取合适的方法解决石油烃和有机氯化合物复合污染问题。
石油烃和有机氯化合物复合污染的去除方法有物理法、化学法和生物法[7-8]。物理修复法和化学修复法可在短时间内有效去除污染物,但往往需要较高的能源消耗和设备成本。生物法因成本低及环境友好的特点,被誉为最具有发展前景的修复技术之一。由于石油烃和有机氯化合物复合污染对功能微生物具有较强的毒性或抑制性,单一降解菌的降解能力往往比微生物联合体要弱,污染物的降解需要多种酶和微生物的参与来完成,且不同微生物对石油烃和有机氯化合物各组分耐受性存在一定差异[9-10]。因此,构建复合菌群不仅可在复杂环境中提高微生物的降解能力,也可使微生物通过“分工协作”增强降解底物的广谱性[11]。已有研究者开展了相关复合菌群的效果研究,Steliga等[12]构建了复合物菌群M1,通过生物强化作用可在6个月时间内对多氯联苯实现降解率84.5%,石油烃的降解率可达到70.8%;黄霞[13]分离的微生物菌群可有效降解石油烃和氯代烃等有机混合污染物;Zhao等[14]研究表明,复合菌群中微生物的协同作用可以增强菌群的稳定性和耐受性。基于上述研究,构建微生物复合菌群修复石油-氯酚污染场地这一科学问题取得一定进展,尚需进一步探究。
笔者选取氯酚类化合物2,4-二氯苯酚与石油构建复合污染体系,以实验室筛选的石油烃降解菌和有机氯降解菌作为实验菌株构建复合菌群,强化修复石油-氯酚模拟污染土壤,考察修复过程中不同菌群对土壤石油及2,4-二氯苯酚降解率、微生物总数、脱氢酶活性和土壤群落结构的影响,为石油-氯酚复合污染场地的修复提供理论支持。
1 实验部分
1.1 原料和试剂
菌株:实验所用石油烃降解菌S4(粪产碱菌,AlcaligenesfaecailsY5)和S5(芽孢杆菌,Bacillussp.7614)是以某油田污染土壤为菌源、胜利原油为唯一碳源筛选驯化所得土著菌,菌株S4和S5在原油质量浓度为2 g/L的无机盐原油培养基中,对石油烃的7 d降解率分别为26.46%和37.54%;有机氯降解菌L3(马氏芽孢杆菌,Bacillusmarisflavistrain BCB4-1)和L4(水芽孢杆菌,BacillusaquimarisT 172)是以某污水处理厂二沉池活性污泥为菌源、2,4-二氯苯酚为唯一碳源筛选驯化所得,菌株L3、L4在2,4-二氯苯酚质量浓度为50 m g/L的无机盐培养基中,对2,4-二氯苯酚7 d的降解率分别达到68.63%、71.84%。菌株S4和S5按体积比3∶2构建石油烃降解菌群,菌株L3和L4按体积比为3∶2构建有机氯降解菌群,S4、S5、L3和L4按体积比1∶2∶2∶1构建复合菌群。
培养基:牛肉膏蛋白胨培养基(1 L)成分为牛肉浸膏5.0 g、胰蛋白胨10.0 g、氯化钠5.0 g,固体培养基添加15.0 g琼脂粉;孟加拉红培养基(36.6 g/L),购自国药集团化学试剂有限公司;pH值调至7.0~7.3,在1×105Pa、121 ℃条件下灭菌20 min。
胰蛋白胨、牛肉浸膏、琼脂粉、氯化钠、石油醚(60~90 ℃)、石油醚(30~60 ℃)、正己烷、磷酸二氢钾、硝酸钠,均为分析纯,购自国药集团化学试剂有限公司;甲醇、2,4-二氯苯酚(质量分数98%),均为色谱纯,购自上海麦克林生化科技有限公司。原油来自胜利油田某采油厂,密度(20 ℃)为891 kg/cm3,运动黏度(50 ℃)为31.05 mm2/s。供试土壤,取自校园内绿植土壤,取样后去除动植物残体并在自然环境下风干,经破碎研磨,过2 mm筛后备用,主要性质见表1。
1.2 模拟污染土壤的制备
根据油田污染井场实际情况,设置模拟污染土壤中石油烃质量分数为10 g/kg,2,4-二氯苯酚质量分数为500 g/kg。将原油和石油醚(30~60 ℃)按照体积比1∶4进行混合,然后按石油烃质量分数10 g/kg均匀掺入供试土壤中,自然风干7 d至石油醚挥发完全;然后用磷酸二氢钾和硝酸钠调节土壤中元素C、N、P的质量比为100∶10∶1[15]得到含油土壤样品。配制质量浓度为4 g/L的2,4-二氯苯酚储备液,按2,4-二氯苯酚质量分数0.5 g/kg均匀掺入含油土壤样品中,置于通风橱中老化平衡2 d后得到石油-2,4-二氯苯酚复合污染土壤样品,即为模拟污染土壤样品。
1.3 模拟污染土壤修复实验
将500 g模拟污染土壤样品平均分成4份置于花盆中,4个花盆对应土壤的4种修复方式:①自然修复(A);②石油烃降解菌S4、S5修复(B);③有机氯降解菌L3和L4修复(C);④石油与有机氯降解菌S4、S5、L3、L4修复(D)。每种处理方式下菌液均按照质量分数10%的接种量接种于花盆土壤。在温度35 ℃、修复时间130 d的条件下进行模拟污染土壤修复实验,修复过程中调节土壤含水质量分数15%~20%,每7 d翻土一次并进行采样分析。在石油-氯酚模拟污染土壤修复过程中的第7、14、28、42、56、70、98、130 d取样,分别测定修复土壤样品中的石油烃含量、2,4-二氯苯酚含量、微生物总数以及土壤脱氢酶活性,并对以上4种修复方式在不同时间内对土壤微生物群落结构的影响进行了检测。
模拟污染土壤的石油烃降解率(η1,%)按式(1)进行计算。
(1)
式(1)中:ws,0为模拟污染土壤中石油烃质量分数,mg/kg;ws,t为模拟污染土壤经过不同时间t修复后土壤中石油烃的质量分数,mg/kg。
模拟污染土壤的2,4-二氯苯酚降解率(η2,%)按式(2)进行计算。
(2)
式(2)中:wd,0为模拟污染土壤中2,4-二氯苯酚质量分数,mg/kg;wd,t为模拟污染土壤经过不同时间t修复后土壤中2,4-二氯苯酚质量分数,mg/kg。
1.4 高通量实验
取模拟污染土壤经过4种修复方式(A、B、C、D)处理修复7 d(修复平衡的第一周)后的土壤样品作为初始样品,分别记作A1、B1、C1、D1,修复130 d后的土壤样品记作A2、B2、C2、D2,委托上海美吉生物医药有限公司对土壤样品进行高通量测序,对土壤修复过程中微生物群落结构变化分析进行补充[16]。高通量测序方法流程:利用土壤DNA提取试剂盒提取土壤样品的总DNA,然后利用1%琼脂糖凝胶电泳检测DNA的完整性与纯度,放入-20 ℃冰箱备用,利用V3-V4区的通用引物进行第一轮PCR扩增和产物纯化,接着对PCR产物定量与均一化,然后构建PE文库,最终进行Illumina测序。
1.5 土壤样品分析方法
采用上海元析仪器公司生产的UV-6000P型紫外可见分光光度计,利用超声萃取-紫外分光光度法测定土壤样品中石油含量[17]。采用《土壤和沉积物石油烃(C10~C40)的测定——气相色谱法》(HJ 1021—2019)对土壤石油烃(C10~C40)组分进行定性分析,选用索式提取法进行提取,经浓缩、净化后测试,使用安捷伦科技有限公司生产的7890B-5977C型气相色谱仪进行检测,气相色谱测试条件:载气为高纯氦气,流量1.0 mL/min,进样口温度320 ℃,进样量1.0 μL,进样方式为分流进样,分流比10∶1,HP-5MS色谱柱,程序升温,初始温度60 ℃,保留2 min,以15 ℃/min升至320 ℃,保留2 min。采用高效液相色谱法测定2,4-二氯苯酚浓度,土壤中2,4-二氯苯酚用甲醇提取[18],使用日本岛津公司生产的LC-20A型高效液相色谱仪进行检测,测定条件为:检测波长284 nm,V(甲醇)∶V(纯水)=50∶50,进样量10 μL,色谱柱为Shim-pack GIST-HP C18,流速0.5 mL/min。采用稀释涂布平板法测定土壤可培养细菌、真菌的数量[19-20]。采用2,3,5-三苯基氯化四氮唑(TTC)还原法测定土壤脱氢酶活性[21]。
2 结果与讨论
2.1 土壤修复过程中石油烃降解率变化
采用4种修复方式(A、B、C、D)对模拟污染土壤进行修复实验,不同修复时间下模拟污染土壤中石油烃降解率的变化结果见图1。

A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图1可以看出,D组模拟污染土壤第130 d时的石油烃降解率达到77.68%,此时土壤样品中石油质量分数为2353.82 mg/kg,符合第二类建设用地土壤污染风险筛选值(4500 mg/kg)的标准,比相同条件下B、C组土壤中石油烃降解率分别提高18.14和19.78百分点,这可能是石油烃降解菌群和有机氯降解菌群之间具有协同作用促进了菌群对石油烃的降解。加入的有机氯降解菌可以降解2,4-二氯苯酚,证明菌株体内含有相关的双加氧酶、脱卤酶及脱氢酶基因[22]。有机氯降解菌也可降解部分石油烃中含有的芳香烃,因此复合菌群扩大了不同微生物降解石油烃的范围,多种菌混合后可实现降解能力的互补[23-24]。
2.2 土壤修复过程中石油烃组分变化
为进一步考察石油-有机氯复合菌群对土壤石油烃(C10~C40)组分强化降解作用,对4种修复方式(A、B、C、D)处理模拟污染土壤130 d后的土壤中提取出的石油烃进行气相色谱法分析,以石油烃类峰强的高低代表石油烃的降解程度,结果见图2。

A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图2可知,B、D组模拟污染土壤在第130 d时,石油烃中C27-所有烃类峰的强度均显著降低,且D组土壤样品的效果更明显,与Schink[25]得出的石油烃中C4~C20中更易被微生物降解的结论一致,复合菌群的添加更好地利用并降解短链烃。而C27+烃类由于其碳链长、相对分子质量大等原因,使得土壤微生物对这部分烃类利用度较低[26-27]。而C组土壤中碳数烃类的峰降低幅度都比较小,表明该菌群对石油烃的降解率低,这可能是单一的有机氯降解菌具有降解底物的专一性,对石油烃不敏感所致。
2.3 修复过程中2,4-二氯苯酚降解率变化
采用4种修复方式(A、B、C、D)对模拟污染土壤进行修复实验,不同修复时间下模拟污染土壤中2,4-二氯苯酚降解率的结果见图3。

A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图3可知:修复时间在130 d时,A组模拟污染土壤中2,4-二氯苯酚降解率为46.74%,可见土壤中2,4-二氯苯酚挥发性较强。D组土壤中2,4-二氯苯酚降解率持续上升,在第70 d时达到100%;C组土壤中2,4-二氯苯酚的降解速率略低于D组,其降解率在第100 d时达到100%。修复过程中前60 d,C和D组土壤的降解率无统计学差异,而60 d后D组降解率继续升高,这是由于复合菌群对土壤环境适应性更强,更利于维持2,4-二氯苯酚的稳定降解[28-30]。第130 d时,B组土壤中降解率为69.74%,测得此时2,4-二氯苯酚质量分数为150.54 mg/kg,符合第一类建设用地土壤污染风险管制值(234 mg/kg)的标准。综上,向石油-氯酚复合污染土壤中添加复合菌群,在促进2,4-二氯苯酚降解的同时保证了菌群降解能力的稳定性。
2.4 土壤修复过程中微生物总数变化
微生物数量反映土壤微生物群落大小,是土壤生物活性的重要组成部分,微生物的增殖、选择和竞争过程实际上就是土壤中石油烃和2,4-二氯苯酚的降解过程。在模拟污染土壤修复过程中分别对A、B、C、D组土壤样品在第7、14、28、42、56、70、98、130 d取样,测定这4组土壤样品中的细菌总数和真菌总数,实验结果见图4。

A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图4(a)可知:在前28 d中,A组模拟污染土壤中细菌总数小幅增加,这是由于土壤中土著菌也会以石油烃和2,4-二氯苯酚作为碳源,促进了土著菌群的繁殖;D组土壤中细菌总数增长最快,其细菌总数在第28 d时达到最大值(9.2×107CFU/g soil),表明复合菌群在石油-氯酚复合污染土壤中对环境的适应能力最强[31]。而B、C组土壤中细菌总数较少,这是由于单一种类微生物对污染物更加敏感。4组土壤中的微生物数量达到最大值后便有下降趋势,与陈凯丽等[32]的研究结果类似,同时结合图2中第130 d时碳数在27以上的烃类残留量较高,表明复合菌群难以利用相对分子质量较大的污染物作为碳源,导致其生长受到抑制。因此修复130 d后,B、C、D组土壤中的细菌总数基本恢复到修复前水平。图4(b)显示了4组土壤中真菌总数的变化,其变化趋势与细菌总数类似。D组土壤中真菌数量最多,其最大值为6.5×105CFU/g soil,B、C组土壤中真菌数量无统计学差异,表明向石油烃-氯酚复合污染土壤中加入复合菌群可以促进真菌的生长。有研究表明,部分真菌含有利于芳环类化合物开环的酶[33],由此可推测真菌在修复污染土壤的过程中也发挥了作用。
2.5 土壤修复过程中土壤脱氢酶活性变化
脱氢酶可促进石油的脱氢,菌株可以通过脱氢酶作用于石油中的氢原子,使之激活并将其转移至受氢体[34],2,4-二氯苯酚的降解也离不开脱氢酶的催化作用。不同修复方式处理模拟污染土壤修复过程中土壤脱氢酶活性随时间的变化结果见图5。
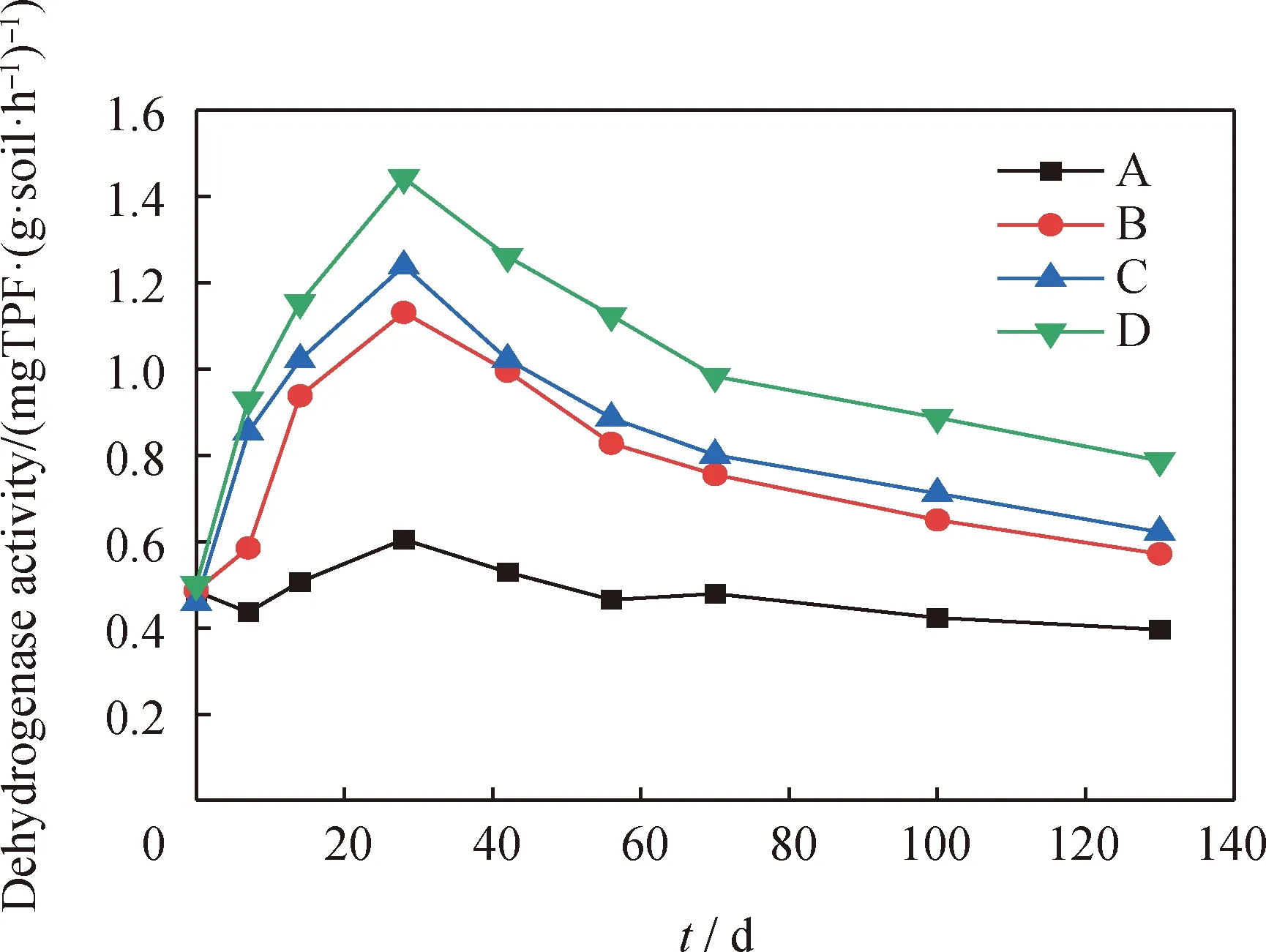
A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图5可知,随着修复时间的延长,4组土壤中脱氢酶活性均呈现先升高后下降的趋势,与图4的变化趋势相一致。D组土壤中脱氢酶活性始终高于其余组,其最高值可达到0.79 mg TPF/(g soil·h-1),这归因于添加复合菌群土壤中较多的微生物数量,且菌群机体内代谢活动旺盛[35]。在修复后期,各组土壤脱氢酶活性降低,这是因为土壤的生物利用度逐渐降低,抑制了酶活性,从而减弱了微生物的代谢能力。
2.6 土壤微生物总数、脱氢酶活性与石油及2,4-二氯苯酚降解率的相关性
通过上述讨论,证明了修复过程中土壤微生物总数及酶活性对石油及2,4-二氯苯酚降解率存在一定关系。采用SPSS 26.0软件分析D组模拟污染土壤修复130 d后的土壤样品中土壤细菌、真菌总数、脱氢酶活性与污染物降解率之间的相关性,结果见表2。

表2 土壤微生物总数、脱氢酶活性与石油烃降解率(η1)及2,4-二氯苯酚降解率(η2)的相关性
由表2可以看出,土壤细菌、真菌总数、脱氢酶活性与石油烃降解率及2,4-二氯苯酚的降解率均成正相关,相关性显著,且土壤真菌总数与石油烃降解率及2,4-二氯苯酚降解率相关性系数最高,分别为0.606、0.636,表明真菌对石油烃和2,4-二氯苯酚2种污染物的去除方面作用明显。结合图4和图5可知,添加复合菌群的土壤中微生物总数及脱氢酶活性均高于添加单一降解菌的土壤。可见,细菌、真菌总数与脱氢酶在石油烃和2,4-二氯苯酚降解过程中发挥了至关重要的作用。
2.7 高通量测定群落结构变化
2.7.1 Alpha多样性分析
对模拟污染土壤经过4种修复方式(A、B、C、D)处理7 d后采集的土壤样品A1、B1、C1、D1和130 d后采集的土壤样品A2、B2、C2、D2进行Alpha多样性指数分析,结果见表3。
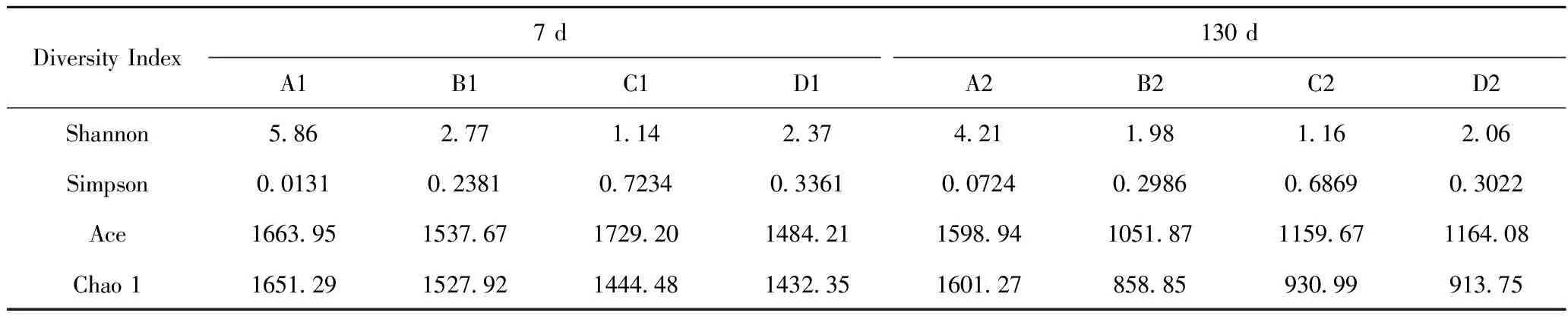
表3 模拟污染土壤经过4种修复方式处理7 d和130 d后的土壤样品的微生物多样性指数
由表3可知,模拟污染土壤进行处理修复130 d后,样品A2和B2的Simpson指数略有增大,这归因于污染物的加入刺激了土壤中具有降解能力的优势微生物种群的生长[36]。然而其余多样性指数较第7 d时均有不同程度的下降,这表明模拟土壤中微生物群落物种和多样性均降低,添加的石油烃和2,4-二氯苯酚破坏了土壤环境,随着修复时间的推移,土壤微生物群落的多样性、丰富度以及均匀度均降低,从而影响土壤微生物种群的代谢活性[37],使得复合菌群在修复污染土壤后期对污染物的代谢速率逐渐降低。
2.7.2 土壤细菌群落结构变化
对模拟污染土壤经过4种修复方式(A、B、C、D)处理7 d后采集的土壤样品A1、B1、C1、D1和130 d后采集的土壤样品A2、B2、C2、D2进行微生物的门水平和属水平的相对丰度分析,结果见图6和图7。

A—Natural remediation;B—Petroleum hydrocarbon degrading bacteria;C—2,4-Dichlorophenol degrading bacteria;D—Petroleum hydrocarbon and 2,4-dichlorophenol degrading bacteria
由图6可知,4组模拟污染土壤样品中的主要菌门为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)和变形菌门(Proteobacteria)。当修复过程进行到第7 d时,B、C、D组土壤样品中厚壁菌门均成为优势菌门,其相对丰度显著增大,均达到60%以上,而A组土壤样品中厚壁菌门的相对丰度基本不变。厚壁菌门丰度的增加主要是来源于添加的菌群中的芽孢杆菌属,而该菌属对降解石油及氯酚具有重要作用[38]。当修复过程进行到第130 d时,B、C、D组土壤样品中厚壁菌门的相对丰度相较于第7 d有不同程度的增加,这说明修复过程中添加的芽孢杆菌属受土壤污染物刺激生长。
由图7可知,与A组相比,B、C、D组土壤中修复后芽孢杆菌属(Bacillus)和苍白杆菌属(Ochrobactrum)成为优势菌属。D组土壤中修复后芽孢杆菌属和苍白杆菌属的相对丰度略有增长,表明这两类菌属在污染土壤中生长代谢稳定,芽孢杆菌属来源于添加的有机氯降解菌L3、L4和石油烃降解菌S5,研究表明芽孢杆菌属对石油及氯酚化合物有很好的降解能力[39]。产碱杆菌属(Alcaligenes)来自添加的石油烃降解菌S4。A组土壤优势菌属由节细菌属(Arthrobacter)和Norank_f_norank_o_norank_c_KD4-96菌属转变为诺卡氏菌属(Nocardioides)、红球菌属(Rhodococcus),这两类菌在修复石油烃污染土壤及氯酚污染土壤中均有广泛研究[40]。在B组土壤中,苍白杆菌属(Ochrobactrum)的相对丰度变化不大,芽孢杆菌属(Bacillus)丰度明显增多,推测是添加的菌株S5具有较强的生存繁殖能力,相比较于D组土壤,B组土壤在第130 d后产碱杆菌属(Alcaligenes)丰度的降低更为明显,这可能是由于加入的石油烃和2,4-二氯苯酚抑制其生长代谢,2,4-二氯苯酚的存在抑制了其对石油的降解效果,这也进一步表明在D组土壤中,有机氯降解菌的存在可以提高石油烃降解菌S4的生存能力[37]。对于C组土壤,修复前后各微生物菌属相对丰度变化不大,恢复到初始土壤微生态群落结构,表明土壤微生物菌群在受污染土壤恢复及维持群落结构稳定性方面发挥了重要作用。
3 结 论
(1)制备含水质量分数15%~20%、石油烃质量分数10 g/kg、2,4-DCP质量分数500 mg/kg的模拟污染土壤,采用不同的修复方式进行土壤修复实验。结果表明:添加石油-有机氯复合降解菌群进行模拟污染土壤修复的效果最佳,修复130 d后石油烃降解率为77.68%,2,4-二氯苯酚降解率为100%,比仅添加石油烃降解菌群或有机氯降解菌群的修复方式下的石油烃降解率分别提高18.14和19.78百分点。其中,被降解的石油烃主要为碳数小于27的中短链烃。
(2)添加石油-有机氯复合降解菌群进行模拟土壤修复后的土壤样品中脱氢酶活性最高,微生物总数最多,脱氢酶活性及细菌、真菌数量在修复28 d前呈升高趋势,28 d后有所下降,且三者与石油烃降解率及2,4-二氯苯酚降解率之间呈正相关。
(3)在石油烃-有机氯的复合污染胁迫下,模拟污染土壤经过不同修复方式处理后的土壤中微生物Alpha多样性指数降低。高通量测序分析表明,添加菌群强化的土壤中在修复前后厚壁菌门(Firmicutes)均为优势菌门,放线菌门(Actinobacteria)所占比例下降;同时,添加石油-有机氯复合菌群的土壤中修复后芽孢杆菌属(Bacillus)和苍白杆菌属(Ochrobactrum)成为优势菌属,所占比例上升。

