基于RNA-seq的甘薯芽变株系类胡萝卜素基因代谢差异分析
赵冬兰 赵凌霄 刘 洋 张 安 戴习彬 周志林 曹清河
基于RNA-seq的甘薯芽变株系类胡萝卜素基因代谢差异分析
赵冬兰*赵凌霄 刘 洋 张 安 戴习彬 周志林 曹清河
江苏徐淮地区徐州农业科学研究所/ 农业农村部甘薯生物学与遗传育种重点实验室, 江苏徐州 221131
为研究甘薯类胡萝卜素代谢的分子机制, 本研究以浙薯81及其芽变系为材料, 利用RNA-seq技术研究了浙薯81及其芽变系的薯皮(红色变黄色)和脉基(紫色变绿色)类胡萝卜素代谢相关基因。经过生物信息学分析, 在薯皮和脉基分别筛选出24个和10个差异表达基因(DEGs), 其中有4个DEGs同时存在于薯皮和脉基中。类胡萝卜合成代谢上游途径中, 与浙薯81相比, 芽变系薯皮中的牻牛儿基牻牛儿基焦磷酸合酶基因(、)、番茄红素合成酶基因()和ζ-胡萝卜素异构酶基因()均显著上调,()仅在突变系中有表达; 脉基部在类胡萝卜素上游代谢途径中没有筛选到DEGs。番茄红素环化分支点后, 在薯皮中检测到2个β-胡萝卜素羟化酶基因(、), 与浙薯81相比, 芽变系中下调表达,则上调表达。在薯皮和脉基分别检测到一个玉米黄质环氧化酶基因, 薯皮中的()显著下调, 脉基部的()显著上调。类胡萝卜素分解代谢中突变体薯皮中类胡萝卜素裂解双加氧酶基因()下调表达; 2个9-顺式环氧类胡萝卜素加氧酶基因(、)在突变系的薯皮和脉基中均下调表达; 此外在薯皮和脉基分别检测出5个黄氧素脱氢酶基因, 薯皮中有4个上调表达, 而脉基中的则全部下调表达。利用实时定量PCR (qRT-PCR)验证了部分基因的表达模式, 与RNA-seq分析结果一致。该研究对甘薯类胡萝卜素代谢的分子机制及解析甘薯薯皮和脉基不同颜色突变具有重要参考价值。
甘薯; 转录组测序; 类胡萝卜素; 差异基因; 颜色变异
类胡萝卜素是在自然界中广泛存在的第二大天然色素, 目前已报道约有800种。它是由异戊二烯骨架组成的C40或C30脂溶性萜类化合物, 广泛存在于微生物、植物、动物及人体内, 仅在植物和微生物中合成[1-2]。在植物细胞中, 类胡萝卜素主要位于质体, 除了具有光保护、抗氧化等[3]多种生理功能外, 还与植物的生长发育相关, 其氧化酶解的产物是植物重要激素脱落酸(ABA)和独脚金内酯(SL)的合成前体[4-5]。同时类胡萝卜素是重要的显色化合物之一, 不同种类的类胡萝卜素组成和含量赋予植物黄色到红色等深浅不同的丰富色彩[2]。人类本身不能合成类胡萝卜素, 但它对人类健康和营养起着重要作用, 具有维生素A活性、治疗白内障、预防癌症、调节免疫力、延缓衰老等多重功效, 被广泛用做抗氧化剂和食品医药添加剂[6-7]。
甘薯是世界上重要的粮食和能源作物, 其用途日益广泛, 尤其是随着人们健康意识的增强, 甘薯作为保健食品越来越受到人们重视, 橘红肉甘薯的类胡萝卜素含量超过一般的水果蔬菜而备受青睐[8]。甘薯中类胡萝卜素的主要成分是β-胡萝卜素及其近似衍生物, 其含量约占总胡萝卜素近90%[9-10]。目前甘薯上对类胡萝卜素的研究主要集中在对橘红肉甘薯薯肉中类胡萝卜素的测定与提取[11-12]、环境与类胡萝卜素的基因型互作[13]以及不同加工方式对类胡萝卜素含量的影响[14-15]等, 对类胡萝卜素生物合成途径的调控作用机制研究较少, 已有的报道大多是借鉴其他植物类胡萝卜素代谢酶催化途径相关基因研究结果, 对甘薯中类胡萝卜素合成的相关基因进行分离和组织表达。程洁等[16]克隆了甘薯的八氢番茄红素合成酶基因, 在拟南芥中超表达后, 拟南芥叶片中类胡萝卜的含量明显提高; 有报道表明过表达番茄红素β环化酶可以显著提高转基因甘薯中的α-胡萝卜素、β-胡萝卜素、叶黄素、β-隐黄质和玉米黄质的含量, 增强了甘薯对盐、干旱和氧化胁迫的耐受性[17]。另外, Park等报道甘薯橙色基因()可以促进甘薯类胡萝卜素积累, 过表达的转基因甘薯植株对高温(47℃)和干旱等非生物胁迫表现出较强的耐受性, 是由于包括β-胡萝卜素在内的类胡萝卜素含量增加所致; 有趣的是在该转基因植株中类胡萝卜素裂解双加氧酶4()也显著上调, 在富含类胡萝卜素的叶片和块根中都有较高的表达; 体外类胡萝卜素裂解试验表明β-胡萝卜素是IbCCD4的主要底物, 酵母双杂和蛋白质体外结合试验表明IbOr和IbCCD4之间存在互作, 但这种互作并不影响β-胡萝卜素的降解[18]。芽变, 源于体细胞自然发生的遗传物质的变异, 甘薯芽变性状通过无性繁殖稳定传递给后代, 便于选择利用的芽变位于薯块和茎蔓上, 薯块上的芽变通过薯块育苗得以应用。许多甘薯良种是由芽变获得的。中国科学院遗传研究所1964年从胜利百号芽变体中选出的北京红, 产量和品种都比胜利百号有明显提高[19]。另外从抗甘薯瘟病的闽抗329的芽变中选出兼抗蔓割病的闽抗33, 从豫薯王芽变体中选出高淀粉品种铜薯1号[20]等。本研究利用田间发现的薯皮色和脉基色发生变化的芽变材料, 采用转录组测序技术, 应用生物信息学方法对测序结果进行分析, 在薯皮和脉基共检测出6260 DEGs, 其中二者共有的DEGs 536个, 在薯皮和脉基中的上调表达/下调表达分别为219个/317个和283个/253个。薯皮中共检测到4742个DEGs, 芽变系中2529个DEGs上调表达, 2195个DEGs下调表达; 脉基部共检测到2072个DEGs, 其中1013个DEGs上调表达, 1059个DEGs下调表达。本研究通过对薯皮和脉基中类胡萝卜素代谢相关DEGs进行分析, 并对部分基因进行了qRT-PCR验证, 探索甘薯类胡萝卜素形成与积累的分子机制, 为开展甘薯类胡萝卜素分子育种提供参考。
1 材料与方法
1.1 试验材料及样品采集
本研究以甘薯品种浙薯81及其芽变株系为材料。浙薯81萌芽性中等, 中长蔓, 茎蔓较粗, 叶片心形带齿, 叶脉淡紫色, 脉基紫色, 茎蔓绿带紫。薯形长纺, 紫红皮橘红肉, 结薯较集中薯块较整齐。芽变系是由2017年收获时发现的一个芽变体繁育而来。该芽变系与浙薯81相比较, 薯皮和脉基颜色发生了变异, 薯皮颜色由红色变为黄色, 脉基的紫色褪去, 变为绿色(图1)。在生长势、叶形、叶色、茎蔓色, 薯肉色等方面没有明显差异, 但芽变系的单株结薯数较浙薯81多。经过多年大田种植观察, 该芽变系的颜色变异能够稳定遗传, 而且薯皮色改变在薯块膨大初期(栽插后50 d)就已经发生。浙薯81和芽变系种植在江苏徐州甘薯研究中心试验田, 2020年6月26日栽插, 8月17日进行样品采集。取膨大初期的薯块, 用刀片刮取薯皮, 用剪刀取叶片的脉基部约0.3 mm, 每个部位取3个重复, 每个重复分别从5个植株上采集, 一共12个样品。采集后立即放入液氮中1 h, 随后放入-80℃冰箱待用。
1.2 总类胡萝卜素测定
总类胡萝卜素含量测定参考Ma等[21]的方法, 取样时期和取样部位同1.1。分别取新鲜薯皮和叶脉基部材料各1 g, 每个部位3个重复, 每个重复分别从3个植株上采集, 加入2 mL丙酮研磨并反复抽提, 直至上清液无色。将上清液定容至10 mL, 取1 mL测定454 nm的吸光度, 根据吸光度计算样品中总类胡萝卜素含量。
1.3 转录组测序与分析
用1.1中的冻存样品提取总RNA, 构建cDNA文库, 测序及分析委托武汉迈特维尔生物科技有限公司(https://www.metware.cn/, 迈维代谢)完成。将经过预处理的测序数据与参考基因组[22](https://sweetpotao. com/download_genome.html)进行比对分析。利用DESeq2软件进行样品组间差异表达分析, 对获得的差异基因进行功能注释和富集分析。具体方法见笔者已有报道[23]。利用迈维代谢云平台的绘图工具高级富集气泡图(https://cloud.metware.cn/)对KEGG富集分析作图, 可视化展示富集分析结果。利用该云平台的高级聚类热图对富集到的差异基因做表达热图。

图1 浙薯81及其芽变体颜色变异
A, B: 浙薯81和芽变系叶脉基部颜色对比, A为浙薯81, B为芽变系。C: 浙薯81与芽变系薯块膨大初期薯皮对比。D: 浙薯81芽变体薯块。标尺为5 cm。
A, B: phenotype comparison of leaf vein base color of Zheshu 81 (A) and its mutant (B). C: phenotype comparison of storage root skin color of Zheshu 81 (left) and its mutant (right). D: the mutant of Zheshu 81 discovered in field. Bar: 5 cm
1.4 实时荧光定量PCR (qRT-PCR)技术
根据转录组数据的注释及与类胡萝卜素合成相关的差异基因序列, 利用NCBI的Primer-BLAST (https:// www.ncbi.nlm.nih.gov/tools/primer-blast/)在线设计引物, 以甘薯肌动蛋白(ACTIN, EU250003.1)[24]为内参基因, 上游引物5¢-CCAGACTCCTCATACTCCCC T-3¢, 下游引物5¢-TGGTGGCTCTACAATGTTCCC-3¢。用RevertAid RT反转录试剂盒合成cDNA, 荧光定量PCR在QuantStudio 6 Flex (美国赛默科技公司)上进行。10 μL反应体系: 含有5 μL 2×SYBR Premix ExII (TAKARA), 正向和反向引物各1 μL, 1 μL模板cDNA (200 ng μL-1), 2 μL灭菌水。反应程序为: 95℃预变性2 min; 95℃15 s, 60℃ 50 s, 40个循环。qRT-PCR的数据分析采用2-DDCt方法[25]。
1.5 数据分析
试验数据采用Microsoft Excel软件分析绘图, 标准差用3次重复的标准偏差,值用T.TEST函数进行计算, 用T检验进行差异显著性分析。
2 结果与分析
2.1 浙薯81及其芽变系类胡萝卜素含量
花青素是一类水溶性色素, 存在于植物表皮细胞的液泡中, 呈现橙色到红、紫、蓝、黑色, 显现出十分广泛的色系, 是决定被子植物花、果实和种皮等颜色的重要色素之一。前面我们报道了浙薯81薯皮和脉基部黄酮类物质尤其是花青素含量远远高于突变系, 分别大约是突变系的6倍和23倍, 推测花青素含量的极大差异是造成浙薯81薯皮和脉基颜色发生突变的主要原因[23]。类胡萝卜素也是一类重要的天然色素, 普遍存在于动物、高等植物、真菌、藻类的黄色、橙红色或红色的色素中, 浙薯81的颜色变异与类胡萝卜素究竟有没有关系?本研究测定了浙薯81及其芽变系薯皮及脉基部的类胡萝卜素含量,结果如图2所示, 薯皮和脉基部类胡萝卜素含量差异显著, 脉基的类胡萝卜素含量比薯皮中的高。突变系薯皮中的类胡萝卜素含量较浙薯81的增加8.99%, 脉基部则比浙薯81降低9.98%。
2.2 差异基因的KEGG富集分析
本研究共筛选到差异表达基因(DEGs) 19,970个,其中脉基部DEGs有2072个(1059个上调, 1013个下调), 薯皮的DEGs有4724个(2195个上调, 2529个下调)。Gene Ontology (简称GO)是基因本体联合会建立的数据库,是基因功能国际标准分类体系。GO分为分子功能(molecular function)、生物过程(biological process)、和细胞组成(cellular component) 3个部分。本研究中脉基部差异基因GO聚类分析, 细胞成分、生物过程和分子功能分别有1331个、1235个和1347个差异基因。薯皮中, 在生物过程、分子功能和细胞成分3个部分则分别鉴定出2900个、3197个和3054个差异基因。对差异表达基因的通路注释分析有助于进一步解读基因的功能。KEGG (Kyoto Encyclopedia of Genes and Genomes, https://www.genome.jp/ kegg)是整合了基因组、生物学通路、疾病、药物、化学物质等信息的综合性数据库[26], 将基因注释到KEGG数据库后, 统计每个KEGG通路包含的DEG数量。以KEGG数据库中的Pathway为单位, 应用超几何检验, 找出与整个基因组背景相比, 在DEG中显著性富集的Pathway。本研究浙薯81及其芽变系的脉基部富集到119条Pathway, 薯皮中富集到130条Pathway。富集最显著的前20条Pathway如图3所示。图中的Rich factor指该pathway中富集到的差异基因个数与注释基因个数的比值。Rich factor越大, 表示富集的程度越大;-value为显著性检验值,-log10(-value)越大, 表示富集越显著。2个部位富集最显著的20条通路中有7条相同, 最显著的通路都是次生代谢物生物合成(Biosynthesis of secondary metabolites, ko01110), 而且类胡萝卜素生物合成通路(Carotenoid biosynthesis, ko00906)都显著地被富集到(-value分别为4.09E-05, 2.04E-02)。薯皮和脉基在该通路上富集到DEG个数分别为24和10。另外薯皮还富集到与类胡萝卜素合成相关的萜类骨架生物合成通路(Terpenoid backbone biosynthesis, ko00900), 该通路为类胡萝卜素合成提供前体物质异戊烯二磷酸(IPP)和直接前体物质牻牛儿基牻牛儿基焦磷酸(GGDP)。

图2 浙薯81及其芽变系类胡萝卜素含量
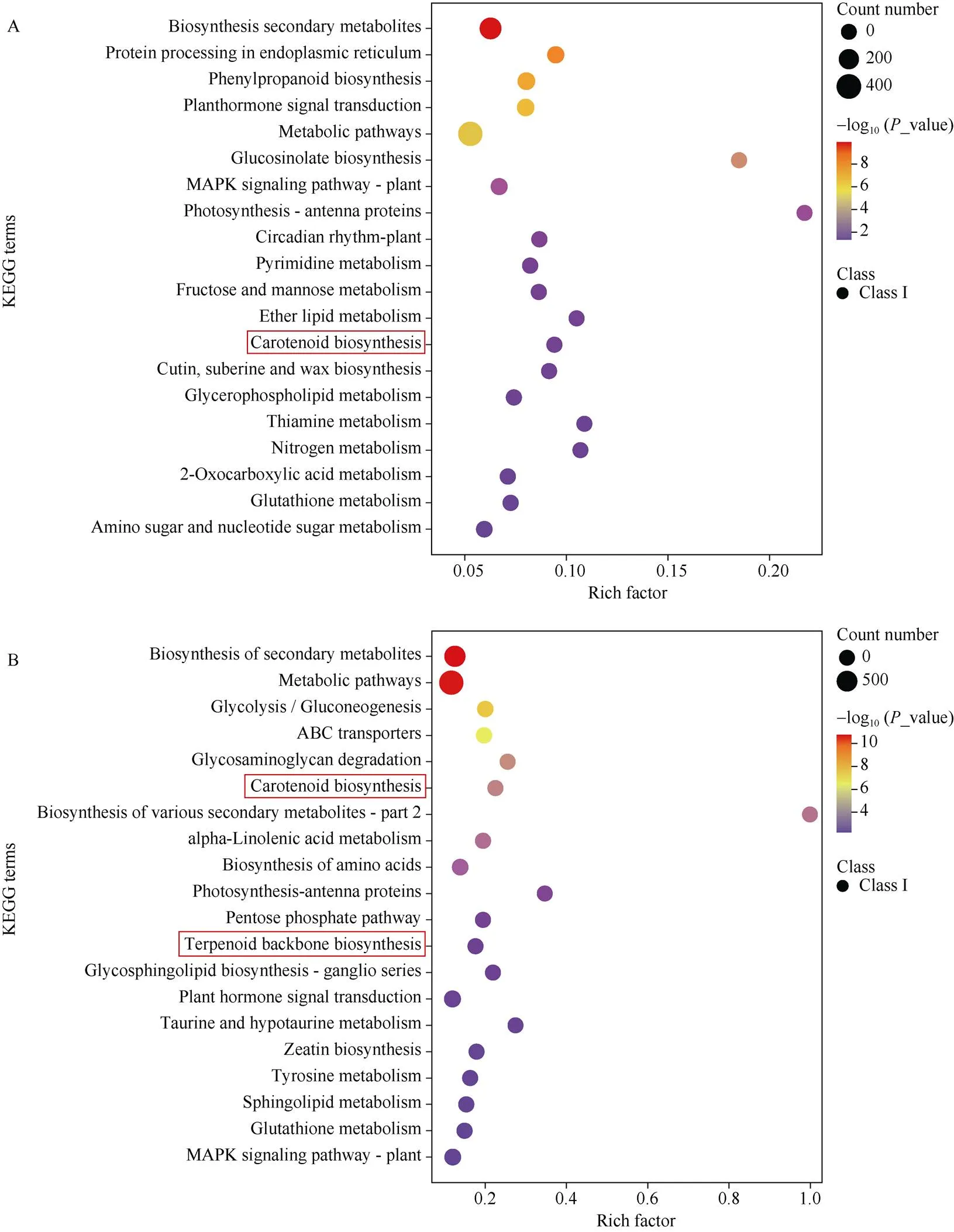
图3 浙薯81及其突变系差异基因KEGG通路富集散点图
A: 叶脉基部差异基因KEGG富集前20条通路; B: 薯皮差异基因KEGG富集前20条通路。红色方框内是本研究重点关注通路。
A: the top 20 of KEGG enrichment pathways of DEGs of the base of leaf vein; B: the top 20 of KEGG enrichment pathways of DEGs of root skin. The pathways in the red box are the focus of this study.
2.3 类胡萝卜素合成相关差异基因分析
高等植物类胡萝卜素是在细胞质体中合成的。越来越多的证据表明, 植物组织中胡萝卜素的生成主要在转录水平上受到调控[27-28], 受合成途径中关键酶基因和其他因素共同影响。参考ko00906 (https:// www.genome.jp/pathway/ko00906)以及其他植物类胡萝卜素合成代谢通路的研究[2,7,29-31], 绘制类胡萝卜素代谢的转录热图, 将富集到的差异基因标注于热图上(图4)。热图矩形图块的左边为芽变系右边为浙薯81, 绿色表示低表达, 红色表示高表达。类胡萝卜素生物合成途径在大多属植物中高度保守, 其生物合成起始于质体甲基赤藓糖醇-4-磷酸酯(MEP)途径生成的5碳结构单元异戊烯焦磷酸(IPP)及其烯丙基异构体二甲基烯丙基焦磷酸(DMAPP), IPP与DMAPP在牻牛儿基牻牛儿基焦磷酸合酶(GGDPS)催化缩合形成C20的香叶基香叶基焦磷酸(GGPP), 两个GGPP在八氢番茄红素合酶(PSY)催化生成C40八氢番茄红素, 随后在八氢番茄红素去饱和酶(PDS)、ζ-胡萝卜素异构酶(Z-ISO)、ζ-胡萝卜素脱氢酶(ZDS)和前番茄红素异构酶(crtISO)作用下生成红色的番茄红素。本研究中, 类胡萝卜代谢途径中上游差异表达结构基因, 与浙薯81相比, 芽变系薯皮中的2个基因(、)、1个()、1个()均显著上调, 2个(、)表达趋势不一致,下调表达,则上调表达。未检测到PDS和ZDS的差异基因。本研究中检测到2个基因, 其中()仅在突变系中有表达,()在突变系的表达量提高了3.9倍。Shadi等[32]在人参()花中分离到2个(、)基因, 干旱胁迫可诱导表达, 进而影响叶绿素水平、赤霉素含量及作为脱落酸(ABA)合成前体的类胡萝卜素积累, 导致气孔关闭从而阻止水分散失; 甜椒在叶绿体和有色体转变的成熟过程中被强烈诱导表达并与酶活性相关[33]; 向日葵中的在种子吸水膨胀后2 d后表达, ABA处理可下调该基因的表达[34]。被认为是类胡萝卜素合成过程中的关键酶, 芒果、番茄和朱红橘随着果实的成熟,表达量呈现上升趋势[35-37], 金边红苞凤梨中可能是金黄色突变叶片类胡萝卜素合成受到限制的关键基因[38]。本研究中()在突变体中的表达量是浙薯81的2.64倍, 其显著上调同样伴随着芽变系的薯皮中类胡萝卜素含量显著高于浙薯81。另外, 我们看到在类胡萝卜素上游代谢中, 脉基部没有富集到差异表达基因。
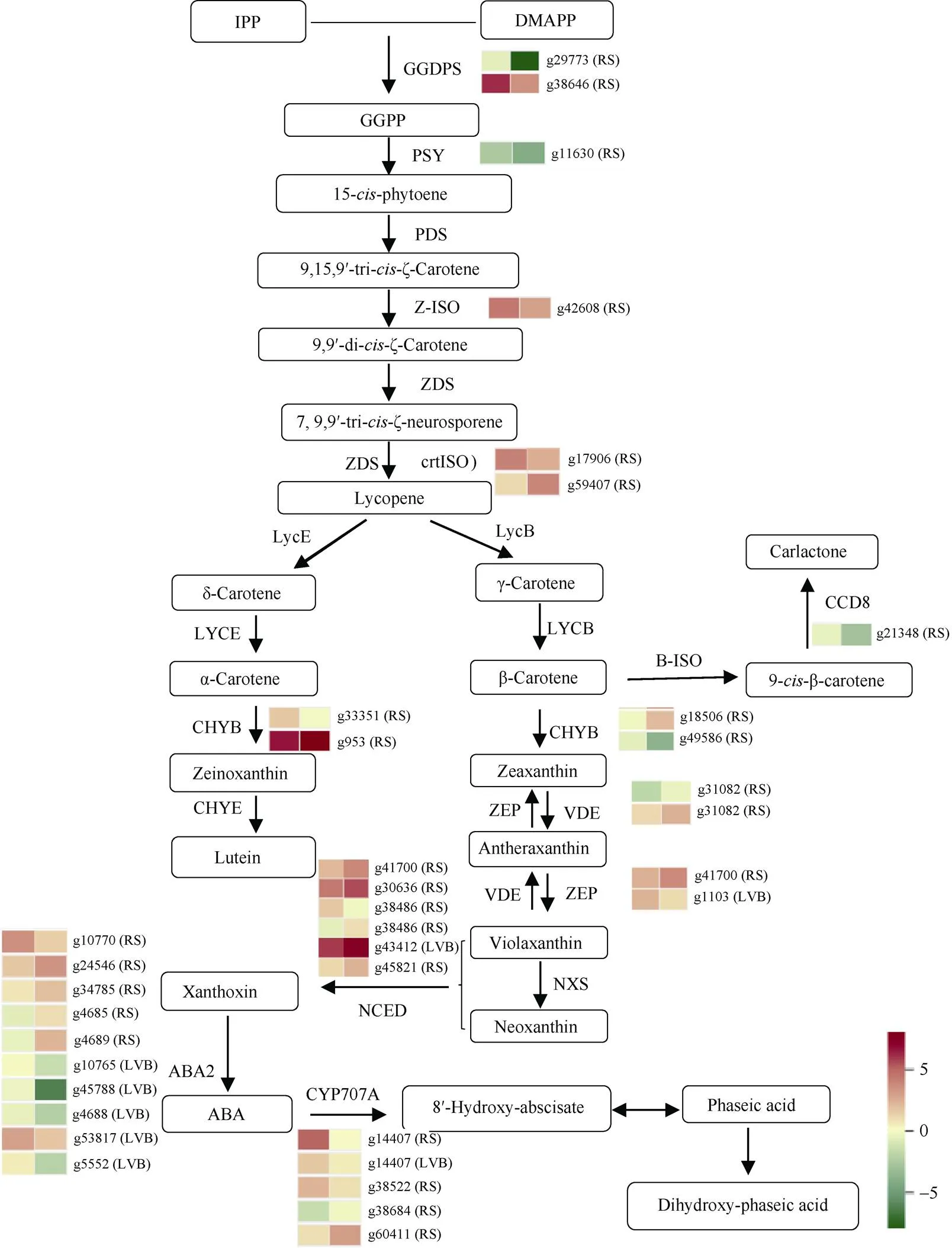
图4 浙薯81及其芽变系类胡萝卜素代谢转录热图
图中基因名称后(LVB)表示该基因是叶脉基部的差异基因, (RS)表示该基因是薯皮的差异基因。
(LVB) indicates that this DEG is from the base of the leaf vein, and (RS) indicates that the gene is from root skin.
类胡萝卜素代谢中的一个重要分支点是番茄红素环化。根据番茄红素两端环化集团的差异(β环/ε环)而分为2个分支: β,β-类胡萝卜素分支和β,ε-类胡萝卜素分支。番茄红素β-环化酶(LYCB)可使对称的番茄红素2个末端均形成β环, 生成的β-胡萝卜素在β-胡萝卜素羟化酶(CHYB)的催化下依次转变为β-隐黄质和玉米黄质, 后者在玉米黄质环氧化酶(ZEP)的作用下依次合成花药黄质和堇菜黄质, 最终进一步在新黄质合成酶(NXS)的催化作用下生成新黄质, 其可作为合成ABA的前体物质。在β,ε-类胡萝卜素分支中, 全反式番茄红素的2个末端分别被LYCB和ε-胡萝卜素羟化酶(LYCE)催化, 形成β环和ε环, 生成α-胡萝卜素, 其进一步在细胞色素P450类型的羟化酶作用下形成叶黄素[39-40]。本研究转录组测序中未检测到和差异表达基因, 在薯皮中检测到2个(,)差异表达基因, 其中下调,上调。在薯皮和脉基分别检测到一个差异基因, 薯皮中的()在芽变系中显著下调, 浙薯81是它的5.6倍。脉基中的() 显著上调, 表达量是浙薯81的2.1倍。
合成的类胡萝卜素在类胡萝卜素裂解双加氧酶(carotenoid cleavage dioxygenases, CCDs)的催化下, 氧化裂解形成许多脱辅基类胡萝卜素, 包括植物激素(ABA和SL)、信号分子以及芳香类物质等[41-42]。类胡萝卜素裂解双加氧酶(CCD)是一个小的基因家族, 其中CCD7和CCD8主要参与植物激素独脚金内酯(SL)的合成[41]。SL主要在植物根部合成, 在茎叶中也有少量分布[43]。本研究中突变系薯皮中的()显著上调, 表达量是浙薯81的4.1倍, 该基因在叶脉基部几乎不表达。9-顺式环氧类胡萝卜素加氧酶(NCED)是控制类胡萝卜素向ABA转化的限速酶, 主要催化紫黄质或新黄质裂解形成ABA前体黄氧素, 之后在黄氧素脱氢酶(ABA2)作用下产生ABA[44]。本研究中4个(、、、)除了外, 在突变体的薯皮和脉基都下调表达。ABA2在薯皮和脉基分别检测出5个差异基因, 薯皮中的有4个下调表达, 脉基部的全部上调表达。
2.4 类胡萝卜素合成相关差异基因qRT-PCR分析
本研究选取类胡萝卜素代谢通路上薯皮中差异基因进行荧光定量表达分析, 结果如图5所示。RNA-seq和qRT-PCR基因相对表达量的相关系数2为0.8149, 二者一致性较好, 表明RNA-seq数据是可信的。在11个基因中, 有5个基因(、、、和)上调, 6个基因下调(、、、、、), 这些基因的差异表达, 是浙薯81薯皮中类胡萝卜素含量差异的直接原因, 进而导致二者在薯皮上颜色不同。
3 讨论
甘薯薯皮和薯肉一样具有丰富的颜色, 主要有白、黄、橘红、红和紫色等[45]。大量研究表明除叶绿素外, 花青素和类胡萝卜素赋予了植物丰富多彩的颜色[7,30,46-47]。基于这2种色素的营养保健作用, 近年来关于甘薯花青素和类胡萝卜素合成相关的基因报道较多。甘薯中与类胡萝卜素合成相关的基因[48]、[16]、[17]和[49]等被先后被克隆和研究。以往研究大多数是对薯块或薯肉内花青素和类胡萝卜素的研究, 极少有对薯皮和地上部的研究。Yang等[50]对薯皮颜色发生变异的2个甘薯品种的总黄酮、类胡萝卜素和花青素含量进行分析, 发现花青素是造成两品系皮色差异的主要原因, 同时利用转录组分析发现了2个与薯皮色高度相关的基因模块。本研究所用材料浙薯81及其突变系颜色变异同时发生在地下部(薯皮)和地上部(叶脉基部), 我们前面报道了这2个材料薯皮和脉基的花青素含量差异极显著, 并对这2个材料薯皮和脉基的转录组和黄酮类和花青素靶向代谢数据进行分析, 发现编码花青素和类黄酮酶促反应后期关键酶的差异表达基因在突变体中明显下调, 但不同部位编码基因有所不同, 转录因子MYB的表达趋势与花青素含量密切相关, 认为花青素可能是造成颜色变异的主要原因[23]。本研究在对2个材料转录组数据进一步分析发现, 无论是薯皮还是脉基, 类胡萝卜素生物合成通路都显著被富集, 处于富集最显著的前20条通路, 我们猜测类胡萝卜素含量差异也是颜色变异的原因之一, 类胡萝卜素和类黄酮/花青素组合共同影响了薯皮和脉基颜色。这与很多花卉植物类似, 如类胡萝卜素和红色花青素形成了橙花龙胆(L.)的橙色花[51]; 花青素和类胡萝卜素的不同组合决定了蝴蝶兰()花色[52]。本研究确定了2个材料的不同部位类胡萝卜素含量差异显著, 且薯皮和脉基类胡萝卜素合成相关基因种类和表达模式不同, 类胡萝卜素含量高的突变体薯皮中, 类胡萝卜素合成通路上游的差异基因(、)、()和()均显著上调, 而脉基部在类胡萝卜素合成上游没有检测到差异; 在类胡萝卜素分解代谢中, 分别从薯皮和脉基部筛选到5个黄氧素脱氢酶基因, 其中、、、在薯皮中下调表达, 而脉基中的5个(、、、、)则全部上调。研究发现黄色菊花中类胡萝卜素裂解基因DNA序列发生缺失导致无法转录, 从而花瓣积累了大量类胡萝卜素, 而白色菊花则源于该基因的表达使合成的类胡萝卜素被降解[53]。因而我们推测, 突变体黄色薯皮类胡萝卜素含量高是在其类胡萝卜素合成上游的差异基因上调表达, 而类胡萝卜素降解酶类基因下调表达共同作用的结果; 突变体脉基部类胡萝卜素含量低可能是上调表达的黄氧素脱氢酶(ABA2)降解所致。

图5 浙薯81及其突变系薯皮类胡萝卜素相关基因的差异表达
A: 浙薯81及其芽变系薯皮中类胡萝卜素相关DEGs RNA-seq和qRT-PCR表达量的相关性分析; B: 芽变系薯皮中类胡萝卜素相关基因相对于浙薯81的差异表达。*表示在< 0.05水平差异显著, **表示在< 0.01水平差异显著。
A: the correlation analysis of DEGs of Zheshu 81 and its mutant line based on RNA-seq and qRT-PCR data; B: the relative expression level of DEGs related to the carotenoid in root skin of Zheshu 81 and its mutant line. * represents significantly different at< 0.05; ** represents significantly different at< 0.01.
植物体内类胡萝卜素含量受外因和内因共同影响, 除了受光照、温度、激素、营养以及发育信号等环境因素影响外, 主要还受植物细胞中一系列结构基因编码的酶催化合成, 且其在质体中的积累还受到类胡萝卜素降解酶及相关存储蛋白的影响, 而这一系列结构基因又被许多转录因子直接或间接调控[2]。已有报道证明植物类胡萝卜素的代谢受几个不同家族转录因子的调控, 包括R2R3-MYB、MADS-box、NAC、bHLH、SBP-box、AP2/ERF、HD-ZIP、NF-Y和WRKY家族等[54], RCP1 (R2R3- MYB)的功能丧失突变导致所有类胡萝卜素生物合成基因的下调, RCP1能激活类胡萝卜素的生物合成并抑制花青素的产生[55]; 在烟草中, 通过RNAi敲掉MYB305导致β-胡萝卜素水平降低[56]。bHLH转录因子家族PIF1通过直接与PSY启动子的G-Box元件结合, 抑制PSY的转录, 降低类胡萝卜素的含量[57]。同样地, 花青素代谢也受许多转录因子的调控, 这些转录因子包括MYB、bHLH、WD40、bZIP、AP2/ERF、MADS-box等[58]。结合我们对这2个材料已有的报道, 突变体薯皮花青素含量显著下降, 类胡萝卜素含量显著升高, 从而导致浙薯81的薯皮从红色变为黄色; 芽变系脉基部花青素和类胡萝卜素同时降低, 从而使得脉基的紫色褪去。转录组测序发现2个材料花青素和类胡萝卜素合成多个相关结构基因差异表达显著, 同时还检测到157个差异表达的转录因子, 这些转录因子主要包括AP2/ERF、MYB、bHLH、bZIP、NAC、C2C2、C2H2、WRKY、GRAS和MADS等。对其中的45个MYB转录因子及其已报道的与花青素合成相关的MYB转录因子进行了系统进化树构建与分析[23], 我们推测可能是浙薯81中的某一个或几个转录因子发生变异, 从而导致了其体内花青素和类胡萝卜素的合成与降解发生改变最终表现在外部颜色的变化。高等植物类胡萝卜素和花青素的代谢途径相对保守, 但其积累模式在不同物种间、器官间均存在显著差异。这种保守性和多样性共存的特征也反映了其调控的复杂性。究竟是哪一种转录因子参与并调控甘薯薯皮和脉基类胡萝卜素和花青素的代谢, 这需要后续我们更系统更深入地进行研究。相信随着研究的日渐深入, 对类胡萝卜素代谢调控会有更加深刻的认识, 从而更好地改良和利用植物类胡萝卜素资源。
4 结论
本研究通过对浙薯81及其芽变系颜色变异的薯皮和脉基部的转录组进行分析, 筛选出类胡萝卜素相关的DEGs 30个, 其中有4个DEGs同时存在于薯皮和脉基中。类胡萝卜合成代谢上游途径中, 芽变系薯皮中的(、)、()和()均显著上调; 而在脉基部没有筛选到DEGs。番茄红素环化分支点后, 在薯皮中检测到2个表达趋势不一致的(、), 其中g在芽变系中下调表达,则上调表达; 在薯皮和脉基分别检测到一个差异表达的, 薯皮中的()显著下调, 脉基部的()则显著上调。类胡萝卜素分解代谢中突变体薯皮中()下调表达; 2个(,)在突变系的薯皮和脉基中均下调表达; 此外在薯皮和脉基分别检测出5个DEGs, 薯皮中有4个上调表达, 脉基部则恰恰相反, 全部下调表达。由此可见, 甘薯不同部位的类胡萝卜代谢相关基因具有很大区别, 正是这些DEGs使得浙薯81及其芽变系的类胡萝卜素含量差异显著, 进而表现在颜色上。本研究筛选出的甘薯不同部位类胡萝卜素代谢相关的差异表达基因, 为甘薯类胡萝卜代谢及解析不同部位颜色变异提供理论依据。
[1] Nisar N, Li L, Lu S, Khin N C, Pogson B J. Carotenoid metabolism in plants., 2015, 8: 68–82.
[2] 何静娟, 范燕萍. 观赏植物花色相关的类胡萝卜素组成及代谢调控研究进展. 园艺学报, 2022, 49: 1162–1172. He J J, Fan Y P. Progress in Composition and metabolic regulation of carotenoids related to floral color., 2022,49: 1162–1172 (in Chinese with English abstract).
[3] Frank H A, Brudvig G W. Redox functions of carotenoids in photosynthesis.,2004, 43: 8607–8615.
[4] Alder A, Jamil M, Marzorati M, Bruno M, Vermathen M, Bigler P, Ghisla S, Bouwmeester H, Beyer P, Al-Babili S. The path from β-Carotene to carlactone, a strigolactone-Like plant hormone., 2012, 335: 1348–1351.
[5] Yang F W, Feng X Q. Abscisic acid biosynthesis and catabolism and their regulation roles in fruit ripening., 2015, 84: 444–453.
[6] Eggersdorfer M, Wyss A. Carotenoids in human nutrition and health.,2018, 652: 18–26.
[7] 张冠华, 刁倩楠. 类胡萝卜素研究进展. 现代农业,2021, (4): 46–49. Zhang G H, Diao Q N. Research progress of carotenoids., 2021, (4): 46–49 (in Chinese).
[8] 谢一芝, 邱瑞镰, 戴起伟, 吴纪中, 张黎玉, 徐品莲. 甘薯胡萝卜素含量的变化及高胡萝卜素育种. 国外农学——杂粮作物, 1998, 18(4): 44–47. Xie Y Z, Qiu R L, Dai Q W, Wu J Z, Zhang L Y, Xu P L. Changes of carotene content in sweet potato and breeding for high carotene content.:, 1998, 18(4): 44–47 (in Chinese).
[9] 后猛, 张允刚, 王欣, 唐维, 刘亚菊, 唐忠厚, 靳容, 闫会, 马代夫, 李强. 橘红肉甘薯块根类胡萝卜素的变化规律及其与主要经济性状的相关性. 中国农业科学,2013, 46: 3988–3996. Hou M, Zhang Y G, Wang X, Tang W, Liu Y J, Tang Z H, Jin R, Yan H, Ma D F, Li Q. Variationlaws of carotenoids content in storage root of orange-fleshed sweetpotato and its relationships with major economic traits., 2013, 46: 3988–3996 (in Chinese with English abstract).
[10] 陈永水. 甘薯品种β-胡萝卜素含量的HPLC测定及其与色值的关系. 国外农学: 杂粮作物,1995, (3): 36–39.Chen Y S. Determination of β-carotene content in sweet potato cultivars by HPLC and its relationship with color value.:, 1995, (3): 36–39 (in Chinese).
[11] 李帑洛, 蒋进勇, 何伟国. 甘薯类胡萝卜素提取工艺的优化. 湖南农业科学,2016, (8): 93–95. Li T L, Jiang J Y, He W G. Optimization of extraction technology of carotenoids from sweet potato., 2016, (8): 93–95 (in Chinese with English abstract).
[12] Rodriguez-Amaya B D, Nutti M R, Carvalho L V. Flour and Breads and Their Fortification in Health & Disease Prevention. San Diego:Academic Press, 2011. pp 301–311.
[13] 陆国权, 黄华宏, 何腾弟. 甘薯维生素C和胡萝卜素含量的基因型, 环境及基因型与环境互作效应的分析. 中国农业科学,2002, 35: 482–486. Lu G Q, Huang H H, He T D. Genotype and environmental effects on vitamin C and carotene contents in sweetpotato., 2002, 35: 482–486 (in Chinese with English abstract).
[14] Waramboi J G, Gidley M J, Sopade P A. Carotenoid contents of extruded and non-extruded sweetpotato flours from Papua New Guinea and Australia.,2013, 141: 1740–1746.
[15] Vimala B, Nambisan B, Hariprakash B. Retention of carotenoids in orange-fleshed sweet potato during processing., 2011, 48: 520–524.
[16] 程洁, 赵腾飞, 廖志华, 杨春贤. 甘薯八氢番茄红素合成酶基因的克隆与功能验证. 植物生理学报,2017, 53: 865–872. Cheng J, Zhao T F, Liao Z H, Yang C X. Cloning and functional identification of phytoene synthase gene from sweetpotat., 2017, 53: 865–872 (in Chinese with English abstract).
[17] Chen K, Hong Z, Xue L, Zhao N, He S, Liu Q. A lycopene β-cyclase gene,, enhances carotenoid contents and abiotic stress tolerance in transgenic sweetpotato.,2018, 272: 243–254.
[18] Park S C, Kang L, Park W S, Ahn M J, Kwak S S, Kim H S. Carotenoid cleavage dioxygenase 4 (CCD4) cleaves β-carotene and interacts with IbOr in sweetpotato., 2020, 14: 737–742.
[19] 江苏省农业科学院、山东省农业科学院. 中国甘薯栽培学. 上海: 上海科学技术出版社, 1984. pp 175–177. Jiangsu Academy of Agricultural Sciences, Shandong Academy of Agricultural Sciences. Chinese Sweet Potato Cultivation. Shanghai: Shanghai Scientific and Technical Publishers, 1984. pp 175–177.
[20] 张小贝, 王光俊. 芽变育种在甘薯品种选育种的应用. 园艺与育苗, 2019, 39(1): 44–45. Zhang X B, Wang G J. Application of bud mutation in the breeding of sweetpotato., 2019, 39(1): 44–45 (in Chinese with English abstract).
[21] Ma D, Li Q, Li X, Li H, Tang Z. Selection of parents for breeding edible varieties of sweetpotato with high carotene content.,2009, 10: 20–27.
[22] Yang J, Moeinzadeh M, Kuhl H, Helmuth J, Xiao P, Liu G, Zheng J, Sun Z, Fan W, Deng G. The haplotype-resolved genome sequence of hexaploid Ipomoea batatas reveals its evolutionary history., 2017, 3: 696–703.
[23] Zhao D, Zhao L, Liu Y, Zhang A, Xiao S, Dai X, Yuan R, Zhou Z, Cao Q. Metabolomic and transcriptomic analyses of the flavonoid biosynthetic pathway for the accumulation of anthocyanins and other flavonoids in sweetpotato root skin and leaf vein base.,2022, 70: 2574–2588.
[24] Park S C, Kim Y H, Ji C Y, Park S, Jeong J C, Lee H S, Kwak S S. Stable internal reference genes for the normalization of real-time pcr in different sweetpotato cultivars subjected to abiotic stress conditions., 2012, 7: e51502.
[25] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-DDCt method.,2001, 25: 402–408.
[26] Minoru K, Michihiro A, Susumu G, Masahiro H, Mika H, Masumi I, Toshiaki K, Shuichi K, Shujiro O, Toshiaki T. KEGG for linking genomes to life and the environment.,2008, 36: 480–484.
[27] Fraser P D, Bramley P M. The biosynthesis and nutritional uses of carotenoids.,2004, 43: 228–265.
[28] Sandmann G, Rmer S, Fraser P D. Understanding carotenoid metabolism as a necessity for genetic engineering of crop plants.,2006, 8: 291–302.
[29] 潘鹤立, 潘腾飞, 佘文琴, 徐世荣, 李小婷, 黄汉唐, 陈源, 吴少华, 潘东明. 柚芽变株系类胡萝卜素代谢差异基因的转录组学分析. 热带作物学报,2020, 41: 2165–2175. Pan H L, Pan T F, She W Q, Xu S R, Li X R, Huang H T, Chen Y, Wu S H, Pan D M. Transcriptome analysis of carotenoid metabolism differential genes in pomelo bud strain., 2020, 41: 2165–2175 (in Chinese with English abstract).
[30] 陆晨飞, 高月霞, 黄河, 戴思兰. 植物类胡萝卜素代谢及调控研究进展. 园艺学报, 2022, 49: 2559–2578. Lu C F, Gao Y X, Huang H, Dai S L. Carotenoid metabolism and regulation in plants., 2022, 49: 2559–2578 (in Chinese with English abstract).
[31] Wisutiamonkul A, Ampomah-Dwamena C, Allan A C, Ketsa S. Carotenoid accumulation in durian () fruit is affected by ethylenemodulation of carotenoid pathway gene expression.,2017, 115: 308–319.
[32] Rahimi S, Kim Y J, Devi B S R, Khorolragchaa A, Sukweenadhi J, Yang D C. Isolation and characterization of Panax ginseng geranylgeranyl-diphosphate synthase genes responding to drought stress.,2015, 142: 747–758.
[33] Kuntz M, Romer S, Suire C, Hugueney P, Weil J H, Schantz R, Camara B. Identification of a cDNA for the plastid-located geranylgeranyl pyrophosphate synthase from Cap sicumannuum: correlative increase in enzyme activity and transcript level during fruit ripening., 2002, 2: 25–34.
[34] Oh S K, Jeong K, Dong H S, Yang J, Han K H. Cloning, characterization, and heterologous expression of a functional geranylgeranyl pyrophosphate synthase from sunflower (L.).,2000, 157: 535–542.
[35] Ma X W, Zheng B, Ma Y L, Xu W T, Wu H X, Wang S B. Carotenoid accumulation and expression of carotenoid biosynthesis genes in mango flesh during fruit development and ripening.,2018, 237: 201–206.
[36] Liu L H, Shao Z Y, Zhang M, Wang Q M. Regulation of carotenoid metabolism in tomato.,2015, 8: 28–39.
[37] 汤雨晴, 万水林, 闫承璞, 王雨亭, 胡钟东. 朱红橘果实成熟过程中类胡萝卜素的积累及相关基因的表达分析. 核农学报,2022, 36: 567–577. Tang Y Q, Wan S L, Yan C P, Wang Y T, Hu Z D. Carotenoids accumalation and relative genes expression during the maturation of Zhuhong mandarin., 2022, 36: 567–577 (in Chinese with English abstract).
[38] 周徐子鑫, 杨威, 毛美琴, 薛彦斌, 马均. 金边红苞凤梨叶色突变体色素鉴定及类胡萝卜素合成限速基因筛选. 园艺学报, 2022, 49: 1081–109. Zhou X Z X, Yang W, Mao M Q, Xue Y B, Ma J. Identification of pigment components and key genes in carotenoid pathway in mutants of chimericvar.., 2022, 49: 1081–109 (in Chinese with English abstract).
[39] Hirschberg J. Carotenoid biosynthesis in flowering plants., 2001, 4: 210–218.
[40] Yagiz A, Pranjali N, Namraj D, Cazzonelli C.-carotene biosynthesis, evolution and regulation in plants: the emergence of novel signaling metabolites., 2018, 654: 172–184.
[41] Al-Babili S, Bouwmeester H J. Strigolactones, a novel carotenoid-derived plant hormone., 2015, 66: 161–186.
[42] Stange J. Apocarotenoids: a new carotenoid-derived pathway.,2016, 79: 239–272.
[43] 安奕霖, 尹克林. 独脚金内酯合成路径及抗逆性研究进展. 现代农业科技,2019, (9): 120–122. An Y L, Yin K L.Research progress of synthetic pathway and stress resistance of strigolactone., 2019, (9): 120–122 (in Chinese).
[44] Leila R, Nejia Z, Alexis D, Valerie L, Ahmed M, Patrice T. Molecular characterization and evolutionary pattern of the 9--epoxycarotenoid dioxygenasegene in grapevine.,2013, 32: 253–266.
[45] Rose I M, Vasanthakaalam H. Comparison of the nutrient composition of four sweet potato varieties cultivated in Rwanda.,2011, 1: 34–38.
[46] Park S C, Kim S H, Park S, Lee H U, Lee J S, Park W S, Ahn M J, Kim Y H, Jeong J C, Lee H S, Kwak S S. Enhanced accumulation of carotenoids in sweetpotato plants overexpressinggene in purple-fleshed sweetpotato cultivar.,2015, 86: 82–90.
[47] 万东璞, 于卓, 吴燕民, 丁梦琦, 李金博, 周美亮. 花青素代谢调控植物彩叶研究进展. 中国农业科技导报, 2020, 22(2): 30–38. Wan D P, Yu Z, Wu Y M, Ding M Q, Li J B, Zhou M L. Regulation of anthocyanin metabolism on colored leaves of plants., 2020, 22(2): 30–38 (in Chinese with English abstract).
[48] 唐俊. 甘薯GGPPS基因的克隆分析及抗草甘膦半夏的获得. 西南大学硕士学位论文, 重庆2008. Tang J. Molecular Characterization of Geranylgeranyl Diphosphate Synthase Gene fromand Obtaining of Anti-glyphosate Pinellia Ternate. MS Thesis of Southwest University, Chongqing, China, 2008 (in Chinese with English abstract).
[49] 王飞. 甘薯类胡萝卜素合成酶基因pds全长cDNA的克隆. 安徽理工大学学报(自然科学版), 2007, 27(1): 55–58. Wang F. Clone of full-length cDNA of phytoene desaturase (gene pds) gene in sweet potato (L.).(Nat Sci Edn), 2007, 27(1): 55–58 (in Chinese with English abstract).
[50] Yang Y, Shi D, Wang Y, Zhang L, Shi A. Transcript profiling for regulation of sweet potato skin color in Sushu 8 and its mutant Zhengshu 20.,2019, 148: 1–9.
[51] Berman J, Sheng Y, Gómez L G, Veiga T, Ni X, Farré G, Capell T, Guitián J, Guitián P, Sandmann G, Christou P, Zhu C. Red anthocyanins and yellow carotenoids form the color of orange-flower gentian (L. var.).,2016, 11: e0162410.
[52] Yang Y X, Wang J J, Ma Z H, Sun G S, Zhang C W. De novo sequencing and comparative transcriptome analysis of white petals and red labella in Phalaenopsis for discovery of genes related to flower color and floral differentation., 2014, 83: 191–199.
[53] Ohmiya A, Kishimoto S, Aida R, Yoshioka S. Carotenoid cleavage dioxygenase (CmCCD4a) contributes to white color formation in chrysanthemum petals.,2006, 142: 1193–1201.
[54] Stanley L, Yuan Y W. Transcriptional regulation of carotenoid biosynthesis in plants: so many regulators, so little consensus., 2019, 10: 1017.
[55] Sagawa J M, Stanley L E, LaFountain A M, Frank H A, Liu C, Yuan Y W. An R2R3-MYB transcription factor regulates carotenoid pigmentation inflowers.,2015, 209: 1049–1057.
[56] Liu G Y, Thornburg R W. Knockdown of MYB305 disrupts nectary starch metabolism and floral nectar production., 2012, 72: 377–388.
[57] Rodriguez-Concepcion M, Lee K P, Johansson H, Toledo-Ortiz G, Steel G, Stewart K, Halliday K, Bou-Torren J. The HY5-PIF regulatory module coordinates light and temperature control of photosynthetic gene transcription.,2014, 10: e1004416.
[58] 王霞, 李恩广, 玄曼霖, 燕宝会, 王晶珊, 隋炯明. 基于转录组测序的紫色甘薯突变体中花青素合成相关基因的分析. 青岛农业大学学报(自然科学版),2018, 35(1): 27–31. Wang X, Li E G, Xuan M L, Yan B H, Wang J S, Sui J M. Gene analysis of anthocyanin biosynthesis in purple sweet potato mutant based otranscriptome sequencing.(Nat Sci Edn), 2018, 35(1): 27–31 (in Chinese with English abstract).
Relative expression profile of the related genes with carotenoids metabolism in sweetpotato () based on RNA-seq data
ZHAO Dong-Lan*, ZHAO Ling-Xiao, LIU Yang, ZHANG An, DAI Xi-Bin, ZHOU Zhi-Lin, and CAO Qing-He
Xuzhou Institute of Agricultural Sciences in Jiangsu Xuhuai District / Key Laboratory of Biology and Genetic Breeding of Sweetpotato, Ministry of Agriculture and Rural Affairs, Xuzhou 221131, Jiangsu, China
The objective of this study is to explore the molecular mechanism of carotenoid metabolism and color mutation of sweetpotato and to study the carotenoid metabolism related genes by RNA-seq technology. Zheshu 81 and its mutant line with color mutation in root skin (from red to yellow) and leaf vein base (from purple to green) were used as the experimental materials. Bioinformatics analysis showed that the carotenoid biosynthesis (ko00906) pathway was significantly enriched in root skin and leaf vein base. The 24 differentially expressed genes (DEGs) and 10 DEGs in the ko00906 were screened from root skin and vein base, among which four were screened in both two parts, respectively. In the upstream pathway of carotenoid anabolism, compared with Zheshu 81, the geranylgeranyl pyrophosphate synthase gene(,), lycopene synthase gene() and ζ-carotene isomerase gene() were significantly up-regulated in mutant line, and() was only expressed in mutant lines. DEGs were not screened in the upstream metabolic pathway of carotenoids in vein base. After the branching point of lycopene cyclization, two β-carotene hydroxylase genes(,) were screened in root skin, one up-regulated and the other down-regulated. Two zeaxanthin epoxidase gene(,)were detected in root skin and vein base, respectively. Andin root skin was significantly down-regulated, andin vein base was significantly up-regulated. In carotenoid catabolism,(), a carotenoid cleavage dioxygenase gene, was significantly up-regulated in root skin of mutant line. Two 9-cis epoxide carotenoid oxygenase genes(,) were down-regulated in root skin and vein base of the mutant line. In addition, ten xanthoxin dehydrogenasegenes were detected in root skin and vein base, and nine of them were up-regulated. The relative expression levels of some genes by qRT-PCR were highly consistent with those of RNA-seq data. This study provides an important reference for the molecular mechanism of carotenoid metabolism and the analysis of different color mutations in root skin and vein base of sweetpotato.
sweetpotato; carotenoid; RNA-seq; differentially expressed gene; color variation
2023-05-24;
2023-06-14.
10.3724/SP.J.1006.2023.24256
通信作者(Corresponding author): 赵冬兰, E-mail: 19991006@jaas.ac.cn
2022-11-18;
本研究由徐州市科技局自然科学基金项目(KC21072)和财政部和农业农村部国家现代农业产业技术体系建设专项(甘薯, CARS-10)资助。
This study was supported by the Natural Fund Project of Xuzhou Science and Technology Bureau (KC21072) and the China Agriculture Research System of MOF and MARA (Sweetpotato, CARS-10).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230613.1019.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).

