植物有性生殖对高温胁迫的响应机制
陈赛华 仲伟杰 薛 明
综述
植物有性生殖对高温胁迫的响应机制
陈赛华*仲伟杰 薛 明
江苏省作物基因组学和分子育种重点实验室 / 植物功能基因组学教育部重点实验室 / 江苏省作物遗传生理重点实验室, 扬州大学农学院, 江苏扬州 225009
极端高温天气频发, 严重威胁农作物的生产。高温胁迫对有性生殖过程的影响与作物减产密切相关, 解析其中的分子机制对于指导作物耐高温遗传改良具有重要意义。然而, 与模式植物拟南芥相比, 目前有关作物有性生殖过程中耐高温的相关研究十分有限。本文从植物有性生殖过程出发, 概述了在减数分裂、花粉绒毡层降解、小孢子发育、花粉管萌发与授精以及籽粒发育等一系列生殖发育过程中响应高温胁迫的分子机制。据此, 我们提出了作物耐高温改良的可行策略, 以期为耐高温品种的遗传改良提供理论依据。
植物; 有性生殖; 热胁迫; 响应; 分子机制; 耐热
随着全球气候变暖, 极端高温天气频繁发生。我国高温天气主要集中在6月下旬至8月下旬, 据统计, 1980—2020年期间, 我国不仅高温期大幅变长, 而且区域性平均高温增强趋势显著[1]。至2022年6月至8月, 我国中东部地区出现大范围高温天气, 持续时间长达79 d, 全国有361个观测站(占总数的14.9%)日最高气温达到或超过历史极值(引自中国气象局)。日趋严重的高温天气极大地威胁着农业生产和粮食安全[2]。研究表明, 全球平均温度升高1℃, 小麦、水稻、玉米和大豆主要农作物产量分别下降6.0%、3.2%、7.4%和3.1%[3]。在我国, 夏季6月至8月正值水稻和玉米等主要农作物的生殖发育阶段, 高温引起的生殖发育异常对产量造成最直接的影响,严重时导致大幅减产[4-6]。因此, 解析作物在生殖生长阶段对高温响应的分子机制将为作物的耐高温改良提供新的途径。
被子植物的有性生殖过程主要包括配子的发生和发育、授粉受精和籽粒发育3个主要阶段。由于胚珠珠心细胞发育形成雌配子的过程在子房中进行, 受外界高温的影响相对较小, 目前鲜有高温对雌配子发育影响的报道。相比之下, 小孢子的发生和发育过程, 包括小孢子母细胞减数分裂、绒毡层降解、小孢子发育、花粉粒萌发和授精发育直至籽粒发育的过程, 则对高温非常敏感, 在基因表达、蛋白稳定性、蛋白修饰和表观修饰等多个层面均存在响应(图1)。许多研究表明, 植物有性生殖过程中遭遇外界环境温度的升高, 会导致花粉发育异常、活力下降、萌发受阻和授精障碍等[7-12]。尽管生殖发育阶段的高温响应分子机制对于指导作物生产相当重要, 但在作物上相关的研究仍然有限, 而模式植物拟南芥的研究则相对较多。因此, 本文围绕有性生殖过程, 概述了植物响应高温分子机制研究的最新进展, 并由此对如何提高作物有性生殖过程中的耐高温特性提出设想和展望, 以期指导作物耐高温品种的选育。
1 减数分裂期的高温响应分子机制
减数分裂是在有性生殖阶段存在的一种特殊细胞分裂方式, 此过程中DNA仅复制一次, 而染色体分离2次, 最终形成染色体数目减半的配子。减数分裂前期同源染色体之间联会配对, 进行同源重组以产生新的基因组合, 后期姐妹染色单体分离形成配子。因此, 减数分裂对于保障基因组稳定性和遗传多样性具有举足轻重的作用。减数分裂同源重组起始于DNA拓扑异构酶SPO11等催化的DNA双链断裂(double-strand break, DSB)。DSB在不同蛋白的共同作用下被剪切形成单链DNA尾巴, 然后由DNA重组蛋白RecA/RAD51/DMC1结合到单链DNA, 促进其侵入同源染色体, 并在染色体轴蛋白ASY1、ASY4和联会复合体蛋白ZYP1等因子的共同作用下形成联会复合体。随后, 部分DSB被修复形成交叉(crossover, CO), 同源重组发生。最后, 同源染色体移向两极, 完成减数第一次分裂。对不同植物的研究发现, 高温可以通过影响不同分子的功能来影响减数分裂过程。
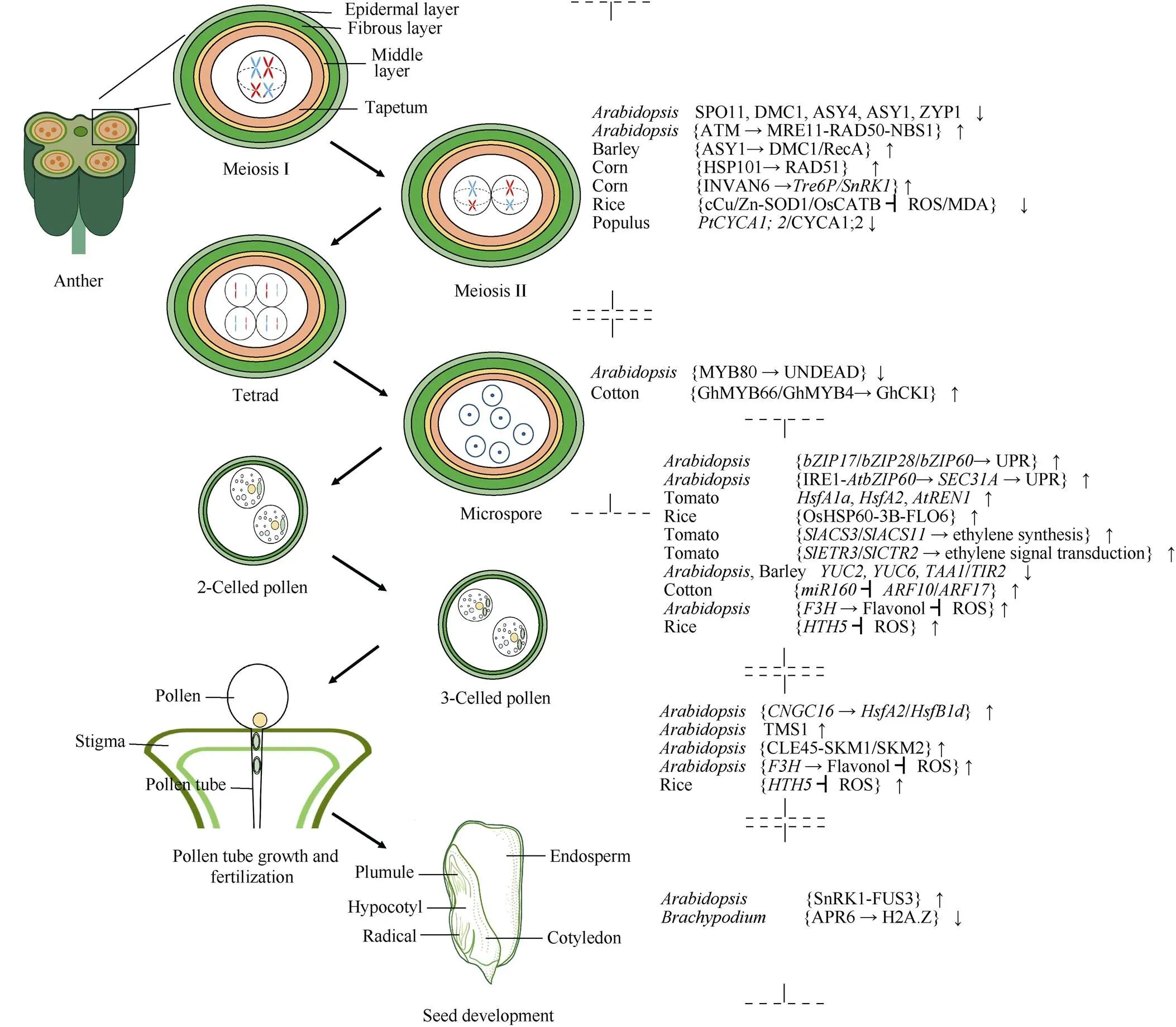
图1 植物生殖发育阶段对高温胁迫的分子响应
图中{ }表示其中响应高温的为蛋白、蛋白复合物或者信号通路, →表示促进, ┫表示抑制, -表示互作, /表示或者。{ }↑表示整体响应高温后上调; { }↓表示整体响应高温后下调。
Inside { } are proteins, protein complexes, or signal pathways responding to heat stress; → represents promotion; ┫represents repression; - means interaction; and / means or. { }↑ represents an integral upregulation when responding to heat stress, { }↓ represents an integral down regulation when responding to heat stress.
在拟南芥中, 当生长温度(32℃)超过育性阈值(28℃)时, 遗传交叉的数量显著减少, 推测同源染色体的联会受到了影响[13]。当温度达到极端高温(36~38℃)时, SPO11介导的DSB形成受到抑制, 同源重组酶DMC1的表达量显著降低。染色体轴蛋白ASY4介导的染色体轴在高温下变得不稳定甚至解体。并且, 高温通过破坏ASY1相关的联会复合体侧生组分和ZYP1介导的联会复合体中央组分, 最终影响联会复合体的组装[14]。尽管高温抑制二倍体和四倍体拟南芥减数分裂的内在机制相似, 但是四倍体中联会复合体的形成对高温更加敏感, 并且随着环境温度的升高, 染色体异常分离和多价体形成的频率也随之提高[15]。极端高温(36~38℃)进一步通过干扰拟南芥微管细胞骨架, 影响同源染色体的分离以及姐妹染色单体的黏连, 而且还会影响减数分裂细胞的胞质分裂[16]。作为DSB形成的负调控因子, 激酶ATM在高温处理后减数分裂时期的花器官中表达上调。然而对拟南芥的研究发现, ATM并不介导高温下DSB的减少, 而是调控DSB修复依赖复合体MRE11- RAD50-NBS1的功能, 确保DSB在高温胁迫下修复成功, 维护高温下减数分裂染色体的完整性[17]。
对大麦的研究表明, 当温度由22°C升高至30℃时, 每个花粉母细胞中的遗传交叉由14.8个降至13.5个, 温度上升至35℃会直接导致减数分裂的失败[18]。大麦的染色体轴蛋白ASY1表达受到高温的诱导, 它通过协调DMC1-RecA同系物的活性以促进同源染色体序列交换, 从而调节减数分裂遗传交叉的产生[19]。
玉米的减数分裂也同样受到高温胁迫的干扰。高温下, 热激蛋白HSP101在花粉母细胞中积累, 它通过招募DSB修复蛋白RAD51来正向调控玉米花粉的减数分裂过程, 从而提高玉米的耐高温性[20]。另外, 细胞质转化酶INVAN6也正向调控玉米高温下的减数分裂。当突变后, 高温(35℃)处理下出现减数分裂I停滞、染色质黏连和产生染色体桥以及微核等现象, 表现出显著的花粉活力下降。结合转录组数据分析, INVAN6在高温胁迫下可能通过调控海藻糖-6-磷酸酶Tre6P和蛋白激酶SnRK1等信号转导通路上的基因以及一些糖代谢、糖转运基因的表达, 调控花药中糖的稳态, 从而调节花粉的耐热性, 由此认为INVAN6对花粉母细胞对抗高温胁迫有重要作用[21]。
水稻中研究表明, 减数分裂时期的高温胁迫(35~38℃)抑制了花药中-基因的表达, 降低了超氧化物歧化酶的含量, 促使花药中活性氧ROS与丙二醛(MDA)含量的显著上升, 进而导致花粉活力降低[22]。同样的, 减数分裂期遭遇高温,的表达也受到抑制, 引发过氧化氢酶CAT的活性下降, ROS和MDA大量积累, 进而引发自由基对细胞的毒害, 导致最终花粉活力下降[23]。因此, 通过提升超氧化物歧化酶的活性来有效抑制ROS也是提升减数分裂时期应对高温的一种方式。
杨树中, 高温引起的减数分裂微管细胞骨架的解聚会造成减数分裂II期姐妹染色单体分离失败, 导致未减数2配子的产生[24]。进一步转录组分析表明, 22个与细胞周期有关的基因在高温处理前后呈差异表达, 其中编码的A型细胞周期蛋白CYCA1;2介导了减数分裂I期到减数分裂II期的转变。当雄花受到高温胁迫后,的表达量显著降低, 故推测减数分裂I期到减数分裂II期的转变失败与的下调表达有关[25]。
2 花药绒毡层细胞程序性死亡响应高温的分子机制
绒毡层是花药室最内层的薄壁细胞, 为发育中的小孢子提供营养物质与胼胝质酶, 从而促进四分体中小孢子的成熟与释放。绒毡层在花粉的发育过程中经历程序性细胞死亡, 在花粉成熟后完全消失, 而高温会使得绒毡层细胞的程序性死亡提前, 破坏小孢子与绒毡层之间的相互作用, 进而影响花粉的发育和功能[26]。
据报道, 拟南芥编码的转录因子通过调控A1天冬氨酸蛋白酶UNDEAD的表达介导绒毡层的正常降解。当和发生突变后, 绒毡层的降解提前[27-28]。绒毡层的降解与细胞自噬相关。在高温(30℃)条件下,和的表达受到抑制, 促进自噬, 绒毡层的降解提前。在自噬缺陷突变体中, 尽管绒毡层的降解不会提前, 但由于绒毡层不能有效实现降解, 因此突变体的花粉发育以及花药开裂仍受到影响[29]。由此推测, 适当增强-模块的表达, 可缓解高温下绒毡层的提前降解, 从而减轻对花粉发育的伤害。
棉花中也鉴定到一个响应高温胁迫, 调控绒毡层细胞程序性死亡的关键基因。编码 I型酪蛋白激酶, 它在高温敏感材料H05花药中的表达受高温诱导上调, 而在耐高温材料84021中则不被高温诱导, 说明表达与耐高温性呈负相关[30-31]。在启动子响应高温的核心区域中, 存在2个与转录因子GhMYB4相作用的MYB结合元件。在高温下, GhMYB4激活的表达, 一旦MYB结合位点被突变,的表达则不再受高温诱导。GhMYB4受高温诱导后在花药发育前期中的小孢子和绒毡层中高表达。GhMYB4与GhMYB66互作形成的异源二聚体可增强GhMYB4与启动子的结合能力。高温敏感棉花材料中, 高温通过GhMYB66/GhMYB4-通路影响绒毡层的程序性细胞死亡和小孢子发育, 导致雄性不育[32]。因此, 削弱这一通路在高温下的表达将有助于提高耐高温性。
3 小孢子发育响应高温的分子机制
绒毡层的降解为小孢子的发育提供了充足的营养。小孢子刚从四分体释放出来时, 细胞体积小, 细胞壁薄, 核中位。随着持续不断吸收养分, 小孢子外壁形成, 核中位逐渐偏移, 内部小液泡形成并最终形成中央大液泡, 细胞逐渐增大。小孢子核首先经历1次不对称分裂产生1个精核和1个营养核, 中央液泡逐渐消失。末期, 精核细胞经历第2次有丝分裂产生2个精细胞, 营养细胞中积累大量的淀粉体, 最终形成成熟的花粉粒。已知的高温响应机制, 包括内质网相关的未折叠蛋白的响应(unfolded protein response, UPR)、热激转录因子(heat shock factors, HSFs)和热激蛋白(heat shock proteins, HSPs)介导的转录信号通路、激素调控与表观遗传等, 均被报道在小孢子发育过程中起作用, 最终导致花粉活力的变化。
高温胁迫导致蛋白质折叠错误, 从而引发内质网中的UPR。折叠错误的蛋白质具有毒性, 阻碍正常的细胞活动, 而UPR能够在一定程度上减轻内质网的负担, 恢复内质网的蛋白质稳态[33]。内质网中、和介导的UPR被报道参与有性生殖过程对高温的响应。高温会造成拟南芥完全可育的type I型荚果比例下降, 产生部分可育的type II型以及完全不育的type III型。在的双突变体中, type II型和type III型荚果比例显著增加, 说明突变使得拟南芥对高温更加敏感。高温胁迫下, 野生型与双突变体相比, 上调表达的基因大多为非典型的UPR类基因, 推测和通过调控高温下内质网蛋白稳态来维持花粉等组织的功能, 从而维持荚果的育性[34]。由于被报道在小孢子和绒毡层细胞中高表达, 因此推测介导的UPR在小孢子发育时应对高温具有重要的作用。拟南芥的作用与和类似, 它在花器官中的表达受高温诱导, 且突变也会造成高温下type II型和type III型荚果比例显著增加。通过CHIP-seq发现, AtbZIP17的结合序列(G-box和ERSE-II顺式作用元件)特征也与AtbZIP28非常相似,推测AtbZIP17在拟南芥高温胁迫下也参与内质网胁迫应答, 调控内质网蛋白稳态[35]。拟南芥双突变体的UPR信号通路被敲除, 该突变体在常温下可育, 当温度升高至27.5℃时表现出不育。尽管UPR在花发育阶段组成型表达, 但是这种高温下的育性改变主要影响孢子体的发育, 因为高温下双突变体的绒毡层发生明显缺陷, 小孢子发育所需的营养供给出现问题。在双突变体中过表达COPII囊泡包被蛋白SEC31A后, 高温下的表型得到恢复。因此推测, 作为UPR信号通路中的一个重要组分, IRE1通过AtbZIP60介导的表达, 调控拟南芥小孢子在高温下的发育和活力[36]。据此, 在高温下通过促进IRE1-AtbZIP60-SEC31A信号通路可以提升UPR反应, 提高高温耐受性。
HSFs和HSPs在植物应对高温胁迫的反应中起关键作用。番茄中的研究表明,和基因介导了花粉的耐热性。高温下,突变体中ROS的含量增加, 花粉的活力和萌发率均下降; 而过表达则引起ROS的含量下降, 花粉活力增强; 这说明正调控花粉发育时期的高温耐受性。转录组数据显示, HsfA1a可以结合到氧化还原调节、蛋白修复和蛋白降解等一系列基因的启动子区, 从而通过增强抗氧化能力、促进蛋白质修复和稳定, 保障高温下花粉的发育[37]。在花粉热应激(39℃/42℃/45℃)反应中,是的一个重要的共激活因子。在减数分裂和小孢子形成期间, 抑制的表达同样会降低高温下花粉的活力和萌发[38]。拟南芥中,的同源基因突变后, 花粉会出现结构和功能异常, 并且这些异常主要表现在二核花粉粒到花粉成熟这一期间。在高温(30℃)下, 花粉异常的比例会更加显著, 这说明对于高温下维持二核花粉粒的发育有正向促进作用[39]。编码水稻热激蛋白HSP60家族成员的基因受高温(34℃)诱导表达, 过表达可以显著提高水稻花粉的耐热性。OsHSP60-3B蛋白通过与淀粉合成及淀粉体起始调节蛋白FLO6的互作, 稳定高温下FLO6的蛋白丰度,调控水稻小孢子发育后期淀粉粒的积累。OsHSP60-3B还能调节热激蛋白和热激转录因子等的表达, 抑制ROS的过度积累及细胞凋亡, 保障花粉的正常发育[40]。
有研究表明, 乙烯合成及信号通路对高温胁迫下小孢子发育的影响从极性小孢子到二核花粉粒, 一直延续到花粉成熟期。(Never ripe)是一个乙烯不敏感突变体, 它呈现出对高温胁迫的极度敏感。高温下,不仅花粉数量减少、花粉活力下降, 而且成熟花粉粒的蔗糖含量也仅为野生型的40%[41]。高温(45℃)胁迫下, 乙烯合成相关基因和以及乙烯信号转导通路中的基因和在番茄花粉中上调表达[42]。除乙烯以外, 生长素也被报道参与高温对花粉发育的影响。当高温(31℃)胁迫处理7 d后, 拟南芥中小孢子可以形成, 但花粉的成熟和花丝的伸长都受到了限制。高温抑制了花粉和绒毡层中生长素合成有关基因的表达, 包括拟南芥的和基因以及大麦的/基因, 降低了内源生长素的含量, 导致花粉败育, 而外施生长素可以部分逆转高温导致的雄性不育[43]。由此可见, 乙烯和生长素在高温下促进小孢子发育的过程中都不可或缺。
在棉花中, 表观遗传机制, 包括DNA甲基化和小RNA等被报道在调控小孢子发育和花药开裂中发挥作用。DNA甲基化图谱分析发现, 无论四分体时期、绒毡层降解时期还是花药开裂时期, 高温敏感棉花H05表现出较低的DNA甲基化水平, 而耐高温棉花84021则一直维持着较高的甲基化水平。高温可能通过抑制DNA甲基化来干扰糖和活性氧代谢, 导致小孢子败育[44]。DNA甲基化水平的下降可能与高温下甲基转移酶活性被抑制有关。因此, 高温下稳定甲基转移酶的活性可有效缓解高温胁迫带来的不利影响[45]。研究还发现, 高温下H05中甲基化水平变化与24nt小RNA含量显著关联, 这表明是小RNA介导的DNA甲基化途径受到影响[44]。在耐高温品种84021和高温敏感品种H05的花药中,呈现对高温不同的响应。在84021中被抑制, 在H05中被诱导, 其下游靶标也呈现出相应的变化。过表达抑制和的表达, 激活生长素响应, 导致花药不开裂, 增强棉花的高温敏感性[46]。因此, 高温下介导的生长素信号变化对于应对高温胁迫非常重要, 可以通过适量抑制的表达来提高耐高温性。
4 花粉管萌发与授精过程响应高温的分子机制
成熟的花粉粒一旦落在柱头上, 即开始萌发形成花粉管, 并通过花粉管通道将精细胞运送到子房中, 进而完成授精的过程。已有报道表明, 高温可以通过破坏花粉管的萌发来阻碍授精过程。位于植物质膜上的钙离子通道是重要的高温感受器, 当外界环境温度上升时, 细胞质膜上的钙离子通道会被瞬间激活, 通过钙离子内流来调控热激反应[47]。拟南芥中鉴定到一个环核苷酸门控离子通道蛋白CNGC16, 与高温下花粉的萌发息息相关[48]。当突变后, 80%以上的花粉要么不能萌发, 要么萌发长度小于30 µm, 仅有1%的花粉粒生长能超过200 µm, 说明CNGC16在花粉管萌发与生长的起始阶段响应高温。高温(40℃)下,突变体花粉中和等高温响应核心转录因子表达量显著下调, 推测高温诱导下CNGC16通道促使钙离子内流, 激活高温响应的信号通路, 进而促进花粉管的萌发[49]。此外, 拟南芥编码了一个HSP40同源蛋白, 在花粉、花粉管以及根茎叶中都有表达, 且受高温诱导。敲除突变体的花粉在高温(30℃)下花粉管生长也严重受阻, 由此可见, TMS1对于高温下花粉管的萌发至关重要[50]。拟南芥CLE分泌肽家族成员CLE45, 可以改善高温下花粉管的生长缺陷。正常条件下(22℃) CLE45仅在柱头以及维管组织中表达, 当温度升高时(30℃), 在雌蕊的转移通道中也有表达, 其受体SKM1和SKM2在花粉和花粉管中表达。CLE45-SKM1/SKM2模块调控了花粉和雌蕊在高温下的相互作用, 使拟南芥在高温胁迫下仍然能够正常结实[51]。番茄中的研究表明, 黄酮醇类化合物不仅会减少高温胁迫诱导(34℃)的ROS累积, 也可以减弱高温对花粉管生长的抑制[52]。综合以上研究,、和编码促进黄酮醇类化合物合成的等基因均可以正向调控高温下花粉管的萌发, 促进授精。
5 籽粒发育响应高温的分子机制
拟南芥中, 转录因子FUSCA3 (FUS3)在调节胚胎发育以及种子成熟过程中起着重要的作用。激酶SnRK1和FUS3在胚胎发生期间有相似的表达模式, SnRK1介导了胚胎发育阶段FUS3的体内磷酸化。相较于野生型,突变体背景下构建的组成型磷酸化(FUS3S>D)和组成型去磷酸化(FUS3S>A)互补植株在温度上升时(27℃), 均表现出胚胎发育的延迟。这些结果说明在高温胁迫下, SnRK1介导的FUS3体内磷酸化对胚胎的正常发育至关重要[53]。
H2A.Z是真核生物细胞中极其保守的组蛋白变体[54]。它具有多方面的功能, 包括调控基因表达、DNA复制、DNA损伤修复和DNA重组等。已有证据表明H2A.Z通过调控基因表达, 在植物响应高温的过程中起着至关重要的作用[55]。对二穗短柄草的研究发现, 组蛋白伴侣蛋白复合体SWR1的关键组分APR6经RNAi沉默后, H2A.Z在染色体上占据的规律被扰乱。对该RNAi材料在授粉5 d后进行高温处理, 发现籽粒的重量和单株的产量均显著下降。由此可见, H2A.Z的染色体占据率对于高温下籽粒干物质的积累是重要的[56], 高温下APR6的稳定表达可以促进对高温的耐受性。
6 其他不同阶段交叉响应的分子机制
高温下ROS对有性生殖过程的影响绝不仅仅局限在减数分裂时期。番茄中的研究表明, 在花青素减少的突变体中, 黄酮醇的累积减少, ROS的含量显著上升, 因此突变体呈现出有性生殖过程不同程度的受损, 包括花粉数量减少, 花粉活力下降, 花粉萌发、花粉管伸长以及花粉管的完整性变差等。黄酮醇类化合物可以减少高温胁迫诱导(34℃)的ROS累积。当通过基因的过表达来提升花青素含量后, 以上缺陷均得到弥补, 说明黄酮类物质在植物有性生殖的多个发育阶段对高温胁迫响应有着不可或缺的作用[52]。据报道, 一个高温下诱导的基因在水稻抽穗期应对高温中起着积极的作用。编码一个磷酸吡哆醛稳态调节蛋白, 定位在线粒体中。在高温胁迫下, 过量表达能够显著减少ROS的积累, 提高花粉活力和结实率; 反之, 抑制则花粉活力和结实率均下降, 这表明通过抑制ROS的积累来正调控水稻花粉的耐热性。在粳稻背景下引入耐热等位基因, 可以在高温下增产约30%[57]。然而, 由于前人在不同研究中设置的高温处理阶段不同, 目前已知基因或信号通路发挥作用的发育阶段划分仍可能存在片面性, 不排除它们在不同的发育阶段存在交叉影响的可能性, 这需要后续更深入细致的研究。
7 总结与展望
解析植物生殖发育阶段响应高温的分子机制, 寻找促进耐高温的基因或信号通路, 进而遗传改良作物的耐高温性, 这些都是作物耐高温育种的关键。基于前人的研究进展, 我们也提出了初步的改良策略(具体见表1列7)。无论是单个基因、蛋白, 还是相对复杂的信号通路, 具体分为4种情形: (1) 高温下被诱导且促进耐高温; (2) 高温下被诱导, 但不利于高温耐受性; (3) 高温下被抑制, 但促进耐高温性; (4) 高温下被抑制, 同时耐高温性下降。简单来说,增强(1)和(4)将有助于提高耐高温性; 反之, 抑制(2)和(3)也同样有助于提高耐高温性。然而, 由于耐高温性是复杂的数量性状, 它的改进与提升绝不是依靠个别基因或某个信号通路可以彻底解决。笔者认为将来植物, 尤其是作物的耐高温分子机制研究还需要在以下几个方面进一步加强:
7.1 迫切需要寻找可用于遗传改良的优异自然变异
关于生殖发育时期响应高温的研究, 绝大多数都是在反向遗传学或组学的基础上锁定基因或通路,并利用野生型与突变体来验证基因在高温响应中的功能, 仅极少数基因除外, 比如水稻[57]。尽管一些基因过表达或敲除后, 耐高温性有显著变化, 然而已知的基因型能否在生产上真正改良作物生殖发育时期的耐高温性仍不得而知。从这些基因入手, 对种质资源中的自然变异进行深度挖掘, 通过序列分析和功能验证, 可以寻找更加优异的等位基因或单倍型, 这些将有助于加速这些基因在生产上的利用。此外, 利用自然群体的GWAS分析或优异种质的QTL分析都是正向遗传学寻找优异基因的途径, 但由于生殖发育时期耐高温表型鉴定的难度很大, 因此相关的研究仍相当匮乏。一个替代的方案是在苗期对材料进行耐高温精准鉴定, 待定位和克隆基因后, 再验证其在生殖发育时期的作用。这一方法有成功的案例可以借鉴, 比如从非洲栽培稻中克隆耐高温基因、和就是采用这样的策略[58-60]。
7.2 作物生殖发育阶段耐高温调控的分子网络有待进一步完善
作物生殖发育时期高温响应的机制研究对于生产中作物耐高温特性的改良无疑是意义重大的。然而, 目前绝大多数的高温响应机制研究集中在营养生长时期, 生殖生长阶段的分子调控网络需进一步加强和完善。就目前作物中已克隆的一些基因而言, 例如水稻、玉米与以及棉花等[21,31,57,61], 它们的分子调控网络研究也比较初步。考虑到耐高温响应的机制在营养生长阶段和生殖生长阶段存在一定的共性和特殊性, 因此, 针对一些共性基因, 可以通过借鉴营养生长阶段的分子网络来逐步补充完善, 而针对生殖生长阶段特异的基因, 可以从已知基因入手, 结合多种分子生物学手段, 寻找上、下游基因, 以此逐步拓展并扩充基因分子调控网络。此外, 由于不同信号通路之间往往存在一定的关联, 通路之间的交叉也是后续研究应该关注的要点。
7.3 综合考虑耐高温性与作物产量等其他农艺性状之间的平衡
众所周知, 植物的生长与抗性之间往往存在着平衡关系。在利用已知的基因去提高作物耐高温性的同时, 一个不得不考虑的方面就是基因对作物的产量及其他重要农艺性状是否存在影响。因此, 在研究基因耐高温特性的同时也要兼顾考虑基因的协同效应。只有那些既能够提高耐高温性且对产量影响极小、甚至没有影响的基因, 才有可能在作物生产中加以利用。当然, 随着转基因、基因编辑等技术的不断进步和分子生物学的发展, 相信会有更多的可供选择的改良方式。
[1] 王荣, 王遵娅, 高荣, 叶殿秀. 1961–2020年中国区域性高温过程的气候特征及变化趋势. 地球物理学报, 2023, 66: 494–504. Wang R, Wang Z Y, Gao R, Ye D X. Climatic characteristics and trends of regional high temperature processes in China during 1961–2020., 2023, 66: 494–504 (in Chinese with English abstract).
[2] Battisti D S, Naylor R L. Historical warnings of future food insecurity with unprecedented seasonal heat., 2009, 323: 240–244.
[3] Zhao C, Liu B, Piao S, Wang X, Lobell D B, Huang Y, Huang M, Yao Y, Bassu S, Ciais P, Durand J L, Elliott J, Ewert F, Janssens I A, Li T, Lin E, Liu Q, Martre P, Muller C, Peng S, Penuelas J, Ruane A C, Wallach D, Wang T, Wu D, Liu Z, Zhu Y, Zhu Z, Asseng S. Temperature increase reduces global yields of major crops in four independent estimates., 2017, 114: 9326–9331.
[4] 凌霄霞, 张作林, 翟景秋, 叶树春, 黄见良. 气候变化对中国水稻生产的影响研究进展. 作物学报, 2019, 45: 323–334.Ling X X, Zhang Z L, Zhai J Q, Ye S C, Huang J L. Research progress on effects of climate change on rice production in China., 2019, 45: 323–334 (in Chinese with English abstract).
[5] 闫振华, 刘东尧, 贾绪存, 杨琴, 陈艺博, 董朋飞, 王群. 花期高温干旱对玉米雄穗发育、生理特性和产量影响. 中国农业科学, 2021, 54: 3592–3608. Yan Z H, Liu D R, Jia X C, Yang Q, Chen Y B, Dong P F, Wang Q. Effects of high temperature and drought on tassel development, physiological characteristics and yield of maize during flowering period., 2021, 54: 3592–3608 (in Chinese with English abstract).
[6] Lohani N, Singh M B, Bhalla P L. High temperature susceptibility of sexual reproduction in crop plants., 2020, 71: 555–568.
[7] Browne R G, Li S F, Iacuone S, Dolferus R, Parish R W. Differential responses of anthers of stress tolerant and sensitive wheat cultivars to high temperature stress., 2021, 254: 4.
[8] Kakani V G, Reddy K R, Koti S, Wallace T P, Prasad P V, Reddy V R, Zhao D. Differences inpollen germination and pollen tube growth of cotton cultivars in response to high temperature., 2005, 96: 59–67.
[9] Minamiyama Y, Takemura S, Ichikawa H. Food additive-induced oxidative stress in rat male reproductive organs and hippocampus., 2021, 701: 108810.
[10] Brauner E V, Hansen A M, Doherty D A, Dickinson J E, Handelsman D J, Hickey M, Skakkebaek N E, Juul A, Hart R. The association between in-utero exposure to stressful life events during pregnancy and male reproductive function in a cohort of 20-year-old offspring: the Raine Study., 2019, 34: 1345–1355.
[11] De Storme N, Geelen D. The impact of environmental stress on male reproductive development in plants: biological processes and molecular mechanisms., 2014, 37: 1–18.
[12] Endo M, Tsuchiya T, Hamada K, Kawamura S, Yano K, Ohshima M, Higashitani A, Watanabe M, Kawagishi-Kobayashi M. High temperatures cause male sterility in rice plants with transcriptional alterations during pollen development., 2009, 50: 1911–1922.
[13] De Storme N, Geelen D. High temperatures alter cross-over distribution and induce male meiotic restitution in., 2020, 3: 187.
[14] Ning Y, Liu Q, Wang C, Qin E, Wu Z, Wang M, Yang K, Elesawi I E, Chen C, Liu H, Qin R, Liu B. Heat stress interferes with formation of double-strand breaks and homolog synapsis., 2021, 185: 1783–1797.
[15] Fu H, Zhao J, Ren Z, Yang K, Wang C, Zhang X, Elesawi I E, Zhang X, Xia J, Chen C, Lu P, Chen Y, Liu H, Yu G, Liu B. Interfered chromosome pairing at high temperature promotes meiotic instability in autotetraploid., 2022, 188: 1210–1228.
[16] Lei X, Ning Y, Eid E I, Yang K, Chen C, Wang C, Liu B. Heat stress interferes with chromosome segregation and cytokinesis during male meiosis in., 2020, 15: 1746985.
[17] Zhao J, Gui X, Ren Z, Fu H, Yang C, Wang W, Liu Q, Zhang M, Wang C, Schnittger A, Liu B. ATM-mediated double-strand break repair is required for meiotic genome stability at high temperature., 2023, 114: 403–423.
[18] Higgins J D, Perry R M, Barakate A, Ramsay L, Waugh R, Halpin C, Armstrong S J, Franklin F C. Spatiotemporal asymmetry of the meiotic program underlies the predominantly distal distribution of meiotic crossovers in barley., 2012, 24: 4096–4109.
[19] De Storme N, Geelen D. The impact of environmental stress on male reproductive development in plants: biological processes and molecular mechanisms., 2014, 37: 1–18.
[20] Li Y, Huang Y, Sun H, Wang T, Ru W, Pan L, Zhao X, Dong Z, Huang W, Jin W. Heat shock protein 101 contributes to the thermotolerance of male meiosis in maize., 2022, 34: 3702–3717.
[21] Huang W, Li Y, Du Y, Pan L, Huang Y, Liu H, Zhao Y, Shi Y, Ruan Y L, Dong Z, Jin W. Maize cytosolic invertase INVAN6 ensures faithful meiotic progression under heat stress., 2022, 236: 2172–2188.
[22] Zhao Q, Zhou L, Liu J, Du X, Asad M A, Huang F, Pan G, Cheng F. Relationship of ROS accumulation and superoxide dismutase isozymes in developing anther with floret fertility of rice under heat stress., 2018, 122: 90–101.
[23] Zhao Q, Zhou L, Liu J, Cao Z, Du X, Huang F, Pan G, Cheng F. Involvement of CAT in the detoxification of HT-induced ROS burst in rice anther and its relation to pollen fertility., 2018, 37: 741–757.
[24] Wang J, Li D, Shang F, Kang X. High temperature-induced production of unreduced pollen and its cytological effects in., 2017, 7: 5281.
[25] Zhou Q, Cheng X, Kong B, Zhao Y, Li Z, Sang Y, Wu J, Zhang P. Heat shock-induced failure of meiosis I to meiosis II transition leads to 2n pollen formation in a woody plant., 2022, 189: 2110–2127.
[26] Hedhly A, Hormaza J I, Herrero M. Global warming and sexual plant reproduction., 2009, 14: 30–36.
[27] Phan H A, Iacuone S, Li S F, Parish R W. The MYB80 transcription factor is required for pollen development and the regulation of tapetal programmed cell death in., 2011, 23: 2209–2224.
[28] Phan H A, Li S F, Parish R W. MYB80, a regulator of tapetal and pollen development, is functionally conserved in crops., 2012, 78: 171–183.
[29] Dundar G, Shao Z, Higashitani N, Kikuta M, Izumi M, Higashitani A. Autophagy mitigates high-temperature injury in pollen development of., 2019, 456: 190–200.
[30] Li Y, Li Y, Chen Y, Wang M, Yang J, Zhang X, Zhu L, Kong J, Min L. Genome-wide identification, evolutionary estimation and functional characterization of two cottongene types., 2021, 21: 229.
[31] Min L, Zhu L, Tu L, Deng F, Yuan D, Zhang X. Cotton GhCKI disrupts normal male reproduction by delaying tapetum programmed cell deathinactivating starch synthase., 2013, 75: 823–835.
[32] Li Y, Li Y, Su Q, Wu Y, Zhang R, Li Y, Ma Y, Ma H, Guo X, Zhu L, Min L, Zhang X. High temperature induces male sterilityMYB66-MYB4-Casein kinase I signaling in cotton., 2022, 189: 2091–2109.
[33] Li B, Gao K, Ren H, Tang W. Molecular mechanisms governing plant responses to high temperatures., 2018, 60: 757–779.
[34] Zhang S S, Yang H, Ding L, Song Z T, Ma H, Chang F, Liu J X. Tissue-specific transcriptomics reveals an important role of the unfolded protein response in maintaining fertility upon heat stress in., 2017, 29: 1007–1023.
[35] Gao J, Wang M J, Wang J J, Lu H P, Liu J X. bZIP17 regulates heat stress tolerance at reproductive stage in., 2022, 3: 1–11.
[36] Deng Y, Srivastava R, Quilichini T D, Dong H, Bao Y, Horner H T, Howell S H. IRE1, a component of the unfolded protein response signaling pathway, protects pollen development infrom heat stress., 2016, 88: 193–204.
[37] Xie D L, Huang H M, Zhou C Y, Liu C X, Kanwar M K, Qi Z Y, Zhou J. HsfA1a confers pollen thermotolerance through upregulating antioxidant capacity, protein repair, and degradation inL., 2022, 9: uhac163.
[38] Fragkostefanakis S, Mesihovic A, Simm S, Paupiere M J, Hu Y, Paul P, Mishra S K, Tschiersch B, Theres K, Bovy A, Schleiff E, Scharf K D. HsfA2 controls the activity of developmentally and stress-regulated heat stress protection mechanisms in tomato male reproductive tissues., 2016, 170: 2461–2477.
[39] Renak D, Gibalova A, Solcova K, Honys D. A new link between stress response and nucleolar function during pollen development inmediated by AtREN1 protein., 2014, 37: 670–683.
[40] Lin S, Liu Z, Sun S, Xue F, Li H, Tursun A, Cao L, Zhang L, Wilson Z A, Zhang D, Liang W. Rice HEAT SHOCK PROTEIN60-3B maintains male fertility under high temperature by starch granule biogenesis., 2023: kiad136.
[41] Firon N, Pressman E, Meir S, Khoury R, Altahan L. Ethylene is involved in maintaining tomato () pollen quality under heat-stress conditions., 2012, 2012: pls24.
[42] Jegadeesan S, Beery A, Altahan L, Meir S, Pressman E, Firon N. Ethylene production and signaling in tomato () pollen grains is responsive to heat stress conditions., 2018, 31: 367–383.
[43] Sakata T, Oshino T, Miura S, Tomabechi M, Tsunaga Y, Higashitani N, Miyazawa Y, Takahashi H, Watanabe M, Higashitani A. Auxins reverse plant male sterility caused by high temperatures., 2010, 107: 8569–8574.
[44] Ma Y, Min L, Wang M, Wang C, Zhao Y, Li Y, Fang Q, Wu Y, Xie S, Ding Y, Su X, Hu Q, Zhang Q, Li X, Zhang X. Disrupted genome methylation in response to high temperature has distinct affects on microspore abortion and anther indehiscence., 2018, 30: 1387–1403.
[45] Min L, Li Y, Hu Q, Zhu L, Gao W, Wu Y, Ding Y, Liu S, Yang X, Zhang X. Sugar and auxin signaling pathways respond to high- temperature stress during anther development as revealed by transcript profiling analysis in cotton., 2014, 164: 1293–1308.
[46] Ding Y, Ma Y, Liu N, Xu J, Hu Q, Li Y, Wu Y, Xie S, Zhu L, Min L, Zhang X. microRNAs involved in auxin signalling modulate male sterility under high-temperature stress in cotton ()., 2017, 91: 977–994.
[47] Saidi Y, Finka A, Muriset M, Bromberg Z, Weiss Y G, Maathuis F J, Goloubinoff P. The heat shock response in moss plants is regulated by specific calcium-permeable channels in the plasma membrane., 2009, 21: 2829–2843.
[48] Tunc-Ozdemir M, Tang C, Ishka M R, Brown E, Groves N R, Myers C T, Rato C, Poulsen L R, Mcdowell S, Miller G, Mittler R, Harper J F. A cyclic nucleotide-gated channel (CNGC16) in pollen is critical for stress tolerance in pollen reproductive development., 2013, 161: 1010–1020.
[49] Rahmati I M, Brown E, Weigand C, Tillett R L, Schlauch K A, Miller G, Harper J F. A comparison of heat-stress transcriptome changes between wild-typepollen and a heat- sensitive mutant harboring a knockout of cyclic nucleotide-gated cation channel 16 (cngc16)., 2018, 19: 549.
[50] Yang K Z, Xia C, Liu X L, Dou X Y, Wang W, Chen L Q, Zhang X Q, Xie L F, He L, Ma X, Ye D. A mutation in Thermosensitive Male Sterile 1, encoding a heat shock protein with DnaJ and PDI domains, leads to thermosensitive gametophytic male sterility in., 2009, 57: 870–882.
[51] Endo S, Shinohara H, Matsubayashi Y, Fukuda H. A novel pollen-pistil interaction conferring high-temperature tolerance during reproductionCLE45 signaling., 2013, 23: 1670–1676.
[52] Muhlemann J K, Younts T, Muday G K. Flavonols control pollen tube growth and integrity by regulating ROS homeostasis during high-temperature stress., 2018, 115: E11188–E11197.
[53] Chan A, Carianopol C, Tsai A Y, Varatharajah K, Chiu R S, Gazzarrini S. SnRK1 phosphorylation of FUSCA3 positively regulates embryogenesis, seed yield, and plant growth at high temperature in., 2017, 68: 4219–4231.
[54] Talbert P B, Henikoff S. Histone variants--ancient wrap artists of the epigenome., 2010, 11: 264–275.
[55] Kumar S V, Wigge P A. H2A.Z-containing nucleosomes mediate the thermosensory response ins., 2010, 140: 136–147.
[56] Boden S A, Kavanova M, Finnegan E J, Wigge P A. Thermal stress effects on grain yield inoccur via H2A.Z-nucleosomes., 2013, 14: R65.
[57] Cao Z, Tang H, Cai Y, Zeng B, Zhao J, Tang X, Lu M, Wang H, Zhu X, Wu X, Yuan L, Wan J. Natural variation of HTH5 from wild rice,Griff., is involved in conferring high-temperature tolerance at the heading stage., 2022, 20: 1591–1605.
[58] Li X M, Chao D Y, Wu Y, Huang X, Chen K, Cui L G, Su L, Ye W W, Chen H, Chen H C, Dong N Q, Guo T, Shi M, Feng Q, Zhang P, Han B, Shan J X, Gao J P, Lin H X. Natural alleles of a proteasome alpha2 subunit gene contribute to thermotolerance and adaptation of African rice., 2015, 47: 827–833.
[59] Kan Y, Mu X R, Zhang H, Gao J, Shan J X, Ye W W, Lin H X. TT2 controls rice thermotolerance through SCT1-dependent alteration of wax biosynthesis., 2022, 8: 53–67.
[60] Zhang H, Zhou J F, Kan Y, Shan J X, Ye W W, Dong N Q, Guo T, Xiang Y H, Yang Y B, Li Y C, Zhao H Y, Yu H X, Lu Z Q, Guo S Q, Lei J J, Liao B, Mu X R, Cao Y J, Yu J J, Lin Y, Lin H X. A genetic module at one locus in rice protects chloroplasts to enhance thermotolerance., 2022, 376: 1293–1300.
[61] Nieto-Sotelo J, Kannan K B, Martinez L M, Segal C. Characterization of a maize heat-shock protein 101 gene, HSP101, encoding a ClpB/Hsp100 protein homologue., 1999, 230: 187–195.
Advances in heat-stress responses at sexual reproduction stage in plants
CHEN Sai-Hua*, ZHONG Wei-Jie, and XUE Ming
Key Laboratory of Plant Functional Genomics of the Ministry of Education / Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou University, Yangzhou 225009, Jiangsu, China
The occurrence of extreme hot weather poses a threat to crop production. Heat stress suffered at reproductive stage in crops is always correlated with crop yield losses, and thus the underlying molecular mechanisms are of great significance in crop thermotolerance improvement. However, relevant studies are mainly focused onand less is known in crops. From the perspective of plants, here, we reviewed the heat-stress responses at reproductive stage, including meiosis process, tapetum degradation, microspore development, pollen-tube germination, and fertilization, as well as seed development. Based on these advances, we proposed feasible strategies for thermotolerance improvement, which will pave a way for the breeding of heat-tolerant crop varieties.
plants; sexual reproduction; heat stress; response; molecular mechanism; thermotolerance
本研究由崖州湾种子实验室与中国种子集团联合资助项目(B23YQ1510), 江苏省种业振兴揭榜挂帅项目(JBGS[2021]002)和江苏省农业科技自主创新项目(CX(21)3100)资助。
This study was supported by the Hainan Yazhou Bay Seed Laboratory and China National Seed Group (B23YQ1510) and the Jiangsu Province Government Funding (JBGS[2021]002), and the Jiangsu Agricultural Science and Technology Innovation Fund(CX (21)3100).
URL: https://kns.cnki.net/kcms2/detail/11.1809.S.20230710.1751.002.html
This is an open access article under the CC BY-NC-ND license (http://creativecommons.org/licenses/by-nc-nd/4.0/).
通信作者(Corresponding author): 陈赛华, E-mail: chensaihua@yzu.edu.cn
2023-05-06;
2023-06-28;
2023-07-11.
10.3724/SP.J.1006.2023.32020

