水稻绒毡层发育相关转录因子研究进展
张秋云,沈亚琦,蒋文翔,刘家林,王联红,贺浩华,2,3,胡丽芳,2,3
(1.江西农业大学作物生理生态与遗传育种教育部重点实验室,南昌 330045;2.江西省超级稻工程技术研究中心,南昌 330045;3.双季稻现代化生产协同中心,南昌 330045)
水稻(Oryza sativaL.)的雄性生殖器官正常发育对其繁衍具有重要意义[1]。雄性核不育水稻是杂交制种的便捷途径[2],雄性生殖器官花药的最内层壁细胞为绒毡层细胞,与小孢子发育紧密联系,是雄性不育的关键因素。绒毡层的正常发育能保障花粉母细胞减数分裂周期完成,在其发育后期可分泌酶降解胼胝质释放小孢子,并为花粉粒的发育提供营养和所需的脂类物质[3]。绒毡层发育依赖于基因的表达,基因的表达受转录因子调控,确定转录因子的功能是了解水稻绒毡层发育相关基因表达的重要部分。
水稻绒毡层的发育过程简述为分化形成和退化降解两个部分,这两个部分受到不同家族转录因子的调控作用。阐明绒毡层分化形成和退化降解的相关转录因子之间的调控网络,可为进一步了解水稻雄性不育分子机理提供理论支撑。
1 绒毡层的发育过程及功能
水稻花药绒毡层发育是一个连续的过程,主要分为2 个阶段:①分化形成。在花粉母细胞形成期绒毡层初步形成,经由次级壁细胞经过两次平周分裂形成于花药壁的最内层[4]。②退化降解。从花粉母细胞减数分裂初期至小孢子早期,绒毡层细胞质开始浓缩、颜色加深;小孢子中期,绒毡层开始退化降解,在成熟花粉时期最终消失[5]。
绒毡层对花粉母细胞和小孢子发育的作用主要体现在3 个方面:①在花粉母细胞四分体时期,绒毡层会分泌胼胝质降解酶,用以分解四分体之间的胼胝质结构,释放小孢子细胞[6]。②从花粉母细胞时期开始,绒毡层为花粉合成营养物质并运至药室中,从而为花粉母细胞减数分裂和小孢子发育提供所需的营养[7]。③小孢子中期,绒毡层开始退化降解,合成花粉壁所需孢粉素等脂类物质,并通过特殊结构乌氏体运输到小孢子表面,使花粉壁结构稳定,从而保证花粉活力[8]。此外,绒毡层细胞能通过影响减数分裂基因的表达对小孢子母细胞发育和成熟发挥作用[9]。
2 调控水稻绒毡层发育的转录因子
水稻绒毡层的发育是一个短暂有序的过程,涉及不同的酶、结构蛋白质和转录因子[10,11]。转录因子在生物中广泛存在,具有保守性,通过特定的DNA 结合域调控特定基因的表达,可以产生信号传导分子,或参与细胞发育过程调节细胞周期[12]。研究发现影响水稻绒毡层发育的相关转录因子主要为bHLH 转录因子、PHD-finger 结构域蛋白质,此外还有MADS 转录因子、bZIP 转录因子、AGO 家族蛋白质等,这些转录因子的功能可分为调控绒毡层的分化形成和退化降解两方面(表1)。
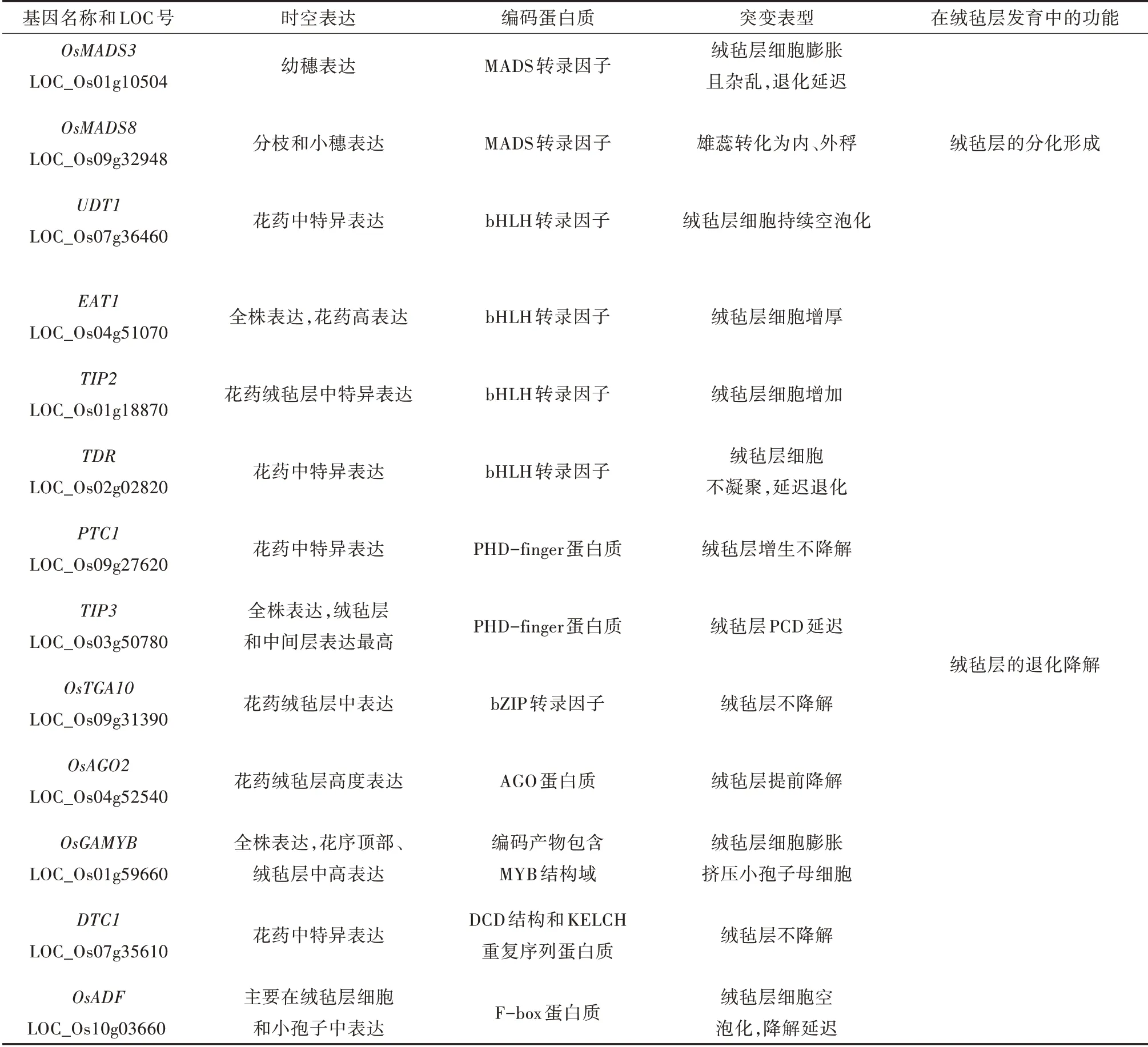
表1 参与水稻绒毡层发育的转录因子
2.1 bHLH 转录因子
目前分离出的参与水稻绒毡层发育的bHLH 转录因子包括UDT1(UNDEVELOPED TAPETUM 1)、TDR(TAPETUM DEGENERATION RETARDATION)、TIP2(TDR INTERACTING PROTEIN 2)和EAT1(ETER⁃NAL TAPETUM 1)。其中UDT1定位于7 号染色体,全长1 698 bp,包括4 个外显子和3 个内含子,编码含有227 个氨基酸的蛋白质。BLAST 功能域分析表明,在第59~118 个氨基酸区域,既有形成二聚体所需的HLH 结构域,又具有DNA 结合所需的碱性结构域,表明该蛋白为bHLH 转录因子。UDT1基因突变得到不育突变植株udt1,表现花药白色且无可育花粉,毡层细胞持续空泡化,降解延迟。该基因在绒毡层细胞早期阶段具有很高的转录活性。芯片分析表明,突变体udt1在绒毡层发育早期大多数Aps(天冬氨酸蛋白酶)和丝氨酸蛋白酶基因下调并优先表达,而Cys(半胱氨酸蛋白酶)基因上调并优先表达,表明UDT1是水稻绒毡层早期发育的关键基因,主要参与次生壁细胞向成熟绒毡层的分化[13]。
TDR位于2 号染色体,全长3 223 bp,包含7 个内显子和8 个外显子,编码一个由552 个氨基酸组成的bHLH 蛋白质,bHLH 结构域位于第280~341 个氨基酸之间。TDR 蛋白与拟南芥AMS 蛋白最为相似,但与UDT1编码的全长蛋白序列仅有12% 的同源性[14]。tdr突变体绒毡层细胞质染色不加深,不浓缩,缺乏变性的超微结构特征。TUNEL 试验和彗星试验表明,绒毡层PCD(程序性死亡)信号微弱,说明其未能降解。Affymetrix 水稻芯片对在减数分裂即小孢子发育阶段的野生型和tdr突变体花药进行转录分析时,发现2 个目标基因OsCP1和Osc6分别编码半胱氨酸蛋白酶和半胱氨酸蛋白酶抑制剂,而半胱氨酸蛋白酶与细胞的凋亡密切相关,表明TDR与水稻花药绒毡层的PCD 过程密切相关[15]。
TIP2位于1 号染色体,全长2 112 bp,包含3 个内含子和3 个外显子,由于其编码的产物与TDR相互作用而命名。TIP2编码的转录因子包含一个保守的bHLH 结构域和一个未知的功能域,与EAT1 蛋白的序列具有高度相似性。对tip2突变体花药横切面观察,发现花药壁内三层细胞形态无明显差异,无法区分绒毡层细胞,细胞数量分析发现绒毡层的平均细胞数较野生型显著增加[14]。共表达TIP2和TDR的酵母菌株在缺乏His 和Ade 的特定培养基上正常生长,显示LacZ报告基因表达激活,证实了TIP2和TDR之间相互作用。研究表明TIP2与TDR互作共同参与调控花药发育后期绒毡层PCD 过程[16]。
EAT1位于4 号染色体上,全长3 063 bp,包含3个内含子和4 个外显子,EAT1编码含有一个bHLH结构域和一个DUF 基序的转录因子。对eat1-1突变体进行花药横切面观察,发现绒毡层异常,乌氏体呈不规则的圆形,并被一层管状结构所覆盖,花药发育和小孢子形成被终止。 qRT-PCR 检测突变体eat1-1,发现GAMYB、UDT1、TDR和PTC1等基因在eat1-1花药中没有明显变化,酵母双杂交分析表明EAT1与TDR相互作用。EAT1在分子调控网络上位于TDR的下游,可直接调控AP25和AP37编码APs来调控水稻绒毡层的PCD 过程[17]。
2.2 PHD-finger 结构域蛋白
目前分离出的参与水稻绒毡层发育的PHDfinger 结构域蛋白质包括PTC1(PERSISTENT TAPE⁃TAL CELL1)和TIP3(TDR INTERACTING PROTEIN 3)。TIP3是最新发现的与水稻TDR 蛋白相互作用的基因,位于3 号染色体上,全长2 094 bp,包含3 个外显子和2 个内含子,编码698 个氨基酸构成的PHD-finger 蛋白质。TIP3敲除突变体植株表现出完全不育,与野生型对比,tip3突变体绒毡层细胞PCD 延迟,尽管小孢子母细胞释放出小孢子,但其细胞质凌乱且密布小液泡。突变体tip3从第8 时期开始在绒毡层中几乎没有TUNEL 信号,再次表明绒毡层PCD 延迟,说明TIP3也参与调控水稻绒毡层的PCD 过程[18]。
PTC1定位在9 号染色体上,包含一个2 040 bp的编码区,其中有3 个外显子和2 个内含子,分别在N 未端和C 末端预测一个核定位信号和一个保守的PHD 结构域。突变体ptc1表现为雄性不育,透射电镜分析其花药结构变化,发现其绒毡层的膜和细胞器持续保持完整,没有破裂和凋亡的迹象,且绒毡层广泛增生向花药室挤压且乌氏体相对减少。对野生型和ptc1 突变体进行转录分析发现,175 个与脂质运输和代谢以及次生代谢物生物的合成、运输和分解代谢有关的基因在突变体ptc1中表达量产生差异[19]。进一步分析发现,PTC1与TIP3在水稻中不是功能冗余基因,能通过另外的途径调控水稻绒毡层的退化降解[20]。
2.3 MADS-box 转录因子
目前分离出的参与水稻绒毡层发育相关的MADS-box 转录因子包括OsMADS3 和OsMADS8。OsMADS3位于1号染色体,为水稻C类器官识别蛋白质,在花药发育早期被证明是雄蕊发育的必需基因。在雄蕊原基中,当外稃和内稃原基启动时,OsMADS3的表达开始被检测到,在第9~12 时期OsMADS3在绒毡层和小孢子中再次表达。突变体mads3-4绒毡层细胞没有凝聚且染色较浅,之后绒毡层细胞增大并杂乱无序,且降解延迟[21]。结果表明,OsMADS3早期参与了花药原基的分化并间接参与绒毡层形成,后期也在绒毡层退化中表达调控[22]。
OsMADS8位于9 号染色体,全长6 377 bp,为水稻E 类器官识别蛋白质。为分析OsMADS8的调控网络,构建了OsMADS8基因敲除转基因株系,收集转基因植株0.5~2.0 cm 的圆锥花序用于基因芯片分析。利用水稻芯片技术分析发现OsMADS8的一个靶向基因OsTGA10,该基因位于9 号染色体上,全长9 095 bp,包含9 个内含子和10 个外显子,被注释为bZIP 转录因子。靶向区域分析表明,OsMADS8直接通过蛋白-DNA 结合方式靶向OsTGA10。对突变体ostga10花药切片观察,发现突变体的绒毡层细胞降解异常,其细胞质不浓缩,细胞核较大,降解延迟[23]。表明OsMADS8不仅调控水稻花分生组织形成雄蕊且抑制小穗分生组织的逆转,还通过调控OsTGA10,参与水稻绒毡层的PCD 过程[24]。
2.4 其他转录因子
目前分离出的参与水稻绒毡层发育相关的其他转录因子还包括OsAGO2、DTC1和OsGAMYB。OsAGO2位于4号染色体,全长3 063 bp,编码包含典型AGO蛋白的PAZ 和PIWI 结构域的转录因子。OsAGO2的敲除导致花药发育缺陷从而花粉不育,绒毡层都出现细胞质疏松和空泡化,绒毡层提前出现降解,后期绒毡层细胞持续空泡化[25]。表明OsAGO2主要参与调控花药后期绒毡层降解。
DTC1(DEFECTIVE TAPETUM CELL DEATH 1)位于7 号染色体,全长为3 163 bp,包含6 个内含子和6 个外显子,编码一种含有DCD 结构域和KELCH重复序列的蛋白质。dtc1突变体的绒毡层没有降解,而是保持原有形状,但小孢子降解消失。qRTPCR 分析dtc1突变体的基因表达差异,发现UDT1、TDR和EAT1的表达水平没有明显变化,而OsCP1、AP25、AP37和Osc6的转录水平显著降低,这些基因在tdr、eat1和eat1突变体中也表达下调。DTC1 的启动子区域包含一个bHLH 转录因子的假定靶序列,说明DTC1可能作用于UDT1、TDR和EAT1的下游。双分子荧光互补试验得出DTC1 蛋白质与OsMT2b和OsMT-I-4b 相互作用,表明DTC1是调控花药后期绒毡层降解的重要基因[26]。
OsGAMYB位于1 号染色体,全长4 325 bp,编码的OsGAMYB 蛋白质包含4 个结构域:MYB 结构域和其他3 个保守域,是水稻绒毡层发育中一个GA 相关的MYB基因。OsGAMYB在花序顶部区域表达,在雄蕊原基和花药绒毡层细胞高表达,在营养生长器官表达较低[27]。突变体gamyb的花药绒毡层发育异常,小孢子母细胞皱缩不紧挨绒毡层,随后绒毡层细胞膨胀延伸到内室,导致雄性不育。OsGAMYB与UDT1平行作用于绒毡层发育,影响了水稻绒毡层的退化降解[28]。
3 水稻绒毡层发育相关基因的转录调控网络
bHLH 蛋白质是调控绒毡层发育过程的核心转录调控因子。UDT1 优先表达于绒毡层早期发育阶段,调控编码转录因子的基因除bHLH 基因外,还包含MYB 和WRKY 转录因子。UDT1 启动子包含Ebox 元件,这些元件是bHLH-MYB 转录复合物中已知的结合位点,表明UDT1 与OsGAMYB 平行调控水稻的早期发育[29,30]。MSP1(MULTIPLE SPORO⁃CYTE 1)和MIL2(MICROSPORELESS2)调节3 个花药内壁层的产生和分化,突变会导致绒毡层消失[31,32]。TIP2、TDR 和EAT1紧密联系,主要调控绒毡层降解,基因表达较晚,可能在UDT1、MSP1和MIL2的下游起作用。TIP2位于TDR和EAT1的上游,在绒毡层分化形成初期表达,促进绒毡层分化。在绒毡层细胞分化形成后期,TIP2 通过激活下游转录因子TDR编码蛋白质,并与TDR 形成复合蛋白质继续促进绒毡层细胞的发育。在四分体时期,TIP2调控第三个bHLH 转录因子EAT1的表达,同时EAT1 蛋白与TDR 蛋白形成新的复合体,调节绒毡层程序性死亡过程(图1)。TDR直接调控花药发育相关基因OsADF、Osc6和OsCP1的表达水平。OsADF 是F-box 蛋白质,在细胞周期进程、转录调控、程序性细胞死亡和细胞信号等许多生理活动中起关键作用[33]。TDR 可能通过触发ADF 介导的蛋白质水解通路调节绒毡层细胞发育和花粉形成[34]。Osc6和OsCP1与水稻花药发育所需的脂质(LTPs)有关,OsCP1编码一种半胱氨酸(Cys)蛋白酶,属于广泛分布于动植物和微生物中的一个酶家族,在降解细胞内蛋白质和促进PCD 方面发挥着重要作用[35]。OsC6编码具有脂质结合活性的特定脂质转移蛋白质(LTP),是绒毡层特定结构乌氏体和花粉外壁发育所必需的[36]。 EAT1 通过激活AP25和AP37(两者都是天冬氨酸蛋白酶)的转录,激活下游蛋白酶表达从而调控绒毡层细胞死亡[37]。
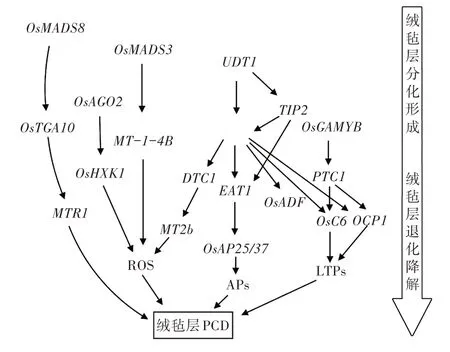
图1 绒毡层的发育调控网络
OsGAMYB、UDT1、TDR、CYP703A3[38]作用于PTC1的上游,而PTC1调控Cys 蛋白酶和质膜ATP酶的表达,质膜ATP 酶是调节细胞凋亡和坏死之间转换的关键蛋白质[39]。TIP3、PTC1和拟南芥中的PHD-finger 蛋白影响雄配子减数分裂的机制不同[40,41],TIP3、PTC1与TDR互作,直接或者间接地激活下游特定靶基因进而调控绒毡层的降解和花粉壁的形成。
OsMADS3和OsMADS8同是花器官识别蛋白质,调控早期绒毡层的分化[42],同时又参与绒毡层的退化降解。OsMADS3与MT-1-4b的启动子有关,降低MT-1-4b的表达会导致转基因植株超氧阴离子水平升高,影响花粉育性[43]。OsTGA10为MADS-box蛋白质OsMADS8的靶点,OsMADS8蛋白与其第二个内含子结合,从而调控OsTGA10表达。MTR1编码一种分泌性成束蛋白糖蛋白,对水稻的雄性生殖发育起重要作用[44]。OsTGA10蛋白与AP25和MTR1启动子中的TGACG 单元结合,抑制了2个基因的启动子活性,TIP2的存在能增强OsTGA10蛋白的抑制作用。
OsAGO2在转录因子基因TIP2、TDR、EAT1/DTD和OsTGA10上游发挥作用。 OsAGO2 蛋白与Os⁃HXK1启动子结合并通过DNA 甲基化直接调控其表达。OsHXK1 是己糖激酶,这是一种双功能酶,它既能将己糖磷酸化,形成6-磷酸己糖,又能在糖传感和信号传导中发挥重要作用[45]。OsHXK1 的表达会影响绒毡层活性氧(ROS)的积累,从而调控绒毡层PCD 和花粉的正常发育。
DTC1在转录因子基因UDT1、TDR、EAT1下游和分泌蛋白基因OsMT2b上游发挥作用。OsMT2b编码一种分子量小、富含半胱氨酸的小分子金属结合蛋白质,在植物抗病信号传导通路中的活性氧产生和细胞死亡中发挥关键作用[46]。DTC1通过降低花药发育后期ROS 清除蛋白OsMT2b 的表达量和活性,提高ROS 的含量,从而促进绒毡层的降解。
4 展望
水稻绒毡层的分化形成和退化降解是一个复杂的过程,对花粉粒的育性有着重要作用,目前已发现多种与水稻绒毡层发育相关的转录因子。bHLH 蛋白质是花药绒毡层细胞分化、形态建成和降解过程的核心调控因子,可调节PHD-finger 蛋白质的表达。MADS-box 转录因子是同时协助水稻绒毡层形成及降解的重要转录因子。绒毡层细胞降解是小孢子发育的重要保障,活性氧(ROS)的积累是导致绒毡层细胞PCD 的关键。DTC1和OsMADS3直接或间接调控ROS 清除蛋白OsMT-1-4b 和OsMT2b 的表达量和活性,从而提高ROS 的含量,进一步促进绒毡层的降解,影响花粉的形成。此外脂肪代谢物是花粉外壁的重要成分,PTC1和EAT1分别影响半胱氨酸蛋白酶和蛋白酶抑制因子的表达,调控花粉壁的脂肪家族代谢,从而影响花粉育性。
应用正向及反向遗传学是了解水稻绒毡层发育相关基因的有效方法,花粉不育为相关突变体的产生和发现提供了良好的试验材料,为研究水稻花粉发育调控网络提供了便利。转录因子之间调控网络主要通过突变体引起的表达量变化来判断其上下游关系。然而人类目前对许多水稻绒毡层发育相关转录因子功能的了解还不深入,其调控网络依旧模糊。近年来,水稻花粉发育特定阶段以及特定组织的基因表达谱分析工作和激光微切割技术的发展为水稻花粉发育的分子机理研究奠定了良好的基础,同时高通量测序及代谢组分析方法的充分利用,使得对水稻绒毡层发育的相关转录因子的调控网络研究更加深入,相信更多未知的控制水稻生殖发育的分子机制将逐渐被人们所解析。

