微波消融治疗肺癌的疗效及安全性△
李帅,韩哲洙,金秀颖,朴正日,张松男#
延边大学附属医院1肿瘤科,2放射肿瘤科,吉林 延边 1330000
据报道,全球范围内肺癌发病率和病死率均居全部恶性肿瘤前列,无论是男性还是女性,肺癌均是第二大常见的肿瘤[1]。肺部具有独特的血液供应特点,因此转移灶在肺部出现的可能性高于身体其他任何部位,各种组织的肿瘤都有可能转移到肺部,甚至转移灶早于原发灶被发现[2],在肺转移癌中约75%为直肠癌、肾癌和乳腺癌[3]。对于早期肺癌,手术仍是首选的一线治疗方案,但因身体状况差或肿瘤分期晚等原因,80%以上的患者无法进行手术治疗,而非手术治疗如放化疗、生物治疗、介入治疗等则成为了这部分患者的主要治疗方法[4-6]。对于肺转移癌患者,主要以治疗原发病和改善症状为主。近年来,微创介入治疗特别是微波消融(microwave ablation,MWA)越来越受欢迎,与射频消融(radiofrequency ablation,RFA)相比,MWA 具有消融时间短、消融区域大、热沉效应低等优点,还具有调节肿瘤微环境的功能,为非手术治疗肺癌提供了新的方案。MWA 在肝脏肿瘤的治疗中得到广泛应用,但较少有研究系统阐述MWA 治疗肺部肿瘤的疗效、并发症及其危险因素。本研究探讨MWA 治疗肺癌的临床疗效及安全性,现报道如下。
1 资料与方法
1.1 一般资料
收集2018 年3 月至2021 年7 月于延边大学附属医院接受CT 引导下经皮MWA 治疗的原发性和转移性肺癌患者的病历资料。纳入标准:①经影像学或病理检查确诊为原发性或转移性肺癌;②不能或不愿意接受手术治疗;③单发病灶最大直径≤5 cm,双侧多发病灶≤3 个;④临床资料完整。排除标准:①合并严重肺纤维化或肺动脉高压;②合并凝血功能障碍(凝血酶原时间﹥18 s 或凝血酶原活动度﹤40%),血小板计数﹤50×109/L;③合并严重心、肺等器官功能障碍;④生存期﹤6 个月;⑤美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体力状况评分≥3 分;⑥失访。依据纳入和排除标准,本研究纳入38 例患者,其中,男性20 例,女性18 例;年龄38~83 岁。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 仪器及治疗方法
仪器:Aquilion ONE 16 排螺旋CT 购自日本TOSHIBA 公司,MTC-3C 微波消融治疗仪购自南京维京九洲医疗器械研发中心,MWA 工作频率为(2450±50)MHz,输出功率为5~120 W,配有内循环水冷系统。
MWA 治疗:术前6 h 禁食禁水,完善血液学检查(血常规、生化、肝肾功能、凝血功能)和影像学检查(胸部CT 平扫及增强扫描),留置静脉输液针,手术全程在心电监护下进行,根据术前影像学检查结果选择穿刺体位,重新进行术前CT 平扫,进一步明确病灶大小、部位、穿刺路径及穿刺点,并做好体表标记。应用2%利多卡因由体表依次逐层进行局部浸润麻醉后,进行MWA。本研究中的患者均使用1 根消融针,微波频率为(2450±50)MHz,功率为30~70 W,时间为4~18 min。沿麻醉路径逐层穿入消融针,尽量减少消融针在胸膜层的停留时间。再次进行CT 扫描,确定针尖与消融肿瘤的位置关系,并根据肿瘤大小、邻近组织、消融针的消融半径等调整穿刺深度。对于病灶直径≤3 cm 的肿瘤,采用单针单点消融;对于病灶直径﹥3 cm 或形态不规则的肿瘤,可调整穿刺路径进行单针多点消融。要求消融范围至少覆盖肿瘤周围5~10 mm,病灶消融结束后带功率拔出消融针,防止针道出血和种植转移。术后随即进行CT 扫描,观察有无出血、气胸等并发症。
1.3 术后随访
术后患者返回病房,给予心电监护、吸氧及相关药物治疗。嘱患者避免剧烈咳嗽,部分患者加用止咳、止痛、抗感染药物。术后24~48 h 复查胸部平扫CT,观察消融范围和并发症发生情况。术后第1、3、6 个月复查胸部CT,以后每隔6 个月复查1 次。将术后第1 个月首次复查的CT 结果作为判断疗效的依据。末次随访时间为2022 年12 月,随访10~52 个月,中位随访22 个月。
1.4 疗效评价
根据文献[7]评价疗效,包括完全消融、不完全消融、局部进展、无进展生存和技术有效。完全消融(出现以下任何1项):靶病灶缩小或消失;靶病灶为无强化空洞;瘤体及瘤周无肿瘤强化区;靶病灶瘢痕化或无实性强化结节。不完全消融(出现以下任何1 项):瘤体增大﹤10 mm;靶病灶空洞形成不完全,病灶内可见直径﹤10 mm 强化区;靶病灶大小无变化但瘤周或瘤体出现强化区﹤10 mm;靶病灶内实性强化结节,但大小不变或增大﹤10 mm。局部进展:靶病灶完全消融后瘤周可见新发强化区≥10 mm;肺内新发病灶。无进展生存时间(progression-free survival,PFS):首次消融后第1 天至发现病灶进展的时间。技术有效:MWA 后第6 个月复查,靶病灶无进展。局部控制率=(完全消融+不完全消融)例数/(完全消融+不完全消融+局部进展)例数×100%。
根据美国介入放射学会(Society of Interventional Radiology,SIR)制定的标准[7-8]评估并发症。①副反应:疼痛;消融后综合征(低热、乏力、全身不适、恶心、呕吐等为主要症状);无症状胸腔积液;无后果的邻近结构损伤。②轻微并发症:无不良结果,不需要治疗;无不良结果,仅需要对症治疗或过夜观察。③严重并发症:需要住院治疗或住院时间延长≤48 h;需要住院进行进一步治疗,提升护理级别;延长住院时间﹥48 h;导致永久不良后遗症;死亡。
1.5 统计学方法
采用SPSS 20.0 软件对数据进行统计分析。计数资料以例数和率(%)表示;符合正态分布的计量资料以均数±标准差(±s)表示,非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示;采用Kaplan-Meier 法绘制生存曲线;采用二元Logistic 回归模型分析并发症发生的影响因素。
2 结果
2.1 临床资料
本研究38 例患者中,男性20 例(52.6%),女性18 例(47.4%);平均年龄(66.6±9.73)岁,﹥60 岁30例(78.9%),≤60 岁8 例(21.1%)。原发性肺癌26例(68.4%),其中腺癌21 例,鳞状细胞癌5 例;转移性肺癌12 例(31.6%),其中原发灶为结直肠癌8例,胆管癌2 例,乳腺癌1 例,子宫内膜癌1 例。共有40 个靶病灶,靶病灶平均直径(2.21±1.06)cm,≤3 cm 28 个(70%),最大直径为4.4 cm,绝大多数病灶为圆形或椭圆形,形态不规则2 个。靶病灶和胸膜距离的中位数为6.8 cm。肿瘤位于左肺上叶12例,左肺下叶7 例,右肺上叶12 例,右肺中叶3 例,右肺下叶6 例。消融时间为90~1620 s,中位消融时间为510 s;消融功率为15.00~56.75 W,中位消融功率为37.45 W;消融能量为0.27~60.60 MJ,中位消融能量为19.89 MJ。2 例患者进行2 个病灶的消融,其余患者均为单病灶消融,所有患者随访时间均超过10 个月。
2.2 MVA 治疗疗效
术后首次影像学检查结果显示,38 例患者的40 个靶病灶中,39 个病灶完全消融,完全消融率为97.5%;1 例病灶在术后1 个月评估中发现残留,再次接受MVA 后达到完全消融。随访第6 个月时,7例(18.4%)患者靶病灶进展,技术有效率为81.6%。至随访结束,13 例(34.2%)患者靶病灶局部进展,其中原发性肺癌8 例,继发性肺癌5 例。术后3 个月、6 个月、9 个月、1 年,患者的局部控制率分别为94.7%(36/38)、81.6%(31/38)、78.9%(30/38)、73.7%(28/38)。其中1 例乳腺癌肺转移患者,术前行增强CT 扫描示:左肺上叶尖后段见结节影,大小约1.8 cm,可见分叶,增强后不均匀强化;术后6 个月复查CT 示:病灶明显缩小,完全消融呈瘢痕化(图1)。至随访结束,该患者肺部病灶未见复发。
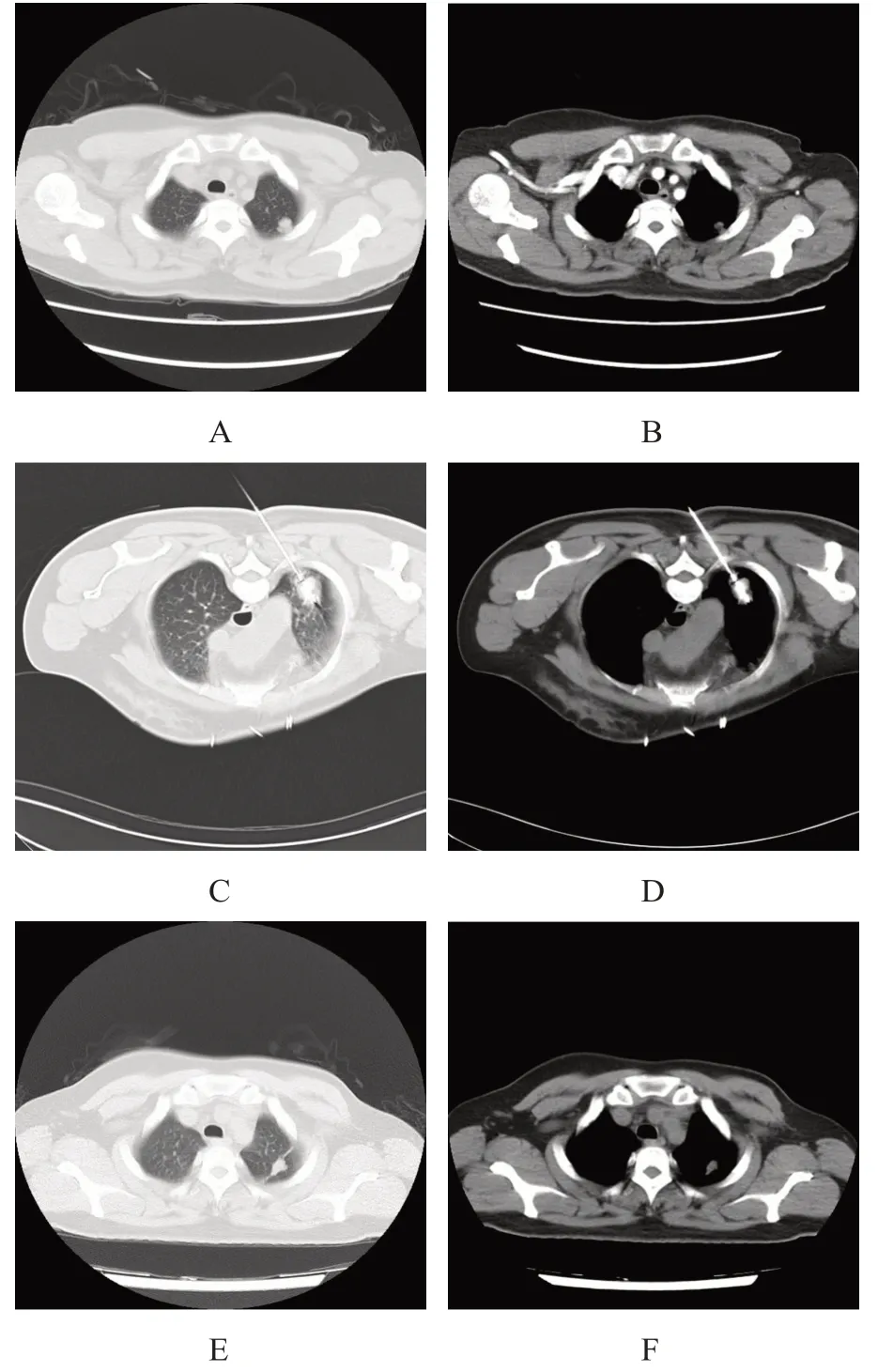
图1 乳腺癌肺转移患者治疗前后CT检查图片
2.3 无进展生存情况
原发性肺癌患者的PFS 为1~52 个月,平均PFS为(37.54±4.24)个月,未达到中位PFS。转移性肺癌患者的PFS 为4~52 个月,平均PFS 为(34.83±6.10)个月,中位PFS 为47 个月。(图2)
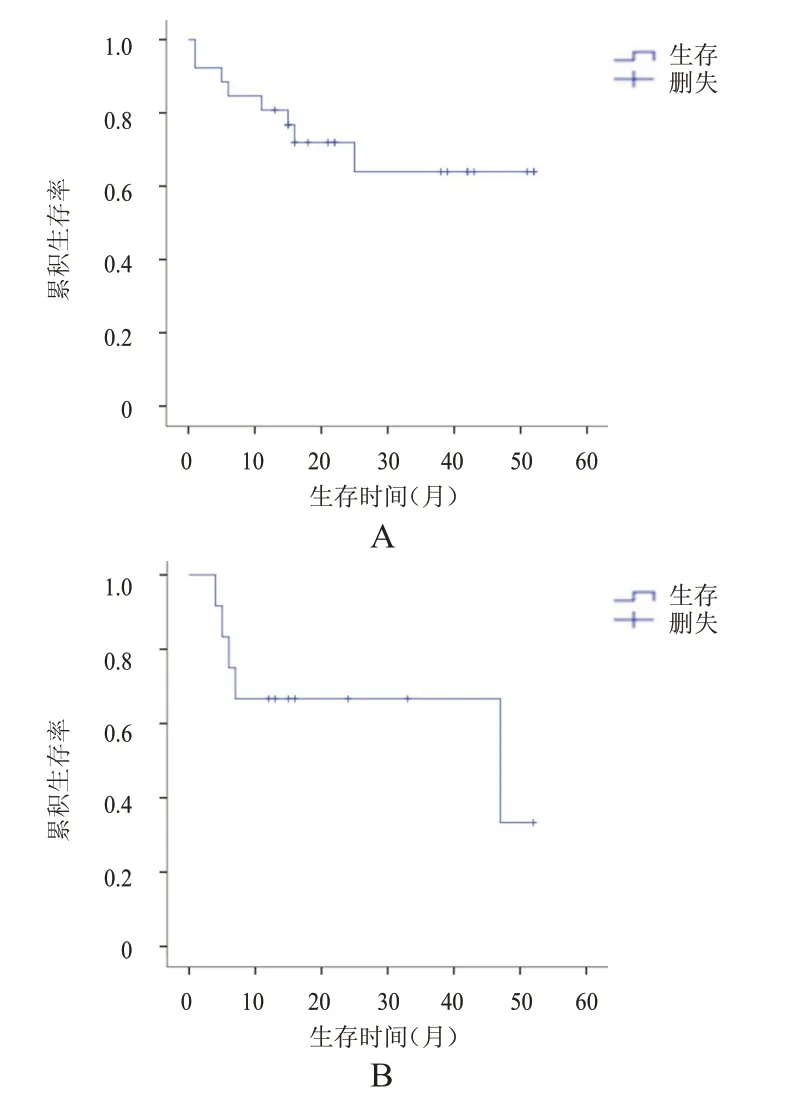
图2 原发性和转移性肺癌患者的PFS曲线
2.4 并发症发生情况及危险因素分析
38 例患者中,胸腔积液、气胸、疼痛发生率均为23.7%,发热发生率为15.8%,肺出血发生率为10.5%,均表现为咯血,肺炎发生率为13.2%(表1)。对各并发症发生的影响因素分别进行二元Logistic回归分析,多因素分析结果显示,靶病灶大小是肺癌患者MWA 治疗后发生气胸的独立危险因素(P=0.017);靶病灶和胸膜的距离是肺癌患者MWA 治疗后发生胸腔积液的独立危险因素(P=0.048),是发生疼痛的独立保护因素(P=0.031);消融能量是肺癌患者MWA 治疗后发生疼痛的独立危险因素(P=0.034)。(表2)
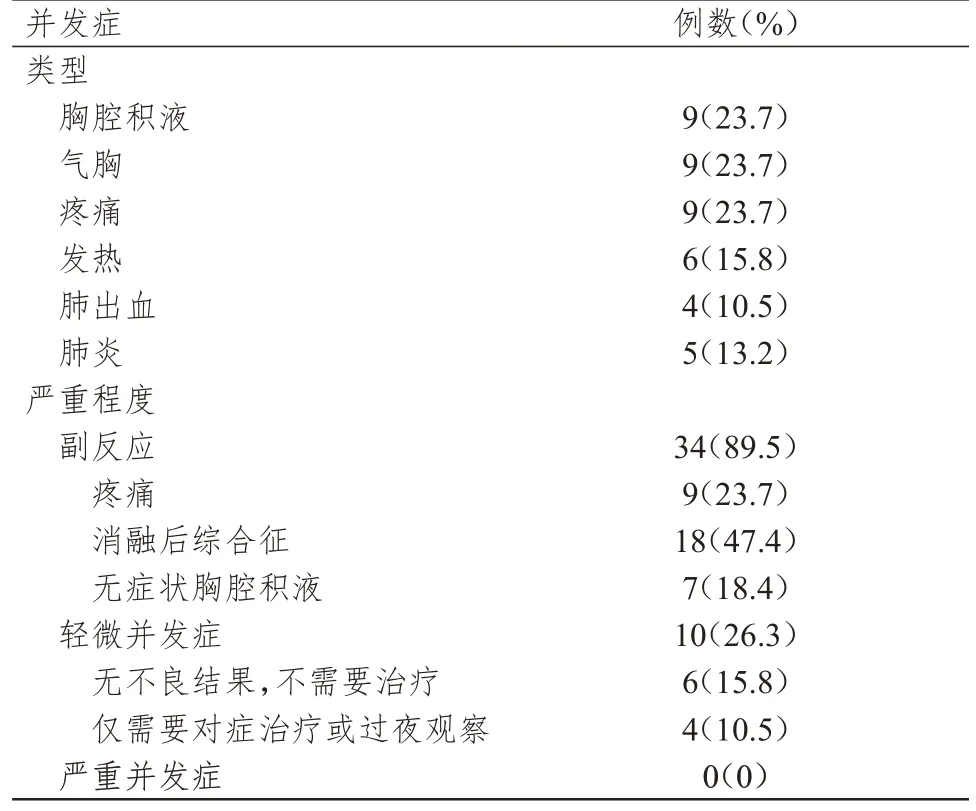
表1 38 例肺癌患者的并发症发生情况
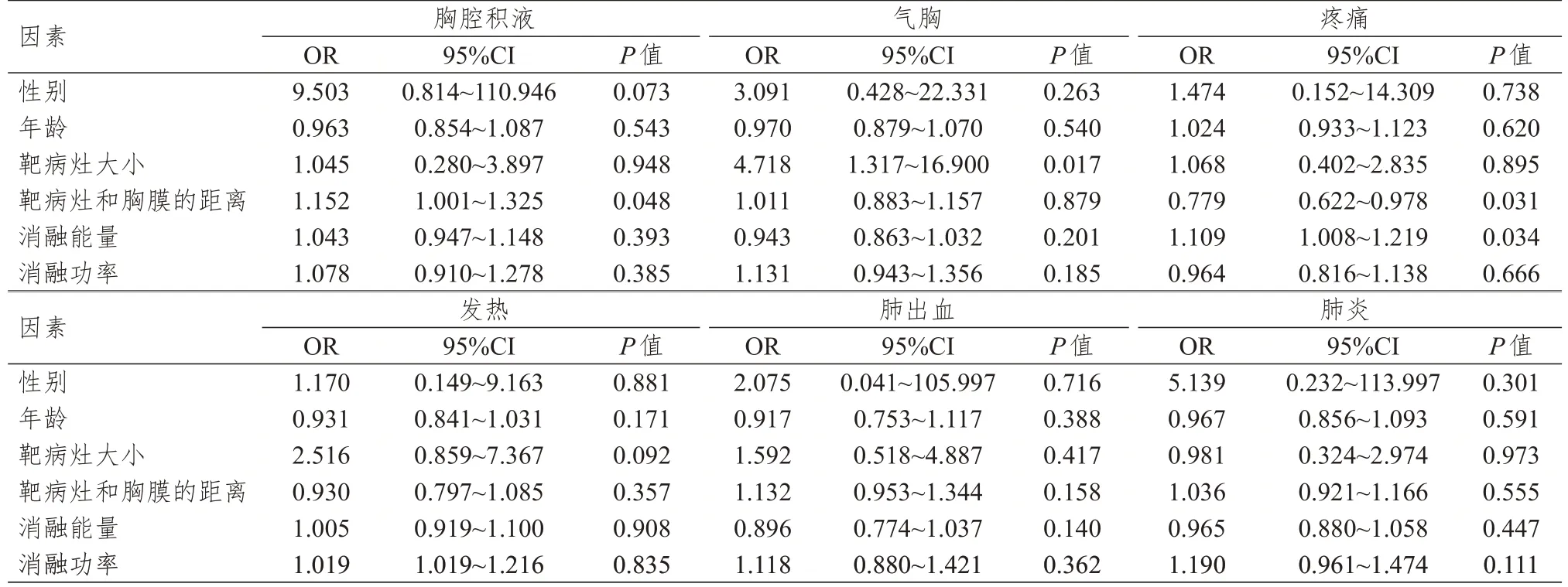
表2 肺癌患者MWA 治疗后并发症发生影响因素的多因素Logistic 回归分析
3 讨论
肺癌是中国及全球范围内发病率和病死率最高的恶性肿瘤之一,常规手术治疗常因患者年龄、心肺功能、肿瘤分期等因素无法进行,因此临床上常采取局部热消融、放疗等方法进行治疗[4,9]。MWA 利用肿瘤中水分子、蛋白质等极性分子和钠、钾等带电粒子的高速转动,产生每秒20~50 亿次的震动,相互摩擦产生高达70~160 ℃的高温,使肿瘤发生凝固性坏死,同时坏死的肿瘤组织能够释放肿瘤特异性抗原,激活机体产生特异性T 细胞免疫反应[8,10]。MWA 不仅能够消灭肿瘤细胞,还能够改变肿瘤微环境,因此广泛应用于肝癌、肺癌、乳腺癌等恶性肿瘤的治疗。有研究表明,对于原发性肺癌和继发性肺癌的局部治疗,MWA 可以达到与外科手术相似的结果[11-12]。
在一项长达10 年的回顾性研究中,接受MWA治疗的肺癌患者的平均PFS 为(19.1±16.2)个月,1、2 年无进展生存率分别为44.5%和32.9%[13]。本研究中,原发性肺癌患者的平均PFS 为(37.54±4.24)个月,1 年无进展生存率为80.77%,高于上述研究报道的结果,可能与本研究中患者完全消融率高、平均年龄小、基础疾病少有关。Wei 等[14]报道了接受MWA 治疗的79 例寡转移非小细胞肺癌患者,91.1%的患者取得技术成功,中位PFS 为14.0 个月(95%CI:10.3~17.8 个月)。在另一项回顾性研究中,32 例肺转移癌患者的48 个病灶接受MWA 治疗,完全消融率为87.5%,患者的中位PFS 为26 个月,1、2 年无进展生存率分别为79.5%和63.8%[15]。与既往报道相比,本研究中转移性肺癌患者的平均PFS 和中位PFS 均较长,可能与本研究中患者完全消融率高、大多数靶病灶﹤3 cm 等复发危险因素少有关。
MWA 是一种相对安全的肿瘤局部治疗方法,本研究中未发生与消融相关的死亡及严重并发症。据报道,与MWA 相关的并发症发生率为40%~60%,最常见的MWA 相关并发症是气胸,发生率为8.5%~63.0%,绝大多数无需额外处理,可自行吸收,约10%的患者因气胸较大需要行胸腔闭式引流[15-18]。本研究中,靶病灶大小是肺癌患者MWA 治疗后发生气胸的独立危险因素(P﹤0.05),这是因为靶病灶越大,消融范围也就越大,造成的肺损伤越大,气胸发生率就越高。也有研究认为,多个消融针是肺癌患者MWA 治疗后发生气胸的危险因素[18],本研究所有患者均使用单针消融,避免了因多针消融造成的气胸。有研究报道,在消融大气道、大血管旁的病灶时,更容易引起出血、气胸等并发症[6]。MWA治疗后疼痛发生率为2.0%~27.6%,一般来说多为轻度和中度疼痛,对镇痛药物的反应良好[19]。本研究中,靶病灶和胸膜的距离、消融能量分别是肺癌患者MWA 治疗后发生疼痛的独立保护因素和独立危险因素(P﹤0.05),这是因为胸膜和胸壁有着丰富的感觉神经,对疼痛较为敏感,消融能量越大,对神经产生的热刺激越大,疼痛也就越明显。有研究报道,在距胸膜1.5 cm 或更近距离的肿瘤MWA 期间疼痛更为显著,人工诱导气胸可预防气胸和胸壁损伤,人工气胸是在肿瘤与胸膜之间填充气体,这样既可以减轻对周围正常肺组织的破坏,也可以减轻对胸壁的热灼伤,从而达到预防气胸和胸壁损伤的目的[20]。在本研究中,MWA 治疗后肺出血的发生率为10.5%,这与消融损伤肺内及肋间血管有关,因此消融时选择的路径应避免靠近较大血管。MWA 治疗后无症状胸腔积液的发生率为2.9%~21.7%,通常无需治疗,本研究中靶病灶和胸膜的距离是肺癌患者MWA 治疗后发生胸腔积液的独立危险因素(P﹤0.05)。Xu 等[21]研究认为,消融最大功率、穿刺次数、针头和胸膜的距离均是肺癌患者MWA 治疗后发生胸腔积液的影响因素。当肿瘤和胸膜的距离﹤7 mm 时,更有可能发生与胸膜相关的重大并发症[22]。本研究中均使用单针消融,避免了因多针消融造成的气胸、出血、针道种植转移、神经损伤等并发症。但单针消融大病灶、不规则病灶时,需要多点消融,容易造成气胸、出血等并发症。
综上所述,MWA 治疗肺癌具有较高的安全性和较好的疗效,为肺癌患者的局部治疗提供了一种可行性。靶病灶大小、靶病灶和胸膜的距离、消融能量均是肺癌患者MWA 治疗后并发症发生的影响因素。术前严格评估靶病灶大小、靶病灶和胸膜的距离,选择合适的穿刺路径和消融能量是减少术后并发症的关键。

