磷酸酶张力蛋白同源物和配对盒2 在子宫内膜诊刮标本中的表达及病理诊断意义△
林建松,刘仙花,廖翏,许淑霞
福建省妇幼保健院病理科,福建 福州 3500010
子宫内膜诊刮标本送病理诊断是临床上十分常见的妇科检查方法,其主要目的是检测是否存在肿瘤病变,病理医师主要通过观察显微镜下子宫内膜碎片的形态进行诊断。正常的子宫内膜形态比较容易辨认,异常增生的子宫内膜表现为子宫内膜非典型增生或子宫内膜样癌,在实际工作中这两种形态经常容易混淆,而且由于标本量少、标本不完整等问题,增加了诊断难度。形态学观察存在较大的主观性,重复性较低,因此需要借助一些检测方法辅助诊断。本研究探讨磷酸酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)和配对盒2(paired box 2,PAX2)在子宫内膜诊刮标本中的表达及病理诊断意义,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年1—12 月于福建省妇幼保健院行子宫内膜诊刮的患者。根据世界卫生组织(WHO)女性生殖系统肿瘤分类标准[1]进行分类:子宫内膜增生不伴非典型是指子宫内膜腺体和间质比例增加,细胞核无非典型表现;子宫内膜增生伴非典型是指子宫内膜腺体结构拥挤,细胞核有非典型表现;子宫内膜样癌是指子宫内膜非典型增生的基础上出现间质浸润,其中间质浸润定义为间质缺失(融合的腺体、筛状或迷宫样模式)、改变的子宫内膜间质(促纤维间质反应)或复杂的结构(主要是绒毛状)。本研究共纳入96 例患者,其中27 例增生期子宫内膜患者、53 例子宫内膜增生患者(24例不伴非典型,29 例伴非典型)、16 例子宫内膜样癌患者,分别作为增生期子宫内膜组、子宫内膜增生不伴非典型组、子宫内膜增生伴非典型组、子宫内膜样癌组。增生期子宫内膜组、子宫内膜增生不伴非典型组、子宫内膜增生伴非典型组、子宫内膜样癌组患者的平均年龄分别为(43.26±9.28)、(42.88±9.29)、(44.10±7.33)、(52.38±8.35)岁,其中子宫内膜样癌组患者平均年龄较大,与其他3 组相比,差异均有统计学意义(P﹤0.01)。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 免疫组化染色法检测PTEN 和PAX2 蛋白表达
所有标本均经4%中性甲醛固定,常规脱水,石蜡包埋,4 μm 厚切片,苏木精-伊红(hematoxylin and eosin,HE)染色。采用EnVision 二步法[2]进行免疫组化染色,石蜡烘烤后脱蜡至水,再行抗原修复10~15 min,阻断内源性过氧化物酶,血清封闭后加入一抗(鼠抗人PTEN 抗体和兔抗人PAX2 抗体)、二抗,显色,复染,脱水,封片。应用免疫组化自动染色机,严格按各抗体说明书步骤进行操作,设置阳性和阴性对照。
1.3 免疫组化染色结果判定
PTEN和PAX2免疫组化染色结果判定标准[3-5]:PTEN 主要位于子宫内膜间质细胞的细胞质与腺上皮细胞的细胞核及细胞质。以子宫内膜腺上皮细胞的细胞核及细胞质出现棕黄色颗粒为阳性(染色不论强弱),反之无染色为阴性(即PTEN 表达缺失)。以子宫内膜间质细胞的细胞质阳性作为阳性对照。PAX2 主要位于子宫内膜腺上皮细胞的细胞核,细胞核染色即为阳性,无染色为阴性(即PAX2 表达缺失)。在正常的子宫内膜中,可发生单个或小簇腺体PTEN 和PAX2 丢失,只有丢失腺体≥5%子宫内膜才算缺失。在异常增生的子宫内膜中,PTEN 和PAX2 丢失范围常常是广泛的。
1.4 统计学方法
采用SPSS 24.0 软件对数据进行统计分析,计量资料以均数±标准差(±s)表示;计数资料以例数和率(%)表示,组间比较采用χ2检验或Fisher 确切概率法。以P﹤0.05 为差异有统计学意义。
2 结果
2.1 PTEN 蛋白缺失情况的比较
子宫内膜样癌组、子宫内膜增生伴非典型组PTEN 蛋白缺失率均高于增生期子宫内膜组、子宫内膜增生不伴非典型组,差异均有统计学意义(P﹤0.05)。(表1、图1)
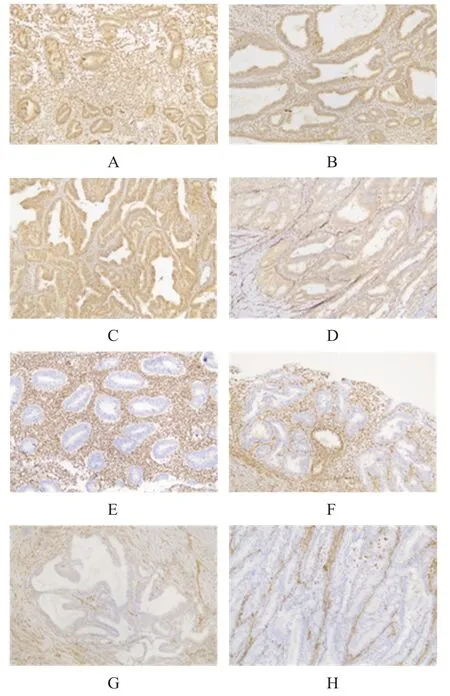
图1 免疫组化染色法检测PTEN蛋白表达(EnVision法染色,×100)

表1 4 组受检者PTEN 蛋白缺失情况的比较[n(%)]
2.2 PAX2 蛋白缺失情况的比较
子宫内膜增生不伴非典型组、子宫内膜增生伴非典型组、子宫内膜样癌组PAX2 蛋白缺失率均高于增生期子宫内膜组,子宫内膜增生伴非典型组PAX2 蛋白缺失率高于子宫内膜增生不伴非典型组,差异均有统计学意义(P﹤0.05)。(表2、图2)
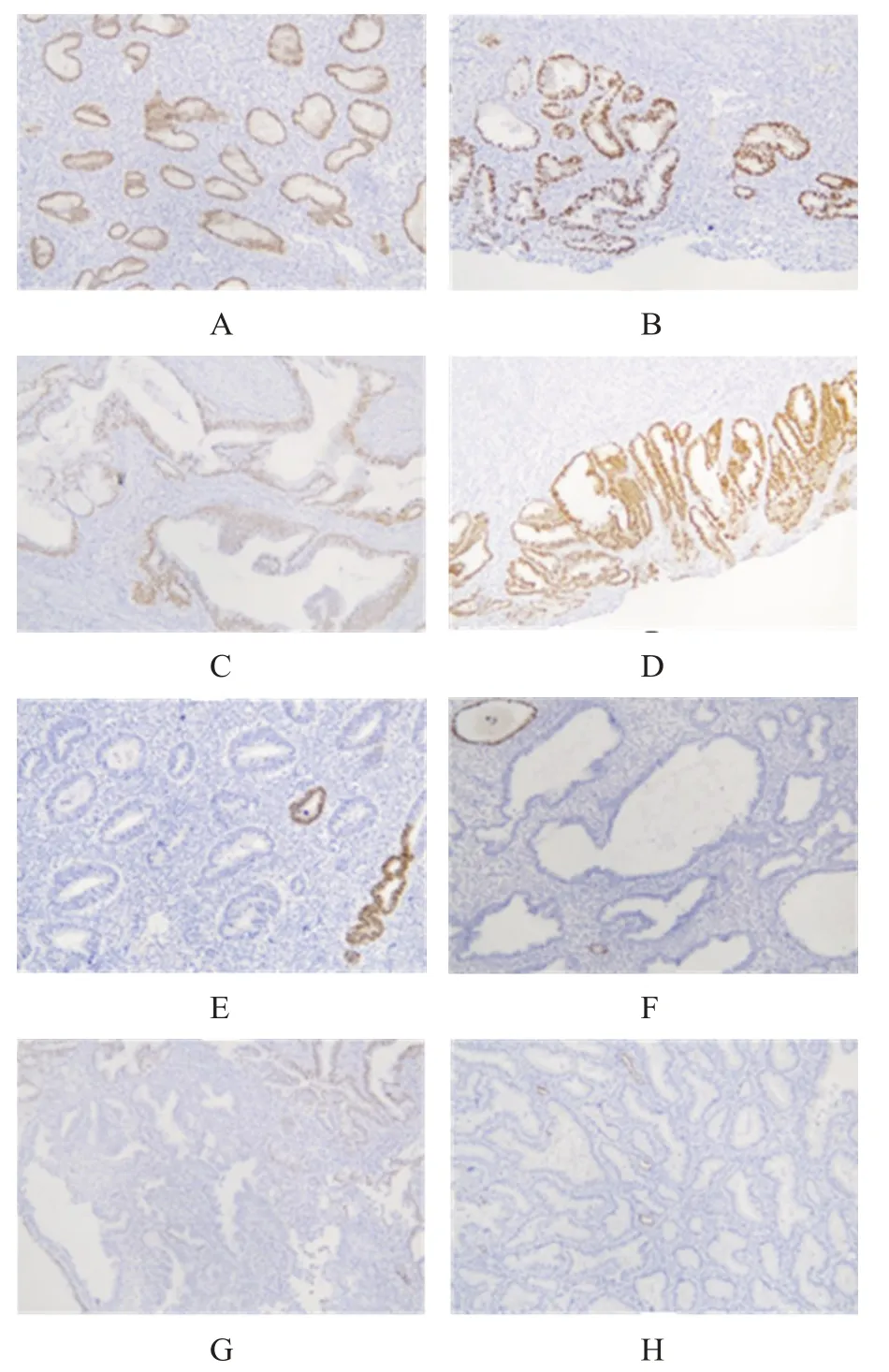
图2 免疫组化染色法检测PAX2蛋白表达(EnVision法染色,×100)

表2 4 组受检者PAX2 蛋白缺失情况的比较[n(%)]
2.3 PTEN 与PAX2 蛋白同时缺失情况的比较
增生期子宫内膜组中3 例受检者PTEN 与PAX2 蛋白同时缺失,而子宫内膜增生不伴非典型组中未发现两者同时缺失。子宫内膜增生伴非典型组与子宫内膜样癌组分别有17 例及8 例受检者PTEN 与PAX2 蛋白同时缺失。由于标本数量较少,为了更好地达到研究目的,本研究将增生期子宫内膜组、子宫内膜增生不伴非典型组合并为良性增生子宫内膜组,子宫内膜增生伴非典型组、子宫内膜样癌组合并为癌前病变以上组。良性增生子宫内膜组PTEN 与PAX2 蛋白同时缺失率为5.9%(3/51),明显低于癌前病变以上组的55.6%(25/45),差异有统计学意义(χ2=28.552,P﹤0.01)。PTEN 及PAX2 同时缺失诊断子宫内膜增生伴非典型/子宫内膜样癌的特异度为94.1%(48/51),高于单独PTEN 缺失的88.2%(45/51)及单独PAX2 缺失的76.5%(39/51)。
3 讨论
PTEN是一种抑癌基因,位于染色体10q23.31,研究证实其突变或缺失与多种肿瘤的发生密切相关,是子宫内膜癌中突变率最高的基因[6-7]。PTEN通过将细胞膜上的3,4,5-三磷酸磷脂酰肌醇(phosphatidylinositol 3, 4, 5-triphosphate,PIP3)去磷酸化,抑制蛋白激酶B(protein kinase B,PKB,又称AKT)及下游激酶活性,从而抑制相关肿瘤基因的表达,调控细胞周期,在磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)/AKT信号通路中起着至关重要的作用。PTEN 功能缺失有多种原因,如常染色体突变、转录和转录后调节异常及PTEN 蛋白稳定性和降解异常等[8-9]。
PAX2 属于配对盒基因家族成员之一,是胚胎时期重要的转录调节因子,在胚胎发育过程中具有重要作用,在中枢神经系统、眼睛、肾、甲状腺、中肾管以及子宫和输卵管等上皮细胞中表达[10-11]。PAX2 在成年人子宫内膜中持续表达,可能与子宫内膜持续自我更新有关。
PTEN 在子宫内膜腺上皮和间质细胞中表达,PAX2 则在子宫内膜腺上皮细胞中表达。文献报道,在正常的子宫内膜中,可发生单个或小簇腺体PTEN 及PAX2 丢失,只有丢失腺体≥5%子宫内膜才算缺失[3]。在异常增生的子宫内膜中,PTEN 及PAX2 丢失范围常常是广泛的,这里的广泛是相对的,由诊刮的标本量及目标病灶的多少决定,一般是片状缺失。本研究中,PAX2一般是强阳性或阴性表达,而PTEN出现微弱阳性表达时不判定为缺失。
研究显示,PTEN 的表达随子宫内膜病变程度的增加而明显减弱或缺失[12-14]。PAX2 在子宫内膜癌中表达降低或缺失,表明在正常子宫内膜上皮细胞中,PAX2 可能起到了肿瘤抑制作用[15-16]。本研究结果显示,PTEN 与PAX2 蛋白缺失率随着子宫内膜增生程度升高而增加,与上述文献报道的结果大体一致。子宫内膜样癌组、子宫内膜增生伴非典型组PTEN 蛋白缺失率均高于增生期子宫内膜组、子宫内膜增生不伴非典型组,差异均有统计学意义(P﹤0.05);子宫内膜增生不伴非典型组、子宫内膜增生伴非典型组、子宫内膜样癌组PAX2蛋白缺失率均高于增生期子宫内膜组,子宫内膜增生伴非典型组PAX2 蛋白缺失率高于子宫内膜增生不伴非典型组,差异均有统计学意义(P﹤0.05)。说明通过免疫组化染色法检测PTEN 与PAX2 蛋白表达,能够帮助病理医师筛查出良性子宫内膜标本。但子宫内膜样癌组和子宫内膜增生伴非典型组PTEN 和PAX2 蛋白缺失率比较,差异均无统计学意义(P﹥0.05),说明PTEN 和PAX2 并不能判断子宫内膜非典型增生是否发生癌变。本研究中子宫内膜增生伴非典型组PAX2 蛋白缺失率高于子宫内膜样癌组,可能是由于诊断子宫内膜样癌的标准过高,过于保守所致,值得反思。
本研究结果显示,PTEN 及PAX2 同时缺失诊断子宫内膜增生伴非典型/子宫内膜样癌的特异度为94.1%(48/51),高于单独PTEN 缺失的88.2%(45/51)及单独PAX2 缺失的76.5%(39/51)。因此,PTEN 与PAX2 蛋白联合检测有助于筛查良性子宫内膜。同时本研究发现,子宫内膜增生不伴非典型组中未发现PTEN 与PAX2 蛋白同时缺失,与相关文献报道的结果类似[2],在判定复杂性增生是否伴有非典型时,当PTEN 与PAX2 同时缺失即诊断为非典型,否则有可能只是复杂性增生。
综上所述,为了克服子宫内膜诊刮标本病理诊断主观性强、可重复性低的缺点,合适的辅助手段是必需的,PTEN 与PAX2 蛋白联合检测有助于筛查良性子宫内膜,但不能判断非典型增生是否发生癌变。

