光子喷流诱导后向作用力研究进展
任煜轩,孔慈航,李 博
(复旦大学脑科学转化研究院,上海 200032 )
光携带动量从而产生力效应,可以用来控制微粒运动,在光流体学、微型游泳体、人造光学物质和生物医学工程中存在重要应用.1970年,贝尔实验室的阿什金(Ashkin)首先提出利用光压操纵微小粒子.1986年,他采用高数值孔径物镜聚焦光束形成三维光学势阱来捕获颗粒,即有名的光镊.强聚焦的激光形成的光强梯度可直接捕获介电微球、细胞等,以及间接捕获蛋白质、核酸等生物分子[1-2].阿什金因单光束梯度力光镊于2018年获得诺贝尔物理学奖.光镊利用光强梯度将微小粒子吸引到光阱中心,而光的辐射压驱动微小物体沿着光的传播方向运动.
光子能否对微粒产生逆光子动量方向的牵引力一直是具有挑战性的国际研究热点.光学牵引,即逆光子流方向操控粒子,在近10年来引起科学界广泛的兴趣.迄今为止,有采用光场调控、物质界面以及设计特殊微纳结构诱导后向作用力[3].光学力所采用的探针多是介电微球,且介电微球本身可以聚焦激光微束形成亚波长级的纳米喷流[4-5].在自然界,海底章鱼凭借喷射墨汁的“喷流”获得反向冲力,从而迅速逃离危险生物或者抵御外敌入侵.这种“喷流”现象也引起科研人员浓郁的兴趣,如利用“喷流”的亚波长尺度实现超高分辨率的显微成像[4-5].受自然界诸多“喷流”现象的启发,通过介电微粒自身聚焦形成光子喷流(photonic nanojet)引起的光热效应,实现对介电粒子的光学牵引,并突破原有技术只能局限于有限区域捕获的瓶颈.悬浮的生物细胞比周围环境具有更高的折射率,可以聚焦光束形成生物光子喷流并用作生物成像[6].纳米光子喷流还可以形成梯度力,用于捕获纳米粒子,例如通过生物光子喷流捕获生物细胞或细菌(如血红细胞、大肠杆菌等),进行纳米成像和操控[6-7],甚至打开细胞膜和操控细胞器等[8].
本综述拟介绍纳米光子喷流的形成、纳米光子喷流诱导光力的迟滞效应,以及在光学牵引方面的研究进展,并对大规模可控光学操控的前沿方向进行讨论.
1 光子喷流后向作用力原理
1.1 光子喷流后向作用力介绍
介电粒子吸收光子后,获得光子所承载的动量,从而产生一个与光子传播方向相同的作用力,即辐射压力.激光的辐射压力也可以平衡颗粒的重力,实现光学悬浮.采用多束激光从不同方向照射粒子,可以减缓粒子的运动,如1997年诺贝尔奖的激光冷却原子技术.光强梯度力形成的光镊可以有效捕获细胞等粒子,但传统技术仍存在通量低的瓶颈.使用分时复用或全息的并行化技术可以产生具有高功率要求的光阱阵列,但由于光束控制的复杂性和功率预算的增加,这一技术对于高通量单粒子分类应用仍然不够.
光镊应用中激光所操控的对象多是介电的微球.2004年,美国西北大学Allen Talflove教授发现,微米大小的介电微球可以将光束聚焦成纳米尺度的焦斑,形成光子喷流,并被用于超显微镜[4-5].光学力所采用的探针多是介电微球,且介电微球本身可以聚焦激光微束形成亚波长级的纳米喷流[4-5].图1a呈现了直径为10微米的聚苯乙烯微球聚焦激光形成的光场分布.在强吸收液体中,光子喷流处的液体分子吸收光子能量并使得液体局域温度升高,导致液体体积膨胀进而反作用力推动微球逆光传播方向移动.图1b展示了纳米光子喷流诱导的稳态温度场分布.
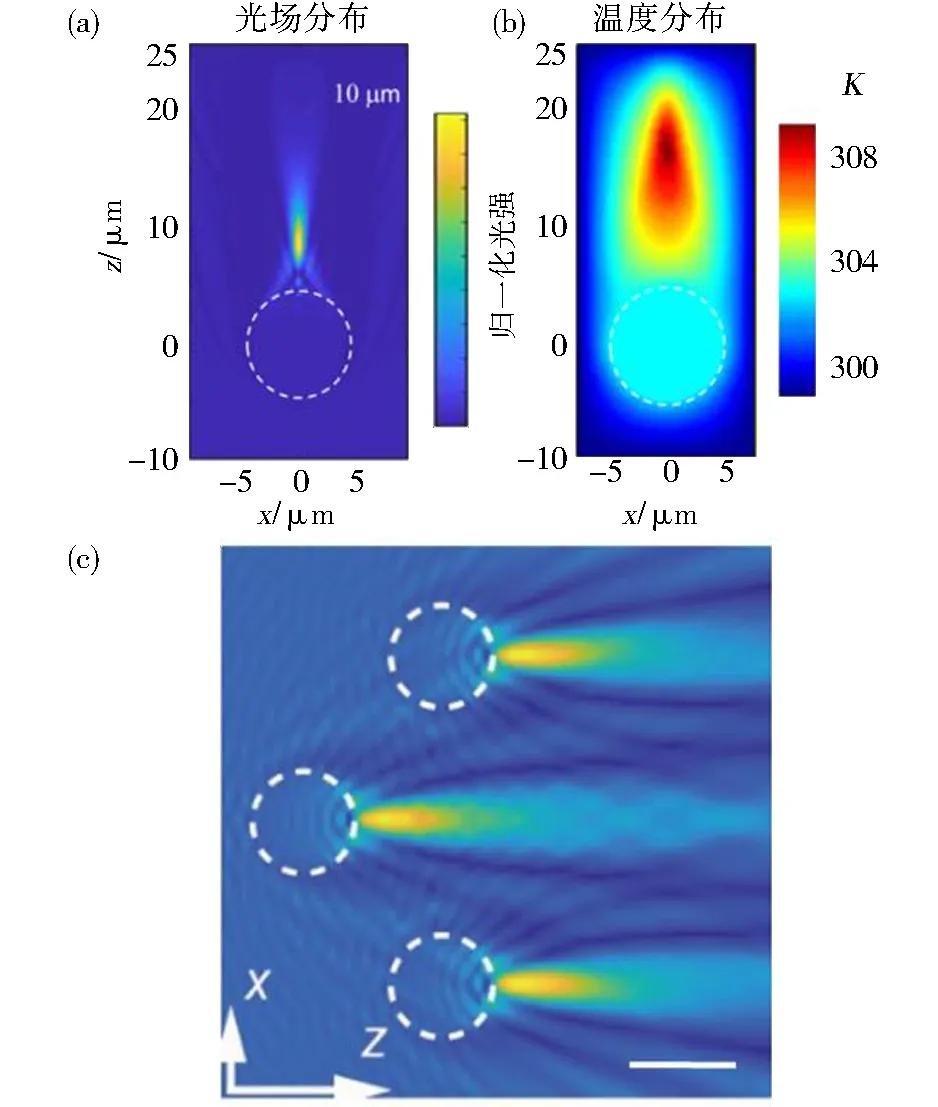
(a)直径为10 μm的聚苯乙烯微球聚焦激光形成纳米光子喷流空间分布图[9];(b)纳米光子喷流处水分子吸收光后诱导的温度场分布图[9];(c)空间任意分布的多个直径为5 μm的聚苯乙烯微球各自聚焦形成光子喷流[10],比例尺为5 μm图1 光子喷流的光场分布和诱导的温度场分布Fig.1 Distribution of photonic nanojet and the mediated temperature field
时域有限差分模拟表明,即使微球不排列在同一横向平面,每个微球都会独自聚焦微光束形成光子喷流,且光子喷流会随着微球移动,其相对距离是由球体大小和折射率等参数共同决定(图1(c)).多个微球形成光子喷流表明,不管微球移动到何处、是否处于同一个横截面内,仍能形成光子喷流并反向推动粒子朝光源移动.当光子喷流处液体分子吸收光能后发生局域膨胀时,附近的水分子推动微球朝光源方向运动.光子喷流也会随着微球移动到新位置,持续反向驱动微球运动.只要粒子受到光照射,粒子就会自驱动地响应反作用力.
1.2 光子喷流后向作用力实验进展
为增强水的吸收,实验中采用通信波段的近红外光.通过自行研制的光纤激光器实现皮秒级的锁模脉冲,以提高激光的峰值功率.皮秒级的种子激光经光纤放大器放大后耦合到自由空间,并照射到微米颗粒悬浮液(图2(a)).将高分子微球或细胞悬浮液等放置于样品池,每个微球或细胞各自聚焦光束后形成光子喷流,并推动微粒朝光源移动(图1).在没有激光照射时,介电粒子作随机布朗运动.当激光打开后,微米粒子会向光源方向移动(图2(b)).交替开关激光时,颗粒运动速率会呈现两个状态(图2(c)).通过调控溶液的热导率和光吸收系数,发现光子喷流诱导的后向光力是溶液光吸收和热传导竞争的结果[9].
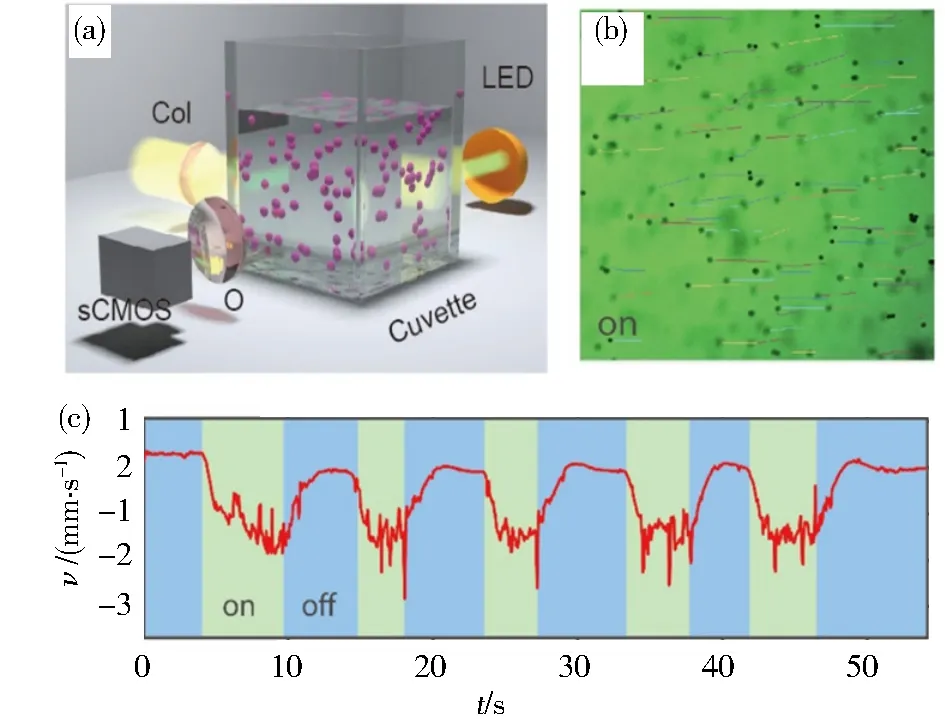
(a)光子喷流诱导的后向光力实验示意图[10];(b)10微米直径的聚苯乙烯微球逆着光传播方向运动显微图[9];(c)当光束交替打开时,微粒运动速率随时间变化呈现出两个态的变化[9]图2 光子喷流后向作用力牵引介电粒子实验结果Fig.2 Experimental results for pulling dielectric microparticles with photonic nanojet mediated backaction force
通过微米级颗粒将脉冲激光聚焦成纳米尺度的光子喷流.光子喷流处的液体分子吸收光能以后发生局域膨胀,其中水分子推动介电微球朝光源方向运动.光子喷流伴随微球出现,紧随微球移动,并不断反向驱动微球运动.只要使用准直的光束,即可实现粒子光学牵引.所发现的后向作用力可以实现大范围、大规模粒子的全光学远程操控,在大规模粒子操控和分选中具有重要而广泛的应用价值[9].
1.3 不同光学作用力机理的比较
在光强梯度力光镊中,微球受到光强梯度力的作用会被吸引到光斑处,并且局限于衍射光斑附近的区域(体积在飞升量级)(图3).梯度力光镊具有较高的探测精度,适用于研究蛋白质复合物动态折叠等单分子研究[11-12].然而,梯度力光镊难以满足大规模、并行粒子检测和分类的应用需求,并且受到衍射极限的制约.其作用范围通常局限于聚焦光斑的小区域,因此在大范围内对微球施加牵引力是具有挑战性的.虽然并行时分复用或全息产生阵列光镊可以在一定程度上提高操控粒子的通量,但仍面临功率不足等问题,并且仍然局限于特定的狭小空间,难以实现大规模细胞操控.
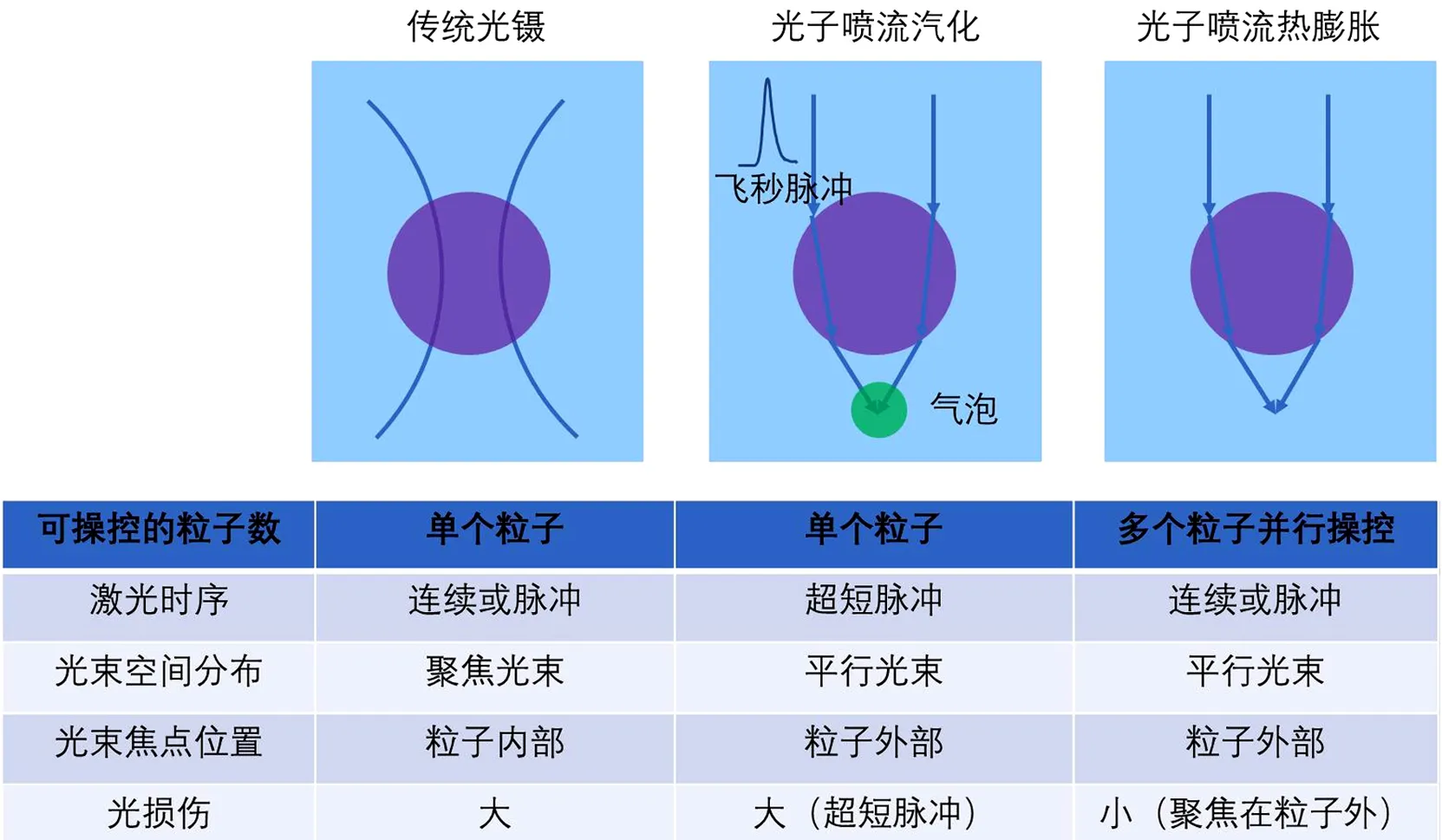
图3 常见光学作用力工作机理比较Fig.3 Comparison of the mechanism for various types of optical force
采用纳米喷流是实现大规模光学操控粒子的一个重要的突破口.纳米光子喷流操控细胞器和微球的机理主要有3种:(1)利用纳米光子喷流形成的聚焦场梯度力捕获纳米粒子;(2)利用纳米喷流形成的强场气化溶剂分子(如水分子)产生气泡,并通过反作用力对微球产生后向作用力;(3)采用微球形成的光子喷流处水分子的热效应导致水分子局域膨胀对微球施加后向作用力(和光子流方向相反),并诱导微球向光源方向移动[9].由于光子喷流通过粒子本身将光聚焦在粒子外部,粒子处光功率密度较低,光损伤较小.相比之下,传统的单光镊是通过聚焦光束来捕获粒子(聚焦点在粒子内部),粒子处的强聚焦光束具有较高的功率密度,因此会导致较强的光损伤.超短脉冲引起汽化液体的方法虽然在粒子处光的空间分布为平行光,但由于在时域上的超短输出,仍会产生强瞬时功率和光损伤.图3比较了传统光镊、光子喷流气泡化和热膨胀等3种情况下光束参数和光损伤大小.在实际应用中,如果需要对含有较多水分的细胞进行操控,采用光子喷流热膨胀可有效地降低光对细胞的损伤.
传统光镊技术多采用显微物镜将激光束聚焦到比较小的空间,只有进入到这个狭小的空间范围内的粒子才会受到光力的作用.由于光子喷流本身伴随微球出现,并且准直的激光就可以形成“喷流”,这使得光子后向力的产生不受空间限制,可实现大规模的光学操控.当分散的粒子被皮秒激光照射时,微球背面纳米喷流处的溶剂分子通过光热效应局部加热,并对微球施加后向作用力.纳米光子喷流后向作用力是溶剂光吸收和热传导竞争的结果,突破了传统光镊只能局限在狭窄区域进行捕获的瓶颈.
激光辐射压产生以及飞秒脉冲诱导气泡的实验通常需要强聚焦的激光来增强光功率密度以提高作用力的大小[13-14].而光子喷流热效应操控微球无需依赖高数值孔径的物镜聚焦激光,只要微球位于准直激光的照射范围内,就能自行形成光子喷流,并且所产生的后向作用力大小比传统的前向散射力高3~4个数量级.光子喷流后向作用力所需的激光峰值功率在10 kW量级[9],比激光诱导气泡产生后向作用力的峰值(约50 MW[15])低3个数量级.更客观地,比较几种作用机理下单位平均功率密度所产生的作用力大小,见表1.光子喷流诱导的后向作用力机理具有更高的力转化效率,单位功率密度受力比其他方法高5~7个数量级.
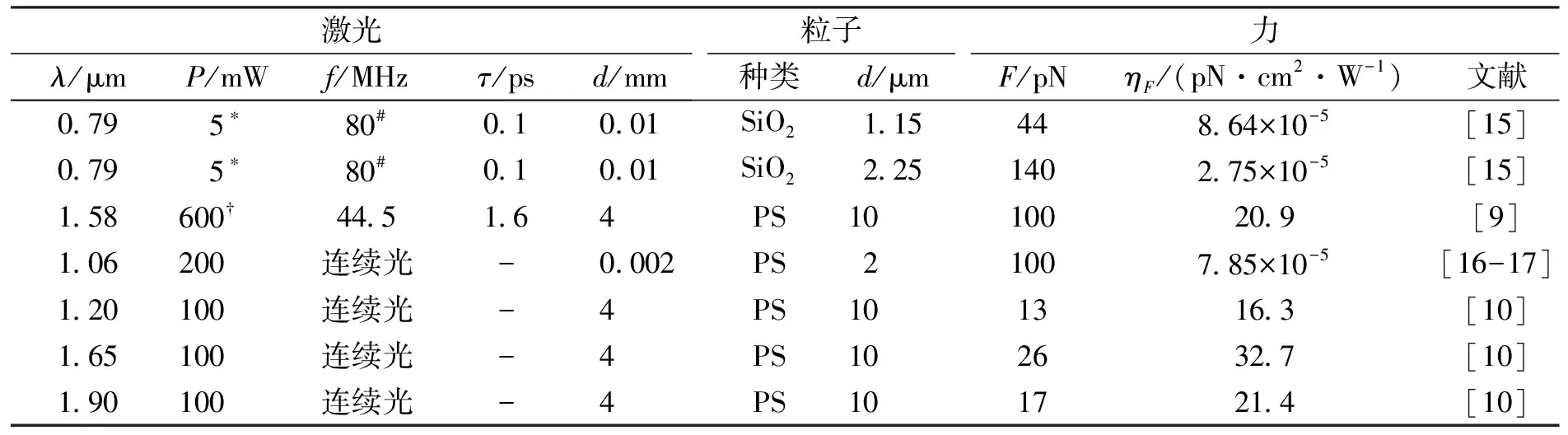
表1 不同机理下后向作用力大小比较Tab.1 Comparison of backaction force magnitude under different mechanisms
在近红外Ⅱ区,不同波长的连续激光也可以实现光学后向作用力来操控介电粒子.与飞秒和皮秒等脉冲相比,连续激光具有更低的峰值功率,从而对生物细胞等材料具有更小的光损伤.此外,具有可区分时空分布的超连续谱源也可以调节介电粒子的反作用力.
采用溶液汽化的方式需要使用超短脉冲激光,而较大的峰值功率容易对细胞等生物样品造成光损伤并导致细胞失活.气泡化还可以通过连续激光表面等离子体增强的方法实现,例如使用镀金膜的介电微球和两面性(Janus)粒子在聚焦激光下形成气泡后所产生的热泳力[18-19].由于光子喷流伴随微球出现,只要有光的照射就可以形成光子喷流,因此所产生的后向作用力在大范围、大规模粒子的全光学远程操控方面具有重要的优势.
2 光子喷流后向作用力应用进展
2.1 多维度操控生物细胞
微米级细胞可通过聚焦光束形成生物纳米光子喷流,实现对细胞的光束牵引.当激光从不同方向照射细胞悬浮液时,可以从多个维度对细胞进行牵引.通过选择具有时空特性迥异的两组激光,抑制两束光在空间中相互干涉.例如,在使用波长为1.5 μm的锁模激光和波长为1.65 μm的拉曼激光时,MB231癌细胞的运动轨迹显示出与这两个激光方向相反的运动[10].图4(a)展示了乳腺癌细胞响应两侧激光移动的实验结果,其中虚线圆圈表示不同帧中同一个细胞.当左侧锁模激光功率占主导地位时,所有癌细胞都向左移动;当右侧拉曼激光占主导时,所有癌细胞都向右移动,并且视野中的所有细胞都同步地朝着强光源方向移动.图4(a)中实线箭头表示细胞的运动方向.图4(b)是细胞受力方向与光纤锁模激光及连续拉曼激光入射方向的示意图.由于细胞自身可以聚焦光子喷流,并且光子喷流伴随着细胞出现,因此视场中的所有癌细胞都朝着同一个方向运动.
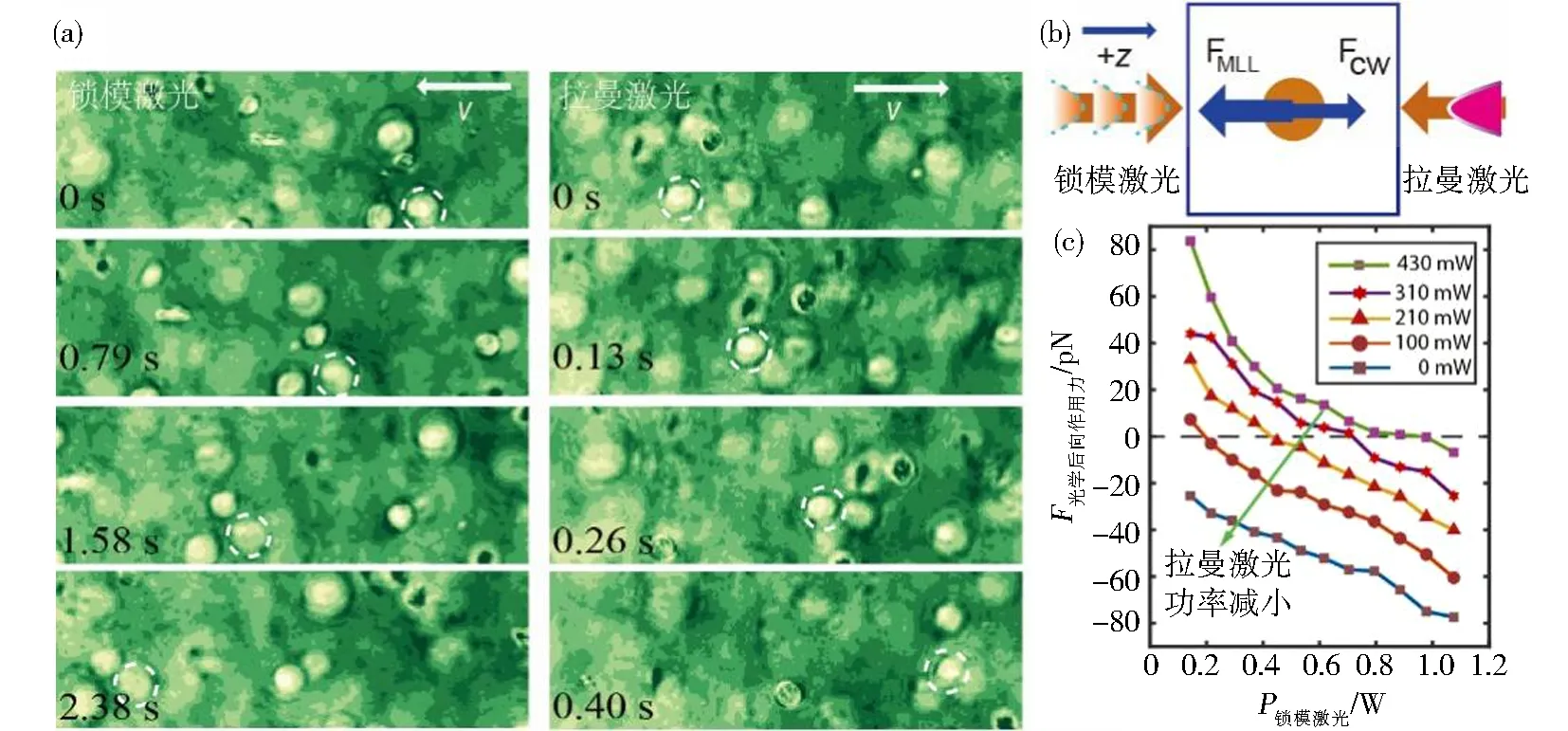
(a)分别只有左侧(MLL)或右侧(RL)激光时,癌细胞运动录像序列;(b)固定右侧激光功率,后向作用力大小随左侧激光功率变化结果图4 双光束牵引乳腺癌细胞的实验[10]Fig.4 Pulling breast cancer cells with dual beams
图4(c)展示了直径为15 μm的聚苯乙烯微球的光学力随功率的变化.在固定拉曼激光器功率的情况下,光学作用力随左侧锁模激光功率增加而增大.随着拉曼激光器功率的增加,平衡点向右移动,这表明需要更大功率的锁模激光来平衡拉曼激光器施加的牵引力.通过构建双光束反向传输的后向作用力平台,可以调控介电粒子的运动.纳米光子喷流辅助的双向光束提供了一个大规模光学牵引平台,可以控制高分子微球、生物细胞等运动速度和运动方向.结合显微成像,可用于癌细胞高通量形态分析,如分类及诊断.此外,由光纤形成的光子喷流还可以级联操纵多个杆状细胞形成光波导[20-22].
2.2 后向作用力迟滞效应翻转细胞运动
近年来,光热捕获取得了蓬勃发展,光热效应激发非线性滞后现象也具有前所未有的重要性.当微球通过聚焦激光形成光子喷流时,光子喷流内液体温度从T0上升到T.同时,微球感受到的反作用力大小为[9]:
(1)
其中,τ为粒子响应时间(在毫秒量级),NA为阿伏加德罗常数,Vjet为纳米喷流体积,ρsol是溶剂的质量密度,Msol为溶剂分子的摩尔质量,T为喷流内温度,T0为背景温度.
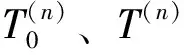
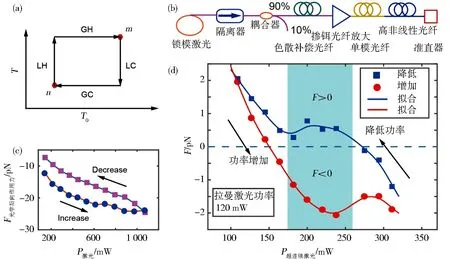
(a)全局温度与局域温度变化图;(b)高分子微球的后向作用力迟滞效应;(c)超连续谱激光原理图;(d)后向作用力迟滞效应实现光力反转[10]图5 后向作用力迟滞效应Fig.5 Hysteresis on the backaction force
(2)
为了简化讨论,式(1)中的常数在式(2)中被省略,由于两个状态的功率非常接近,可以将τ视为常数.实际上,背景温度相比于纳米喷流内部的温度的增加速度要缓慢得多,因此考虑到滞后效应,光学力可以近似表示为:
(3)
考虑差值,
(4)
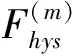
由于反作用力的大小随激光功率单调增加,与直觉相反,尽管激光功率相同,但反作用力的大小根据功率变化的方向而变化.特别地,与功率加载相比,在功率卸载期间力以单独的轨迹减小.类似于磁性材料的磁化或生物组织的光弹性响应[23],在功率加载/卸载期间这种不同的力路径表明介电粒子悬浮液中反作用力存在滞后(图 5(b)).这一观察结果很好地证实了对介电粒子反作用力滞后行为的理论分析.
由于溶液吸收光能导致的全局温度变化相对于纳米喷流内部温度变化存在滞后,光子喷流的后向作用力随功率变化存在迟滞效应.在存在反向传播光束的情况下,利用滞后效应可以反转力方向.在左侧使用超连续激光,当右侧拉曼激光器的功率固定为120 mW时,直径为10 μm的聚苯乙烯微球所受的反作用力随超连续谱源功率变化如图5(d)所示.对于阴影区域的超连续谱功率,反作用力由功率变化方向可逆地确定.滞后的力响应意味着反作用力不仅由平均激光功率决定,而且与粒子悬浮液所经历的先前状态密切相关.用反向传播的光束操纵细胞在高通量细胞流动和与细胞形态相结合的分选中具有广泛的潜在应用.
2.3 细胞等颗粒筛选
细胞筛选在细胞种类识别和疾病诊断等方面有重要的应用.传统细胞筛选采用荧光标记细胞特定成分,通过测量多通道荧光信号强度来区分不同种类的细胞.细胞在受力作用下会发生形变,传统方法不能感知细胞形变信息.外力诱导的形变可用来筛选细胞[24],然而,人为施加的液体压力会引起细胞破裂.
自然界中许多颗粒,如细胞,其光学折射率大于周围介质,因而可以通过聚焦激光形成光子喷流.在生物体系存在大量细胞、细胞器等微米纳米级介电颗粒,通过生物光子喷流的作用可以驱动生物颗粒的运动,并结合单粒子追踪来区分颗粒的大小和种类.微球通过纳米喷流内部的局部能量转换推动而自主移动.
大规模的光学操控突破传统光镊每次只能操控少数粒子的局限,可以用于对粒子进行分类.以高分子聚苯乙烯微球与酵母细胞为例,通过力与面积的分布图可以区分出不同粒子的大小和种类(图6(a),6(b)).综合考虑光学作用力、细胞几何形态、力学响应时间等因素,可以对不同种类的细胞和高分子微球进行分类筛选,具有在生物医学工程、环境科学等领域的潜在应用.
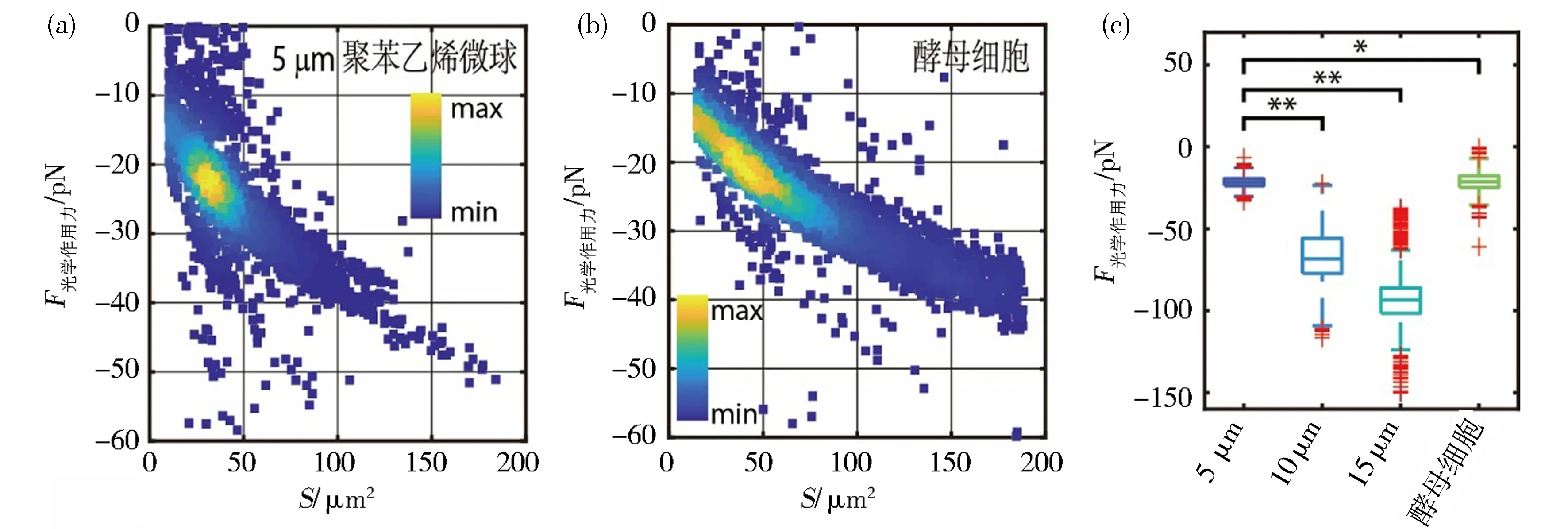
图6 光子“喷流”作用力对微米球和细胞进行分类[9]Fig.6 Classification of microparticle and cells using photonic nanojet mediated force
细胞的形态和膜弹性会随着形变发生变化,因此利用光学力和形态学参数对细胞进行筛选具有很强的可行性.通过结合光学力和微观粒子的显微图像特征,可以对不同种类的粒子进行标记,并运用神经网络等深度学习技术对不同种类的颗粒进行筛选和分类,从而在疾病诊断等场合实现快速识别细胞种类中发挥纳米光子喷流特有的功效.
在传统的流式细胞分析中,细胞通常沿着一个方向运动并在通过检测区域后进入废液搜集通道,这使得对同一细胞进行重复检测以降低假阳性率变得困难.通过利用迟滞效应来反转细胞的运动方向,可以再次将特定细胞移到检测区域,从而实现对细胞的重复检测.对于病毒等低丰度物质的检测降低假阳性具有重要的现实意义.
3 总结
大视场和多粒子并行操控在提高细胞筛选通量方面具有重要的应用价值.光子喷流伴随着微球的出现,只要有光照射,就可以形成光子喷流.光子喷流诱导的后向作用力可以实现大范围、多尺度和大规模粒子的全光学远程操控.光子喷流操控生物细胞的方法具有大规模操控粒子的潜力,有望在细胞筛选方面发挥重要作用,并为罕见疾病早期检测提供单细胞检测的依据.此外,光子喷流的聚焦点在所操控粒子之外,有助于降低对细胞的光毒性,采用连续激光可进一步降低光损伤.
纳米喷流在高效率光学操纵中展现出新颖现象,不同时空光束并行操控粒子的方法仍值得进一步探索.这些方法在细胞生物学、疾病诊断、药物递送、人造光流体等领域具有广泛的应用前景.对于生物细胞悬浮液等软物质体系,控制微/纳米游泳器对于设计目标药物递送系统和纳米外科手术具有重要的现实意义.深入理解纳米光子喷流后向作用力的实现机理以及对后向光子力的非线性机理的认识,结合多种成像手段对不同折射率差异的癌细胞、高分子微球、细菌等多尺度微粒进行大规模的光学操控和分选.这将实现对癌症等细胞的分类,通过细胞形态和机械受力确定其种类、形态和病变等特征,为临床诊断提供科学依据.

