紫球藻培养动力学模型的构建
吴文茜,钟 晨,周有彩,陈必链,2,何勇锦,2
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学工业微生物教育部工程研究中心,福建 福州 350117)
紫球藻(Porphyridiumcruentum)是红藻门的一种单细胞红藻,可合成胞外多糖(EPS)、多不饱和脂肪酸(PUFA)、B-藻红蛋白(B-PE)等高价值生物活性物质,已广泛应用于食品、医药、化妆品等领域[1].这些活性物质具有抗病毒、抗菌、抗氧化、促进心血管健康、促进婴儿认知发育和促进癌症细胞凋亡等作用[2].因此,研发紫球藻生物活性物质的联产技术,有助于推动海洋微藻生物技术的发展和应用[3].当前,培养紫球藻的氮源有硝酸盐、尿素、铵盐等[4],且氮源质量浓度会影响紫球藻的生长及其活性物质的合成[5-7].例如,12.3 mg·L-1硝酸钠的培养基有利于紫球藻合成藻胆蛋白,而同样质量浓度尿素的培养基可促进其细胞外多糖合成[8].本课题组前期研究发现[9],在绿光条件下,1.0 g·L-1硝酸钾最适合紫球藻生长和活性物质合成.然而,绿光光源昂贵,能效低,不利于微藻培养的推广使用.另一方面,与硝酸钠相比,尿素的价格更低,可降低培养成本.因此,需要研究在白光下评估尿素质量浓度对紫球藻生长和活性物质联产合成的影响,为规模化养殖和产物合成提供依据.
动力学模型是评估细胞生长、产物形成和底物消耗的有力工具,可准确预测微生物在特定反应器下的变化行为,为规模生产提供理论支持.例如Yang等[10]建立了2 L发酵反应器中藻类生长、脂质合成和甘油消耗的动力学模型,为微藻发酵合成油脂提供实践依据.周有彩等[11]构建了50 L发酵罐的小球藻分批培养动力学模型,为半连续发酵提供理论指导.He等[12]建立的Logsitic和Luedeking-Piret方程可很好拟合等鞭金藻的生长和油脂合成.
目前,微藻培养的光反应器有管式光生物反应器、跑道池、鼓泡式光生物反应器等.鼓泡式光生物反应器由透明玻璃制成,具有低能耗、良好混合效果、简单结构等优点[13],适合作为实验室内进行理论研究的模型反应器和藻种扩培的装置.因此,本研究是基于本课题组前期的研究基础上[9],在白光条件下,选择开放式鼓泡式光生物反应器用于培养紫球藻,研究尿素质量浓度对其生长和生物活性物质合成的影响;同时,基于所得数据,构建相应的动力学模型,为紫球藻的规模养殖和生物活性物质生产提供指导意见.
1 实验与方法
1.1 藻种来源及培养反应器
紫球藻(P.cruentumFJ-12)保存于本实验室[14].所使用的培养光反应器为1.5 L开放式柱型鼓泡光生物反应器(长1 000 mm,外径50 mm和内径45 mm)购买于南京启衡渔业科技有限公司.
1.2 培养基
培养基为改良型f/2培养基[12],在原有f/2培养基的基础上添加2.5%质量分数的海盐并以尿素为唯一氮源.
1.3 实验方法
1.3.1 藻种的制备
将紫球藻接种于装有250 mL改良型f/2培养基的500 mL锥形瓶中,于25 ℃、150 μmol·m-2·s-1光强和1 L·min-1通空气量条件下培养至对数期,获得紫球藻种子液.
1.3.2 紫球藻培养
采用1.5 L柱式反应器探究不同尿素质量浓度(50、 100、 200、400 mg·L-1)对紫球藻生长和生物活性物质合成的影响.改良型f/2培养基装液量为1 L,紫球藻初始接种量为0.28 g·L-1,在25 ℃、150 μmol·m-2·s-1光强和1 L·min-1通空气量条件下培养18 d.每3 d取样测定紫球藻生物量、EPS和B-PE含量及培养基中剩余尿素质量浓度.
1.4 分析测定
1.4.1 生物量测定
采用干质量法[15]测定紫球藻的生物量.取2 mL紫球藻培养液于预先称重的5 mL离心管中离心,弃上清液,加入纯水洗涤3次后,置于80 ℃干燥箱烘干至恒质量.
1.4.2 细胞生物大分子的测定
采用Marcati等[16]的方法测定藻红蛋白(B-PE)含量.采用苯酚-硫酸法[17]检测胞外多糖(EPS)含量.采用Pimentel等[18]的方法分析脂肪酸组成.
1.4.3 尿素质量浓度测定方法
利用南京建成生物工程研究所血尿素(BUN)测试盒测定紫球藻培养液的尿素质量浓度.
1.5 构建紫球藻生长、生物活性物质合成和基质消耗动力学
1.5.1 紫球藻生长动力学
Logistic数学方程常用于解释微藻的生长特性[19].因此,本研究将建立Logistic方程阐明尿素质量浓度对紫球藻生长的影响差异,其公式如下:
(1)
式中,dX/dt为紫球藻生长速率;μm为紫球藻最大比生长速率(d-1);X为紫球藻生物量(g·L-1);Xm为紫球藻最大生物量(g·L-1);X0为最初菌体质量浓度(g·L-1).
初始接种时,即t=0,初始细胞量为X0.对式(1)进行积分,得:
(2)
1.5.2 生物活性物质合成动力学
在活性产物合成方面,培养基中的尿素氮元素用于紫球藻B-PE和EPS(含有氨基酸序列,认定为糖蛋白)的合成.因此,采用Luedeking-Piret方程描述微藻的产物形成,其方程如下:
(3)
式中,dP/dt为产物的合成速率;P为产物质量浓度(mg·L-1);α为生长相关系数;β为非生长相关系数.
产物合成与细胞生长动力学模型存在以下3种情况[20]:(1)产物合成与细胞生长相关型(α≠0,β=0);(2)产物合成与细胞生长部分相关型(α≠0,β≠0);(3)产物合成与细胞生长非相关型(α=0,β≠0).当t=0时,初始产物含量为P0.积分式(3)后,得:
(4)
式中,P为产物质量浓度(mg·L-1);P0为起始蛋白质质量浓度(mg·L-1);α为生长相关系数;β为非生长相关系数.
1.5.3 基质消耗动力学
在紫球藻培养中,尿素主要用于生长、合成和维持细胞代谢[21].尿素质量浓度显著影响藻红蛋白和胞外多糖的合成.因此,尿素消耗可用式(5)表示:
(5)
式中,dS/dt是指尿素的去除速率;S为尿素的总量;YX/S是尿素维持藻的生长系数 ;YP/S为尿素合成B-PE和EPS的生产系数;m是最大维持系数.
当t=0时,尿素质量浓度表示为初始尿素质量浓度(S=S0).积分后,可用式(6)描述尿素的消耗.
(6)
1.5.4 统计分析
采用Microsoft Excel 2010和Origin 8.5软件分析实验数据,结果表示为平均值(n=3)±标准偏差.采用Origin 8.5软件对生物量、基质消耗和产物合成等实验数据进行模型拟合.
2 结果与分析
2.1 不同尿素质量浓度对紫球藻生长和尿素消耗的影响
在白光条件下,尿素质量浓度对紫球藻生长有显著影响(图1(a)).从图1(a)可得,在所设定的尿素质量浓度下,紫球藻均能正常生长.值得注意的是,200 mg·L-1尿素质量浓度培养紫球藻的生物量达到最高值(3.1 g·L-1).图1(b)显示了尿素质量浓度对紫球藻消耗尿素的影响.紫球藻在第12天和第15天可全部消耗A组和B组的尿素.在200 mg·L-1尿素组中,紫球藻在第18d时可消耗完所有尿素.然而,在400 mg·L-1尿素质量浓度下,经培养18 d后,培养基仍剩余105.4 mg·L-1的尿素.此外,高质量浓度尿素会明显抑制紫球藻生长(图1).这与Carvalho等[22]研究的结果相吻合.由此可说明200 mg·L-1尿素更适合紫球藻FJ-12的生长.
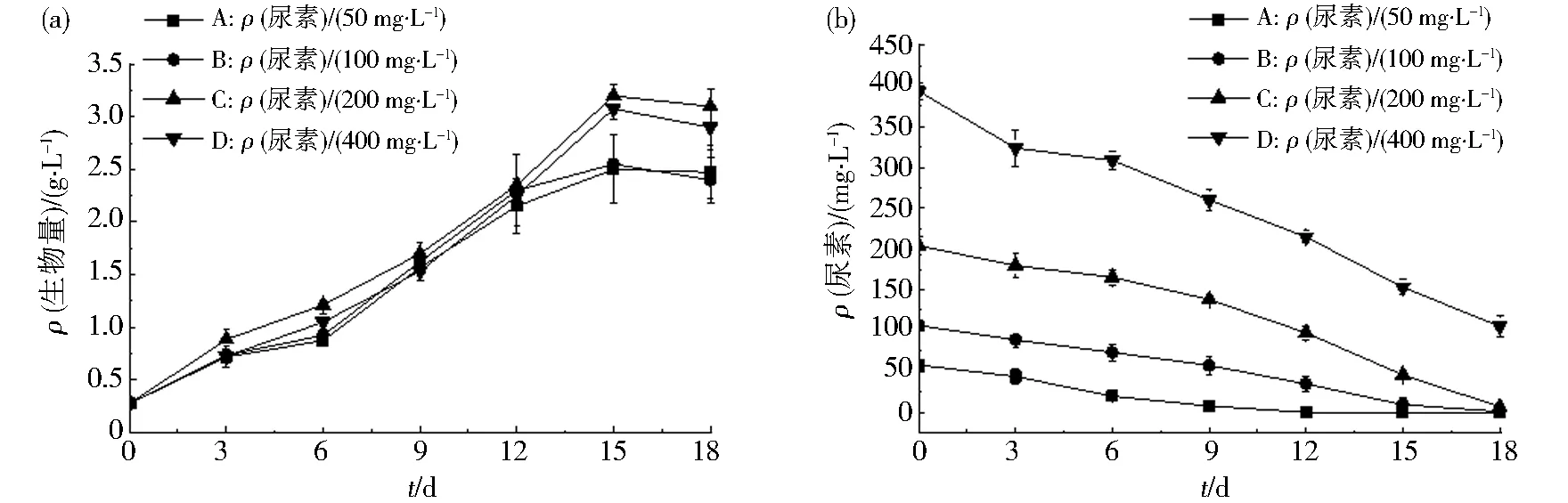
图1 不同尿素质量浓度对紫球藻FJ-12细胞生长影响和尿素消耗情况Fig.1 The effects of different urea mass concentrations on the cell biomass and the urea consumption of Porphyridium cruentum FJ-12
2.2 不同尿素质量浓度对紫球藻生物活性合成的影响
2.2.1 藻红蛋白(B-PE)
图2显示不同尿素质量浓度对紫球藻FJ-12藻红蛋白合成的影响.随着培养时间的延长,各实验组的紫球藻细胞合成B-PE都呈现先上升后趋于平稳的趋势.200、400 mg·L-1尿素质量浓度组的紫球藻具有更高的B-PE合成能力.这与Guihéneuf等[23]的研究结果吻合.因此,为了节省尿素的使用,选择紫球藻合成藻红蛋白的尿素质量浓度为200 mg·L-1.
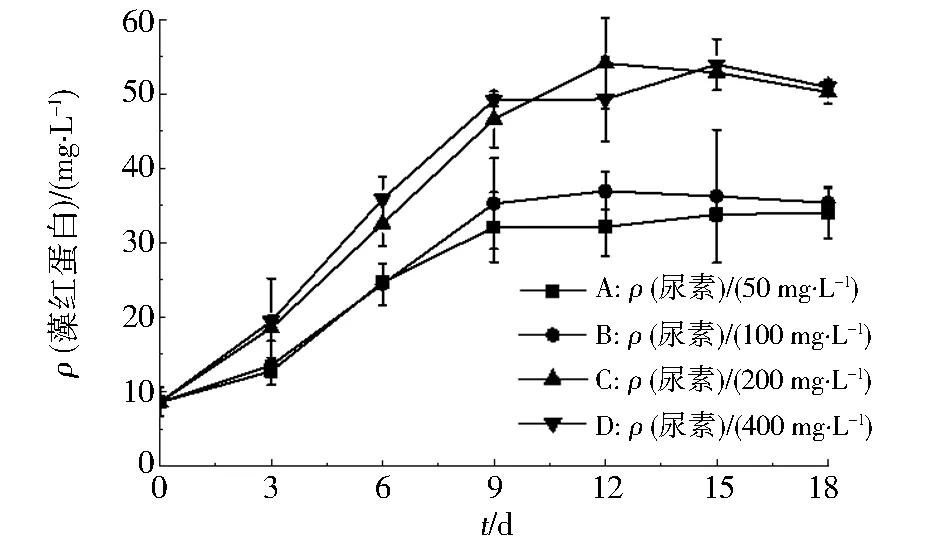
图2 不同尿素质量浓度对紫球藻FJ-12合成藻红蛋白的影响Fig.2 The effects of different urea mass concentrations on the synthesis of phycoerythrin by Porphyridium cruentum FJ-12
2.2.2 胞外多糖(EPS)
图3显示了不同尿素质量浓度对紫球藻合成EPS的影响.在培养初期阶段(0~9 d),各组紫球藻细胞合成EPS的含量没有明显差异.然而,随着培养时间的延长(12~18 d),200 mg·L-1尿素质量浓度下的紫球藻合成了最多的EPS.但是,400 mg·L-1尿素质量浓度下的紫球藻合成了最少的EPS.这表明,高质量浓度尿素会抑制紫球藻的EPS合成,可能是因为高质量浓度尿素影响了其代谢活性,导致合成能力降低[24].所以,最适合紫球藻FJ-12合成EPS的尿素质量浓度为50~200 mg·L-1.
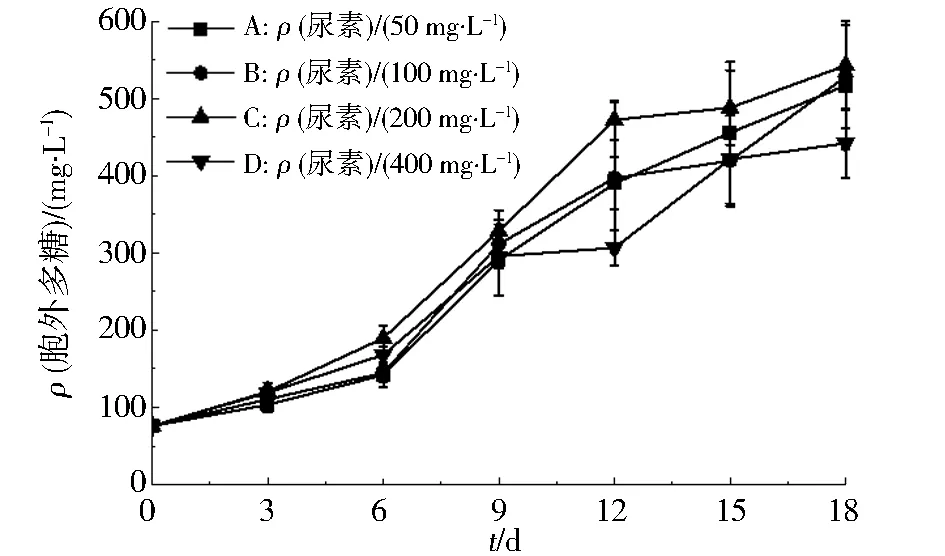
图3 不同尿素质量浓度对紫球藻FJ-12合成胞外多糖的影响Fig.3 The effects of different urea mass concentrations on the EPS biosynthesis by Porphyridium cruentum FJ-12
2.3 多不饱和脂肪酸合成
有研究发现,紫球藻多不饱和脂肪酸合成受到培养条件等因素的影响[25].各组紫球藻脂肪酸含量和组成的结果见表1.紫球藻主要合成的脂肪酸是月桂酸(C12∶0)、棕榈酸(C16∶0)、亚油酸(C18∶2,Linoleic acid,LA)、花生四烯酸(C20∶4,ARA)和二十碳五烯酸(C20∶5,EPA).同时,高质量浓度尿素更有利于紫球藻合成EPA和ARA.这可能是紫球藻脂肪酸合成代谢的脱氢酶、延长酶等活性会随尿素质量浓度的提高而增强,从而促进ARA和EPA的积累[26],且该结果与Asgharpour等[27]的发现相符.此外,50 mg·L-1尿素条件下紫球藻合成LA含量最高,占总脂肪酸的28.99%.综上,紫球藻ARA和EPA含量与初始尿素质量浓度呈正相关,而LA含量则呈负相关.
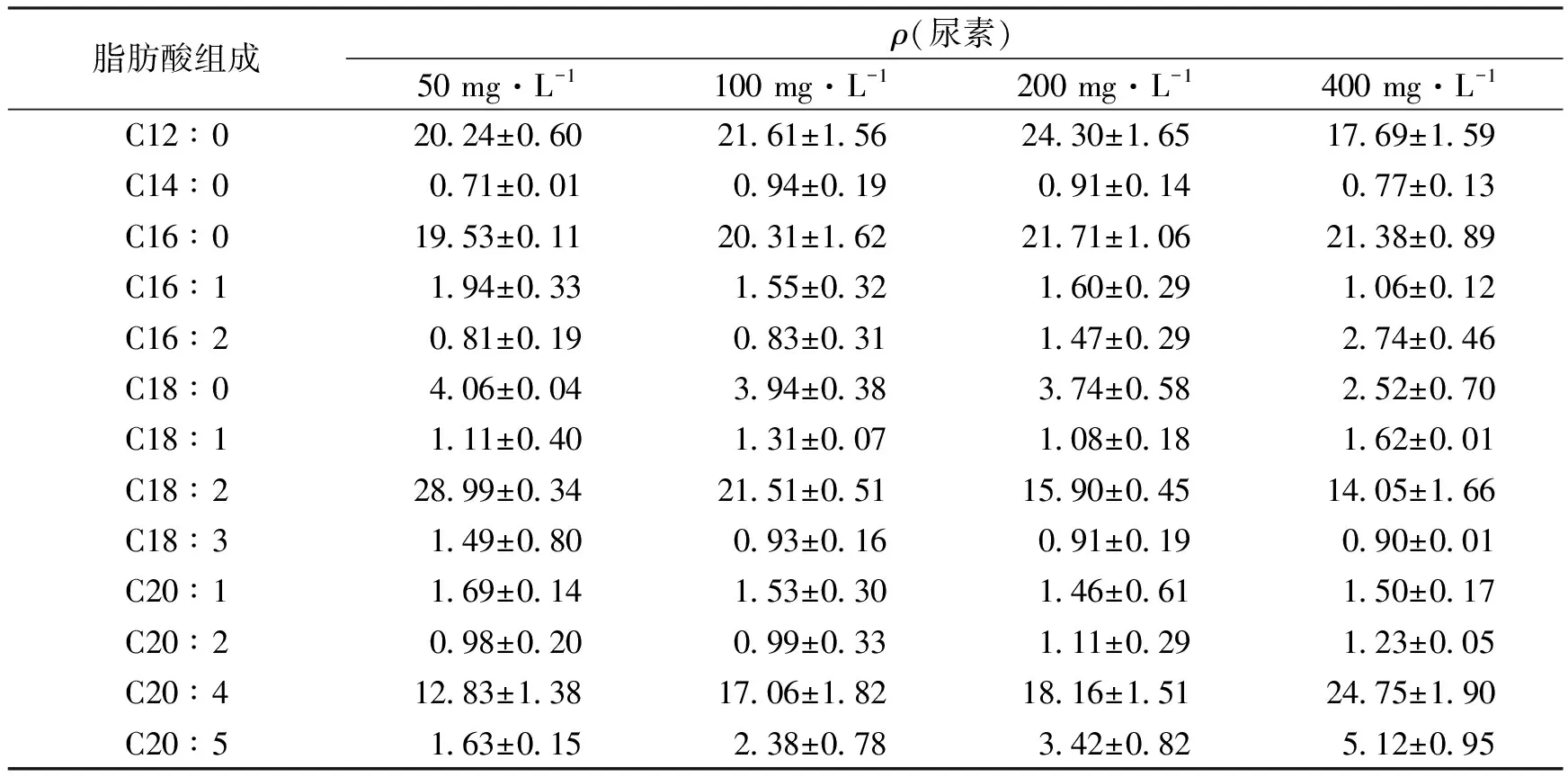
表1 不同尿素质量浓度下的紫球藻脂肪酸组成和含量Tab.1 Fatty acid composition of Porphyridium cruentumFJ-12 at different urea mass concentrations %
2.4 紫球藻生长、B-PE与胞外多糖合成和氮消耗的动力学模型
2.4.1 紫球藻生长动力学
使用Logistic方程(2)对实验数值进行非线性拟合,拟合结果见图4与表2.结果显示Logistic方程能够很好地拟合图1中紫球藻的生长.由于紫球藻FJ-12在200 mg·L-1尿素条件下获得最高生物量,则该组紫球藻细胞干重(X)与培养时间的函数为:
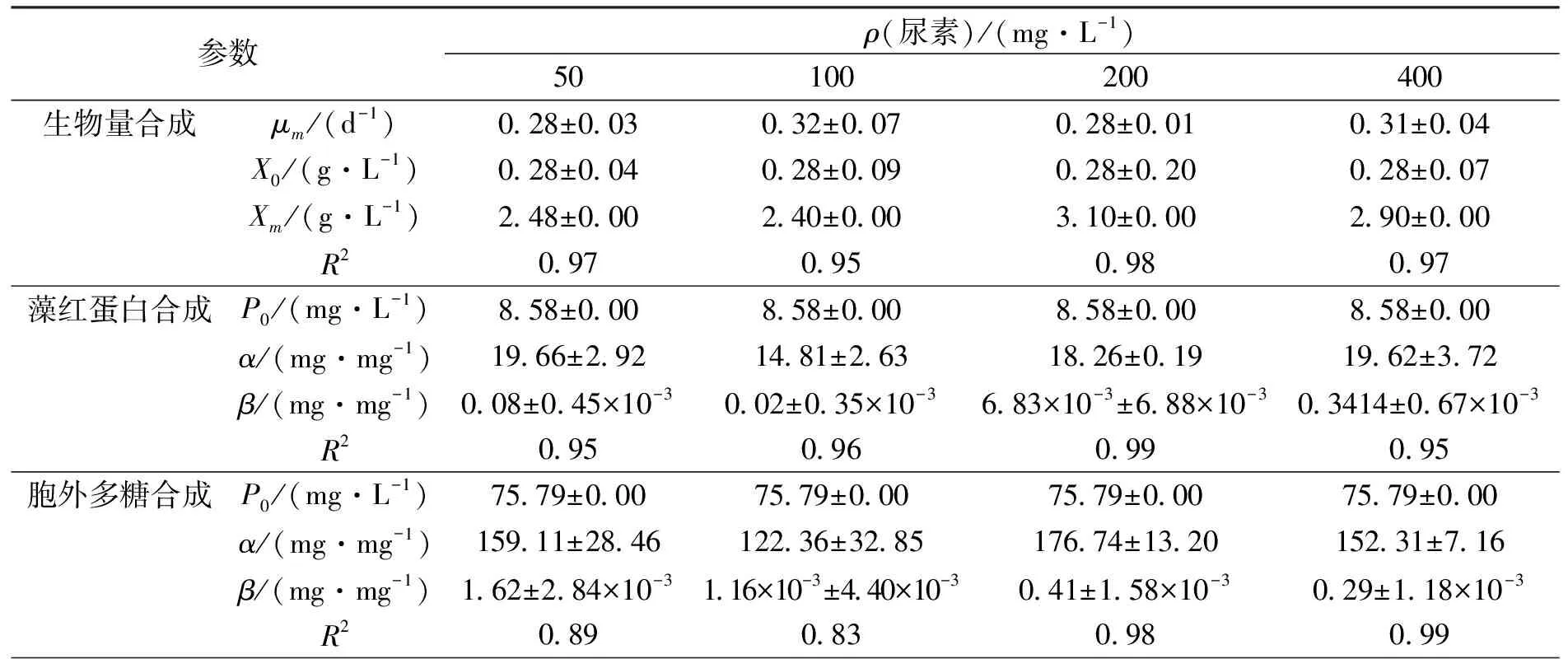
表2 动力学模型拟合参数值Tab.2 Fitting parameters of the kinetic models
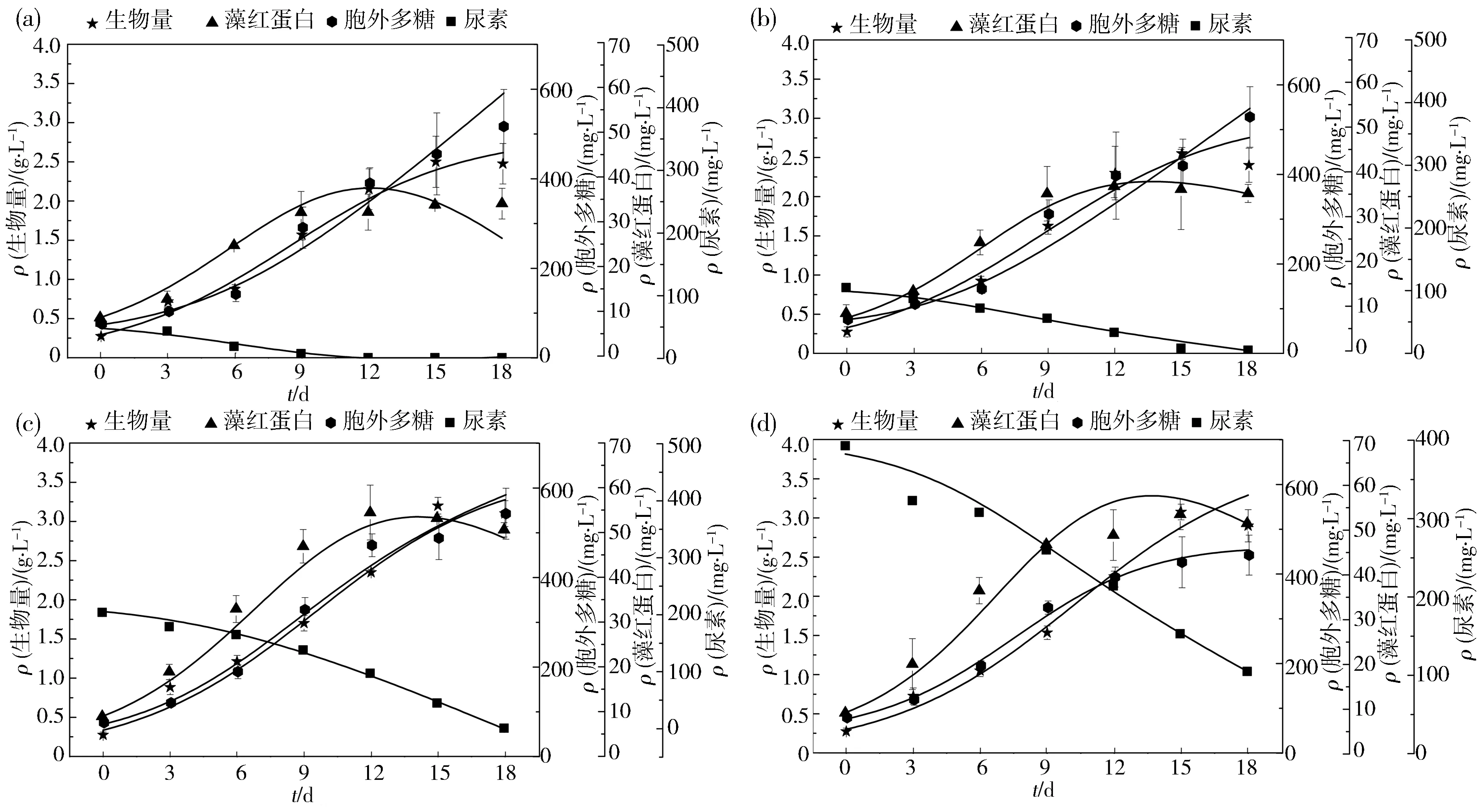
图4 紫球藻FJ-12的生长、藻红蛋白与胞外多糖合成和尿素消耗的实验数据与模型方程拟合曲线Fig.4 Experimental data and model equation fitting curves for growth,B-PE and EPS biosynthesis,and urea consumption by Porphyridium cruentum FJ-12
2.4.2 藻红蛋白(B-PE)与胞外多糖(EPS)合成动力学
根据图2和图3,B-PE和EPS含量与藻细胞增长呈现部分相关,可采用部分相关模型(α≠0,β≠0)描述它们的合成.用Luedekig-Piret方程(4)拟合B-PE和EPS实验数据,结果见图4,通过计算得出该方程的生长相关系数(α)和非相关系数(β),数值见表2.表2数据表明,α和β均为正值,进一步证明B-PE和EPS的合成与紫球藻细胞生长为部分相关.基于图2和图3,可得紫球藻在200 mg·L-1尿素组获得了最高的B-PE和EPS产量.从而获得如下的数学方程:
2.4.3 尿素消耗动力学
紫球藻生长过程中,尿素主要用于细胞的生长、B-PE和EPS的合成以及维持细胞代谢.因此,尿素的消耗可用方程(6)表示,实验数据拟合结果见图4,图4(a)-(d)分别为紫球藻在50、100、 200 和400 mg·L-1初始尿素质量浓度下的结果.拟合所得的m、YP/S与YX/S值见表2.从表2可知,200 mg·L-1尿素组中具有最佳的尿素利用率,有利于生物质合成,同时也促进了B-PE和EPS的合成.由此可得紫球藻FJ-12在200 mg·L-1尿素条件下的尿素消耗方程可表示为:
3 结论
本研究实验结果表明,紫球藻FJ-12在200 mg·L-1的尿素质量浓度下可获得最高的生物量和藻红蛋白与胞外多糖的合成能力.在PUFA合成方面,尿素质量浓度的增加有利于紫球藻合成ARA和EPA,但会抑制LA的合成.此外,建立的Logistic、Luedeking-Piret产物合成和尿素消耗动力学方程可以很好地描述紫球藻生长、B-PE与EPS合成能力和尿素消耗.基于所得的结果,紫球藻生长及其活性物质合成对尿素底物依赖性的动力学特征,可以系统阐明B-PE/EPS合成和尿素吸收之间的相互作用,不仅有利于更好地剖析光生物反应器的培养行为,而且对改进与设计现用光反应器结构提供理论依据.

